nebulinとN-WASPは協同してIGF-1により誘導される筋原線維のアクチン線維の形成をひき起こす
高野和儀・遠藤 剛
(千葉大学大学院理学研究科 生物学分野)
email:高野和儀,遠藤 剛
DOI: 10.7875/first.author.2011.011
Nebulin and N-WASP cooperate to cause IGF-1-induced sarcomeric actin filament formation.
Kazunori Takano, Haruko Watanabe-Takano, Shiro Suetsugu, Souichi Kurita, Kazuya Tsujita, Sumiko Kimura, Takashi Karatsu, Tadaomi Takenawa, Takeshi Endo
Science, 330, 1536-1540 (2010)
IGF-1によって骨格筋の成熟と肥大がもたらされるが,これらの過程にはタンパク質の合成だけでなく筋原線維の形成が必要である.しかし,この筋原線維の形成を誘導するシグナル伝達機構はまったく不明である.筆者らは,IGF-1の刺激によりN-WASPがnebulinに結合して筋原線維のZ帯に局在化し,Z帯からアクチン線維の形成が起こることを見い出した.このnebulinとN-WASPとの結合はIGF-1により活性化されるPI3K-Aktシグナル伝達系がGSK-3βを抑制することによりもたらされた.非筋細胞においてN-WASPはArp2/3複合体を活性化して枝分かれしたアクチン線維を形成する.しかし,nebulinとN-WASPとの複合体はArp2/3複合体に依存せずにアクチン重合核を形成し枝分かれのないアクチン線維を形成した.さらに,IGF-1により誘導される骨格筋の肥大にはN-WASPが必要であった.この研究により,筋成熟や筋肥大に必要な筋原線維の形成におけるアクチン線維の形成,および,アクチン重合核の形成の新たな機構が明らかになった.
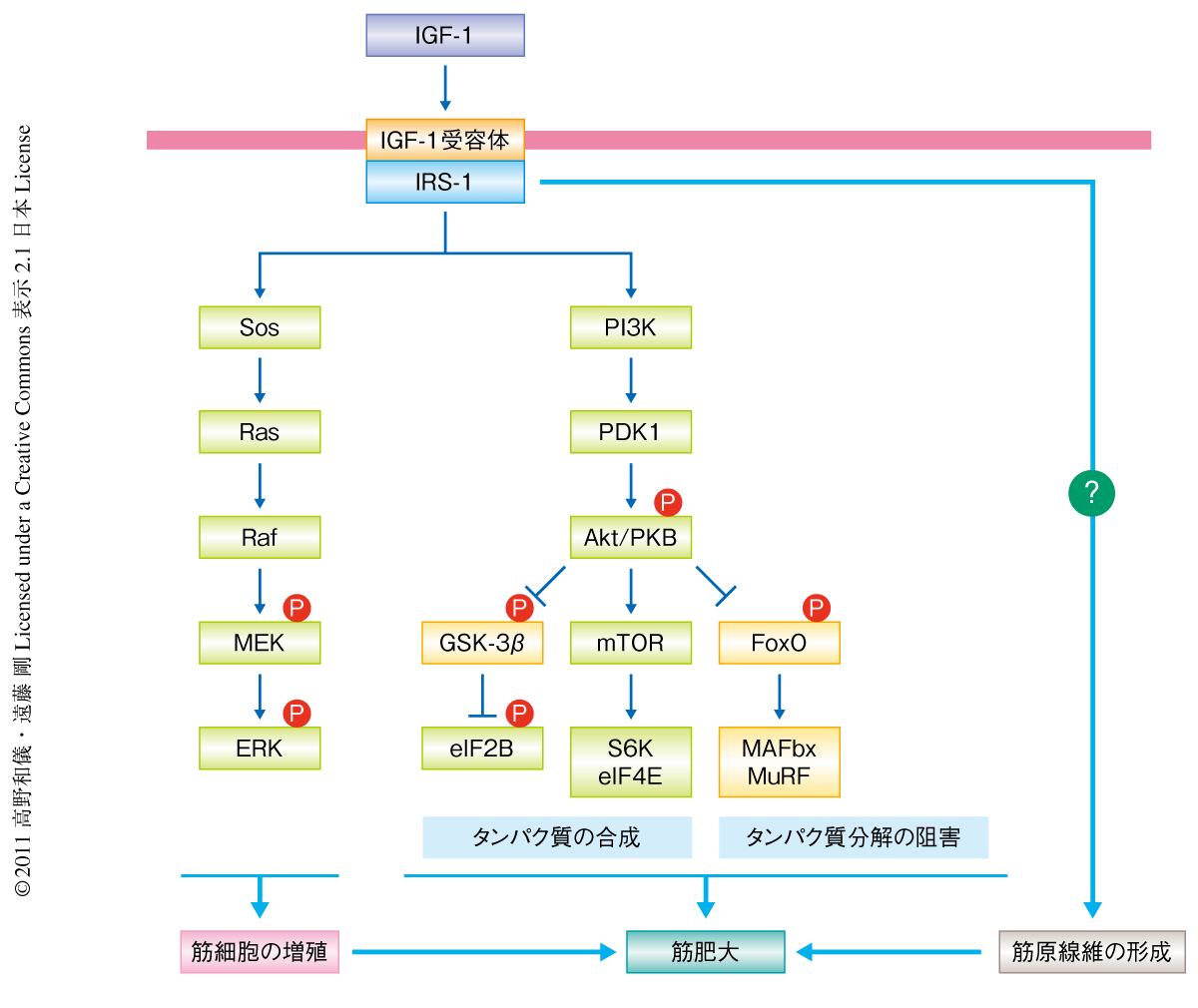
インスリン様増殖因子1(insulin-like growth factor-1:IGF-1)により誘導される骨格筋の成熟と肥大にはタンパク質の合成およびタンパク質分解の阻害が必要である1).しかし,骨格筋は筋原線維によりみたされているため,筋成熟や筋肥大には筋原線維の形成も必要である.IGF-1によるタンパク質の合成とタンパク質分解の阻害にはPI3K-Aktシグナル伝達系がはたらいている.一方,IGF-1による筋原線維の形成のシグナル伝達機構はこれまでまったく不明であった(図1).筋原線維構造の単位であるサルコメアはおもにアクチン線維とミオシン線維,および,アクチン線維をつなぐZ帯から構成されている.アクチン線維はZ帯から伸長し,すべて約1μmの長さにそろっている.このアクチン線維の長さはZ帯からアクチン線維のほぼ全長にそって伸展している約1μmの長さの巨大線維状タンパク質nebulinが決定しているものと考えられている2).これらのアクチン線維と重合して形成されたミオシン線維が規則正しくサルコメアに組み込まれて筋原線維が形成される.
非筋細胞のアクチン線維の形成にかかわっているアクチン重合核形成タンパク質とアクチン核形成促進タンパク質およびアクチン伸長タンパク質についての研究は,近年,大いに進展し新たなタンパク質の同定があいついでいる3).N-WASPはアクチン核形成促進タンパク質のひとつでありArp2/3複合体を活性化して枝分かれしたアクチン線維を形成する.これによりN-WASPは細胞遊走やエンドサイトーシスなどさまざまな細胞機能にかかわっている4).しかし,筋細胞における機能は不明である.そこで,筆者らは,N-WASPが筋原線維のアクチン線維の形成に関与しているかどうかを検討した.
N-WASPが筋原線維のアクチン線維の形成に関与しているかどうかを明らかにするため,まず,成体のマウス骨格筋におけるN-WASPの局在を免疫蛍光染色により解析した.その結果,N-WASPはZ帯に特異的に局在していることが示された.そこでつぎに,骨格筋に筋崩壊を起こしそれにひき続いて起こる筋再生の過程でN-WASPの局在を調べた.Z帯が形成される以前の幼若な筋管細胞ではN-WASPは細胞質の全体に分散していたが,筋原線維が形成され筋細胞が成熟するにつれてN-WASPはZ帯に明瞭に局在化した.
筋細胞の成熟と筋肥大はIGF-1によりもたらされるため,N-WASPのZ帯への局在化がIGF-1により制御されているかどうかを検討した.絶食させたマウスの骨格筋ではN-WASPは筋原線維の全体に分散していたが,IGF-1を投与すると一過的にZ帯に局在化した.さらに,マウス骨格筋に発現させたEGFP標識アクチンの局在を解析した.絶食させたマウスの骨格筋ではEGFP標識アクチンは筋原線維の全体に分散していたが,IGF-1を投与するとZ帯に集積したのち,Z帯から徐々にアクチン線維の全長にわたって局在した.これらの結果から,IGF-1刺激によりN-WASPはZ帯に局在化してZ帯からのアクチン線維の形成にかかわっている可能性が示された.
つぎに,IGF-1刺激に依存的にN-WASPをZ帯に局在化させるタンパク質の同定を行った.プルダウンアッセイによってN-WASPに特異的に結合する骨格筋のタンパク質はnebulinであることが明らかになった.筋原線維の巨大タンパク質nebulinのC末端側はZ帯に入り込んでおり,そのC末端にはSH3ドメインが存在している2).そこで,N-WASPのProリッチ領域とnebulinのSH3ドメインとの結合を調べた.nebulinのSH3ドメインはN-WASP全長またはN-WASPのProリッチ領域と結合したが,Proリッチ領域を欠損させたN-WASPとは結合しなかった.また,プルダウンアッセイにおけるN-WASPとnebulinとの結合はN-WASPのProリッチ領域により阻害された.さらに,マウス骨格筋に発現させたN-WASPはZ帯に局在したが,Proリッチ領域を欠損させたN-WASPはZ帯に局在しなかった.これらの結果から,N-WASPはProリッチ領域を介してZ帯に位置するnebulinのSH3ドメインと結合することによりZ帯に局在化することが明らかになった.
つぎに,nebulinとN-WASPとの結合がIGF-1シグナル伝達系により制御されているのかどうかを検討した.絶食マウスの骨格筋の抽出物ではnebulinはN-WASPと免疫共沈しなかった.それに対し,IGF-1を投与した絶食マウスの骨格筋の抽出物ではnebulinはN-WASPと共沈した.したがって,N-WASPのnebulinへの結合はIGF-1刺激によって誘導されることが明らかになった.
IGF-1刺激によってPI3K-Aktシグナル伝達系とRas-ERKシグナル伝達系とが活性化される.そこで,これらのシグナル伝達系のいずれによりnebulinとN-WASPとの結合がひき起こされるのか調べた.COS-1細胞に発現させたnebulinのC末端領域とN-WASPとの結合はIGF-1刺激により誘導された.この結合はPI3K阻害剤により抑制されたがMEK阻害剤によっては抑制されなかった.これらの結果から,nebulinとN-WASPとの結合にはRas-ERKシグナル伝達系ではなくPI3K-Aktシグナル伝達系の関与していることが示された.
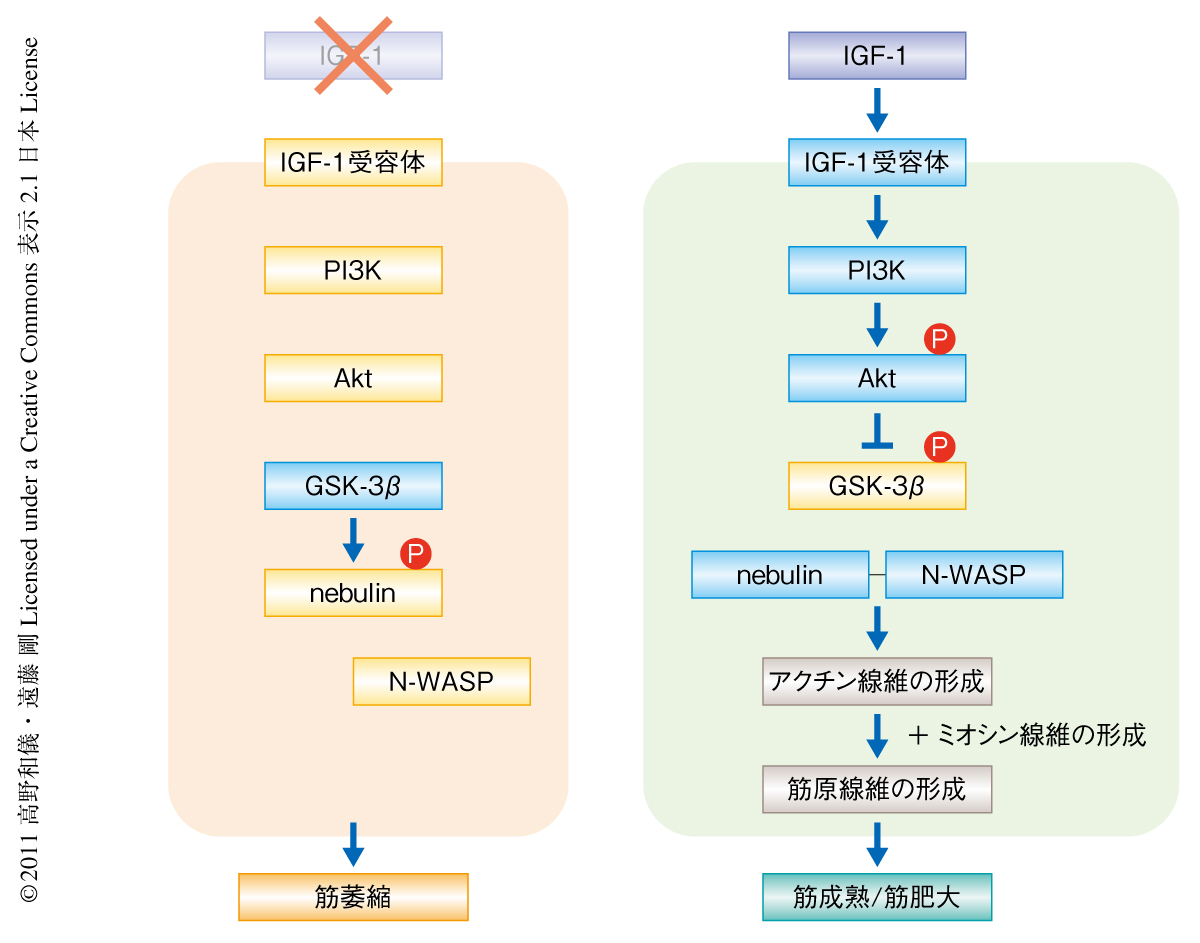
Aktはさまざまなタンパク質を基質とするSer/Thrキナーゼである.それらの基質のひとつであるGSK-3βはAktによりリン酸化されるとそのキナーゼ活性が阻害される5).COS-1細胞に発現させたnebulinのC末端領域とN-WASPとの結合はIGF-1刺激がなくてもGSK-3β阻害剤により誘導された.また,GSK-3βはin vitroでnebulinのC末端領域をリン酸化し,リン酸化されたこのnebulinのC末端領域はN-WASPとは結合しなかった.実際に,nebulinのSH3ドメインに隣接したSerリッチ領域には2個のGSK-3βでリン酸化されうるコンセンサスSer残基が存在していた.これらのSer残基を非リン酸化Alaに置換したnebulinのC末端領域はGSK-3βによってリン酸化されなかった.さらに,IGF-1を投与した絶食マウスの骨格筋ではZ帯においてAktによるGSK-3βの不活性化リン酸化が起こり,nebulinのコンセンサスSer残基のリン酸化が抑制された.また,nebulinのC末端領域の非リン酸化変異体を骨格筋に発現させた場合にはIGF-1刺激がなくてもN-WASPはZ帯に局在したが,nebulinのC末端領域の擬似リン酸化変異体を骨格筋に発現させた場合にはN-WASPはZ帯に局在しなかった.これらの結果から,IGF-1刺激によって誘導されたPI3K-Aktシグナル伝達系がGSK-3βをリン酸化して不活性化し,その結果,GSK-3βによるnebulinのリン酸化が抑制されることが明らかになった.リン酸化されているnebulinはN-WASPを結合できないが,リン酸化されていないnebulinはN-WASPを結合し,これによりN-WASPはZ帯に局在化することが示された(図2).
4.nebulinとN-WASPとの複合体はアクチン重合核を形成しZ帯からのアクチン重合をひき起こす
N-WASPはArp2/3複合体を活性化して枝分かれしたアクチン線維を形成することが知られている.しかし,筋原線維のアクチン線維には枝分かれはなく直鎖状である.また,筋原線維においてArp2/3複合体は特定の構造に局在していなかった.したがって,N-WASPはArp2/3複合体を介さずに筋原線維のアクチン線維の形成に関与している可能性が考えられた.N-WASPには種々のアクチン重合核形成タンパク質やアクチン伸長タンパク質にみられるWH2(WASP homology 2)ドメインが2つ連続して存在する3,4).WH2ドメインはアクチン単量体を結合する.一方,nebulinにはアクチン単量体結合モチーフをもつモジュールが185個,連続して存在する2).そこで,nebulinとN-WASPとの結合によりnebulinのアクチン単量体結合モチーフをもつモジュールとN-WASPのWH2ドメインとのあいだでアクチン重合核が形成される可能性を検討した.蛍光標識アクチンを用いたアクチン重合アッセイではN-WASPは単独では重合を促進しなかったが,C末端の4個のモジュールを含むnebulin断片は単独で重合を促進した.そして,これにN-WASPをくわえるとさらに重合が促進された.しかし,nebulinに結合できないProリッチ領域を欠損させたN-WASPやアクチン単量体を結合できないC末端を欠損させたN-WASPをくわえた場合には重合は促進されなかった.
つぎに,全反射蛍光顕微鏡(total internal reflection fluorescence microcopy:TIRFM)によりアクチン重合のようすを可視化し解析した.アクチンにアクチン単量体結合モチーフをもつ4個のモジュールを含むnebulinのC末端側の断片をくわえると形成された直鎖状のアクチン線維の数と重合核形成の速度が増加した.これにN-WASPをくわえると形成された直鎖状のアクチン線維の数と重合核形成の速度が大いに増加したが,アクチン線維の伸長速度には影響がみられなかった.また,Proリッチ領域を欠損させたN-WASPやC末端を欠損させたN-WASPをくわえた場合にはアクチン線維の数と重合核形成の速度は増加しなかった.
さらに,マウス骨格筋にN-WASPのsiRNAを発現させN-WASPをノックダウンした.これらのマウスを絶食させてIGF-1を投与してもEGFP標識アクチンはZ帯に集積せず,また,アクチン線維の伸長はみられなかった.したがって,N-WASPはIGF-1によるZ帯からのアクチン線維の形成に不可欠であることが示された.これらの結果から,nebulinとN-WASPとの結合によりnebulinのアクチン単量体結合モチーフをもつモジュールとN-WASPのWH2ドメインとが協同してアクチン重合核を形成しZ帯からのアクチン線維の形成をもたらすものと考えられた.in vitroではnebulinの連続したアクチン単量体結合モチーフをもつモジュールもある程度の重合核形成能を示すが,これはin vivoでのZ帯からのアクチン線維の形成にははたらいていないと思われた.なぜならば,nebulinのアクチン単量体結合モチーフをもつモジュールはZ帯だけでなくアクチン線維の全長にわたり存在するが,アクチン線維の途中からのアクチン重合は起こらないからである.
マウスの成長にともない骨格筋細胞は肥大する.この生理的な筋肥大は内在性のIGF-1が作用することによりもたらされるものと考えられる.また,マウスにIGF-1を投与することによっても筋肥大はひき起こされる.RNAi法によりN-WASPの発現をノックダウンしたマウス骨格筋では成長による生理的な筋肥大もIGF-1投与による筋肥大も抑制された.この筋肥大の抑制はN-WASPの過剰発現により解除されたが,Proリッチ領域を欠損させたN-WASPやC末端を欠損させたN-WASPを過剰発現しても解除されなかった.したがって,N-WASPはnebulinとN-WASPとの複合体の形成をとおして筋原線維のアクチン線維の形成をもたらすことによりIGF-1による筋肥大に必須の役割を担っていることが明らかになった.
この研究により,IGF-1によるZ帯からの筋原線維のアクチン線維の形成のシグナル伝達とアクチン重合核の形成の機構が解明された.IGF-1シグナル伝達系はさらにミオシン線維の形成にもかかわっているものと考えられる.この両者があいまって,筋成熟および筋肥大における筋原線維の形成がもたらされるのであろう(図2).最近,心筋細胞における筋原線維のアクチン線維の形成にはたらいているアクチン重合核形成タンパク質の候補としてleiomodin(Lmod)とFhod3とが報告された6,7).しかし,これらのタンパク質はZ帯ではなくアクチン線維の先端に局在しており,Z帯からのアクチン重合にははたらいていないものと考えられる.実際に,Lmodは筋細胞が成熟したあとに発現する.したがって,これらのタンパク質が骨格筋細胞にも発現しているならば,nebulinとN-WASPとの複合体によってZ帯から形成されたアクチン線維の先端の補充や修復にはたらいている可能性が考えられる.
nebulinをコードする遺伝子NEBの突然変異は筋疾患ネマリンミオパチーの原因となっている.このネマリンミオパチーにおいても,また,nebulinのノックアウトマウスにおいても,筋原線維のアクチン線維は短くふぞろいで十分な筋張力が発生せず筋萎縮がみられる8,9).ネマリンミオパチーにおけるNEB遺伝子の突然変異の多くはN-WASPの結合するnebulinのC末端側の欠損をひき起こすものである.したがって,この突然変異によりnebulinとN-WASPとの複合体が形成されずアクチン線維の形成が正常に起こらないことがこの筋疾患の原因のひとつであると考えられる.
nebulinは骨格筋に特異的に発現しており,心筋ではnebulinの代わりに長さが約0.15μmのタンパク質nebuletteが発現している10).nebuletteのC末端にはnebulinと同様にSH3ドメインとそれに隣接するSerリッチ領域とが存在するが,アクチン単量体結合モチーフをもつモジュールは22個しかない.それにもかかわらず,心筋細胞のアクチン線維の長さは約1μmである.そこで,心筋においては,nebuletteとN-WASPとが複合体を形成して重合核を形成するのか,アクチン線維の長さはどのように決定されているのか,また,これらの機構が心筋症や心肥大にかかわっているのかなど,今後,解明されなければならない点は多い.
略歴:2006年 千葉大学大学院自然科学研究科 単位取得退学(2007年 理学博士),2007年 東京大学分子細胞生物学研究所 特任研究員を経て,2008年より千葉大学大学院融合科学研究科 助教.
研究テーマ:横紋筋の筋原線維の形成を制御するシグナル伝達系の解明.
抱負:in vivoにおける筋原線維の形成と筋肥大の分子機構の全容を分子細胞生物学的な手法と蛍光イメージングを用いて解明したい.
遠藤 剛(Takeshi Endo)
千葉大学大学院理学研究科 教授.
研究室URL:http://life.s.chiba-u.jp/endo/hp/index.html
© 2011 高野和儀・遠藤 剛 Licensed under CC 表示 2.1 日本
(千葉大学大学院理学研究科 生物学分野)
email:高野和儀,遠藤 剛
DOI: 10.7875/first.author.2011.011
Nebulin and N-WASP cooperate to cause IGF-1-induced sarcomeric actin filament formation.
Kazunori Takano, Haruko Watanabe-Takano, Shiro Suetsugu, Souichi Kurita, Kazuya Tsujita, Sumiko Kimura, Takashi Karatsu, Tadaomi Takenawa, Takeshi Endo
Science, 330, 1536-1540 (2010)
要 約
IGF-1によって骨格筋の成熟と肥大がもたらされるが,これらの過程にはタンパク質の合成だけでなく筋原線維の形成が必要である.しかし,この筋原線維の形成を誘導するシグナル伝達機構はまったく不明である.筆者らは,IGF-1の刺激によりN-WASPがnebulinに結合して筋原線維のZ帯に局在化し,Z帯からアクチン線維の形成が起こることを見い出した.このnebulinとN-WASPとの結合はIGF-1により活性化されるPI3K-Aktシグナル伝達系がGSK-3βを抑制することによりもたらされた.非筋細胞においてN-WASPはArp2/3複合体を活性化して枝分かれしたアクチン線維を形成する.しかし,nebulinとN-WASPとの複合体はArp2/3複合体に依存せずにアクチン重合核を形成し枝分かれのないアクチン線維を形成した.さらに,IGF-1により誘導される骨格筋の肥大にはN-WASPが必要であった.この研究により,筋成熟や筋肥大に必要な筋原線維の形成におけるアクチン線維の形成,および,アクチン重合核の形成の新たな機構が明らかになった.
はじめに
インスリン様増殖因子1(insulin-like growth factor-1:IGF-1)により誘導される骨格筋の成熟と肥大にはタンパク質の合成およびタンパク質分解の阻害が必要である1).しかし,骨格筋は筋原線維によりみたされているため,筋成熟や筋肥大には筋原線維の形成も必要である.IGF-1によるタンパク質の合成とタンパク質分解の阻害にはPI3K-Aktシグナル伝達系がはたらいている.一方,IGF-1による筋原線維の形成のシグナル伝達機構はこれまでまったく不明であった(図1).筋原線維構造の単位であるサルコメアはおもにアクチン線維とミオシン線維,および,アクチン線維をつなぐZ帯から構成されている.アクチン線維はZ帯から伸長し,すべて約1μmの長さにそろっている.このアクチン線維の長さはZ帯からアクチン線維のほぼ全長にそって伸展している約1μmの長さの巨大線維状タンパク質nebulinが決定しているものと考えられている2).これらのアクチン線維と重合して形成されたミオシン線維が規則正しくサルコメアに組み込まれて筋原線維が形成される.
非筋細胞のアクチン線維の形成にかかわっているアクチン重合核形成タンパク質とアクチン核形成促進タンパク質およびアクチン伸長タンパク質についての研究は,近年,大いに進展し新たなタンパク質の同定があいついでいる3).N-WASPはアクチン核形成促進タンパク質のひとつでありArp2/3複合体を活性化して枝分かれしたアクチン線維を形成する.これによりN-WASPは細胞遊走やエンドサイトーシスなどさまざまな細胞機能にかかわっている4).しかし,筋細胞における機能は不明である.そこで,筆者らは,N-WASPが筋原線維のアクチン線維の形成に関与しているかどうかを検討した.
1.IGF-1刺激によりN-WASPはZ帯に局在化する
N-WASPが筋原線維のアクチン線維の形成に関与しているかどうかを明らかにするため,まず,成体のマウス骨格筋におけるN-WASPの局在を免疫蛍光染色により解析した.その結果,N-WASPはZ帯に特異的に局在していることが示された.そこでつぎに,骨格筋に筋崩壊を起こしそれにひき続いて起こる筋再生の過程でN-WASPの局在を調べた.Z帯が形成される以前の幼若な筋管細胞ではN-WASPは細胞質の全体に分散していたが,筋原線維が形成され筋細胞が成熟するにつれてN-WASPはZ帯に明瞭に局在化した.
筋細胞の成熟と筋肥大はIGF-1によりもたらされるため,N-WASPのZ帯への局在化がIGF-1により制御されているかどうかを検討した.絶食させたマウスの骨格筋ではN-WASPは筋原線維の全体に分散していたが,IGF-1を投与すると一過的にZ帯に局在化した.さらに,マウス骨格筋に発現させたEGFP標識アクチンの局在を解析した.絶食させたマウスの骨格筋ではEGFP標識アクチンは筋原線維の全体に分散していたが,IGF-1を投与するとZ帯に集積したのち,Z帯から徐々にアクチン線維の全長にわたって局在した.これらの結果から,IGF-1刺激によりN-WASPはZ帯に局在化してZ帯からのアクチン線維の形成にかかわっている可能性が示された.
2.N-WASPはProリッチ領域を介してnebulinのSH3ドメインと結合する
つぎに,IGF-1刺激に依存的にN-WASPをZ帯に局在化させるタンパク質の同定を行った.プルダウンアッセイによってN-WASPに特異的に結合する骨格筋のタンパク質はnebulinであることが明らかになった.筋原線維の巨大タンパク質nebulinのC末端側はZ帯に入り込んでおり,そのC末端にはSH3ドメインが存在している2).そこで,N-WASPのProリッチ領域とnebulinのSH3ドメインとの結合を調べた.nebulinのSH3ドメインはN-WASP全長またはN-WASPのProリッチ領域と結合したが,Proリッチ領域を欠損させたN-WASPとは結合しなかった.また,プルダウンアッセイにおけるN-WASPとnebulinとの結合はN-WASPのProリッチ領域により阻害された.さらに,マウス骨格筋に発現させたN-WASPはZ帯に局在したが,Proリッチ領域を欠損させたN-WASPはZ帯に局在しなかった.これらの結果から,N-WASPはProリッチ領域を介してZ帯に位置するnebulinのSH3ドメインと結合することによりZ帯に局在化することが明らかになった.
3.nebulinとN-WASPとの結合はIGF-1-PI3K-Aktシグナル伝達系により制御される
つぎに,nebulinとN-WASPとの結合がIGF-1シグナル伝達系により制御されているのかどうかを検討した.絶食マウスの骨格筋の抽出物ではnebulinはN-WASPと免疫共沈しなかった.それに対し,IGF-1を投与した絶食マウスの骨格筋の抽出物ではnebulinはN-WASPと共沈した.したがって,N-WASPのnebulinへの結合はIGF-1刺激によって誘導されることが明らかになった.
IGF-1刺激によってPI3K-Aktシグナル伝達系とRas-ERKシグナル伝達系とが活性化される.そこで,これらのシグナル伝達系のいずれによりnebulinとN-WASPとの結合がひき起こされるのか調べた.COS-1細胞に発現させたnebulinのC末端領域とN-WASPとの結合はIGF-1刺激により誘導された.この結合はPI3K阻害剤により抑制されたがMEK阻害剤によっては抑制されなかった.これらの結果から,nebulinとN-WASPとの結合にはRas-ERKシグナル伝達系ではなくPI3K-Aktシグナル伝達系の関与していることが示された.
Aktはさまざまなタンパク質を基質とするSer/Thrキナーゼである.それらの基質のひとつであるGSK-3βはAktによりリン酸化されるとそのキナーゼ活性が阻害される5).COS-1細胞に発現させたnebulinのC末端領域とN-WASPとの結合はIGF-1刺激がなくてもGSK-3β阻害剤により誘導された.また,GSK-3βはin vitroでnebulinのC末端領域をリン酸化し,リン酸化されたこのnebulinのC末端領域はN-WASPとは結合しなかった.実際に,nebulinのSH3ドメインに隣接したSerリッチ領域には2個のGSK-3βでリン酸化されうるコンセンサスSer残基が存在していた.これらのSer残基を非リン酸化Alaに置換したnebulinのC末端領域はGSK-3βによってリン酸化されなかった.さらに,IGF-1を投与した絶食マウスの骨格筋ではZ帯においてAktによるGSK-3βの不活性化リン酸化が起こり,nebulinのコンセンサスSer残基のリン酸化が抑制された.また,nebulinのC末端領域の非リン酸化変異体を骨格筋に発現させた場合にはIGF-1刺激がなくてもN-WASPはZ帯に局在したが,nebulinのC末端領域の擬似リン酸化変異体を骨格筋に発現させた場合にはN-WASPはZ帯に局在しなかった.これらの結果から,IGF-1刺激によって誘導されたPI3K-Aktシグナル伝達系がGSK-3βをリン酸化して不活性化し,その結果,GSK-3βによるnebulinのリン酸化が抑制されることが明らかになった.リン酸化されているnebulinはN-WASPを結合できないが,リン酸化されていないnebulinはN-WASPを結合し,これによりN-WASPはZ帯に局在化することが示された(図2).
4.nebulinとN-WASPとの複合体はアクチン重合核を形成しZ帯からのアクチン重合をひき起こす
N-WASPはArp2/3複合体を活性化して枝分かれしたアクチン線維を形成することが知られている.しかし,筋原線維のアクチン線維には枝分かれはなく直鎖状である.また,筋原線維においてArp2/3複合体は特定の構造に局在していなかった.したがって,N-WASPはArp2/3複合体を介さずに筋原線維のアクチン線維の形成に関与している可能性が考えられた.N-WASPには種々のアクチン重合核形成タンパク質やアクチン伸長タンパク質にみられるWH2(WASP homology 2)ドメインが2つ連続して存在する3,4).WH2ドメインはアクチン単量体を結合する.一方,nebulinにはアクチン単量体結合モチーフをもつモジュールが185個,連続して存在する2).そこで,nebulinとN-WASPとの結合によりnebulinのアクチン単量体結合モチーフをもつモジュールとN-WASPのWH2ドメインとのあいだでアクチン重合核が形成される可能性を検討した.蛍光標識アクチンを用いたアクチン重合アッセイではN-WASPは単独では重合を促進しなかったが,C末端の4個のモジュールを含むnebulin断片は単独で重合を促進した.そして,これにN-WASPをくわえるとさらに重合が促進された.しかし,nebulinに結合できないProリッチ領域を欠損させたN-WASPやアクチン単量体を結合できないC末端を欠損させたN-WASPをくわえた場合には重合は促進されなかった.
つぎに,全反射蛍光顕微鏡(total internal reflection fluorescence microcopy:TIRFM)によりアクチン重合のようすを可視化し解析した.アクチンにアクチン単量体結合モチーフをもつ4個のモジュールを含むnebulinのC末端側の断片をくわえると形成された直鎖状のアクチン線維の数と重合核形成の速度が増加した.これにN-WASPをくわえると形成された直鎖状のアクチン線維の数と重合核形成の速度が大いに増加したが,アクチン線維の伸長速度には影響がみられなかった.また,Proリッチ領域を欠損させたN-WASPやC末端を欠損させたN-WASPをくわえた場合にはアクチン線維の数と重合核形成の速度は増加しなかった.
さらに,マウス骨格筋にN-WASPのsiRNAを発現させN-WASPをノックダウンした.これらのマウスを絶食させてIGF-1を投与してもEGFP標識アクチンはZ帯に集積せず,また,アクチン線維の伸長はみられなかった.したがって,N-WASPはIGF-1によるZ帯からのアクチン線維の形成に不可欠であることが示された.これらの結果から,nebulinとN-WASPとの結合によりnebulinのアクチン単量体結合モチーフをもつモジュールとN-WASPのWH2ドメインとが協同してアクチン重合核を形成しZ帯からのアクチン線維の形成をもたらすものと考えられた.in vitroではnebulinの連続したアクチン単量体結合モチーフをもつモジュールもある程度の重合核形成能を示すが,これはin vivoでのZ帯からのアクチン線維の形成にははたらいていないと思われた.なぜならば,nebulinのアクチン単量体結合モチーフをもつモジュールはZ帯だけでなくアクチン線維の全長にわたり存在するが,アクチン線維の途中からのアクチン重合は起こらないからである.
5.N-WASPはIGF-1による筋肥大に必要である
マウスの成長にともない骨格筋細胞は肥大する.この生理的な筋肥大は内在性のIGF-1が作用することによりもたらされるものと考えられる.また,マウスにIGF-1を投与することによっても筋肥大はひき起こされる.RNAi法によりN-WASPの発現をノックダウンしたマウス骨格筋では成長による生理的な筋肥大もIGF-1投与による筋肥大も抑制された.この筋肥大の抑制はN-WASPの過剰発現により解除されたが,Proリッチ領域を欠損させたN-WASPやC末端を欠損させたN-WASPを過剰発現しても解除されなかった.したがって,N-WASPはnebulinとN-WASPとの複合体の形成をとおして筋原線維のアクチン線維の形成をもたらすことによりIGF-1による筋肥大に必須の役割を担っていることが明らかになった.
おわりに
この研究により,IGF-1によるZ帯からの筋原線維のアクチン線維の形成のシグナル伝達とアクチン重合核の形成の機構が解明された.IGF-1シグナル伝達系はさらにミオシン線維の形成にもかかわっているものと考えられる.この両者があいまって,筋成熟および筋肥大における筋原線維の形成がもたらされるのであろう(図2).最近,心筋細胞における筋原線維のアクチン線維の形成にはたらいているアクチン重合核形成タンパク質の候補としてleiomodin(Lmod)とFhod3とが報告された6,7).しかし,これらのタンパク質はZ帯ではなくアクチン線維の先端に局在しており,Z帯からのアクチン重合にははたらいていないものと考えられる.実際に,Lmodは筋細胞が成熟したあとに発現する.したがって,これらのタンパク質が骨格筋細胞にも発現しているならば,nebulinとN-WASPとの複合体によってZ帯から形成されたアクチン線維の先端の補充や修復にはたらいている可能性が考えられる.
nebulinをコードする遺伝子NEBの突然変異は筋疾患ネマリンミオパチーの原因となっている.このネマリンミオパチーにおいても,また,nebulinのノックアウトマウスにおいても,筋原線維のアクチン線維は短くふぞろいで十分な筋張力が発生せず筋萎縮がみられる8,9).ネマリンミオパチーにおけるNEB遺伝子の突然変異の多くはN-WASPの結合するnebulinのC末端側の欠損をひき起こすものである.したがって,この突然変異によりnebulinとN-WASPとの複合体が形成されずアクチン線維の形成が正常に起こらないことがこの筋疾患の原因のひとつであると考えられる.
nebulinは骨格筋に特異的に発現しており,心筋ではnebulinの代わりに長さが約0.15μmのタンパク質nebuletteが発現している10).nebuletteのC末端にはnebulinと同様にSH3ドメインとそれに隣接するSerリッチ領域とが存在するが,アクチン単量体結合モチーフをもつモジュールは22個しかない.それにもかかわらず,心筋細胞のアクチン線維の長さは約1μmである.そこで,心筋においては,nebuletteとN-WASPとが複合体を形成して重合核を形成するのか,アクチン線維の長さはどのように決定されているのか,また,これらの機構が心筋症や心肥大にかかわっているのかなど,今後,解明されなければならない点は多い.
文 献
- Glass, D. J.: Skeletal muscle hypertrophy and atrophy signaling pathways. Int. J. Biochem. Cell Biol., 37, 1974-1984 (2005)[PubMed]
- Labeit, S., Ottenheijm, C. A. & Granzier, H.: Nebulin, a major player in muscle health and disease. FASEB J., 25, 822-829 (2011)[PubMed]
- Chesarone, M. A. & Goode, B. L.: Actin nucleation and elongation factors: mechanisms and interplay. Curr. Opin. Cell Biol., 21, 28-37 (2009)[PubMed]
- Takenawa, T. & Suetsugu, S.: The WASP-WAVE protein network: connecting the membrane to the cytoskeleton. Nat. Rev. Mol. Cell Biol., 8, 37-48 (2007)[PubMed]
- Manning, B. D. & Cantley, L. C.: AKT/PKB signaling: navigating downstream. Cell, 129, 1261-1274 (2007)[PubMed]
- Chereau, D., Boczkowska, M., Skwarek-Maruszewska, A. et al.: Leiomodin is an actin filament nucleator in muscle cells. Science, 320, 239-243 (2008)[PubMed]
- Taniguchi, K., Takeya, R., Suetsugu, S. et al.: Mammalian formin fhod3 regulates actin assembly and sarcomere organization in striated muscles. J. Biol. Chem., 284, 29873-29881 (2009)[PubMed]
- Ottenheijm, C. A.: Thin filament length dysregulation contributes to muscle weakness in nemaline myopathy patients with nebulin deficiency. Hum. Mol. Genet., 18, 2359-2369 (2009)[PubMed]
- Witt, C. C., Burkart, C., Labeit, D. et al.: Nebulin regulates thin filament length, contractility, and Z-disk structure in vivo. EMBO J., 25, 3843-3855 (2006)[PubMed]
- Littlefield, R. S. & Fowler, V. M.: Thin filament length regulation in striated muscle sarcomeres: pointed-end dynamics go beyond a nebulin ruler. Semin. Cell Dev. Biol., 19, 511-519 (2008)[PubMed]
著者プロフィール
略歴:2006年 千葉大学大学院自然科学研究科 単位取得退学(2007年 理学博士),2007年 東京大学分子細胞生物学研究所 特任研究員を経て,2008年より千葉大学大学院融合科学研究科 助教.
研究テーマ:横紋筋の筋原線維の形成を制御するシグナル伝達系の解明.
抱負:in vivoにおける筋原線維の形成と筋肥大の分子機構の全容を分子細胞生物学的な手法と蛍光イメージングを用いて解明したい.
遠藤 剛(Takeshi Endo)
千葉大学大学院理学研究科 教授.
研究室URL:http://life.s.chiba-u.jp/endo/hp/index.html
© 2011 高野和儀・遠藤 剛 Licensed under CC 表示 2.1 日本