キナーゼ阻害剤とビグアナイド系薬剤の併用による相乗的な抗がん作用の分子機構
森田 斉弘
(米国Texas大学Health Science Center,Department of Molecular Medicine)
email:森田斉弘
DOI: 10.7875/first.author.2018.112
Translational and HIF-1α-dependent metabolic reprogramming underpin metabolic plasticity and responses to kinase inhibitors and biguanides.
Laura Hulea, Simon-Pierre Gravel, Masahiro Morita, Marie Cargnello, Oro Uchenunu, Young Kyuen Im, Camille Lehuédé, Eric H. Ma, Matthew Leibovitch, Shannon McLaughlan, Marie-José Blouin, Maxime Parisotto, Vasilios Papavasiliou, Cynthia Lavoie, Ola Larsson, Michael Ohh, Tiago Ferreira, Celia Greenwood, Gaëlle Bridon, Daina Avizonis, Gerardo Ferbeyre, Peter Siegel, Russell G. Jones, William Muller, Josie Ursini-Siegel, Julie St-Pierre, Michael Pollak, Ivan Topisirovic
Cell Metabolism, 28, 817-832.e8 (2018)
近年,正常な細胞とがん細胞とのあいだの代謝の差異をがんの治療の標的とすることに関心が高まっている.この研究において,筆者らは,キナーゼ阻害剤とビグアナイド系薬剤の併用が種々のがん細胞に対し相乗的かつ選択的に抗がん作用を示すことを明らかにした.キナーゼ阻害剤とビグアナイドの併用は,mTOR複合体1による翻訳の制御を介してアスパラギン酸やセリンといったアミノ酸の合成を抑制し,HIF-1αを介して還元型グルタミン代謝を制御することにより相乗的に抗がん作用を発揮した.以上の結果より,がん細胞は代謝の再プログラム化を介して抗がん剤の処理に適応することにより抵抗性を獲得することが明らかにされ,がん細胞の代謝の可塑性を標的とするキナーゼ阻害剤とビグアナイド系薬剤の併用は新たな治療法につながる可能性が示された.
がん細胞は栄養状態など環境に適応しながら異常な増殖を維持するため代謝を再プログラム化する必要がある1).がん細胞を選択的に抑制するのに,この正常な細胞とがん細胞の代謝の違いを標的とすることが示唆されている.臨床の現場にて抗がん剤として使用されているさまざまなキナーゼ阻害剤の有効性は,解糖系といった代謝経路への作用と相関することが知られている2).また,がんのさまざまなモデルにおいて抗がん作用を示すメトホルミンなどビグアナイド系薬剤に分類される糖尿病の治療薬は,ミトコンドリアにおいて複合体Iを抑制し,エネルギーストレスの誘発および解糖系の活性化をひき起こすことにより抗がん作用を示すことが報告されている3).同様に抗がん作用を示すビグアナイド系薬剤であるフェンホルミンは,より強力な複合型Iの阻害剤であり,乳酸アシドーシスのリスクはあるものの一般に使用される多くの抗がん剤より毒性が低い4).ビグアナイド系薬剤による抗がん作用はキナーゼ阻害剤といった解糖系を抑制する薬剤により増強される5).しかしながら,キナーゼ阻害剤とビグアナイド系薬剤の併用がどのように相乗的に抗がん作用を示すのか,その詳細な分子機構については明らかにされていなかった.
キナーゼ阻害剤とビグアナイド系薬剤の併用はメラノーマに対し有効であることが報告されている6).これらの知見の一般性を確立するため,変異型ErbB2により形質転換したマウス乳がんNT2197細胞,BRAF変異をもつメラノーマ細胞,BCR-ABL陽性の骨髄性白血病細胞,結腸直腸がん細胞において,それぞれに有効なキナーゼ阻害剤およびビグアナイド系薬剤を併用して処理した.ラパチニブは乳がんの治療について承認されたキナーゼ阻害剤である.NT2197細胞をラパチニブおよびフェンホルミンの単独あるいは併用にて処理したところ,単独で処理した場合に比べ併用の処理では低濃度でも細胞の増殖を相乗的に抑制し顕著な細胞死をひき起こした.非がん細胞の増殖に対してはわずかな影響しかおよぼさなかった.キナーゼ阻害剤とビグアナイド系薬剤の併用は,ほかのがん細胞に対しても相乗的な抗がん作用を示した.細胞における結果と一致して,NT2197細胞を移植したマウスにおいても同様の相乗的な抗がん作用が確認された.以上のことより,キナーゼ阻害剤とビグアナイド系薬剤の併用は抗がん作用を増強することが明らかにされた.
ラパチニブとフェンホルミンの併用による相乗的な抗がん作用にかかわる代謝経路の同定を試みた.フェンホルミンは,ミトコンドリアの活性を抑制しクエン酸回路の中間代謝物であるクエン酸およびコハク酸をいちじるしく減少させ,その代償的な結果として解糖系を活性化し乳酸を増加させた.対照的に,ラパチニブは解糖系を抑制し乳酸を減少させた.解糖系の活性の指標となるグルコースの取り込みおよび乳酸とピルビン酸の比はフェンホルミンにより増加しラパチニブにより減少した.さらに,ラパチニブはフェンホルミンによるグルコースの取り込みおよび乳酸とピルビン酸の比の増加を抑制した.したがって,ラパチニブとフェンホルミンの併用は,フェンホルミンに対するがん細胞の解糖系の代謝への適応をラパチニブが阻害することにより相乗的な作用をもたらすことが示唆された.
ラパチニブとフェンホルミンは,クエン酸回路の中間代謝物であるフマル酸,リンゴ酸,クエン酸,2-オキソグルタル酸に対し反対の効果を示した.このことから,ラパチニブはフェンホルミンによるクエン酸回路における代謝への効果を相殺する可能性が示唆され,実際に,ラパチニブはフェンホルミンによるクエン酸回路の中間代謝物およびアスパラギン酸への作用を減弱させた.
還元型グルタミン代謝は,脂質やアミノ酸の合成といった同化代謝のために必要とされるクエン酸回路の中間代謝物の産生に寄与する1).フェノホルンは還元型グルタミン代謝の指標となる2-オキソグルタル酸とクエン酸の比を上昇させた.このフェンホルミンによる作用はラパチニブにより抑制された.還元型グルタミン代謝の活性をより詳細に測定するため13C5-グルタミンの追跡実験を実施したところ,予想どおり,還元型グルタミン代謝はフェンホルミンにより活性化され,その活性化はラパチニブとフェンホルミンの併用により減弱した.
ラパチニブとフェンホルミンの併用による同様の代謝への作用は種々のがん細胞において観察され,NT2197細胞を移植したマウスにおいても確認された.以上のことより,ラパチニブとフェンホルミンの併用はがん細胞の個々の薬剤への代謝の適応を相殺することにより相乗的に抗がん作用を示すことが示唆された.
ラパチニブとフェンホルミンの併用による相乗的な抗がん作用および代謝への作用について詳細な分子機構を明らかにすることを試みた.発がん性のシグナル伝達経路の多くは翻訳を活性化しタンパク質の合成を増加させることが知られている7).ラパチニブとフェンホルミンの併用は単独と比較してより強く翻訳を抑制した.細胞の内外の栄養状態を感知し翻訳を制御するシグナル伝達経路を構成するキナーゼとしてmTOR複合体1が知られている.予想したとおり,ラパチニブおよびフェンホルミンは単独でもmTOR複合体1のキナーゼ活性の指標となる4E-BP1およびS6Kのリン酸化を抑制し,併用ではより強力に抑制した.mTOR複合体1-4E-BP-eIF4Eシグナル伝達経路がラパチニブとフェンホルミンの併用による相乗的な作用に寄与するかどうかを調べるため,NT2197細胞において4E-BP1および4E-BP2を欠損させたところ,ラパチニブとフェンホルミンの併用による相乗的な抗がん作用およびアポトーシスの促進作用は4E-BP1および4E-BP2が欠損した細胞において減弱した.このことから,4E-BP1および4E-BP2はキナーゼ阻害剤あるいはビグアナイド系薬剤の作用に重要であることが示唆された.筆者らは,eIF4Eの標的となるmRNAの網羅的な探索について報告しており8)(新着論文レビュー でも掲載),eIF4Eに感受性のmRNAの翻訳活性に対するラパチニブおよびフェンホルミンによる抑制が確認された.ラパチニブとフェンホルミンの併用は,単独より劇的にeIF4Fに感受性のmRNAにコードされるタンパク質を減少させた.
ラパチニブとフェンホルミンの併用によるがん細胞の代謝に対する相乗的な効果にmTOR複合体1-4E-BP-eIF4Eシグナル伝達経路がかかわるかどうか調べた.質量分析計を用いたメタボローム解析により,ラパチニブとフェンホルミンの併用はセリン,グリシン,プロリンを増加させ,アスパラギン酸,グルタミン酸,メチオニンを減少させることが明らかにされた.これらの代謝経路に関与する酵素に対する影響について調べたところ,ラパチニブとフェンホルミンの併用は,セリンおよびアスパラギン酸の代謝経路におけるホスホグリセリン酸デヒドロゲナーゼ,ホスホセリンアミノトランスフェラーゼ1,ピルビン酸カルボキシラーゼ,アスパラギンシンテターゼのタンパク質レベルでの発現を低下させた.併用によるこれらの酵素への発現の抑制は,4E-BP1および4E-BP2を欠損させた細胞においては減弱していた.薬剤を処理していないがん細胞においては,これらの酵素をコードするmRNAはポリソーム画分に分布し高効率で翻訳されているが,ラパチニブとフェンホルミンの併用はこれらのmRNAの翻訳の効率を低下させた.併用による翻訳の抑制は4E-BP1および4E-BP2を欠損させた細胞では減弱しており,4E-BP1および4E-BP2がラパチニブあるいはフェンホルミンによる翻訳の抑制を仲介することが明らかにされた.対照的に,ラパチニブあるいはフェンホルミンはeIF4Fに非感受性であるβアクチンをコードするmRNAの翻訳には影響をおよぼさなかった.
NT2197細胞における4E-BP1および4E-BP2の欠損は,アスパラギン酸,グルタミン酸,ピルビン酸,マレイン酸,フマル酸といったクエン酸回路の中間代謝物を増加させた.ラパチニブとフェンホルミンの併用はこれら中間代謝物の量を変化させたが,4E-BP1および4E-BP2を欠損させた細胞においてその変化は減弱した.アスパラギン酸およびセリンの合成は,核酸やタンパク質の合成といった増殖に必要な同化代謝に重要であることが知られている1).4E-BP1および4E-BP2を欠損させた細胞におけるアスパラギン酸の代謝の活性化を担う代謝経路を同定するため13C6-グルコースを用いた追跡実験を実施したところ,4E-BP1および4E-BP2の欠損によるアスパラギン酸の増加はピルビン酸カルボキシラーゼを介した代謝経路によりもたらされていた.この結果は,ピルビン酸カルボキシラーゼをコードするmRNAの翻訳活性の上昇と一致した.セリンは解糖系の中間代謝物によるセリンペントース代謝経路に由来するが,4E-BP1および4E-BP2の欠損はセリンも増加させた.このことは,セリンペントース代謝経路にかかわるホスホグリセリン酸デヒドロゲナーゼおよびホスホセリンアミノトランスフェラーゼ1をコードするmRNAの翻訳活性の上昇と一致した.さらに,ラパチニブとフェンホルミンの併用に対し抵抗性を示す4E-BP1および4E-BP2を欠損させた細胞においてホスホグリセリン酸デヒドロゲナーゼの発現を低下させたところ,併用への感受性が上昇した.したがって,mTOR複合体1-4E-BP-eIF4Eシグナル伝達経路によるアスパラギン酸およびセリンの合成の制御がラパチニブとフェンホルミンの併用による作用を決定することが示唆された.
ラパチニブとフェンホルミンの併用により強い影響をうけるタンパク質として,転写因子であるHIF-1αも同定された.HIF-1αは,酸素の濃度が正常な状態においてはユビキチンリガーゼであるVHLにより分解に導かれ,低酸素の状態においては発現が誘導される.腎臓がん細胞であるRCC4細胞においてはVHLが欠損しているためHIF-1αが強く発現し,VHLを発現するRCC4-VHL細胞においてはHIF-1αの発現は抑制される.ラパチニブとフェンホルミンの併用により,RCC4細胞におけるHIF-1αの発現はVHLに依存的に低下した.さらに,併用による抗がん作用は,RCC4-VHL細胞においてはみられたものの,RCC4細胞においては顕著ではなかった.
ラパチニブとフェンホルミンの併用によるがん細胞での代謝の適応の抑制におけるVHLおよびHIF-1αの役割について検証した.フェンホルミンは副次的に解糖系を活性化し,ラパチニブとフェンホルミンの併用は活性化された解糖系を抑制する.この作用はRCC4-VHL細胞においてより大きく,RCC4細胞は併用に対し抵抗性を示した.フェンホルミンは副次的に還元型グルタミン代謝を活性化し,この作用はラパチニブによって抑制される.13C5-グルタミンの追跡実験を実施したところ,フェンホルミンとラパチニブの併用における還元型グルタミン代謝への作用はRCC4-VHL細胞においてより大きく,RCC4細胞は抵抗性を示した.以上の結果により,HIF-1αが還元型グルタミン代謝におけるフェンホルミンとラパチニブの併用による作用に対する感受性を決定することが示された.
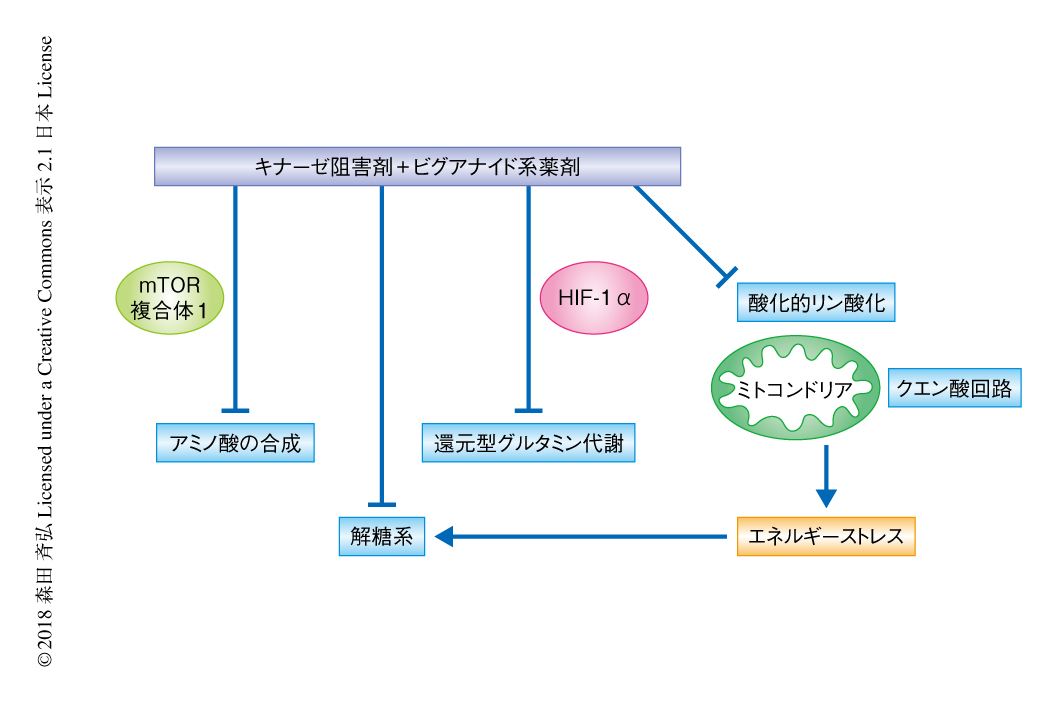
ビグアナイド系薬剤はキナーゼ阻害剤の有効性を改善することが示唆されており,臨床試験において,ビグアナイド系薬剤はトラスツズマブ,BRAF阻害剤,ERK阻害剤の活性を増強することが報告されている6).この研究において,筆者らは,mTOR複合体およびHIF-1αを介して制御される代謝および翻訳が,キナーゼ阻害剤とビグアナイド系薬剤の併用における抗がん作用に決定的に寄与することを明らかにした(図1).これまで,筆者らは,mTOR複合体1-4E-BP-eIF4Eシグナル伝達経路がミトコンドリアの活性および動態を制御することを明らかにしてきた9)(新着論文レビュー でも掲載).この研究においては,セリンの合成における4E-BPに依存的な翻訳の制御,および,還元型グルタミン代謝におけるHIF-1αに依存的な制御が,キナーゼ阻害剤とビグアナイド系薬剤の併用におけるがん細胞の感受性の決定因子であることが示された.キナーゼ阻害剤とビグアナイド系薬剤の併用は相乗的に抗がん作用を示すことが明らかにされたが,ビグアナイド系薬剤を用いた臨床試験の初期の結果は残念なものであったことに注意する必要がある.現在,新規のビグアナイド系薬剤あるいはほかのOXPHOS阻害剤も開発が進められており,BRAF阻害剤とフェンホルミンとの併用を含む臨床試験が進行中である.また,この研究においては細胞を用いた実験系が主体であったが,キナーゼ阻害剤とビグアナイド系薬剤の併用の効用だけでなく薬物の動態や薬力学について調べるためには臨床に近いモデルを用いた実験系が必要であり,今後,個体のレベルでの解析が重要となると考えられる.
略歴:2008年 東京大学大学院理学系研究科 修了,同年 東京大学医科学研究所 博士研究員,2010年 カナダMcGill大学 博士研究員,同 助教を経て,2017年より米国Texas大学Health Science Center助教授.
研究テーマ:がんやメタボリックシンドロームにおけるmRNAの翻訳および分解の制御機構.
関心事:ラボの運営と日々の健康.
© 2018 森田 斉弘 Licensed under CC 表示 2.1 日本
(米国Texas大学Health Science Center,Department of Molecular Medicine)
email:森田斉弘
DOI: 10.7875/first.author.2018.112
Translational and HIF-1α-dependent metabolic reprogramming underpin metabolic plasticity and responses to kinase inhibitors and biguanides.
Laura Hulea, Simon-Pierre Gravel, Masahiro Morita, Marie Cargnello, Oro Uchenunu, Young Kyuen Im, Camille Lehuédé, Eric H. Ma, Matthew Leibovitch, Shannon McLaughlan, Marie-José Blouin, Maxime Parisotto, Vasilios Papavasiliou, Cynthia Lavoie, Ola Larsson, Michael Ohh, Tiago Ferreira, Celia Greenwood, Gaëlle Bridon, Daina Avizonis, Gerardo Ferbeyre, Peter Siegel, Russell G. Jones, William Muller, Josie Ursini-Siegel, Julie St-Pierre, Michael Pollak, Ivan Topisirovic
Cell Metabolism, 28, 817-832.e8 (2018)
要 約
近年,正常な細胞とがん細胞とのあいだの代謝の差異をがんの治療の標的とすることに関心が高まっている.この研究において,筆者らは,キナーゼ阻害剤とビグアナイド系薬剤の併用が種々のがん細胞に対し相乗的かつ選択的に抗がん作用を示すことを明らかにした.キナーゼ阻害剤とビグアナイドの併用は,mTOR複合体1による翻訳の制御を介してアスパラギン酸やセリンといったアミノ酸の合成を抑制し,HIF-1αを介して還元型グルタミン代謝を制御することにより相乗的に抗がん作用を発揮した.以上の結果より,がん細胞は代謝の再プログラム化を介して抗がん剤の処理に適応することにより抵抗性を獲得することが明らかにされ,がん細胞の代謝の可塑性を標的とするキナーゼ阻害剤とビグアナイド系薬剤の併用は新たな治療法につながる可能性が示された.
はじめに
がん細胞は栄養状態など環境に適応しながら異常な増殖を維持するため代謝を再プログラム化する必要がある1).がん細胞を選択的に抑制するのに,この正常な細胞とがん細胞の代謝の違いを標的とすることが示唆されている.臨床の現場にて抗がん剤として使用されているさまざまなキナーゼ阻害剤の有効性は,解糖系といった代謝経路への作用と相関することが知られている2).また,がんのさまざまなモデルにおいて抗がん作用を示すメトホルミンなどビグアナイド系薬剤に分類される糖尿病の治療薬は,ミトコンドリアにおいて複合体Iを抑制し,エネルギーストレスの誘発および解糖系の活性化をひき起こすことにより抗がん作用を示すことが報告されている3).同様に抗がん作用を示すビグアナイド系薬剤であるフェンホルミンは,より強力な複合型Iの阻害剤であり,乳酸アシドーシスのリスクはあるものの一般に使用される多くの抗がん剤より毒性が低い4).ビグアナイド系薬剤による抗がん作用はキナーゼ阻害剤といった解糖系を抑制する薬剤により増強される5).しかしながら,キナーゼ阻害剤とビグアナイド系薬剤の併用がどのように相乗的に抗がん作用を示すのか,その詳細な分子機構については明らかにされていなかった.
1.キナーゼ阻害剤とビグアナイド系薬剤の併用は相乗的かつ選択的に抗がん作用を示す
キナーゼ阻害剤とビグアナイド系薬剤の併用はメラノーマに対し有効であることが報告されている6).これらの知見の一般性を確立するため,変異型ErbB2により形質転換したマウス乳がんNT2197細胞,BRAF変異をもつメラノーマ細胞,BCR-ABL陽性の骨髄性白血病細胞,結腸直腸がん細胞において,それぞれに有効なキナーゼ阻害剤およびビグアナイド系薬剤を併用して処理した.ラパチニブは乳がんの治療について承認されたキナーゼ阻害剤である.NT2197細胞をラパチニブおよびフェンホルミンの単独あるいは併用にて処理したところ,単独で処理した場合に比べ併用の処理では低濃度でも細胞の増殖を相乗的に抑制し顕著な細胞死をひき起こした.非がん細胞の増殖に対してはわずかな影響しかおよぼさなかった.キナーゼ阻害剤とビグアナイド系薬剤の併用は,ほかのがん細胞に対しても相乗的な抗がん作用を示した.細胞における結果と一致して,NT2197細胞を移植したマウスにおいても同様の相乗的な抗がん作用が確認された.以上のことより,キナーゼ阻害剤とビグアナイド系薬剤の併用は抗がん作用を増強することが明らかにされた.
2.キナーゼ阻害剤とビグアナイド系薬剤の併用はがん細胞の代謝を標的にする
ラパチニブとフェンホルミンの併用による相乗的な抗がん作用にかかわる代謝経路の同定を試みた.フェンホルミンは,ミトコンドリアの活性を抑制しクエン酸回路の中間代謝物であるクエン酸およびコハク酸をいちじるしく減少させ,その代償的な結果として解糖系を活性化し乳酸を増加させた.対照的に,ラパチニブは解糖系を抑制し乳酸を減少させた.解糖系の活性の指標となるグルコースの取り込みおよび乳酸とピルビン酸の比はフェンホルミンにより増加しラパチニブにより減少した.さらに,ラパチニブはフェンホルミンによるグルコースの取り込みおよび乳酸とピルビン酸の比の増加を抑制した.したがって,ラパチニブとフェンホルミンの併用は,フェンホルミンに対するがん細胞の解糖系の代謝への適応をラパチニブが阻害することにより相乗的な作用をもたらすことが示唆された.
ラパチニブとフェンホルミンは,クエン酸回路の中間代謝物であるフマル酸,リンゴ酸,クエン酸,2-オキソグルタル酸に対し反対の効果を示した.このことから,ラパチニブはフェンホルミンによるクエン酸回路における代謝への効果を相殺する可能性が示唆され,実際に,ラパチニブはフェンホルミンによるクエン酸回路の中間代謝物およびアスパラギン酸への作用を減弱させた.
還元型グルタミン代謝は,脂質やアミノ酸の合成といった同化代謝のために必要とされるクエン酸回路の中間代謝物の産生に寄与する1).フェノホルンは還元型グルタミン代謝の指標となる2-オキソグルタル酸とクエン酸の比を上昇させた.このフェンホルミンによる作用はラパチニブにより抑制された.還元型グルタミン代謝の活性をより詳細に測定するため13C5-グルタミンの追跡実験を実施したところ,予想どおり,還元型グルタミン代謝はフェンホルミンにより活性化され,その活性化はラパチニブとフェンホルミンの併用により減弱した.
ラパチニブとフェンホルミンの併用による同様の代謝への作用は種々のがん細胞において観察され,NT2197細胞を移植したマウスにおいても確認された.以上のことより,ラパチニブとフェンホルミンの併用はがん細胞の個々の薬剤への代謝の適応を相殺することにより相乗的に抗がん作用を示すことが示唆された.
3.キナーゼ阻害剤とビグアナイド系薬剤の併用はmTOR複合体1およびタンパク質の合成を相乗的に抑制する
ラパチニブとフェンホルミンの併用による相乗的な抗がん作用および代謝への作用について詳細な分子機構を明らかにすることを試みた.発がん性のシグナル伝達経路の多くは翻訳を活性化しタンパク質の合成を増加させることが知られている7).ラパチニブとフェンホルミンの併用は単独と比較してより強く翻訳を抑制した.細胞の内外の栄養状態を感知し翻訳を制御するシグナル伝達経路を構成するキナーゼとしてmTOR複合体1が知られている.予想したとおり,ラパチニブおよびフェンホルミンは単独でもmTOR複合体1のキナーゼ活性の指標となる4E-BP1およびS6Kのリン酸化を抑制し,併用ではより強力に抑制した.mTOR複合体1-4E-BP-eIF4Eシグナル伝達経路がラパチニブとフェンホルミンの併用による相乗的な作用に寄与するかどうかを調べるため,NT2197細胞において4E-BP1および4E-BP2を欠損させたところ,ラパチニブとフェンホルミンの併用による相乗的な抗がん作用およびアポトーシスの促進作用は4E-BP1および4E-BP2が欠損した細胞において減弱した.このことから,4E-BP1および4E-BP2はキナーゼ阻害剤あるいはビグアナイド系薬剤の作用に重要であることが示唆された.筆者らは,eIF4Eの標的となるmRNAの網羅的な探索について報告しており8)(新着論文レビュー でも掲載),eIF4Eに感受性のmRNAの翻訳活性に対するラパチニブおよびフェンホルミンによる抑制が確認された.ラパチニブとフェンホルミンの併用は,単独より劇的にeIF4Fに感受性のmRNAにコードされるタンパク質を減少させた.
4.mTOR複合体1はがん細胞の増殖を促進する酵素の翻訳を制御する
ラパチニブとフェンホルミンの併用によるがん細胞の代謝に対する相乗的な効果にmTOR複合体1-4E-BP-eIF4Eシグナル伝達経路がかかわるかどうか調べた.質量分析計を用いたメタボローム解析により,ラパチニブとフェンホルミンの併用はセリン,グリシン,プロリンを増加させ,アスパラギン酸,グルタミン酸,メチオニンを減少させることが明らかにされた.これらの代謝経路に関与する酵素に対する影響について調べたところ,ラパチニブとフェンホルミンの併用は,セリンおよびアスパラギン酸の代謝経路におけるホスホグリセリン酸デヒドロゲナーゼ,ホスホセリンアミノトランスフェラーゼ1,ピルビン酸カルボキシラーゼ,アスパラギンシンテターゼのタンパク質レベルでの発現を低下させた.併用によるこれらの酵素への発現の抑制は,4E-BP1および4E-BP2を欠損させた細胞においては減弱していた.薬剤を処理していないがん細胞においては,これらの酵素をコードするmRNAはポリソーム画分に分布し高効率で翻訳されているが,ラパチニブとフェンホルミンの併用はこれらのmRNAの翻訳の効率を低下させた.併用による翻訳の抑制は4E-BP1および4E-BP2を欠損させた細胞では減弱しており,4E-BP1および4E-BP2がラパチニブあるいはフェンホルミンによる翻訳の抑制を仲介することが明らかにされた.対照的に,ラパチニブあるいはフェンホルミンはeIF4Fに非感受性であるβアクチンをコードするmRNAの翻訳には影響をおよぼさなかった.
NT2197細胞における4E-BP1および4E-BP2の欠損は,アスパラギン酸,グルタミン酸,ピルビン酸,マレイン酸,フマル酸といったクエン酸回路の中間代謝物を増加させた.ラパチニブとフェンホルミンの併用はこれら中間代謝物の量を変化させたが,4E-BP1および4E-BP2を欠損させた細胞においてその変化は減弱した.アスパラギン酸およびセリンの合成は,核酸やタンパク質の合成といった増殖に必要な同化代謝に重要であることが知られている1).4E-BP1および4E-BP2を欠損させた細胞におけるアスパラギン酸の代謝の活性化を担う代謝経路を同定するため13C6-グルコースを用いた追跡実験を実施したところ,4E-BP1および4E-BP2の欠損によるアスパラギン酸の増加はピルビン酸カルボキシラーゼを介した代謝経路によりもたらされていた.この結果は,ピルビン酸カルボキシラーゼをコードするmRNAの翻訳活性の上昇と一致した.セリンは解糖系の中間代謝物によるセリンペントース代謝経路に由来するが,4E-BP1および4E-BP2の欠損はセリンも増加させた.このことは,セリンペントース代謝経路にかかわるホスホグリセリン酸デヒドロゲナーゼおよびホスホセリンアミノトランスフェラーゼ1をコードするmRNAの翻訳活性の上昇と一致した.さらに,ラパチニブとフェンホルミンの併用に対し抵抗性を示す4E-BP1および4E-BP2を欠損させた細胞においてホスホグリセリン酸デヒドロゲナーゼの発現を低下させたところ,併用への感受性が上昇した.したがって,mTOR複合体1-4E-BP-eIF4Eシグナル伝達経路によるアスパラギン酸およびセリンの合成の制御がラパチニブとフェンホルミンの併用による作用を決定することが示唆された.
5.HIF-1αはラパチニブおよびフェンホルミンに対する感受性に影響する
ラパチニブとフェンホルミンの併用により強い影響をうけるタンパク質として,転写因子であるHIF-1αも同定された.HIF-1αは,酸素の濃度が正常な状態においてはユビキチンリガーゼであるVHLにより分解に導かれ,低酸素の状態においては発現が誘導される.腎臓がん細胞であるRCC4細胞においてはVHLが欠損しているためHIF-1αが強く発現し,VHLを発現するRCC4-VHL細胞においてはHIF-1αの発現は抑制される.ラパチニブとフェンホルミンの併用により,RCC4細胞におけるHIF-1αの発現はVHLに依存的に低下した.さらに,併用による抗がん作用は,RCC4-VHL細胞においてはみられたものの,RCC4細胞においては顕著ではなかった.
ラパチニブとフェンホルミンの併用によるがん細胞での代謝の適応の抑制におけるVHLおよびHIF-1αの役割について検証した.フェンホルミンは副次的に解糖系を活性化し,ラパチニブとフェンホルミンの併用は活性化された解糖系を抑制する.この作用はRCC4-VHL細胞においてより大きく,RCC4細胞は併用に対し抵抗性を示した.フェンホルミンは副次的に還元型グルタミン代謝を活性化し,この作用はラパチニブによって抑制される.13C5-グルタミンの追跡実験を実施したところ,フェンホルミンとラパチニブの併用における還元型グルタミン代謝への作用はRCC4-VHL細胞においてより大きく,RCC4細胞は抵抗性を示した.以上の結果により,HIF-1αが還元型グルタミン代謝におけるフェンホルミンとラパチニブの併用による作用に対する感受性を決定することが示された.
おわりに
ビグアナイド系薬剤はキナーゼ阻害剤の有効性を改善することが示唆されており,臨床試験において,ビグアナイド系薬剤はトラスツズマブ,BRAF阻害剤,ERK阻害剤の活性を増強することが報告されている6).この研究において,筆者らは,mTOR複合体およびHIF-1αを介して制御される代謝および翻訳が,キナーゼ阻害剤とビグアナイド系薬剤の併用における抗がん作用に決定的に寄与することを明らかにした(図1).これまで,筆者らは,mTOR複合体1-4E-BP-eIF4Eシグナル伝達経路がミトコンドリアの活性および動態を制御することを明らかにしてきた9)(新着論文レビュー でも掲載).この研究においては,セリンの合成における4E-BPに依存的な翻訳の制御,および,還元型グルタミン代謝におけるHIF-1αに依存的な制御が,キナーゼ阻害剤とビグアナイド系薬剤の併用におけるがん細胞の感受性の決定因子であることが示された.キナーゼ阻害剤とビグアナイド系薬剤の併用は相乗的に抗がん作用を示すことが明らかにされたが,ビグアナイド系薬剤を用いた臨床試験の初期の結果は残念なものであったことに注意する必要がある.現在,新規のビグアナイド系薬剤あるいはほかのOXPHOS阻害剤も開発が進められており,BRAF阻害剤とフェンホルミンとの併用を含む臨床試験が進行中である.また,この研究においては細胞を用いた実験系が主体であったが,キナーゼ阻害剤とビグアナイド系薬剤の併用の効用だけでなく薬物の動態や薬力学について調べるためには臨床に近いモデルを用いた実験系が必要であり,今後,個体のレベルでの解析が重要となると考えられる.
文 献
- Vander Heiden, M. G. & DeBerardinis, R. J.: Understanding the intersections between metabolism and cancer biology. Cell, 168, 657-669 (2017)[PubMed]
- Poliakova, M., Aebersold, D. M., Zimmer, Y. et al.: The relevance of tyrosine kinase inhibitors for global metabolic pathways in cancer. Mol. Cancer, 17, 27 (2018)[PubMed]
- DeBerardinis, R. J. & Chandel, N. S.: Fundamentals of cancer metabolism. Sci. Adv., 2, e1600200 (2016)[PubMed]
- Bridges, H. R., Jones, A. J., Pollak, M. N. et al.: Effects of metformin and other biguanides on oxidative phosphorylation in mitochondria. Biochem. J., 462, 475-487 (2014)[PubMed]
- Pollak, M.: Targeting oxidative phosphorylation: why, when, and how. Cancer Cell, 23, 263-264 (2013)[PubMed]
- Trousil, S., Chen, S., Mu, C. et al.: Phenformin enhances the efficacy of ERK inhibition in NF1-mutant melanoma. J. Invest. Dermatol., 137, 1135-1143 (2017)[PubMed]
- Bhat, M., Robichaud, N., Hulea, L. et al.: Targeting the translation machinery in cancer. Nat. Rev. Drug Discov., 14, 261-278 (2015)[PubMed]
- Morita, M., Gravel, S. P., Chenard, V. et al.: mTORC1 controls mitochondrial activity and biogenesis through 4E-BP-dependent translational regulation. Cell Metab., 18, 698-711 (2013)[PubMed] [新着論文レビュー]
- Morita, M., Prudent, J., Basu, K. et al.: mTOR controls mitochondrial dynamics and cell survival via MTFP1. Mol. Cell, 67, 922-935.e5 (2017)[PubMed] [新着論文レビュー]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2008年 東京大学大学院理学系研究科 修了,同年 東京大学医科学研究所 博士研究員,2010年 カナダMcGill大学 博士研究員,同 助教を経て,2017年より米国Texas大学Health Science Center助教授.
研究テーマ:がんやメタボリックシンドロームにおけるmRNAの翻訳および分解の制御機構.
関心事:ラボの運営と日々の健康.
© 2018 森田 斉弘 Licensed under CC 表示 2.1 日本