白血病における幹細胞治療の新たな標的タンパク質TIM-3の同定
菊繁吉謙・赤司浩一
(九州大学大学院医学研究院 病態修復内科学)
email:菊繁吉謙
DOI: 10.7875/first.author.2011.010
TIM-3 is a promising target to selectively kill acute myeloid leukemia stem cells.
Yoshikane Kikushige, Takahiro Shima, Shin-ichiro Takayanagi, Shingo Urata, Toshihiro Miyamoto, Hiromi Iwasaki, Katsuto Takenaka, Takanori Teshima, Toshiyuki Tanaka, Yoshimasa Inagaki, Koichi Akashi
Cell Stem Cell, 7, 708-717 (2010)
ヒト急性骨随性白血病においては一部の白血病幹細胞のみが自己複製能と限定された分化能をもち白血病細胞集団を維持している.急性骨随性白血病の根治のためにはこの白血病幹細胞の根絶が必要であるが,この幹細胞を治療の標的とするのにはその生物学的な特性の詳細な解明が重要である.筆者らは,ヒトの白血病試料より白血病幹細胞の画分を純化し正常な造血幹細胞と遺伝子発現プロファイリングを比較した.その結果,造血幹細胞には発現せず白血病幹細胞に特異的に高発現する表面抗原としてTIM-3を同定した.このTIM-3は急性前骨髄球性白血病を除くほぼすべての急性骨随性白血病の白血病幹細胞に高発現していた.細胞障害活性をもつマウス抗ヒトTIM-3モノクローナル抗体を樹立し免疫不全マウスを用いて急性骨随性白血病に対する効果をin vivoで検討した.急性骨随性白血病を再構築したマウスにこのモノクローナル抗体を投与することで白血病幹細胞を含む急性骨随性白血病細胞は有意に減少し,治療ののち残存した急性骨随性白血病細胞も2次移植ではマウスに白血病を再構築できなかった.以上より,TIM-3は急性骨随性白血病の治療において有用な治療標的である可能性が示された.
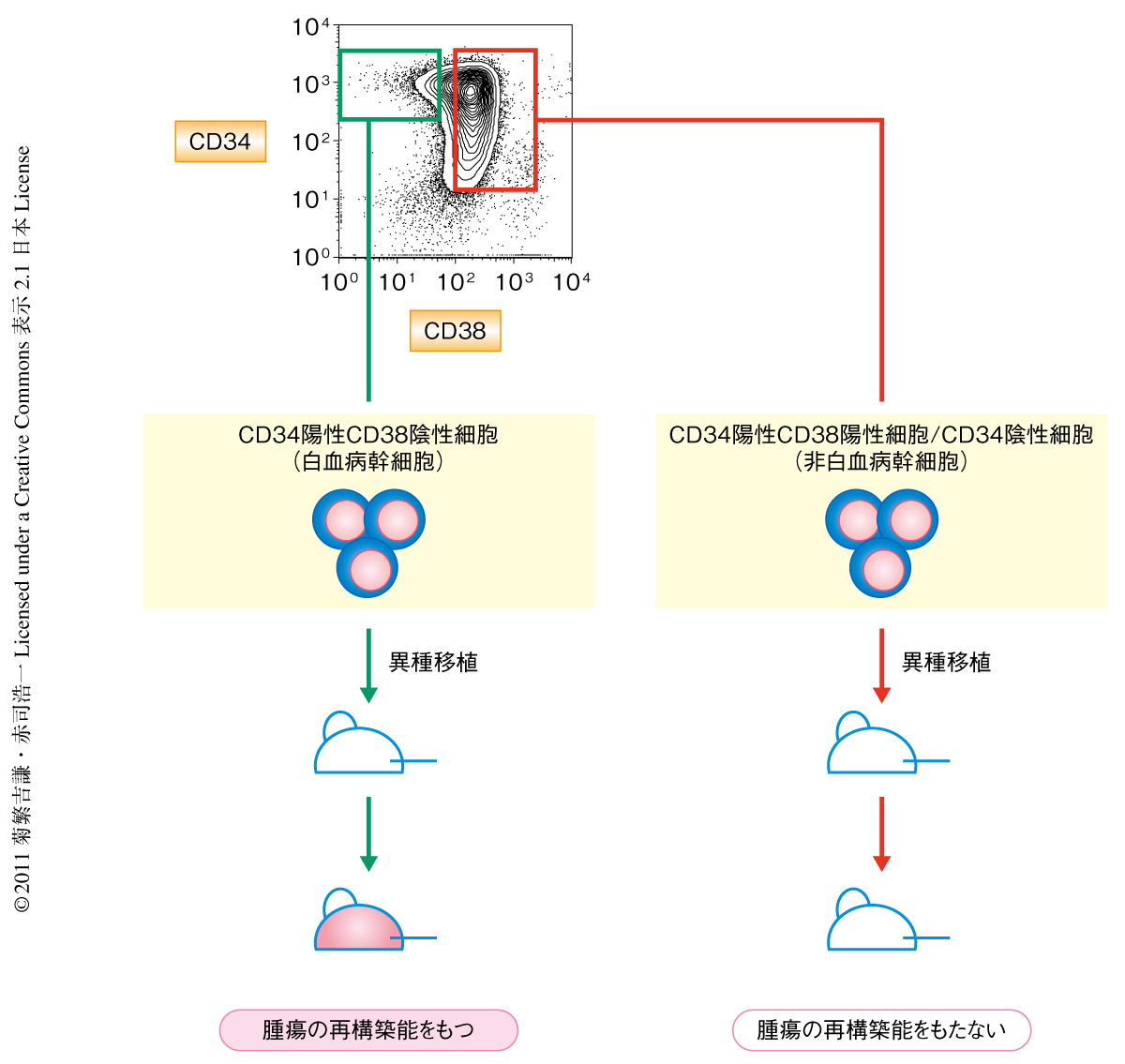
ヒト急性骨随性白血病(acute myeloid leukemia:AML)ではごく少数の白血病幹細胞(leukemic stem cell:LSC)のみが造腫瘍能をもち白血病細胞集団を維持していることが免疫不全マウスを用いた近年の研究で明らかになった1,2)(図1).急性骨随性白血病は化学療法によりいったんは寛解を得られても残存する白血病幹細胞の再増殖によりその多くが再発をきたす.したがって,治癒のためには白血病幹細胞の根絶が必要である.白血病幹細胞は正常な造血幹細胞(hematopoietic stem cell:HSC)と同様にCD34陽性CD38陰性画分に存在し,その多くがG0期にあって細胞周期に依存的な化学療法には抵抗性を示す3).また,自己複製能および骨髄支持構造も正常な造血幹細胞と類似した機構を利用しており,白血病幹細胞を標的とした治療法の確立はいまだ困難である.今回,筆者らは,白血病幹細胞に特異的に発現する細胞表面抗原TIM-3を同定し,これが有用な治療標的となりうることを見い出した.
白血病幹細胞には高発現するが正常な造血幹細胞には発現しない表面抗原を同定できれば白血病幹細胞を直接に治療標的とした抗体療法が可能となる.そこで,蛍光セルソーター(FACS)によって白血病幹細胞の存在するCD34陽性CD38陰性の急性骨随性白血病細胞画分とCD34陽性CD38陰性の造血幹細胞画分を純化し,マイクロアレイによる遺伝子発現プロファイリング解析を行い白血病幹細胞のみに高発現する候補遺伝子を抽出した.その結果,白血病幹細胞に特異的な表面抗原として既知のCLL-1 4),CD96 5) にくわえ,新規にTIM-3(T-cell immunoglobulin mucin-3)が白血病幹細胞において高発現することを見い出した.TIM-3はマウスTh1細胞に発現する表面抗原として報告され,そののち,樹状細胞,マクロファージ,さらには,CD8陽性T細胞での発現も報告されており,種々の免疫応答を調節するタンパク質として注目されている6-10).
つぎに,白血病幹細胞におけるタンパク質レベルでのTIM-3の発現をFACSにて解析した(図2).CD34陽性CD38陰性CD90陰性の白血病幹細胞は一様にTIM-3を高発現しているのに対し,CD34陽性CD38陰性CD90陽性の造血幹細胞はTIM-3を発現していなかった.すなわち,TIM-3は白血病幹細胞に特異的な治療標的の候補としての条件をみたしていた.急性骨随性白血病のサブタイプにおいてTIM-3の発現に差があるかどうかを検討したところ,急性前骨髄球性白血病以外のすべての症例の白血病幹細胞画分で高発現を認めた.染色体異常などの遺伝子変異の有無によりTIM-3の発現に差は認められなかった.
近年,CD34陽性CD38陰性画分以外の急性骨随性白血病細胞にも腫瘍の再構築能をもつ白血病幹細胞の存在する可能性が報告されている.そこで,機能的な白血病幹細胞がTIM-3を発現するかどうかを評価するため,TIM-3陽性急性骨随性白血病細胞とTIM-3陰性急性骨随性白血病を純化して免疫不全マウスに移植し,急性骨随性白血病の再構築能を比較検討した.その結果,TIM-3陽性細胞は急性骨随性白血病をマウスに再構築したがTIM-3陰性細胞は再構築しなかった.このことから,急性骨随性白血病の再構築能をもつ白血病幹細胞はTIM-3を発現していることが示された.表面形質により定義されたCD34陽性CD38陰性の白血病幹細胞,および,異種移植アッセイ系により定義された機能的な白血病幹細胞はともにTIM-3を発現していたので,TIM-3を標的とした新規の抗体療法を試みた.
TIM-3を標的とするうえでは,ヒトの正常な造血におけるTIM-3の発現分布やその機能を明らかにすることが重要である.そこで,健常人の末梢血と骨髄を用いてTIM-3の発現を血球系統ごとに検討した.これまでの報告と同様に,TIM-3は成熟単球に発現を認めた.また,TIM-3はNK細胞の一部に弱く発現していたが,顆粒球,B細胞,大多数のT細胞には発現が認められなかった.正常のCD34陽性CD38陽性の造血前駆細胞画分において,骨髄系共通前駆細胞(common myeloid progenitors:CMPs)および巨核球赤芽系前駆細胞(megakaryocyte-erythrocyte progenitors:MEPs)はTIM-3の発現を認めず,顆粒球マクロファージ系前駆細胞(granulocyte-macrophage progenitor:GMP)の一部(10~20%)がTIM-3を細胞表面に発現していた.ヒト造血器系においてTIM-3は骨髄系前駆細胞の一部および成熟単球に発現しているがそのほかの系統の血球細胞には発現しないので,TIM-3を標的とした抗体療法が正常な造血細胞にあたえる影響は限定的と考え,細胞障害活性をもつモノクローナル抗体の樹立を試みた.
以上の検討により,細胞障害活性をもつマウス免疫グロブリンG2a抗ヒトTIM-3モノクローナル抗体ATIK2aを樹立した.このモノクローナル抗体はin vitroでヒトTIM-3を発現する白血病細胞株に対し抗体依存性細胞傷害活性および補体依存性細胞傷害活性の細胞傷害活性を示した.最初に,ヒトの正常な造血における抗ヒトTIM-3モノクローナル抗体の効果を検討した.臍帯血から得た造血幹細胞を移植し12時間後より週1回,モノクローナル抗体15μgの腹腔内投与を解析時まで継続して造血幹細胞の生着およびヒトの造血の再構築にあたえる影響を評価した.移植12週後の解析では対照群と投与群とで骨髄のヒト造血細胞のキメリズムに有意な差は認められなかった.また,B細胞系細胞および骨髄系細胞の分布に差は認められないものの,投与群ではCD33陽性TIM-3陽性単球が有意に減少した.以上から,抗ヒトTIM-3モノクローナル抗体ATIK2aはヒトの正常な造血幹細胞の生着および造血の再構築に影響をあたえず,in vivoにおいてTIM-3陽性細胞のみを特異的に傷害することが示された.
つぎに,急性骨随性白血病に対するマウス抗ヒトTIM-3モノクローナル抗体ATIK2a投与の効果をin vivoで検討した.さきに述べた臍帯血移植実験と同様の急性骨随性白血病細胞の移植後早期からの抗体投与により,白血病幹細胞に対するモノクローナル抗体の効果を急性骨随性白血病4症例で評価した.4症例とも対照群ではすべてのNOD/SCIDマウスにヒト急性骨随性白血病が再構築された一方,投与群では急性骨随性白血病細胞のキメリズムは有意に低下していた.しかし,移植後早期からの抗体投与では白血病幹細胞の生着を阻害することで抗白血病活性を示している可能性が除外できないため,急性骨随性白血病を再構築したマウスに対する抗体投与実験が必要であった.
そこで,急性骨随性白血病細胞を安定的に高キメリズムで生着可能な新規の高度免疫不全マウスであるNRGマウスをレシピエントに使用した.放射線照射したNRGマウスに1×106個の急性骨随性白血病細胞を移植し,8週後に末梢血にて急性骨随性白血病の再構築を確認したのち,75μgのマウス抗ヒトTIM-3モノクローナル抗体の投与を開始した.週3回の投与を4週間行ったところ,投与群では対照群と比較して有意にCD45陽性CD33陽性TIM-3陽性の急性骨随性白血病細胞のキメリズムが減少し,TIM-3を高発現するCD45陽性CD34陽性CD38陰性の白血病幹細胞画分も減少した.つぎに,自己複製能をもつ機能的な白血病幹細胞に対するマウス抗ヒトTIM-3モノクローナル抗体の殺細胞効果を検討するため連続移植実験を行った.モノクローナル抗体の投与ののちにレシピエントマウスに残存する急性骨随性白血病細胞を回収して2次移植を行ったところ,対照群の1次マウスから移植した急性骨随性白血病細胞はすべての2次レシピエントマウスに急性骨随性白血病を再構築することが可能であった一方,投与群の1次マウスから採取した残存急性骨随性白血病細胞は2次レシピエントマウスには生着を認めなかった.ずなわち,抗ヒトTIM-3モノクローナル抗体ATIK2aの投与は自己複製能をもつ機能的な白血病幹細胞を傷害していることが示された.
今回,筆者らは,ヒト急性骨随性白血病において白血病幹細胞に高発現する新規の細胞表面抗原TIM-3を同定した.異種移植を用いた検討から,TIM-3に対する標的治療がヒトの正常な造血幹細胞に影響をあたえることなく白血病幹細胞に特異的な殺細胞効果をもつ可能性を示した.今後,白血病幹細胞におけるTIM-3の機能の解析とあわせ臨床応用を検討したい.
略歴:2009年 九州大学大学院医学系学府博士課程 修了,同年より九州大学病院遺伝子細胞療法部 医員.
研究テーマ:ヒトの正常造血幹細胞および悪性造血幹細胞.
抱負:分子生物学的な手法を用いたヒト造血器疾患,とくに,白血病幹細胞の解析により,難治性の造血器腫瘍に対する新規の治療法の開発と造血器悪性腫瘍の克服をめざします.
赤司 浩一(Koichi Akashi)
九州大学大学院医学研究院 教授.
研究室URL:http://www.med.kyushu-u.ac.jp/intmed1/
© 2011 菊繁吉謙・赤司浩一 Licensed under CC 表示 2.1 日本
(九州大学大学院医学研究院 病態修復内科学)
email:菊繁吉謙
DOI: 10.7875/first.author.2011.010
TIM-3 is a promising target to selectively kill acute myeloid leukemia stem cells.
Yoshikane Kikushige, Takahiro Shima, Shin-ichiro Takayanagi, Shingo Urata, Toshihiro Miyamoto, Hiromi Iwasaki, Katsuto Takenaka, Takanori Teshima, Toshiyuki Tanaka, Yoshimasa Inagaki, Koichi Akashi
Cell Stem Cell, 7, 708-717 (2010)
要 約
ヒト急性骨随性白血病においては一部の白血病幹細胞のみが自己複製能と限定された分化能をもち白血病細胞集団を維持している.急性骨随性白血病の根治のためにはこの白血病幹細胞の根絶が必要であるが,この幹細胞を治療の標的とするのにはその生物学的な特性の詳細な解明が重要である.筆者らは,ヒトの白血病試料より白血病幹細胞の画分を純化し正常な造血幹細胞と遺伝子発現プロファイリングを比較した.その結果,造血幹細胞には発現せず白血病幹細胞に特異的に高発現する表面抗原としてTIM-3を同定した.このTIM-3は急性前骨髄球性白血病を除くほぼすべての急性骨随性白血病の白血病幹細胞に高発現していた.細胞障害活性をもつマウス抗ヒトTIM-3モノクローナル抗体を樹立し免疫不全マウスを用いて急性骨随性白血病に対する効果をin vivoで検討した.急性骨随性白血病を再構築したマウスにこのモノクローナル抗体を投与することで白血病幹細胞を含む急性骨随性白血病細胞は有意に減少し,治療ののち残存した急性骨随性白血病細胞も2次移植ではマウスに白血病を再構築できなかった.以上より,TIM-3は急性骨随性白血病の治療において有用な治療標的である可能性が示された.
はじめに
ヒト急性骨随性白血病(acute myeloid leukemia:AML)ではごく少数の白血病幹細胞(leukemic stem cell:LSC)のみが造腫瘍能をもち白血病細胞集団を維持していることが免疫不全マウスを用いた近年の研究で明らかになった1,2)(図1).急性骨随性白血病は化学療法によりいったんは寛解を得られても残存する白血病幹細胞の再増殖によりその多くが再発をきたす.したがって,治癒のためには白血病幹細胞の根絶が必要である.白血病幹細胞は正常な造血幹細胞(hematopoietic stem cell:HSC)と同様にCD34陽性CD38陰性画分に存在し,その多くがG0期にあって細胞周期に依存的な化学療法には抵抗性を示す3).また,自己複製能および骨髄支持構造も正常な造血幹細胞と類似した機構を利用しており,白血病幹細胞を標的とした治療法の確立はいまだ困難である.今回,筆者らは,白血病幹細胞に特異的に発現する細胞表面抗原TIM-3を同定し,これが有用な治療標的となりうることを見い出した.
1.白血病幹細胞の特異的な抗原としてのTIM-3の同定
白血病幹細胞には高発現するが正常な造血幹細胞には発現しない表面抗原を同定できれば白血病幹細胞を直接に治療標的とした抗体療法が可能となる.そこで,蛍光セルソーター(FACS)によって白血病幹細胞の存在するCD34陽性CD38陰性の急性骨随性白血病細胞画分とCD34陽性CD38陰性の造血幹細胞画分を純化し,マイクロアレイによる遺伝子発現プロファイリング解析を行い白血病幹細胞のみに高発現する候補遺伝子を抽出した.その結果,白血病幹細胞に特異的な表面抗原として既知のCLL-1 4),CD96 5) にくわえ,新規にTIM-3(T-cell immunoglobulin mucin-3)が白血病幹細胞において高発現することを見い出した.TIM-3はマウスTh1細胞に発現する表面抗原として報告され,そののち,樹状細胞,マクロファージ,さらには,CD8陽性T細胞での発現も報告されており,種々の免疫応答を調節するタンパク質として注目されている6-10).
つぎに,白血病幹細胞におけるタンパク質レベルでのTIM-3の発現をFACSにて解析した(図2).CD34陽性CD38陰性CD90陰性の白血病幹細胞は一様にTIM-3を高発現しているのに対し,CD34陽性CD38陰性CD90陽性の造血幹細胞はTIM-3を発現していなかった.すなわち,TIM-3は白血病幹細胞に特異的な治療標的の候補としての条件をみたしていた.急性骨随性白血病のサブタイプにおいてTIM-3の発現に差があるかどうかを検討したところ,急性前骨髄球性白血病以外のすべての症例の白血病幹細胞画分で高発現を認めた.染色体異常などの遺伝子変異の有無によりTIM-3の発現に差は認められなかった.
2.機能的な白血病幹細胞はTIM-3を発現する
近年,CD34陽性CD38陰性画分以外の急性骨随性白血病細胞にも腫瘍の再構築能をもつ白血病幹細胞の存在する可能性が報告されている.そこで,機能的な白血病幹細胞がTIM-3を発現するかどうかを評価するため,TIM-3陽性急性骨随性白血病細胞とTIM-3陰性急性骨随性白血病を純化して免疫不全マウスに移植し,急性骨随性白血病の再構築能を比較検討した.その結果,TIM-3陽性細胞は急性骨随性白血病をマウスに再構築したがTIM-3陰性細胞は再構築しなかった.このことから,急性骨随性白血病の再構築能をもつ白血病幹細胞はTIM-3を発現していることが示された.表面形質により定義されたCD34陽性CD38陰性の白血病幹細胞,および,異種移植アッセイ系により定義された機能的な白血病幹細胞はともにTIM-3を発現していたので,TIM-3を標的とした新規の抗体療法を試みた.
3.TIM-3の正常な造血における発現分布
TIM-3を標的とするうえでは,ヒトの正常な造血におけるTIM-3の発現分布やその機能を明らかにすることが重要である.そこで,健常人の末梢血と骨髄を用いてTIM-3の発現を血球系統ごとに検討した.これまでの報告と同様に,TIM-3は成熟単球に発現を認めた.また,TIM-3はNK細胞の一部に弱く発現していたが,顆粒球,B細胞,大多数のT細胞には発現が認められなかった.正常のCD34陽性CD38陽性の造血前駆細胞画分において,骨髄系共通前駆細胞(common myeloid progenitors:CMPs)および巨核球赤芽系前駆細胞(megakaryocyte-erythrocyte progenitors:MEPs)はTIM-3の発現を認めず,顆粒球マクロファージ系前駆細胞(granulocyte-macrophage progenitor:GMP)の一部(10~20%)がTIM-3を細胞表面に発現していた.ヒト造血器系においてTIM-3は骨髄系前駆細胞の一部および成熟単球に発現しているがそのほかの系統の血球細胞には発現しないので,TIM-3を標的とした抗体療法が正常な造血細胞にあたえる影響は限定的と考え,細胞障害活性をもつモノクローナル抗体の樹立を試みた.
4.マウス抗ヒトTIM-3モノクローナル抗体はヒトの正常な造血幹細胞を障害しない
以上の検討により,細胞障害活性をもつマウス免疫グロブリンG2a抗ヒトTIM-3モノクローナル抗体ATIK2aを樹立した.このモノクローナル抗体はin vitroでヒトTIM-3を発現する白血病細胞株に対し抗体依存性細胞傷害活性および補体依存性細胞傷害活性の細胞傷害活性を示した.最初に,ヒトの正常な造血における抗ヒトTIM-3モノクローナル抗体の効果を検討した.臍帯血から得た造血幹細胞を移植し12時間後より週1回,モノクローナル抗体15μgの腹腔内投与を解析時まで継続して造血幹細胞の生着およびヒトの造血の再構築にあたえる影響を評価した.移植12週後の解析では対照群と投与群とで骨髄のヒト造血細胞のキメリズムに有意な差は認められなかった.また,B細胞系細胞および骨髄系細胞の分布に差は認められないものの,投与群ではCD33陽性TIM-3陽性単球が有意に減少した.以上から,抗ヒトTIM-3モノクローナル抗体ATIK2aはヒトの正常な造血幹細胞の生着および造血の再構築に影響をあたえず,in vivoにおいてTIM-3陽性細胞のみを特異的に傷害することが示された.
5.マウス抗ヒトTIM-3モノクローナル抗体はin vivoで白血病幹細胞を傷害する
つぎに,急性骨随性白血病に対するマウス抗ヒトTIM-3モノクローナル抗体ATIK2a投与の効果をin vivoで検討した.さきに述べた臍帯血移植実験と同様の急性骨随性白血病細胞の移植後早期からの抗体投与により,白血病幹細胞に対するモノクローナル抗体の効果を急性骨随性白血病4症例で評価した.4症例とも対照群ではすべてのNOD/SCIDマウスにヒト急性骨随性白血病が再構築された一方,投与群では急性骨随性白血病細胞のキメリズムは有意に低下していた.しかし,移植後早期からの抗体投与では白血病幹細胞の生着を阻害することで抗白血病活性を示している可能性が除外できないため,急性骨随性白血病を再構築したマウスに対する抗体投与実験が必要であった.
そこで,急性骨随性白血病細胞を安定的に高キメリズムで生着可能な新規の高度免疫不全マウスであるNRGマウスをレシピエントに使用した.放射線照射したNRGマウスに1×106個の急性骨随性白血病細胞を移植し,8週後に末梢血にて急性骨随性白血病の再構築を確認したのち,75μgのマウス抗ヒトTIM-3モノクローナル抗体の投与を開始した.週3回の投与を4週間行ったところ,投与群では対照群と比較して有意にCD45陽性CD33陽性TIM-3陽性の急性骨随性白血病細胞のキメリズムが減少し,TIM-3を高発現するCD45陽性CD34陽性CD38陰性の白血病幹細胞画分も減少した.つぎに,自己複製能をもつ機能的な白血病幹細胞に対するマウス抗ヒトTIM-3モノクローナル抗体の殺細胞効果を検討するため連続移植実験を行った.モノクローナル抗体の投与ののちにレシピエントマウスに残存する急性骨随性白血病細胞を回収して2次移植を行ったところ,対照群の1次マウスから移植した急性骨随性白血病細胞はすべての2次レシピエントマウスに急性骨随性白血病を再構築することが可能であった一方,投与群の1次マウスから採取した残存急性骨随性白血病細胞は2次レシピエントマウスには生着を認めなかった.ずなわち,抗ヒトTIM-3モノクローナル抗体ATIK2aの投与は自己複製能をもつ機能的な白血病幹細胞を傷害していることが示された.
おわりに
今回,筆者らは,ヒト急性骨随性白血病において白血病幹細胞に高発現する新規の細胞表面抗原TIM-3を同定した.異種移植を用いた検討から,TIM-3に対する標的治療がヒトの正常な造血幹細胞に影響をあたえることなく白血病幹細胞に特異的な殺細胞効果をもつ可能性を示した.今後,白血病幹細胞におけるTIM-3の機能の解析とあわせ臨床応用を検討したい.
文 献
- Lapidot, T., Sirard, C., Vormoor, J. et al.: A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature, 367, 645-648 (1994)[PubMed]
- Bonnet, D., Dick, J. E.: Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat. Med., 3, 730-737 (1997)[PubMed]
- Ishikawa, F., Yoshida, S., Saito, Y. et al.: Chemotherapy-resistant human AML stem cells home to and engraft within the bone-marrow endosteal region. Nat. Biotechnol., 25, 1315-1321 (2007)[PubMed]
- van Rhenen, A., van Dongen, G. A., Kelder, A. et al.: The novel AML stem cell associated antigen CLL-1 aids in discrimination between normal and leukemic stem cells. Blood, 110, 2659-2666 (2007)[PubMed]
- Hosen, N., Park, C. Y., Tatsumi, N. et al.: CD96 is a leukemic stem cell-specific marker in human acute myeloid leukemia. Proc. Natl. Acad. Sci. USA, 104, 11008-11013 (2007)[PubMed]
- Monney, L., Sabatos, C. A., Gaglia, J. L. et al.: Th1-specific cell surface protein Tim-3 regulates macrophage activation and severity of an autoimmune disease. Nature, 415, 536-541 (2002)[PubMed]
- Anderson, A. C., Anderson, D. E., Bregoli, L. et al.: Promotion of tissue inflammation by the immune receptor Tim-3 expressed on innate immune cells. Science, 318, 1141-1143 (2007)[PubMed]
- Jin, H. T., Anderson, A. C., Tan, W. G. et al.: Cooperation of Tim-3 and PD-1 in CD8 T-cell exhaustion during chronic viral infection. Proc. Natl. Acad. Sci. USA, 107, 14733-14738 (2010)[PubMed]
- McMahan, R. H., Golden-Mason, L., Nishimura, M. I. et al.: Tim-3 expression on PD-1+ HCV-specific human CTLs is associated with viral persistence, and its blockade restores hepatocyte-directed in vitro cytotoxicity. J. Clin. Invest., 120, 4546-4557 (2010)[PubMed]
- Nakayama, M., Akiba, H., Takeda, K. et al.: Tim-3 mediates phagocytosis of apoptotic cells and cross-presentation. Blood, 113, 3821-3830 (2009)[PubMed]
著者プロフィール
略歴:2009年 九州大学大学院医学系学府博士課程 修了,同年より九州大学病院遺伝子細胞療法部 医員.
研究テーマ:ヒトの正常造血幹細胞および悪性造血幹細胞.
抱負:分子生物学的な手法を用いたヒト造血器疾患,とくに,白血病幹細胞の解析により,難治性の造血器腫瘍に対する新規の治療法の開発と造血器悪性腫瘍の克服をめざします.
赤司 浩一(Koichi Akashi)
九州大学大学院医学研究院 教授.
研究室URL:http://www.med.kyushu-u.ac.jp/intmed1/
© 2011 菊繁吉謙・赤司浩一 Licensed under CC 表示 2.1 日本