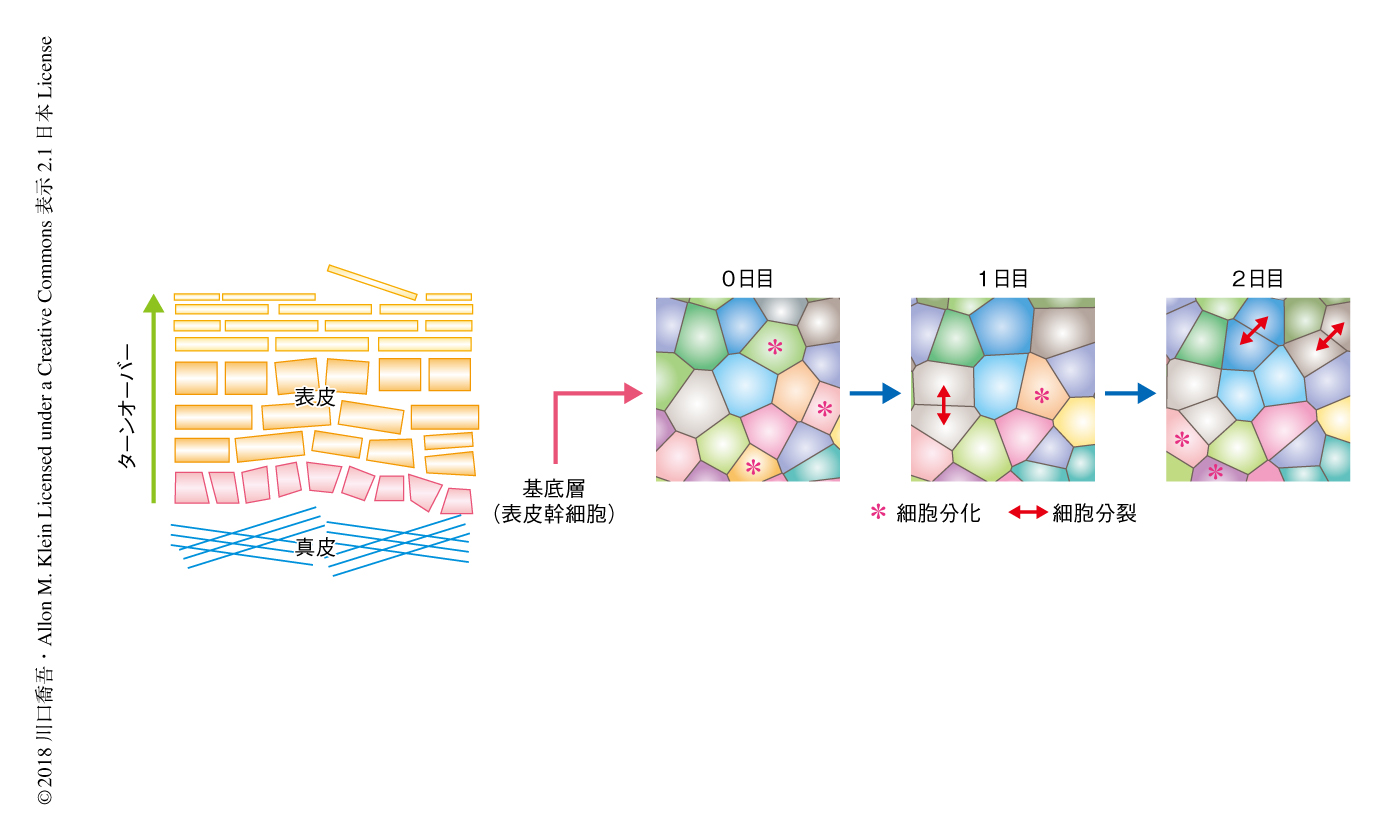
表皮幹細胞は隣接する細胞の分化に促され分裂する
川口喬吾・Allon M. Klein
(米国Harvard Medical School,Department of Systems Biology)
email:川口喬吾
DOI: 10.7875/first.author.2018.108
Homeostatic epidermal stem cell self-renewal is driven by local differentiation.
Kailin R. Mesa, Kyogo Kawaguchi, Katie Cockburn, David Gonzalez, Jonathan Boucher, Tianchi Xin, Allon M. Klein, Valentina Greco
Cell Stem Cell, 23, 677-686.e8 (2018)
哺乳類の成体の組織は長期間にわたりターンオーバーしつづける.これは,組織において細胞分化と細胞分裂が共存するなか,細胞数のロスとゲインがつりあうことにより達成されているはずであるが,そのくわしい機構については未解明である.この研究において,筆者らは,成体のマウスの皮膚を1週間にわたりライブイメージングしたデータをもとに,表皮幹細胞のダイナミクスについて調べた.その結果,シート状の幹細胞の集団のなかで,ごく近くにいる細胞どうしにおいて分化と分裂の数がつりあっていることがわかった.この運命決定のダイナミクスにおいては,まずひとつの細胞が分化し,隣接する細胞がそれをおって1~2日後に分裂するという,時間的な順序のあることもわかった.これらの発見により,成体の組織においては細胞分化によるロスに応じオンデマンドで細胞分裂が起こることにより恒常性が維持されるという機構が強く示唆された.
ヒトを含む哺乳類は,成体の大きさまで成長したのち,その発生に要した時間よりも10倍以上も長いスケールにわたり,ほぼ定常な状態で生きつづける.1950年代から1960年代のかけての系統的な研究により,この定常な成体の組織において,上皮,腸,精細管などにおいては激しいターンオーバーの起こることがわかっている1,2).ここでいうターンオーバーとは,細胞が分化や体外への排出などによりロスされると同時に,組織において細胞分裂がさかんに起こりそのロスを補いつづけている状態をさす.ターンオーバーの時間のスケールはせいぜい数日間と短いにもかかわらず,組織が何年も何十年もほぼ定常でいるのはなぜか.このごくシンプルな問いに対しまだ明快な答えはだされていない.
上皮組織はターンオーバーしている組織のなかでも研究の代表的な対象であり,とくに,皮膚に生じる傷や細胞レベルの異常は医学や美容の見地からも注目度が高い.皮膚の上皮組織においては,真皮に接する1層の基底細胞の集団のみが細胞分裂をする.この基底細胞は,角質細胞にいたるまで表皮のすべての細胞のもとであるという意味で,表皮の幹細胞であるといえる(図1).この基底細胞の分裂と分化のダイナミクスについては歴史的にさまざまな議論がなされてきたが,クローナルラベリング法などの発達により,現在では,少なくともマウスにおいては,この集団のなかにはヒエラルキーのようなものはなく,均一な幹細胞の集団が単にシート状に存在するとみなせることがわかってきている3).
表皮幹細胞には,分化して基底膜をはなれるか,分裂して基底細胞を増やすかの2つの運命がある.この運命決定のダイナミクスにおいて,表皮幹細胞の数が長期間にわたりほぼ一定に維持されつづけるには,細胞分化によるロスと細胞分裂によるゲインがおおむねつりあっていなければならない.これが実現されるためのひとつの方法は,分裂した娘細胞のうちひとつが分化し,もうひとつが表皮幹細胞としてまた分裂するという非対称分裂の機構を採用することである.しかし,放射性チミジンを用いた古典的な研究や4),長期間にわたる幹細胞のダイナミクスを推定するクローンサイズ分布を用いた手法3,5),また,筆者らによる成体のマウスの表皮幹細胞の直接的なライブイメージングの結果からも6),表皮幹細胞は有意な割合で対称分裂をしていることがわかっており,非対称分裂がつりあいの機構ではないことが明確になってきている.
分裂する幹細胞の娘細胞どうしに運命のつりあいがほぼないとしたら,どのような機構により分化と分裂は均衡しているのだろうか.ひとつの可能性は,組織のレベルでのフィードバック制御である.たとえば,組織のある領域でたまたま細胞数が過剰になったときには,全体として分化を促すようなシグナルが外部から到達したり,免疫系の細胞が多めに侵入して余計に増えた細胞を抜き取ってしまったり,といったフィードバックが考えられる.もうひとつの可能性は,幹細胞が近くで起こっているほかの幹細胞の分化や分裂をなんらかの方法により検出し,ロスを埋めるため分裂したりゲインをキャンセルするため分化したりする,というローカルなフィードバックである.
この2つのシナリオは細胞生物学的にはまったく違う機構をさす.しかし,理論モデルのうえでは,細胞運命の決定のフィードバックにおいて距離のスケールが違うだけ,ととらえることもできる7).すなわち,外部からのシグナルや免疫細胞の増加などによる制御も,ひとつの細胞の分化や分裂が組織のレベルにおける細胞数の変化に少しの影響をあたえ,それが積算された結果,組織のレベルにおいて分化と分裂の割合にフィードバックがかかっていると考えれば,フィードバックの距離のスケールがとても大きい場合とみなすことができる.また,フィードバックの距離が小さい場合も,本当に真隣の細胞に応答するのか,数細胞の範囲で決まる細胞密度に応答するのかなど,さまざまな長さのスケールが考えらえる.
表皮幹細胞の分化と分裂とのあいだにフィードバックが存在するとして,その距離のスケールはどのくらいなのか.これを測定するため,生きた成体のマウスからライブイメージングのデータを取得する方法を見直した.これまでの方法では,Creシステムや光により活性化する蛍光タンパク質を用いてごく少数の表皮幹細胞を標識し,個々の幹細胞がどのようにふるまうかをおいかけていたが6),この方法では近接する細胞の運命の相互作用をみることはできない.そこで,表皮幹細胞がすべて標識された成体のマウスを用いて,12時間に1回,2光子顕微鏡により耳や足の裏の表皮を3次元撮影し,画像解析によりある領域の数百細胞の表皮幹細胞のダイナミクスをすべてトラックする,という手法をとった.
表皮幹細胞の集団の1週間にわたるトラックの結果,ある領域において,細胞分化か細胞分裂かの運命決定のイベントが起こっている場所と時間がまずわかった.これによると,空間的かつ時間的に近い2つのイベントは,細胞分化と細胞分裂のペアである確率がランダムに比べ有意に高かった.このことから,フィードバックの距離のスケールは比較的小さく,大きくても数細胞のスケールであろうと推察された.同時に,幹細胞が分裂して生じた2つの細胞の運命をみると,細胞分化と細胞分化,あるいは,細胞分裂と細胞分裂と,むしろ同じ運命にある割合がランダムに比べ高く,あらためて,表皮幹細胞において非対称分裂モデルが成り立たないことが確認された.
フィードバックの距離のスケール,さらに,フィードバックがどのくらいのインターバルでかかっているかという時間のスケールをさらにくわしく定量するため,細胞数の増減の空間的および時間的なゆらぎを測定し,理論モデルと比較する手法を新たに開発した.これにより,フィードバックは距離にして1細胞,時間にして1~2日で起こっていることがわかった.この結果から,表皮幹細胞の集団においては,外部からのシグナルや免疫細胞などによる組織のレベルのフィードバックや,数細胞のスケールでの細胞密度の変化の応答の影響は小さく,隣接する幹細胞どうしが細胞分化と細胞分裂のペアを組むという小さい距離での運命の相互作用が支配的であることが示唆された.
つぎなる疑問は,この細胞分化と細胞分裂のペアのイベントに時間的な順序があるのかどうかである.いっけん,表皮幹細胞の分化と分裂はいたるところでランダムに起こっているようにみえ,時間的な順序もなさそうであった.しかし,運命決定のイベントが起こったのちの周囲の細胞の挙動をトラックし多数のイベントの平均を得るという手法により,ペアのイベントにおいて細胞分化がさきで細胞分裂があとになること,さらに,細胞分化とそのあとの近接する細胞の分裂には,平均的にみてほぼ1対1の対応のあることが明らかにされた.
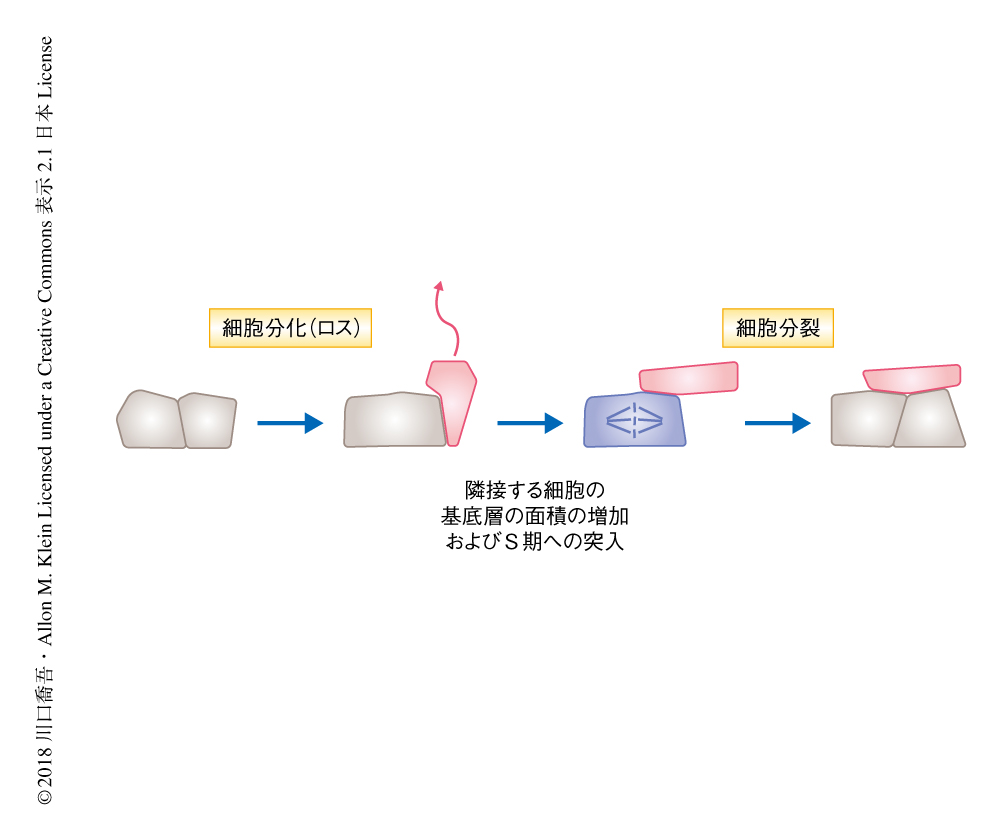
細胞分化におくれて起こる隣接する細胞の分裂のタイミングをよりくわしく調べるため,細胞周期のマーカータンパク質を発現するマウスを用いて同様に解析した.その結果,まず細胞分化が起こり,空いた空間に隣接する細胞が広がり基底層のうえでのその細胞の面積が増え,それから,その隣接する細胞がG1期を脱して細胞分裂に入る,という平均の時間的な順序がわかった(図2).この結果から,細胞の成長が隣接する細胞を押し出して分化させるのではなく,分化が隣接する細胞の成長や分裂を促しているのであろうことが示唆された.
ここまでの恒常的な表皮幹細胞のダイナミクスの観察から,細胞分化がさきで細胞分裂がおくれて促される,という因果関係が強く示唆された(図2).この関係を確かめるため,3つの試験を実施した.
細胞分化が細胞分裂を促しており,細胞分裂が細胞分化をひき起こすのではないとすれば,細胞分裂を止めた場合にもそれにより細胞分化は止まらないはずである.マウスへの薬剤の投与により組織のレベルで細胞周期を止めたところ,細胞分化は影響をうけず進行し,予想どおり,表皮幹細胞は枯渇した.
細胞分化に促されて近隣する細胞が1~2日というラグをもって分裂するのだとすれば,たとえば,分化の誘導を一時的に加速したときには,いちど幹細胞の密度が下がり,残った細胞がおくれて応答して分裂をはじめ,もとの細胞密度が回復するはずである.皮膚の表面に粘着テープを貼ってはがすtape strippingとよばれる実験をマウスの耳の表皮において実施したところ,実際に,いちど細胞密度が下がり1~2日後に回復するようすが確認された.
幹細胞の分裂は近隣する細胞の分化によるロスにより促されることがわかったが,この誘導は細胞の物理的な切除や細胞死など,細胞分化以外の理由による細胞のロスでも実現するのではないかと考えられた.そこで,表皮幹細胞のレーザーによる切除実験,および,ジフテリア毒素によるアポトーシスの誘導実験を実施し,あらためて,ロスした細胞の周囲の細胞の運命を追跡した.その結果,1細胞のロスがどのように生じた場合においても,まわりの細胞がおくれてそのロスを埋めるだけの分裂を平均的に起こし,局所的な細胞密度がおくれて回復することがわかった.
この研究において,筆者らは,表皮幹細胞の摂動のない状態における恒常的なダイナミクスを詳細に解析することにより,細胞分化に促されて近隣する細胞が分裂するという機構を見い出し,それを摂動実験により確認した.細胞密度の低下や上昇に応じて細胞分裂やロスがひき起こされるというフィードバック機構の存在はこれまでに何度も報告されてきたが8,9),成体の組織においてこの機構が確認されたこと,また,フィードバックの距離のスケールが短く,組織のレベルではなく近接する細胞どうしが協調して恒常性を維持していることがわかったのは,この研究がはじめてである.結果的に,幹細胞の研究としてはめずらしく,ほとんど分子や経路の名前がでてこない現象論を重視した研究になったが,はじめに分化が起こる原因はなにか,隣接する細胞の分裂を促している因子や物理的な要素はなにかなど,つぎなる問いがつぎつぎとたてられたという意味でも,重要な一歩であると考えられる.
ほかの報告によると,発生の過程においては細胞分裂による密度の上昇に促されるよう細胞が分化などによりロスするという,この研究において見い出されたものとは逆向きのフィードバックが支配的らしい10).これらの研究をあわせると,発生期においては組織の形成が重要であるため細胞分裂がおもなドライバーである一方,成体になるとむやみに細胞分裂を起こすリスクはさけるようになり,細胞のロスが生じたときにのみオンデマンドで分細胞裂をするように変化する,という描像がうかびあがってくる.この発生期から成体への組織のダイナミクスの切り替えはどのように起こるのかなど,未解明なことはまだ多い.
最後に,この研究の物理学的な側面にもふれたい.筆者が恒常性の問題に興味をもったのは,表皮幹細胞のような2次元の組織において,これまでの手法ではフィードバックの距離の大小を判別できないことに気づいたからである.距離のスケールが大きい場合にはcritical birth deathモデルとよばれる確率モデルを解析に用いることが正当化されるが3,5),距離のスケールが小さい場合にはvoterモデルとよばれる別の非平衡統計力学のモデルを想定しなければならない.このvoterモデルは,これまでに集団における意見の形成(それゆえ,voter)や表面張力のきかない系でのcoarsening現象など,数理や物理の文脈における理論あるいは数値シミュレーションにてさかんに研究されているものの11),2次元系における実験の例はこれまでひとつもなかった.この研究において,表皮幹細胞の恒常性のダイナミクスが2次元voterモデルにしたがうことが見い出されたのと同時に,voterモデル様の現象がどのようなシナリオにより自然界に現われるかについても新しい知見が得られた7).今後も,マクロな非平衡現象のモデルが多細胞からなる現象の解析に役だち,また,生命現象にインスパイアされて理論研究が進展するような例が多く現われることが期待される.
略歴:2015年 東京大学大学院理学系研究科博士課程 修了,同年 米国Harvard Medical School博士研究員を経て,2018年より理化学研究所生命機能科学研究センター チームリーダー.
研究テーマ:生物物理の理論と実験.
Allon M. Klein
米国Harvard Medical SchoolにてAssistant Professor.
研究室URL:https://klein.hms.harvard.edu/
© 2018 川口喬吾・Allon M. Klein Licensed under CC 表示 2.1 日本
(米国Harvard Medical School,Department of Systems Biology)
email:川口喬吾
DOI: 10.7875/first.author.2018.108
Homeostatic epidermal stem cell self-renewal is driven by local differentiation.
Kailin R. Mesa, Kyogo Kawaguchi, Katie Cockburn, David Gonzalez, Jonathan Boucher, Tianchi Xin, Allon M. Klein, Valentina Greco
Cell Stem Cell, 23, 677-686.e8 (2018)
要 約
哺乳類の成体の組織は長期間にわたりターンオーバーしつづける.これは,組織において細胞分化と細胞分裂が共存するなか,細胞数のロスとゲインがつりあうことにより達成されているはずであるが,そのくわしい機構については未解明である.この研究において,筆者らは,成体のマウスの皮膚を1週間にわたりライブイメージングしたデータをもとに,表皮幹細胞のダイナミクスについて調べた.その結果,シート状の幹細胞の集団のなかで,ごく近くにいる細胞どうしにおいて分化と分裂の数がつりあっていることがわかった.この運命決定のダイナミクスにおいては,まずひとつの細胞が分化し,隣接する細胞がそれをおって1~2日後に分裂するという,時間的な順序のあることもわかった.これらの発見により,成体の組織においては細胞分化によるロスに応じオンデマンドで細胞分裂が起こることにより恒常性が維持されるという機構が強く示唆された.
はじめに
ヒトを含む哺乳類は,成体の大きさまで成長したのち,その発生に要した時間よりも10倍以上も長いスケールにわたり,ほぼ定常な状態で生きつづける.1950年代から1960年代のかけての系統的な研究により,この定常な成体の組織において,上皮,腸,精細管などにおいては激しいターンオーバーの起こることがわかっている1,2).ここでいうターンオーバーとは,細胞が分化や体外への排出などによりロスされると同時に,組織において細胞分裂がさかんに起こりそのロスを補いつづけている状態をさす.ターンオーバーの時間のスケールはせいぜい数日間と短いにもかかわらず,組織が何年も何十年もほぼ定常でいるのはなぜか.このごくシンプルな問いに対しまだ明快な答えはだされていない.
上皮組織はターンオーバーしている組織のなかでも研究の代表的な対象であり,とくに,皮膚に生じる傷や細胞レベルの異常は医学や美容の見地からも注目度が高い.皮膚の上皮組織においては,真皮に接する1層の基底細胞の集団のみが細胞分裂をする.この基底細胞は,角質細胞にいたるまで表皮のすべての細胞のもとであるという意味で,表皮の幹細胞であるといえる(図1).この基底細胞の分裂と分化のダイナミクスについては歴史的にさまざまな議論がなされてきたが,クローナルラベリング法などの発達により,現在では,少なくともマウスにおいては,この集団のなかにはヒエラルキーのようなものはなく,均一な幹細胞の集団が単にシート状に存在するとみなせることがわかってきている3).
表皮幹細胞には,分化して基底膜をはなれるか,分裂して基底細胞を増やすかの2つの運命がある.この運命決定のダイナミクスにおいて,表皮幹細胞の数が長期間にわたりほぼ一定に維持されつづけるには,細胞分化によるロスと細胞分裂によるゲインがおおむねつりあっていなければならない.これが実現されるためのひとつの方法は,分裂した娘細胞のうちひとつが分化し,もうひとつが表皮幹細胞としてまた分裂するという非対称分裂の機構を採用することである.しかし,放射性チミジンを用いた古典的な研究や4),長期間にわたる幹細胞のダイナミクスを推定するクローンサイズ分布を用いた手法3,5),また,筆者らによる成体のマウスの表皮幹細胞の直接的なライブイメージングの結果からも6),表皮幹細胞は有意な割合で対称分裂をしていることがわかっており,非対称分裂がつりあいの機構ではないことが明確になってきている.
分裂する幹細胞の娘細胞どうしに運命のつりあいがほぼないとしたら,どのような機構により分化と分裂は均衡しているのだろうか.ひとつの可能性は,組織のレベルでのフィードバック制御である.たとえば,組織のある領域でたまたま細胞数が過剰になったときには,全体として分化を促すようなシグナルが外部から到達したり,免疫系の細胞が多めに侵入して余計に増えた細胞を抜き取ってしまったり,といったフィードバックが考えられる.もうひとつの可能性は,幹細胞が近くで起こっているほかの幹細胞の分化や分裂をなんらかの方法により検出し,ロスを埋めるため分裂したりゲインをキャンセルするため分化したりする,というローカルなフィードバックである.
この2つのシナリオは細胞生物学的にはまったく違う機構をさす.しかし,理論モデルのうえでは,細胞運命の決定のフィードバックにおいて距離のスケールが違うだけ,ととらえることもできる7).すなわち,外部からのシグナルや免疫細胞の増加などによる制御も,ひとつの細胞の分化や分裂が組織のレベルにおける細胞数の変化に少しの影響をあたえ,それが積算された結果,組織のレベルにおいて分化と分裂の割合にフィードバックがかかっていると考えれば,フィードバックの距離のスケールがとても大きい場合とみなすことができる.また,フィードバックの距離が小さい場合も,本当に真隣の細胞に応答するのか,数細胞の範囲で決まる細胞密度に応答するのかなど,さまざまな長さのスケールが考えらえる.
1.表皮幹細胞の分裂と分化は近くで起こる
表皮幹細胞の分化と分裂とのあいだにフィードバックが存在するとして,その距離のスケールはどのくらいなのか.これを測定するため,生きた成体のマウスからライブイメージングのデータを取得する方法を見直した.これまでの方法では,Creシステムや光により活性化する蛍光タンパク質を用いてごく少数の表皮幹細胞を標識し,個々の幹細胞がどのようにふるまうかをおいかけていたが6),この方法では近接する細胞の運命の相互作用をみることはできない.そこで,表皮幹細胞がすべて標識された成体のマウスを用いて,12時間に1回,2光子顕微鏡により耳や足の裏の表皮を3次元撮影し,画像解析によりある領域の数百細胞の表皮幹細胞のダイナミクスをすべてトラックする,という手法をとった.
表皮幹細胞の集団の1週間にわたるトラックの結果,ある領域において,細胞分化か細胞分裂かの運命決定のイベントが起こっている場所と時間がまずわかった.これによると,空間的かつ時間的に近い2つのイベントは,細胞分化と細胞分裂のペアである確率がランダムに比べ有意に高かった.このことから,フィードバックの距離のスケールは比較的小さく,大きくても数細胞のスケールであろうと推察された.同時に,幹細胞が分裂して生じた2つの細胞の運命をみると,細胞分化と細胞分化,あるいは,細胞分裂と細胞分裂と,むしろ同じ運命にある割合がランダムに比べ高く,あらためて,表皮幹細胞において非対称分裂モデルが成り立たないことが確認された.
フィードバックの距離のスケール,さらに,フィードバックがどのくらいのインターバルでかかっているかという時間のスケールをさらにくわしく定量するため,細胞数の増減の空間的および時間的なゆらぎを測定し,理論モデルと比較する手法を新たに開発した.これにより,フィードバックは距離にして1細胞,時間にして1~2日で起こっていることがわかった.この結果から,表皮幹細胞の集団においては,外部からのシグナルや免疫細胞などによる組織のレベルのフィードバックや,数細胞のスケールでの細胞密度の変化の応答の影響は小さく,隣接する幹細胞どうしが細胞分化と細胞分裂のペアを組むという小さい距離での運命の相互作用が支配的であることが示唆された.
2.細胞分化の1~2日後に近隣する細胞の分裂が起こる
つぎなる疑問は,この細胞分化と細胞分裂のペアのイベントに時間的な順序があるのかどうかである.いっけん,表皮幹細胞の分化と分裂はいたるところでランダムに起こっているようにみえ,時間的な順序もなさそうであった.しかし,運命決定のイベントが起こったのちの周囲の細胞の挙動をトラックし多数のイベントの平均を得るという手法により,ペアのイベントにおいて細胞分化がさきで細胞分裂があとになること,さらに,細胞分化とそのあとの近接する細胞の分裂には,平均的にみてほぼ1対1の対応のあることが明らかにされた.
細胞分化におくれて起こる隣接する細胞の分裂のタイミングをよりくわしく調べるため,細胞周期のマーカータンパク質を発現するマウスを用いて同様に解析した.その結果,まず細胞分化が起こり,空いた空間に隣接する細胞が広がり基底層のうえでのその細胞の面積が増え,それから,その隣接する細胞がG1期を脱して細胞分裂に入る,という平均の時間的な順序がわかった(図2).この結果から,細胞の成長が隣接する細胞を押し出して分化させるのではなく,分化が隣接する細胞の成長や分裂を促しているのであろうことが示唆された.
3.細胞分裂は細胞のロスに応答して起こる
ここまでの恒常的な表皮幹細胞のダイナミクスの観察から,細胞分化がさきで細胞分裂がおくれて促される,という因果関係が強く示唆された(図2).この関係を確かめるため,3つの試験を実施した.
細胞分化が細胞分裂を促しており,細胞分裂が細胞分化をひき起こすのではないとすれば,細胞分裂を止めた場合にもそれにより細胞分化は止まらないはずである.マウスへの薬剤の投与により組織のレベルで細胞周期を止めたところ,細胞分化は影響をうけず進行し,予想どおり,表皮幹細胞は枯渇した.
細胞分化に促されて近隣する細胞が1~2日というラグをもって分裂するのだとすれば,たとえば,分化の誘導を一時的に加速したときには,いちど幹細胞の密度が下がり,残った細胞がおくれて応答して分裂をはじめ,もとの細胞密度が回復するはずである.皮膚の表面に粘着テープを貼ってはがすtape strippingとよばれる実験をマウスの耳の表皮において実施したところ,実際に,いちど細胞密度が下がり1~2日後に回復するようすが確認された.
幹細胞の分裂は近隣する細胞の分化によるロスにより促されることがわかったが,この誘導は細胞の物理的な切除や細胞死など,細胞分化以外の理由による細胞のロスでも実現するのではないかと考えられた.そこで,表皮幹細胞のレーザーによる切除実験,および,ジフテリア毒素によるアポトーシスの誘導実験を実施し,あらためて,ロスした細胞の周囲の細胞の運命を追跡した.その結果,1細胞のロスがどのように生じた場合においても,まわりの細胞がおくれてそのロスを埋めるだけの分裂を平均的に起こし,局所的な細胞密度がおくれて回復することがわかった.
おわりに
この研究において,筆者らは,表皮幹細胞の摂動のない状態における恒常的なダイナミクスを詳細に解析することにより,細胞分化に促されて近隣する細胞が分裂するという機構を見い出し,それを摂動実験により確認した.細胞密度の低下や上昇に応じて細胞分裂やロスがひき起こされるというフィードバック機構の存在はこれまでに何度も報告されてきたが8,9),成体の組織においてこの機構が確認されたこと,また,フィードバックの距離のスケールが短く,組織のレベルではなく近接する細胞どうしが協調して恒常性を維持していることがわかったのは,この研究がはじめてである.結果的に,幹細胞の研究としてはめずらしく,ほとんど分子や経路の名前がでてこない現象論を重視した研究になったが,はじめに分化が起こる原因はなにか,隣接する細胞の分裂を促している因子や物理的な要素はなにかなど,つぎなる問いがつぎつぎとたてられたという意味でも,重要な一歩であると考えられる.
ほかの報告によると,発生の過程においては細胞分裂による密度の上昇に促されるよう細胞が分化などによりロスするという,この研究において見い出されたものとは逆向きのフィードバックが支配的らしい10).これらの研究をあわせると,発生期においては組織の形成が重要であるため細胞分裂がおもなドライバーである一方,成体になるとむやみに細胞分裂を起こすリスクはさけるようになり,細胞のロスが生じたときにのみオンデマンドで分細胞裂をするように変化する,という描像がうかびあがってくる.この発生期から成体への組織のダイナミクスの切り替えはどのように起こるのかなど,未解明なことはまだ多い.
最後に,この研究の物理学的な側面にもふれたい.筆者が恒常性の問題に興味をもったのは,表皮幹細胞のような2次元の組織において,これまでの手法ではフィードバックの距離の大小を判別できないことに気づいたからである.距離のスケールが大きい場合にはcritical birth deathモデルとよばれる確率モデルを解析に用いることが正当化されるが3,5),距離のスケールが小さい場合にはvoterモデルとよばれる別の非平衡統計力学のモデルを想定しなければならない.このvoterモデルは,これまでに集団における意見の形成(それゆえ,voter)や表面張力のきかない系でのcoarsening現象など,数理や物理の文脈における理論あるいは数値シミュレーションにてさかんに研究されているものの11),2次元系における実験の例はこれまでひとつもなかった.この研究において,表皮幹細胞の恒常性のダイナミクスが2次元voterモデルにしたがうことが見い出されたのと同時に,voterモデル様の現象がどのようなシナリオにより自然界に現われるかについても新しい知見が得られた7).今後も,マクロな非平衡現象のモデルが多細胞からなる現象の解析に役だち,また,生命現象にインスパイアされて理論研究が進展するような例が多く現われることが期待される.
文 献
- Leblond, C. P. & Walker, B. E.: Renewal of cell populations. Physiol. Rev., 36, 255-276 (1956)[PubMed]
- Messier, B. & Leblond, C. P.: Cell proliferation and migration as revealed by radioautography after injection of thymidine-H3 into male rats and mice. Am. J. Anat., 106, 247-285 (1960)[PubMed]
- Clayton, E., Doupe, D. P., Klein, A. M. et al.: A single type of progenitor cell maintains normal epidermis. Nature, 446, 185-189 (2007)[PubMed]
- Marques, J. P. & Leblond, C. P.: Mitosis and differentiation in the stratified squamous epithelium of the rat esophagus. Am. J. Anat., 117, 73-87 (1965)[PubMed]
- Klein, A. M. & Simons, B. D.: Universal patterns of stem cell fate in cycling adult tissues. Development, 138, 3103-3111 (2011)[PubMed]
- Rompolas, P., Mesa, K. R., Kawaguchi, K. et al.: Spatiotemporal coordination of stem cell commitment during epidermal homeostasis. Science, 352, 1471-1474 (2016)[PubMed]
- Yamaguchi, H., Kawaguchi, K. & Sagawa, T.: Dynamical crossover in a stochastic model of cell fate decision. Phys. Rev. E., 96, 012401 (2017)[PubMed]
- Marinari, E., Mehonic, A., Curran, S. et al.: Live-cell delamination counterbalances epithelial growth to limit tissue overcrowding. Nature, 484, 542-545 (2012)[PubMed]
- Eisenhoffer, G. T., Loftus, P. D., Yoshigi, M. et al.: Crowding induces live cell extrusion to maintain homeostatic cell numbers in epithelia. Nature, 484, 546-549 (2012)[PubMed]
- Miroshnikova, Y. A., Le, H. Q., Schneider, D. et al.: Adhesion forces and cortical tension couple cell proliferation and differentiation to drive epidermal stratification. Nat. Cell Biol., 20, 69-80 (2018)[PubMed]
- Dornic, I., Chate, H., Chave, J. et al.: Critical coarsening without surface tension: the universality class of the voter model. Phys. Rev. Lett., 87, 045701 (2001)[PubMed]
著者プロフィール
略歴:2015年 東京大学大学院理学系研究科博士課程 修了,同年 米国Harvard Medical School博士研究員を経て,2018年より理化学研究所生命機能科学研究センター チームリーダー.
研究テーマ:生物物理の理論と実験.
Allon M. Klein
米国Harvard Medical SchoolにてAssistant Professor.
研究室URL:https://klein.hms.harvard.edu/
© 2018 川口喬吾・Allon M. Klein Licensed under CC 表示 2.1 日本