転写因子Bach1およびBach2は環境の変化に応じた赤血球系細胞とミエロイド系細胞との分化の運命決定を制御する
加藤浩貴・五十嵐和彦
(東北大学大学院医学系研究科 生物化学分野)
email:五十嵐和彦
DOI: 10.7875/first.author.2018.102
Infection perturbs Bach2- and Bach1-dependent erythroid lineage ‘choice’ to cause anemia.
Hiroki Kato, Ari Itoh-Nakadai, Mitsuyo Matsumoto, Yusho Ishii, Miki Watanabe-Matsui, Masatoshi Ikeda, Risa Ebina-Shibuya, Yuki Sato, Masahiro Kobayashi, Hironari Nishizawa, Katsushi Suzuki, Akihiko Muto, Tohru Fujiwara, Yasuhito Nannya, Luca Malcovati, Mario Cazzola, Seishi Ogawa, Hideo Harigae, Kazuhiko Igarashi
Nature Immunology, 19, 1059-1070 (2018)
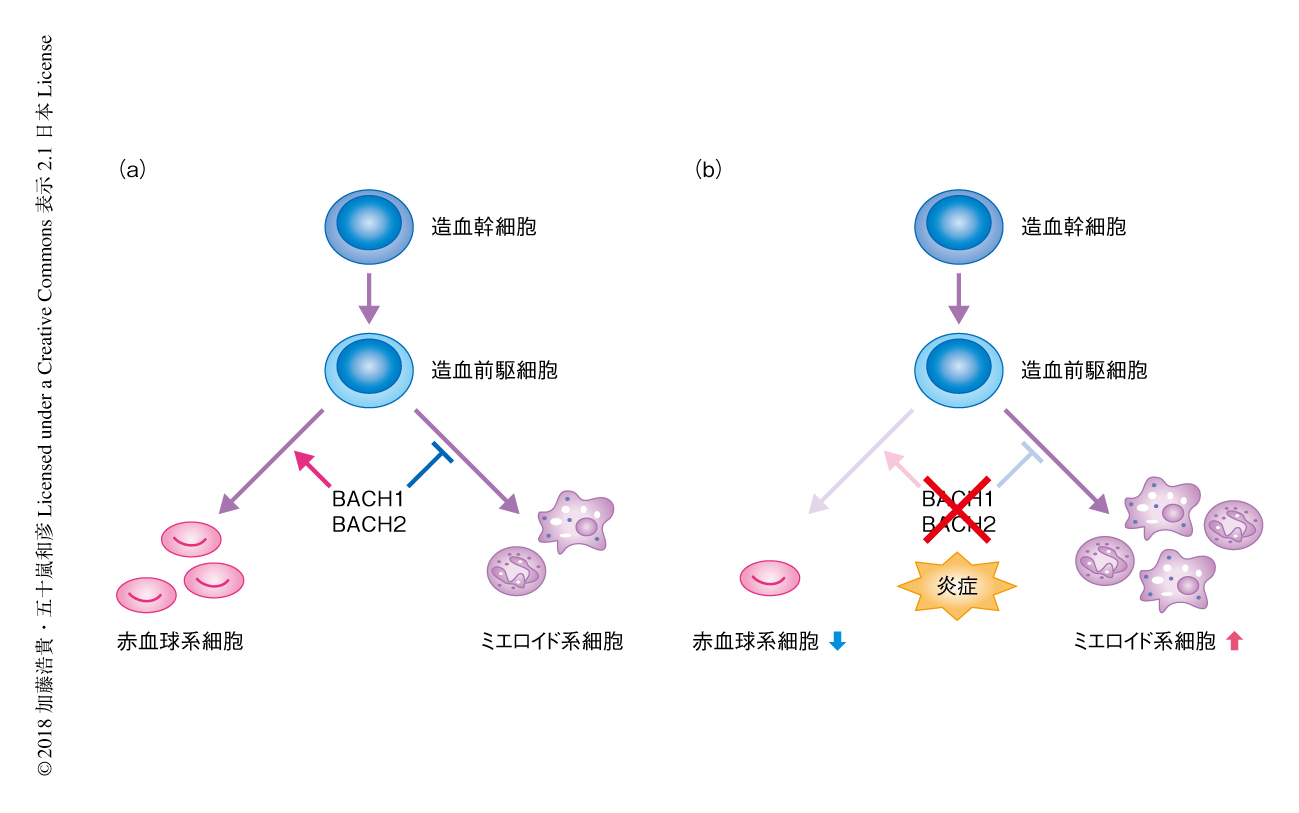
複雑な造血系は少数の造血幹細胞および造血前駆細胞の分化および成熟により構築される.生体における恒常性の維持には環境の変化に応じて造血幹細胞および造血前駆細胞の分化が適切に制御される必要があるのと当時に,その制御の異常はさまざまな血液疾患の原因となりうる.しかし,環境の変化に応じて造血幹細胞および造血前駆細胞の分化がどのように制御されるかについてはいまだ不明な点が多い.この研究において,筆者らは,ヘムにより抑制されるというユニークな特徴をもつ転写因子Bach1およびBach2が,定常な状態では造血幹細胞および造血前駆細胞の赤血球系細胞への分化を支持する一方,感染症あるいは炎症の状態においてはそのはたらきが抑制されることにより赤血球系細胞への分化が低下し,転写因子C/EBPβによるミエロイド系遺伝子の活性化によりミエロイド系細胞への分化が亢進することを明らかにした.この機構は感染症にともなう貧血の発症機構のひとつと考えられた.また,Bach2の発現の低下は代表的な造血器腫瘍のひとつである骨髄異形成症候群においても認められた.Bach2は骨髄異形成症候群における貧血などの病態の発症に関与する可能性があり,治療の新たな標的となりうると考えられた.
造血系はごく少数の造血幹細胞および造血前駆細胞が徐々にその多分化能を失いながら最終的にはひとつの成熟した細胞へと分化および成熟することにより構築される非常に複雑なシステムである1).生体がその恒常性を維持するためにはこれら造血幹細胞および造血前駆細胞の分化が環境の変化に応じて適切に制御される必要があり,たとえば,感染症や炎症の状態においては自然免疫を担当する顆粒球やマクロファージなどミエロイド系細胞が増加し赤血球系細胞が減少することが知られている2).緊急の際のミエロイド系細胞への分化の亢進は合理的である一方,感染や炎症が遷延した場合には貧血などの原因となりうる.しかし,環境の変化に応じて造血幹細胞および造血前駆細胞の分化がどのように変化し,そこにどのような機序があるのかについては不明な点が多く,その解明は血液疾患や自己免疫疾患などさまざまな疾患の理解につながるものと考えられる.この問題は,細胞の運命決定の機構とも密接にかかわることが予想されるが,近年,赤血球への運命決定はGATA-1のみでは説明されない可能性が指摘されており3),赤血球への運命決定の機構についてもいまだ不明な点が多い.
これまで,筆者らの研究室は,ヘムにより抑制されるというユニークな特徴をもつ転写因子Bach1およびBach2について研究してきた4).Bach1およびBach2はミエロイド系遺伝子の発現を抑制することによりリンパ球系細胞の適切な分化を支持することなどを報告した5,6)(文献5) は 新着論文レビュー でも掲載).Bach1およびBach2のもつミエロイド系遺伝子の抑制能は赤血球系細胞とミエロイド系細胞との分化の分岐点においても重要な役割をはたす可能性が考えられた.この研究においては,Bach1とBach2のダブルノックアウトマウスの解析を中心としてBach1およびBach2の赤血球系細胞とミエロイド系細胞との分化における機能を解析し,環境の変化に応じた造血幹細胞および造血前駆細胞の分化の制御機構について研究を進めた.
フローサイトメトリーなどを用いたBach1 Bach2ダブルノックアウトマウスの表現型の解析の結果,Bach1 Bach2ダブルノックアウトマウスは軽度の貧血を呈し,野生型のマウスと比較して骨髄における赤血球の造血が前駆細胞の段階から低下した.そこで,赤血球系細胞とミエロイド系細胞との共通の前駆細胞である骨髄系共通前駆細胞に対し網羅的なトランスクリプトーム解析を実施したところ,Bach1 Bach2ダブルノックアウトマウスに由来する骨髄系共通前駆細胞においては野生型と比較して赤血球系遺伝子およびリンパ球系遺伝子の発現が低下しミエロイド系遺伝子の発現が上昇していた.造血幹細胞および造血前駆細胞の画分を用いた移植実験においては,Bach1 Bach2ダブルノックアウトマウスに由来する造血幹細胞および造血前駆細胞は野生型と比較してミエロイド系細胞への分化が亢進しリンパ球系細胞への分化が低下した.さらに,造血幹細胞および造血前駆細胞の画分においてBach2を過剰に発現したのち移植したところ,ミエロイド系細胞への分化が抑制され赤血球系細胞への分化が亢進した.これらの結果から,Bach1およびBach2は赤血球系細胞とミエロイド系細胞との分化の段階において,遺伝子発現の制御により赤血球系細胞への分化を促進しミエロイド系細胞への分化を抑制すると考えられた.
トランスクリプトーム解析において,Bach1 Bach2ダブルノックアウトマウスに由来する骨髄系共通前駆細胞においては野生型と比較してリポ多糖の刺激により発現の誘導される遺伝子が有意に発現していた.Bach1 Bach2ダブルノックアウトマウスにおいて認められたミエロイド系細胞の分化の亢進および赤血球系細胞の分化の低下は野生型のマウスをリポ多糖により刺激したときの表現型としても認められるため7),Bach1 Bach2ダブルノックアウトマウスに由来する骨髄系共通前駆細胞は感染の状態を反映する遺伝子の発現パターンをもつと考えられた.そこで,リポ多糖の刺激によるBach1およびBach2の発現の変動について解析した.in vitroにおいて野生型のマウスに由来する骨髄系共通前駆細胞をリポ多糖により刺激したところBach1およびBach2の発現が低下した.同様の所見は,リポ多糖の刺激によりミエロイド系細胞への分化がひき起こされるマウスの白血病細胞株M1細胞においても認められた.さらに,M1細胞にBach1およびBach2を過剰に発現させたところ,リポ多糖の刺激によるM1細胞のミエロイド系細胞への分化が抑制された.これらの結果から,リポ多糖の刺激によるミエロイド系細胞への分化の亢進はBach1およびBach2の抑制により起こると考えられた.そのほかのToll様受容体に対する刺激によってもBach1およびBach2の発現は抑制されることが確認され,Bach1およびBach2の発現は各種の感染性の刺激により抑制されると考えられた.また,細胞が傷害されたときに細胞から放出され“危険信号”としても知られているヘムを野生型のマウスへ投与したところ,ヘムはミエロイド系細胞への分化の亢進および赤血球系細胞への分化の抑制をもたらした.この所見はBach1 Bach2ダブルノックアウトマウスにおいてはキャンセルされたことから,ヘムによるミエロイド系細胞への分化の亢進および赤血球系細胞への分化の抑制にはヘムによるBach1およびBach2の抑制が関与することが示唆された.これらの結果から,Bach1およびBach2は感染症や炎症など環境の変化に応じてその発現および機能が抑制され,Bach1およびBach2の機能の低下が造血幹細胞および造血前駆細胞からのミエロイド系細胞への分化の亢進をひき起こすことが示唆された.
Bach1およびBach2は転写因子であることから,赤血球系細胞とミエロイド系細胞との分化の制御において直接の標的となる遺伝子の同定を試みた.M1細胞におけるBach1およびBach2のChIP-seq解析のデータと網羅的なトランスクリプトーム解析のデータを統合したところ,Bach1およびBach2はミエロイド系細胞の分化や炎症に関連する遺伝子の発現を抑制し,逆に,赤血球系細胞およびリンパ球系細胞の分化に関連する遺伝子の発現を促進することが示唆された.Bach1およびBach2により発現の抑制されたC/EBPβは感染症などにおける緊急の顆粒球の産生において重要な転写因子であるとともに8),Bach1およびBach2と共通の認識配列をもつ可能性があったことから,Bach1およびBach2とC/EBPβのChIP-seq解析のデータを統合したところ,ミエロイド系遺伝子の周辺の領域に多数の共局在領域のあることが示された.これらの結果から,Bach1およびBach2はC/EBPβと拮抗的に作用しながらミエロイド系細胞の分化や炎症に関連する遺伝子の発現を制御すると考えられた.
ヒトの臍帯血を用いたin vitroにおける赤血球の分化の誘導系においてBach1およびBach2をノックダウンしたところ赤血球の分化が低下し,Bach1およびBach2はヒトにおいても赤血球の造血に重要である可能性が示唆された.Bach1およびBach2の機能が障害されたときに予想される貧血や炎症の亢進などの所見は,代表的な造血器腫瘍である骨髄異形成症候群の臨床的な特徴と類似する.そこで,骨髄異形成症候群の患者に由来する検体を用いたトランスクリプトーム解析のデータ9,10) を再解析した.その結果,骨髄異形成症候群の患者においては健常者と比べてBach2の発現が有意に低下していた.また,Bach2の発現が骨髄異形成症候群の病勢の進行にともない低下する所見が認められた.これらのことから,骨髄異形成症候群におけるBach2の発現の低下はその病態に関与する可能性が示唆された.
この研究において,Bach1およびBach2が赤血球系細胞とミエロイド系細胞との分化の分岐点においてミエロイド系遺伝子の発現の抑制などを介して赤血球系細胞への分化を促進し,感染症などの環境の変化によりBach1およびBach2のはたらきが抑制されることにより造血幹細胞および造血前駆細胞の分化が制御されることが明らかにされた(図1).Bach1およびBach2とC/EBPβとの拮抗は,造血幹細胞および造血前駆細胞の赤血球系細胞とミエロイド細胞との運命決定にかかわり,感染症などはこの拮抗の状態を変化させることによりミエロイド系細胞の優位な造血をもたらすと考えられた.リンパ球系細胞の分化とミエロイド系細胞との分化にくわえ5),Bach1およびBach2の赤血球系細胞とミエロイド系細胞との分化における機能が示されたことにより,Bach1およびBach2は造血幹細胞および造血前駆細胞の運命決定において普遍的な役割をはたす可能性が考えられた.進化の過程において,生物が自然免疫を担当するミエロイド系細胞から獲得免疫を担当するリンパ球系細胞や酸素の輸送能をもつ赤血球系細胞などを獲得した際には,Bach1およびBach2などミエロイド系細胞への分化の抑制能をもつ転写因子の出現が重要な役割をはたした可能性が考えられる.さらに,Bach2の機能の低下は骨髄異形成症候群の病態にも関与する可能性があり,治療の新たな標的になりうると期待される.
略歴:2017年 東北大学大学院医学系研究科 修了,同年 東北大学病院 医員を経て,2018年より米国Massachusetts General Hospitalリサーチフェロー.
研究テーマ:造血幹細胞および造血前駆細胞の分化と造血器腫瘍.
関心事:造血幹細胞および造血前駆細胞の異常にともなう造血器腫瘍の発症の機構および新規の治療法の開発.
五十嵐 和彦(Kazuhiko Igarashi)
東北大学大学院医学系研究科 教授.
研究室URL:http://www.biochem.med.tohoku.ac.jp/
© 2018 加藤浩貴・五十嵐和彦 Licensed under CC 表示 2.1 日本
(東北大学大学院医学系研究科 生物化学分野)
email:五十嵐和彦
DOI: 10.7875/first.author.2018.102
Infection perturbs Bach2- and Bach1-dependent erythroid lineage ‘choice’ to cause anemia.
Hiroki Kato, Ari Itoh-Nakadai, Mitsuyo Matsumoto, Yusho Ishii, Miki Watanabe-Matsui, Masatoshi Ikeda, Risa Ebina-Shibuya, Yuki Sato, Masahiro Kobayashi, Hironari Nishizawa, Katsushi Suzuki, Akihiko Muto, Tohru Fujiwara, Yasuhito Nannya, Luca Malcovati, Mario Cazzola, Seishi Ogawa, Hideo Harigae, Kazuhiko Igarashi
Nature Immunology, 19, 1059-1070 (2018)
要 約
複雑な造血系は少数の造血幹細胞および造血前駆細胞の分化および成熟により構築される.生体における恒常性の維持には環境の変化に応じて造血幹細胞および造血前駆細胞の分化が適切に制御される必要があるのと当時に,その制御の異常はさまざまな血液疾患の原因となりうる.しかし,環境の変化に応じて造血幹細胞および造血前駆細胞の分化がどのように制御されるかについてはいまだ不明な点が多い.この研究において,筆者らは,ヘムにより抑制されるというユニークな特徴をもつ転写因子Bach1およびBach2が,定常な状態では造血幹細胞および造血前駆細胞の赤血球系細胞への分化を支持する一方,感染症あるいは炎症の状態においてはそのはたらきが抑制されることにより赤血球系細胞への分化が低下し,転写因子C/EBPβによるミエロイド系遺伝子の活性化によりミエロイド系細胞への分化が亢進することを明らかにした.この機構は感染症にともなう貧血の発症機構のひとつと考えられた.また,Bach2の発現の低下は代表的な造血器腫瘍のひとつである骨髄異形成症候群においても認められた.Bach2は骨髄異形成症候群における貧血などの病態の発症に関与する可能性があり,治療の新たな標的となりうると考えられた.
はじめに
造血系はごく少数の造血幹細胞および造血前駆細胞が徐々にその多分化能を失いながら最終的にはひとつの成熟した細胞へと分化および成熟することにより構築される非常に複雑なシステムである1).生体がその恒常性を維持するためにはこれら造血幹細胞および造血前駆細胞の分化が環境の変化に応じて適切に制御される必要があり,たとえば,感染症や炎症の状態においては自然免疫を担当する顆粒球やマクロファージなどミエロイド系細胞が増加し赤血球系細胞が減少することが知られている2).緊急の際のミエロイド系細胞への分化の亢進は合理的である一方,感染や炎症が遷延した場合には貧血などの原因となりうる.しかし,環境の変化に応じて造血幹細胞および造血前駆細胞の分化がどのように変化し,そこにどのような機序があるのかについては不明な点が多く,その解明は血液疾患や自己免疫疾患などさまざまな疾患の理解につながるものと考えられる.この問題は,細胞の運命決定の機構とも密接にかかわることが予想されるが,近年,赤血球への運命決定はGATA-1のみでは説明されない可能性が指摘されており3),赤血球への運命決定の機構についてもいまだ不明な点が多い.
これまで,筆者らの研究室は,ヘムにより抑制されるというユニークな特徴をもつ転写因子Bach1およびBach2について研究してきた4).Bach1およびBach2はミエロイド系遺伝子の発現を抑制することによりリンパ球系細胞の適切な分化を支持することなどを報告した5,6)(文献5) は 新着論文レビュー でも掲載).Bach1およびBach2のもつミエロイド系遺伝子の抑制能は赤血球系細胞とミエロイド系細胞との分化の分岐点においても重要な役割をはたす可能性が考えられた.この研究においては,Bach1とBach2のダブルノックアウトマウスの解析を中心としてBach1およびBach2の赤血球系細胞とミエロイド系細胞との分化における機能を解析し,環境の変化に応じた造血幹細胞および造血前駆細胞の分化の制御機構について研究を進めた.
1.Bach1およびBach2は赤血球系細胞への分化を促進する
フローサイトメトリーなどを用いたBach1 Bach2ダブルノックアウトマウスの表現型の解析の結果,Bach1 Bach2ダブルノックアウトマウスは軽度の貧血を呈し,野生型のマウスと比較して骨髄における赤血球の造血が前駆細胞の段階から低下した.そこで,赤血球系細胞とミエロイド系細胞との共通の前駆細胞である骨髄系共通前駆細胞に対し網羅的なトランスクリプトーム解析を実施したところ,Bach1 Bach2ダブルノックアウトマウスに由来する骨髄系共通前駆細胞においては野生型と比較して赤血球系遺伝子およびリンパ球系遺伝子の発現が低下しミエロイド系遺伝子の発現が上昇していた.造血幹細胞および造血前駆細胞の画分を用いた移植実験においては,Bach1 Bach2ダブルノックアウトマウスに由来する造血幹細胞および造血前駆細胞は野生型と比較してミエロイド系細胞への分化が亢進しリンパ球系細胞への分化が低下した.さらに,造血幹細胞および造血前駆細胞の画分においてBach2を過剰に発現したのち移植したところ,ミエロイド系細胞への分化が抑制され赤血球系細胞への分化が亢進した.これらの結果から,Bach1およびBach2は赤血球系細胞とミエロイド系細胞との分化の段階において,遺伝子発現の制御により赤血球系細胞への分化を促進しミエロイド系細胞への分化を抑制すると考えられた.
2.Bach1およびBach2の発現は感染症あるいは炎症の状態においては抑制される
トランスクリプトーム解析において,Bach1 Bach2ダブルノックアウトマウスに由来する骨髄系共通前駆細胞においては野生型と比較してリポ多糖の刺激により発現の誘導される遺伝子が有意に発現していた.Bach1 Bach2ダブルノックアウトマウスにおいて認められたミエロイド系細胞の分化の亢進および赤血球系細胞の分化の低下は野生型のマウスをリポ多糖により刺激したときの表現型としても認められるため7),Bach1 Bach2ダブルノックアウトマウスに由来する骨髄系共通前駆細胞は感染の状態を反映する遺伝子の発現パターンをもつと考えられた.そこで,リポ多糖の刺激によるBach1およびBach2の発現の変動について解析した.in vitroにおいて野生型のマウスに由来する骨髄系共通前駆細胞をリポ多糖により刺激したところBach1およびBach2の発現が低下した.同様の所見は,リポ多糖の刺激によりミエロイド系細胞への分化がひき起こされるマウスの白血病細胞株M1細胞においても認められた.さらに,M1細胞にBach1およびBach2を過剰に発現させたところ,リポ多糖の刺激によるM1細胞のミエロイド系細胞への分化が抑制された.これらの結果から,リポ多糖の刺激によるミエロイド系細胞への分化の亢進はBach1およびBach2の抑制により起こると考えられた.そのほかのToll様受容体に対する刺激によってもBach1およびBach2の発現は抑制されることが確認され,Bach1およびBach2の発現は各種の感染性の刺激により抑制されると考えられた.また,細胞が傷害されたときに細胞から放出され“危険信号”としても知られているヘムを野生型のマウスへ投与したところ,ヘムはミエロイド系細胞への分化の亢進および赤血球系細胞への分化の抑制をもたらした.この所見はBach1 Bach2ダブルノックアウトマウスにおいてはキャンセルされたことから,ヘムによるミエロイド系細胞への分化の亢進および赤血球系細胞への分化の抑制にはヘムによるBach1およびBach2の抑制が関与することが示唆された.これらの結果から,Bach1およびBach2は感染症や炎症など環境の変化に応じてその発現および機能が抑制され,Bach1およびBach2の機能の低下が造血幹細胞および造血前駆細胞からのミエロイド系細胞への分化の亢進をひき起こすことが示唆された.
3.Bach1およびBach2の標的となる遺伝子の同定
Bach1およびBach2は転写因子であることから,赤血球系細胞とミエロイド系細胞との分化の制御において直接の標的となる遺伝子の同定を試みた.M1細胞におけるBach1およびBach2のChIP-seq解析のデータと網羅的なトランスクリプトーム解析のデータを統合したところ,Bach1およびBach2はミエロイド系細胞の分化や炎症に関連する遺伝子の発現を抑制し,逆に,赤血球系細胞およびリンパ球系細胞の分化に関連する遺伝子の発現を促進することが示唆された.Bach1およびBach2により発現の抑制されたC/EBPβは感染症などにおける緊急の顆粒球の産生において重要な転写因子であるとともに8),Bach1およびBach2と共通の認識配列をもつ可能性があったことから,Bach1およびBach2とC/EBPβのChIP-seq解析のデータを統合したところ,ミエロイド系遺伝子の周辺の領域に多数の共局在領域のあることが示された.これらの結果から,Bach1およびBach2はC/EBPβと拮抗的に作用しながらミエロイド系細胞の分化や炎症に関連する遺伝子の発現を制御すると考えられた.
4.Bach2の骨髄異形成症候群の病態への関与
ヒトの臍帯血を用いたin vitroにおける赤血球の分化の誘導系においてBach1およびBach2をノックダウンしたところ赤血球の分化が低下し,Bach1およびBach2はヒトにおいても赤血球の造血に重要である可能性が示唆された.Bach1およびBach2の機能が障害されたときに予想される貧血や炎症の亢進などの所見は,代表的な造血器腫瘍である骨髄異形成症候群の臨床的な特徴と類似する.そこで,骨髄異形成症候群の患者に由来する検体を用いたトランスクリプトーム解析のデータ9,10) を再解析した.その結果,骨髄異形成症候群の患者においては健常者と比べてBach2の発現が有意に低下していた.また,Bach2の発現が骨髄異形成症候群の病勢の進行にともない低下する所見が認められた.これらのことから,骨髄異形成症候群におけるBach2の発現の低下はその病態に関与する可能性が示唆された.
おわりに
この研究において,Bach1およびBach2が赤血球系細胞とミエロイド系細胞との分化の分岐点においてミエロイド系遺伝子の発現の抑制などを介して赤血球系細胞への分化を促進し,感染症などの環境の変化によりBach1およびBach2のはたらきが抑制されることにより造血幹細胞および造血前駆細胞の分化が制御されることが明らかにされた(図1).Bach1およびBach2とC/EBPβとの拮抗は,造血幹細胞および造血前駆細胞の赤血球系細胞とミエロイド細胞との運命決定にかかわり,感染症などはこの拮抗の状態を変化させることによりミエロイド系細胞の優位な造血をもたらすと考えられた.リンパ球系細胞の分化とミエロイド系細胞との分化にくわえ5),Bach1およびBach2の赤血球系細胞とミエロイド系細胞との分化における機能が示されたことにより,Bach1およびBach2は造血幹細胞および造血前駆細胞の運命決定において普遍的な役割をはたす可能性が考えられた.進化の過程において,生物が自然免疫を担当するミエロイド系細胞から獲得免疫を担当するリンパ球系細胞や酸素の輸送能をもつ赤血球系細胞などを獲得した際には,Bach1およびBach2などミエロイド系細胞への分化の抑制能をもつ転写因子の出現が重要な役割をはたした可能性が考えられる.さらに,Bach2の機能の低下は骨髄異形成症候群の病態にも関与する可能性があり,治療の新たな標的になりうると期待される.
文 献
- Laurenti, E. & Gottgens, B.: From haematopoietic stem cells to complex differentiation landscapes. Nature, 553, 418-426 (2018)[PubMed]
- Glatman Zaretsky, A., Engiles, J. B. & Hunter, C. A.: Infection-induced changes in hematopoiesis. J. Immunol., 192, 27-33 (2014)[PubMed]
- Hoppe, P. S., Schwarzfischer, M. Loeffler, D. et al.: Early myeloid lineage choice is not initiated by random PU.1 to GATA1 protein ratios. Nature, 535, 299-302 (2016)[PubMed]
- Igarashi, K. & Watanabe-Matsui, M.: Wearing red for signaling: the heme-Bach axis in heme metabolism, oxidative stress response and iron immunology. Tohoku J. Exp. Med., 232, 229-253 (2014)[PubMed]
- Itoh-Nakadai, A., Hikota, R., Muto, A. et al.: The transcription repressors Bach2 and Bach1 promote B cell development by repressing the myeloid program. Nat. Immunol., 15, 1171-1180 (2014)[PubMed] [新着論文レビュー]
- Itoh-Nakadai, A., Matsumoto, M., Kato, H. et al.: A Bach2-Cebp gene regulatory network for the commitment of multipotent hematopoietic progenitors. Cell Rep., 18, 2401-2414 (2017)[PubMed]
- O'Connell, R. M., Rao, D. S., Chaudhuri, A. A. et al.: Sustained expression of microRNA-155 in hematopoietic stem cells causes a myeloproliferative disorder. J. Exp. Med., 205, 585-594 (2008)[PubMed]
- Hirai, H., Zhang, P., Dayaram, T. et al.: C/EBPβ is required for 'emergency' granulopoiesis. Nat. Immunol., 7, 732-739 (2006)[PubMed]
- Pellagatti, A., Cazzola, M., Giagounidis, A. et al.: Deregulated gene expression pathways in myelodysplastic syndrome hematopoietic stem cells. Leukemia, 24, 756-764 (2010)[PubMed]
- Shiozawa, Y., Malcovati, L., Galli, A. et al.: Gene expression and risk of leukemic transformation in myelodysplasia. Blood, 130, 2642-2653 (2017)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2017年 東北大学大学院医学系研究科 修了,同年 東北大学病院 医員を経て,2018年より米国Massachusetts General Hospitalリサーチフェロー.
研究テーマ:造血幹細胞および造血前駆細胞の分化と造血器腫瘍.
関心事:造血幹細胞および造血前駆細胞の異常にともなう造血器腫瘍の発症の機構および新規の治療法の開発.
五十嵐 和彦(Kazuhiko Igarashi)
東北大学大学院医学系研究科 教授.
研究室URL:http://www.biochem.med.tohoku.ac.jp/
© 2018 加藤浩貴・五十嵐和彦 Licensed under CC 表示 2.1 日本