ヒトにおいてRad52およびXPGを介したRループ構造の解消により転写共役型相同組換え修復がひき起こされる
安原崇哲1・加藤玲於奈1・柴田淳史2・宮川 清1
(1東京大学大学院医学系研究科 疾患生命工学センター放射線分子医学部門,2群馬大学大学院医学系研究科 大学院教育研究支援センター)
email:安原崇哲
DOI: 10.7875/first.author.2018.100
Human Rad52 promotes XPG-mediated R-loop processing to initiate transcription-associated homologous recombination repair.
Takaaki Yasuhara, Reona Kato, Yoshihiko Hagiwara, Bunsyo Shiotani, Motohiro Yamauchi, Shinichiro Nakada, Atsushi Shibata, Kiyoshi Miyagawa
Cell, 175, 558-570.e11 (2018)
ゲノムは実際にはその一部しか利用されておらず,頻繁に転写される領域は相対的に重要であると考えられるが,そのような領域に生じたDNA損傷は遺伝情報を保持するため正確に修復されることが必要である.これまでの研究においてそのような現象は観察されていたが,どのようにしてDNA損傷を正確に修復する経路がひき起こされるのかについてはわかっていなかった.この研究において,筆者らは,転写が活性化している領域にDNA損傷,とくに2本鎖DNA切断が生じると,その周辺にRループとよばれるDNAおよびRNAからなる構造が形成されることを見い出した.さらに,Rad52およびXPGがRループ構造を認識し解消することにより正確なDNA修復経路,すなわち,相同組換えによるDNA修復がひき起こされることが明らかにされた.このような転写に共役した相同組換えによるDNA修復を阻害すると染色体の異常が顕著に増加したことから,転写共役型相同組換え修復はがんなどの疾患をふせぐ重要な機構であることが示唆された.
ゲノムは日々たくさんの損傷をうけているが,そのほとんどがDNA修復機構により修復され恒常性が維持される.種々のDNA損傷のなかでも2本鎖DNA切断はもっとも重篤であり,その不正確な修復によりがんなどにみられるゲノムの異常が生じる.ヒトにおいて2本鎖DNA切断はおもに2つの経路,すなわち,非相同末端結合(non-homologous end-joining),および,相同組換え(homologous recombination)により修復される.相同組換え修復は姉妹染色体を鋳型とするため相対的に正確なDNA修復機構であると考えられるが,姉妹染色体の存在するS期/G2期にしか起こらない.酵母などの単細胞生物においてほとんどすべての2本鎖DNA切断は相同組換えにより修復される一方,ヒトのG2期の細胞においてはゲノムにランダムに発生した2本鎖DNA切断のうち約30%が相同組換え,約70%が非相同末端結合により修復される1).これらのことから,進化の過程において相同組換え修復の起こる領域とそうでない領域を選択するための機構が獲得されたことが示唆される.これまでの研究において,この選択の機構についてさまざまなモデルが提唱されており,相同組換え修復は転写の活性化した領域において起こりやすいことが知られていた2).しかしながら,細胞が転写の活性化した領域にある2本鎖DNA切断をどのように認識し相同組換えをひき起こすのかについてはくわしくわかっていなかった.
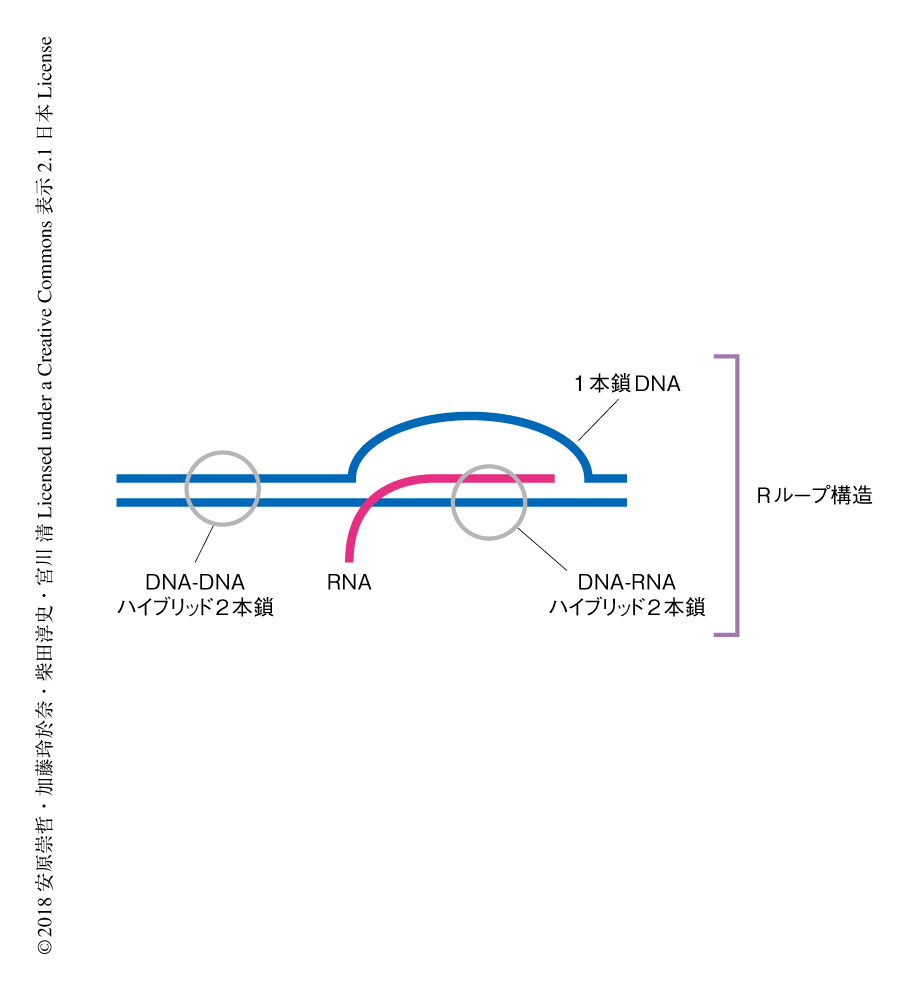
転写の活性化した領域にはRNAが豊富に存在するため,それらがDNA修復をはじめとするさまざまな機能に影響をおよぼすと考えられている.DNAとRNAが形成したDNA-RNAハイブリッド2本鎖と1本鎖DNAにより構成される構造はRループとよばれる(図1).このRループ構造がゲノムの安定性におよぼす影響についてはさまざまな研究がなされており,近年,分裂酵母においてRループ構造が相同組換え修復をひき起こすことが示された3).この研究において,筆者らは,ヒトにおいてもRループ構造が相同組換え修復をひき起こすのか,また,その詳細な分子機構の解明をめざした.
相同組換え修復はG0期/G1期において起こらないこと,さらに,DNA複製のおよぼす影響を排除するため,ヒトのG2期の細胞に放射線を照射し2本鎖DNA切断を起こした.相同組換え修復は,ヌクレアーゼにより2本鎖DNA切断の末端から削り込みが起こり1本鎖DNAが露出することにより開始する4).このとき,1本鎖DNAに結合するRPA複合体やRad51の集積を免疫染色法により可視化することで,相同組換え修復の開始を定量することができる.この方法を用いて転写の阻害剤により処理した細胞における相同組換え修復の頻度を測定したところ,すべての相同組換え修復のイベントに対し20~30%の割合で,処理していない細胞に比べ頻度が低下した.このことから,相同組換え修復の一部は進行している転写に依存することが示唆され,このDNA修復経路を転写共役型相同組換え修復とよぶことにした.
出芽酵母においてRad52はRNAと2本鎖DNA切断の修復とを結びつけるタンパク質であるとの報告があったことから5),ヒトにおいてもRad52が転写共役型相同組換え修復に関与するとの仮説をたてた.CRISPR-Cas9によるゲノム編集によりRad52を欠損した細胞を作製し解析したところ,転写共役型相同組換え修復は起こらないことが判明した.したがって,ヒトにおいてRad52が転写共役型相同組換え修復に関与することが示された.
最近,RIF1-53BP1複合体による非相同末端結合の促進がBRCA1により抑制されることにより相同組換え修復は開始することが明らかにされた6).そこで,転写共役型相同組換え修復がBRCA1によるRIF1-53BP1複合体の抑制に依存するかどうかを調べた.まず,Rad52の欠損により抑制された転写共役型相同組換え修復はRIF1あるいは53BP1のノックダウンにより回復するが,転写の阻害剤により抑制された転写共役型相同組換え修復は回復しないことが判明した.これらのことから,転写共役型相同組換え修復の開始においては,進行している転写の存在は必須であるが,Rad52はRIF1-53BP1複合体を抑制するために必要であることが示唆された.さらに,BRCA1をノックダウンした細胞において転写共役型相同組換え修復は起こらなかったことから,Rad52はBRCA1の機能を促進する可能性が示唆された.実際,転写共役型相同組換え修復が起こる部位へのBRCA1の集積はRad52に依存していた.したがって,Rad52の転写共役型相同組換え修復における機能のひとつは,BRCA1を介したRIF1-53BP1複合体の抑制であることが示された.
2本鎖DNA切断を特異的に発生させるレーザーの照射のシステム7),および,Rループ構造のインジケーター8) を組み合わせることにより,2本鎖DNA切断が生じたのちのRループ構造の形成,および,それが解消されるようすをリアルタイムで可視化することに成功した.2本鎖DNA切断が生じたのちのRループ構造の形成は,約1分でピークに達し,5分以内に大半が解消された.つぎに,Rループ構造の形成が相同組換え修復の開始に必要かどうかを調べた.Rループ構造を特異的に分解するRNaseH1を過剰に発現させることによりRループ構造の形成を阻害することができる.この方法を用いてRループ構造が相同組換え修復の頻度におよぼす影響について測定したところ,Rad52を欠損した細胞と同じ程度の低下が認められ,Rループ構造およびRad52は同じ経路において相同組換え修復に関与することが示された.
2本鎖DNA切断が生じたのちのRループ構造の解消について,さまざまなタンパク質のおよぼす影響について調べたところ,Rad52を欠損した細胞においてRループ構造の解消が遅滞することがわかった.さきの結果をあわせると,相同組換え修復の開始には,Rループ構造の形成および解消のどちらも必要であるとともに,Rad52はRループ構造の解消を促進することにより相同組換え修復を開始することが示唆された.
2本鎖DNA切断が生じたのちのRループ構造の解消にかかわるタンパク質についてさらに調べていくと,塩基除去修復において機能する2つのヌクレアーゼXPFおよびXPGのうち,XPGのみが2本鎖DNA切断が生じたのちのRループ構造の解消に寄与することが判明した.さらに,Rad52とXPGとの関係について調べたところ,2本鎖DNA切断の生じた部位へのXPGの集積はRad52に依存することがわかった.したがって,転写共役型相同組換え修復におけるRad52のもうひとつの役割として,XPGを介したRループ構造の解消の促進が示された.
転写共役型相同組換え修復が不全になった場合に細胞にどのような影響があるかを解析するため,G2期の細胞における不正なDNA修復により起こりうるゲノムの異常のうち,姉妹染色体のあいだの結合の頻度について測定した.姉妹染色体のあいだの不正な結合の頻度は,転写の阻害剤により処理した細胞やRad52を欠損した細胞において顕著に上昇した一方,非相同末端結合にかかわるLIG4を欠損した細胞においては頻度の上昇はみられなかった.したがって,転写共役型相同組換え修復が不全になった場合には,不正な非相同末端結合によるDNA修復によりゲノムの異常が顕著に増大することが判明した.また,転写共役型相同組換え修復を含むすべての相同組換え修復の開始に必須であるCtIPをノックダウンした場合にも,転写の阻害剤により処理した細胞やRad52を欠損した細胞においてみられる頻度と同等の異常しか観察されなかった.このことから,すべての相同組換え修復のなかでも,とくに転写共役型相同組換え修復がゲノムの異常の抑制に強く寄与することが示唆された.
ゲノムにおいて頻繁に転写される領域はとくに重要性が高いと考えられ,そのような領域に生じたDNA損傷は正確に修復する必要性が非常に高いと考えられる.この研究により明らかにされた転写共役型相同組換え修復は,まさにその一端を担う機構であると考えられ,その破綻によりゲノムの重要な領域に生じた異常が,のちにがんなどの疾患につながることは容易に想像される(図2).このように,正常な細胞がいかにその正常性を維持するかについての分子機構を解明していくことは,がんなどの疾患に対する根源的な理解をみちびくとともに,それらに対抗するヒントをあたえるものと思われる.
略歴:2015年 東京大学大学院医学系研究科 修了,同年 同 助教を経て,2018年より米国Massachusetts General HospitalにてResearch Fellow.
研究テーマ:ゲノムの安定性を維持する機構.
抱負:非常に合理的かつ洗練された細胞におけるシステムの解明をつうじた疾患の根源的な理解に,今後もさまざまな角度から挑戦したい.
加藤 玲於奈(Reona Kato)
東京大学大学院医学系研究科博士課程 在学中.
柴田 淳史(Atsushi Shibata)
群馬大学大学院医学系研究科 研究講師.
宮川 清(Kiyoshi Miyagawa)
東京大学大学院医学系研究科 教授.
研究室URL:http://www.cdbim.m.u-tokyo.ac.jp/research/07.php
© 2018 安原崇哲・加藤玲於奈・柴田淳史・宮川 清 Licensed under CC 表示 2.1 日本
(1東京大学大学院医学系研究科 疾患生命工学センター放射線分子医学部門,2群馬大学大学院医学系研究科 大学院教育研究支援センター)
email:安原崇哲
DOI: 10.7875/first.author.2018.100
Human Rad52 promotes XPG-mediated R-loop processing to initiate transcription-associated homologous recombination repair.
Takaaki Yasuhara, Reona Kato, Yoshihiko Hagiwara, Bunsyo Shiotani, Motohiro Yamauchi, Shinichiro Nakada, Atsushi Shibata, Kiyoshi Miyagawa
Cell, 175, 558-570.e11 (2018)
要 約
ゲノムは実際にはその一部しか利用されておらず,頻繁に転写される領域は相対的に重要であると考えられるが,そのような領域に生じたDNA損傷は遺伝情報を保持するため正確に修復されることが必要である.これまでの研究においてそのような現象は観察されていたが,どのようにしてDNA損傷を正確に修復する経路がひき起こされるのかについてはわかっていなかった.この研究において,筆者らは,転写が活性化している領域にDNA損傷,とくに2本鎖DNA切断が生じると,その周辺にRループとよばれるDNAおよびRNAからなる構造が形成されることを見い出した.さらに,Rad52およびXPGがRループ構造を認識し解消することにより正確なDNA修復経路,すなわち,相同組換えによるDNA修復がひき起こされることが明らかにされた.このような転写に共役した相同組換えによるDNA修復を阻害すると染色体の異常が顕著に増加したことから,転写共役型相同組換え修復はがんなどの疾患をふせぐ重要な機構であることが示唆された.
はじめに
ゲノムは日々たくさんの損傷をうけているが,そのほとんどがDNA修復機構により修復され恒常性が維持される.種々のDNA損傷のなかでも2本鎖DNA切断はもっとも重篤であり,その不正確な修復によりがんなどにみられるゲノムの異常が生じる.ヒトにおいて2本鎖DNA切断はおもに2つの経路,すなわち,非相同末端結合(non-homologous end-joining),および,相同組換え(homologous recombination)により修復される.相同組換え修復は姉妹染色体を鋳型とするため相対的に正確なDNA修復機構であると考えられるが,姉妹染色体の存在するS期/G2期にしか起こらない.酵母などの単細胞生物においてほとんどすべての2本鎖DNA切断は相同組換えにより修復される一方,ヒトのG2期の細胞においてはゲノムにランダムに発生した2本鎖DNA切断のうち約30%が相同組換え,約70%が非相同末端結合により修復される1).これらのことから,進化の過程において相同組換え修復の起こる領域とそうでない領域を選択するための機構が獲得されたことが示唆される.これまでの研究において,この選択の機構についてさまざまなモデルが提唱されており,相同組換え修復は転写の活性化した領域において起こりやすいことが知られていた2).しかしながら,細胞が転写の活性化した領域にある2本鎖DNA切断をどのように認識し相同組換えをひき起こすのかについてはくわしくわかっていなかった.
転写の活性化した領域にはRNAが豊富に存在するため,それらがDNA修復をはじめとするさまざまな機能に影響をおよぼすと考えられている.DNAとRNAが形成したDNA-RNAハイブリッド2本鎖と1本鎖DNAにより構成される構造はRループとよばれる(図1).このRループ構造がゲノムの安定性におよぼす影響についてはさまざまな研究がなされており,近年,分裂酵母においてRループ構造が相同組換え修復をひき起こすことが示された3).この研究において,筆者らは,ヒトにおいてもRループ構造が相同組換え修復をひき起こすのか,また,その詳細な分子機構の解明をめざした.
1.ヒトにおける相同組換え修復の一部は転写およびRad52に依存する
相同組換え修復はG0期/G1期において起こらないこと,さらに,DNA複製のおよぼす影響を排除するため,ヒトのG2期の細胞に放射線を照射し2本鎖DNA切断を起こした.相同組換え修復は,ヌクレアーゼにより2本鎖DNA切断の末端から削り込みが起こり1本鎖DNAが露出することにより開始する4).このとき,1本鎖DNAに結合するRPA複合体やRad51の集積を免疫染色法により可視化することで,相同組換え修復の開始を定量することができる.この方法を用いて転写の阻害剤により処理した細胞における相同組換え修復の頻度を測定したところ,すべての相同組換え修復のイベントに対し20~30%の割合で,処理していない細胞に比べ頻度が低下した.このことから,相同組換え修復の一部は進行している転写に依存することが示唆され,このDNA修復経路を転写共役型相同組換え修復とよぶことにした.
出芽酵母においてRad52はRNAと2本鎖DNA切断の修復とを結びつけるタンパク質であるとの報告があったことから5),ヒトにおいてもRad52が転写共役型相同組換え修復に関与するとの仮説をたてた.CRISPR-Cas9によるゲノム編集によりRad52を欠損した細胞を作製し解析したところ,転写共役型相同組換え修復は起こらないことが判明した.したがって,ヒトにおいてRad52が転写共役型相同組換え修復に関与することが示された.
2.Rad52はBRCA1を介してRIF1-53BP1複合体を抑制することにより転写共役型相同組換え修復を開始する
最近,RIF1-53BP1複合体による非相同末端結合の促進がBRCA1により抑制されることにより相同組換え修復は開始することが明らかにされた6).そこで,転写共役型相同組換え修復がBRCA1によるRIF1-53BP1複合体の抑制に依存するかどうかを調べた.まず,Rad52の欠損により抑制された転写共役型相同組換え修復はRIF1あるいは53BP1のノックダウンにより回復するが,転写の阻害剤により抑制された転写共役型相同組換え修復は回復しないことが判明した.これらのことから,転写共役型相同組換え修復の開始においては,進行している転写の存在は必須であるが,Rad52はRIF1-53BP1複合体を抑制するために必要であることが示唆された.さらに,BRCA1をノックダウンした細胞において転写共役型相同組換え修復は起こらなかったことから,Rad52はBRCA1の機能を促進する可能性が示唆された.実際,転写共役型相同組換え修復が起こる部位へのBRCA1の集積はRad52に依存していた.したがって,Rad52の転写共役型相同組換え修復における機能のひとつは,BRCA1を介したRIF1-53BP1複合体の抑制であることが示された.
3.2本鎖DNA切断にともない形成および解消されるRループ構造が相同組換え修復の開始に必要である
2本鎖DNA切断を特異的に発生させるレーザーの照射のシステム7),および,Rループ構造のインジケーター8) を組み合わせることにより,2本鎖DNA切断が生じたのちのRループ構造の形成,および,それが解消されるようすをリアルタイムで可視化することに成功した.2本鎖DNA切断が生じたのちのRループ構造の形成は,約1分でピークに達し,5分以内に大半が解消された.つぎに,Rループ構造の形成が相同組換え修復の開始に必要かどうかを調べた.Rループ構造を特異的に分解するRNaseH1を過剰に発現させることによりRループ構造の形成を阻害することができる.この方法を用いてRループ構造が相同組換え修復の頻度におよぼす影響について測定したところ,Rad52を欠損した細胞と同じ程度の低下が認められ,Rループ構造およびRad52は同じ経路において相同組換え修復に関与することが示された.
2本鎖DNA切断が生じたのちのRループ構造の解消について,さまざまなタンパク質のおよぼす影響について調べたところ,Rad52を欠損した細胞においてRループ構造の解消が遅滞することがわかった.さきの結果をあわせると,相同組換え修復の開始には,Rループ構造の形成および解消のどちらも必要であるとともに,Rad52はRループ構造の解消を促進することにより相同組換え修復を開始することが示唆された.
4.XPGがRループ構造を解消することにより相同組換え修復は開始する
2本鎖DNA切断が生じたのちのRループ構造の解消にかかわるタンパク質についてさらに調べていくと,塩基除去修復において機能する2つのヌクレアーゼXPFおよびXPGのうち,XPGのみが2本鎖DNA切断が生じたのちのRループ構造の解消に寄与することが判明した.さらに,Rad52とXPGとの関係について調べたところ,2本鎖DNA切断の生じた部位へのXPGの集積はRad52に依存することがわかった.したがって,転写共役型相同組換え修復におけるRad52のもうひとつの役割として,XPGを介したRループ構造の解消の促進が示された.
5.転写共役型相同組換え修復は不正な非相同末端結合により起こるゲノムの異常を抑制する
転写共役型相同組換え修復が不全になった場合に細胞にどのような影響があるかを解析するため,G2期の細胞における不正なDNA修復により起こりうるゲノムの異常のうち,姉妹染色体のあいだの結合の頻度について測定した.姉妹染色体のあいだの不正な結合の頻度は,転写の阻害剤により処理した細胞やRad52を欠損した細胞において顕著に上昇した一方,非相同末端結合にかかわるLIG4を欠損した細胞においては頻度の上昇はみられなかった.したがって,転写共役型相同組換え修復が不全になった場合には,不正な非相同末端結合によるDNA修復によりゲノムの異常が顕著に増大することが判明した.また,転写共役型相同組換え修復を含むすべての相同組換え修復の開始に必須であるCtIPをノックダウンした場合にも,転写の阻害剤により処理した細胞やRad52を欠損した細胞においてみられる頻度と同等の異常しか観察されなかった.このことから,すべての相同組換え修復のなかでも,とくに転写共役型相同組換え修復がゲノムの異常の抑制に強く寄与することが示唆された.
おわりに
ゲノムにおいて頻繁に転写される領域はとくに重要性が高いと考えられ,そのような領域に生じたDNA損傷は正確に修復する必要性が非常に高いと考えられる.この研究により明らかにされた転写共役型相同組換え修復は,まさにその一端を担う機構であると考えられ,その破綻によりゲノムの重要な領域に生じた異常が,のちにがんなどの疾患につながることは容易に想像される(図2).このように,正常な細胞がいかにその正常性を維持するかについての分子機構を解明していくことは,がんなどの疾患に対する根源的な理解をみちびくとともに,それらに対抗するヒントをあたえるものと思われる.
文 献
- Shibata, A., Conrad, S., Birraux, J. et al.: Factors determining DNA double-strand break repair pathway choice in G2 phase. EMBO J., 30, 1079-1092 (2011)[PubMed]
- Aymard, F., Bugler, B., Schmidt, C. K. et al.: Transcriptionally active chromatin recruits homologous recombination at DNA double-strand breaks. Nat. Struct. Mol. Biol., 21, 366-374 (2014)[PubMed]
- Ohle, C., Tesorero, R., Schermann, G. et al.: Transient RNA-DNA hybrids are required for efficient double-strand break repair. Cell, 167, 1001-1013.e7 (2016)[PubMed]
- Shibata, A., Moiani, D., Arvai, A. S. et al.: DNA double-strand break repair pathway choice is directed by distinct MRE11 nuclease activities. Mol. Cell, 53, 7-18 (2014)[PubMed]
- Keskin, H., Shen, Y., Huang, F. et al.: Transcript-RNA-templated DNA recombination and repair. Nature, 515, 436-439 (2014)[PubMed]
- Isono, M., Niimi, A., Oike, T. et al.: BRCA1 directs the repair pathway to homologous recombination by promoting 53BP1 dephosphorylation. Cell Rep., 18, 520-532 (2017)[PubMed]
- Reynolds, P., Botchway, S. W., Parker, A. W. et al.: Spatiotemporal dynamics of DNA repair proteins following laser microbeam induced DNA damage: when is a DSB not a DSB? Mutat. Res., 756, 14-20 (2013)[PubMed]
- Bhatia, V., Barroso, S. I., Garcia-Rubio, M. L. et al.: BRCA2 prevents R-loop accumulation and associates with TREX-2 mRNA export factor PCID2. Nature, 511, 362-365 (2014)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2015年 東京大学大学院医学系研究科 修了,同年 同 助教を経て,2018年より米国Massachusetts General HospitalにてResearch Fellow.
研究テーマ:ゲノムの安定性を維持する機構.
抱負:非常に合理的かつ洗練された細胞におけるシステムの解明をつうじた疾患の根源的な理解に,今後もさまざまな角度から挑戦したい.
加藤 玲於奈(Reona Kato)
東京大学大学院医学系研究科博士課程 在学中.
柴田 淳史(Atsushi Shibata)
群馬大学大学院医学系研究科 研究講師.
宮川 清(Kiyoshi Miyagawa)
東京大学大学院医学系研究科 教授.
研究室URL:http://www.cdbim.m.u-tokyo.ac.jp/research/07.php
© 2018 安原崇哲・加藤玲於奈・柴田淳史・宮川 清 Licensed under CC 表示 2.1 日本