酢酸を基質としてRNAをアセチル化する酵素の発見
谷口貴昭・鈴木 勉
(東京大学大学院工学系研究科 化学生命工学専攻)
email:谷口貴昭,鈴木 勉
DOI: 10.7875/first.author.2018.097
Acetate-dependent tRNA acetylation required for decoding fidelity in protein synthesis.
Takaaki Taniguchi, Kenjyo Miyauchi, Yuriko Sakaguchi, Seisuke Yamashita, Akiko Soma, Kozo Tomita, Tsutomu Suzuki
Nature Chemical Biology, 14, 1010-1020 (2018)
タンパク質が翻訳ののちアセチル化されるように,RNAも転写ののちアセチル化されることが知られている.RNAのアセチル化修飾であるN4-アセチルシチジンはtRNAやrRNAに存在する.大腸菌にはtRNAMetのアンチコドン1字目にN4-アセチルシチジン修飾が存在し,修飾酵素TmcAによりアセチルCoAを基質として導入されることが知られていた.この研究において,筆者らは,TmcAのホモログをもたない枯草菌においてもtRNAMetのアンチコドン1字目にN4-アセチルシチジン修飾が存在することを見い出した.比較ゲノム解析による遺伝子の探索の結果,枯草菌をはじめとする一群の細菌には酢酸を基質としてN4-アセチルシチジン修飾を導入するユニークな修飾酵素TmcALの存在が明らかにされた.生化学的な解析および構造生物学的な解析の結果,TmcALはアミノアシルtRNA合成酵素と同じファミリーに属し,tRNAのアミノアシル化と同様の反応機構でアセチル化することが判明した.さらに,遺伝学的な解析から,TmcALがイソロイシンの遺伝暗号の解読に必須なライシジン修飾を担う酵素であるTilSと遺伝学的な相互作用のあることが判明した.TmcALがない状態でTilSのはたらきを抑制すると,tRNAMetによりAUAコドンがまちがってメチオニンとして解読されたことから,N4-アセチルシチジン修飾が正確な遺伝暗号の解読に決定的な役割を担うことが明らかにされた.この研究は,N4-アセチルシチジン修飾の生物学的な役割を解明した最初の報告である.
RNAは転写ののちさまざまな修飾をうけることが知られており,これまでに,140種類をこえるRNA修飾がさまざまな生物から報告されている1).最近では,エピトランスクリプトームとよばれ,転写後の段階における新しい遺伝子発現の制御機構として生命科学における大きな潮流を生み出している2).翻訳の過程において遺伝情報をアミノ酸配列へと変換するアダプター分子であるtRNAは多種多様な修飾を含むことが知られ,歴史的にも多くの研究がなされてきた.実際に,これまでに見い出されたRNA修飾の約8割はtRNAからみつかったものである.
N4-アセチルシチジン(ac4C)はシチジンの4位のアミノ基がアセチル化された修飾塩基であり,細菌,古細菌,真核生物にいたるすべての生物界において幅広くみつかっている.1972年,グラム陰性細菌である大腸菌においてtRNAMetのアンチコドン1字目にac4C修飾が発見された3).そして,1978年のin vitroにおける生化学的な実験により,ac4C修飾はAUAコドンの誤翻訳を防止することが示されたが4),その生物学的な機能は明らかにされていなかった.また,ac4C修飾の反応機構についてはながらく不明であったが,2008年,筆者らの研究室において,修飾酵素としてTmcAが同定された5).TmcAはヒストンアセチル化酵素にみられるNアセチルトランスフェラーゼドメインをもち,アセチルCoAを基質としてATPに依存的にac4C修飾を導入した.しかし,TmcAは一部のガンマプロテオバクテリアにおいてのみみつかっており,グラム陽性細菌である枯草菌などには存在しない.そのため,これまで,枯草菌などTmcAのホモログをもたない細菌にはac4C修飾は存在しないと考えられてきた.この研究において,筆者らは,枯草菌においてもtRNAMetのアンチコドン1字目にac4C修飾が存在することを見い出し,修飾酵素の探索および修飾の反応機構の解明を進めた.
筆者らの研究室においては,さまざまな生物のtRNAを単離精製し,高感度な質量分析法であるRNA-MS法を用いて修飾構造を解析している.枯草菌のtRNAMetを単離精製し修飾構造を解析したところ,これまでの報告に反して,アンチコドン1字目C34にac4C修飾の存在することが判明した.しかしながら,枯草菌には大腸菌にてみつかったac4C修飾酵素であるTmcAのホモログは存在しない.そこで,未知の修飾酵素が存在すると考え,その遺伝子を探索することにした.まず,細菌の系統において枯草菌と比較的近くゲノムサイズの小さい5種のマイコプラズマにおいてac4C修飾の分布を調べた.その結果,ac4C修飾をもつ種ともたない種のあることが判明した.新規の修飾酵素はac4C修飾をもつ生物に共通に存在しac4C修飾をもたない生物はこの修飾酵素をもたないと予想されたことから,これらの情報をもとに,遺伝子データベースIMG/M(https://img.jgi.doe.gov/)を用いて比較ゲノム解析を実施した.その結果,ylbM遺伝子が候補遺伝子として絞り込まれた.そこで,枯草菌においてylbM欠損株を作製し,tRNAMetを単離精製しRNA-MS法により解析したところ,アンチコドン1字目C34のac4C修飾は完全に欠失していた.これにより,ylbM遺伝子は枯草菌におけるac4C修飾酵素をコードする遺伝子であると同定された.
枯草菌YlbMの組換えタンパク質を発現精製し,ac4C修飾のin vitroにおける再構成を試みた.基質となるtRNAとYlbMを混合しATP存在下において反応させると,わずかではあるがtRNAにac4C修飾が導入された.これは,反応液にアセチル基のドナーがわずかに混入していたためと考えられた.この反応系にアセチル基のドナーとしてアセチルCoAをくわえたところ,予想に反して,ac4C修飾は増加しなかった.この結果から,YlbMはアセチルCoAではない,別のアセチル基のドナーを使用する可能性が示唆された.そこで,反応液にATPとともに酢酸ナトリウムをくわえたところ,ac4C修飾が劇的に増加した.安定同位体により標識した酢酸を用いてYlbMによるac4C修飾反応を実施したところ,安定同位体に応じた質量数の増加がみられた.この結果より,酢酸が基質としてac4Cのアセチル基に直接的に取り込まれることが証明された.この反応は,酢酸を使ってRNAをアセチル化するはじめての例であった.以上の結果をふまえて,YlbMをTmcAL(tRNAMet cytidine acetate ligase)と命名した.
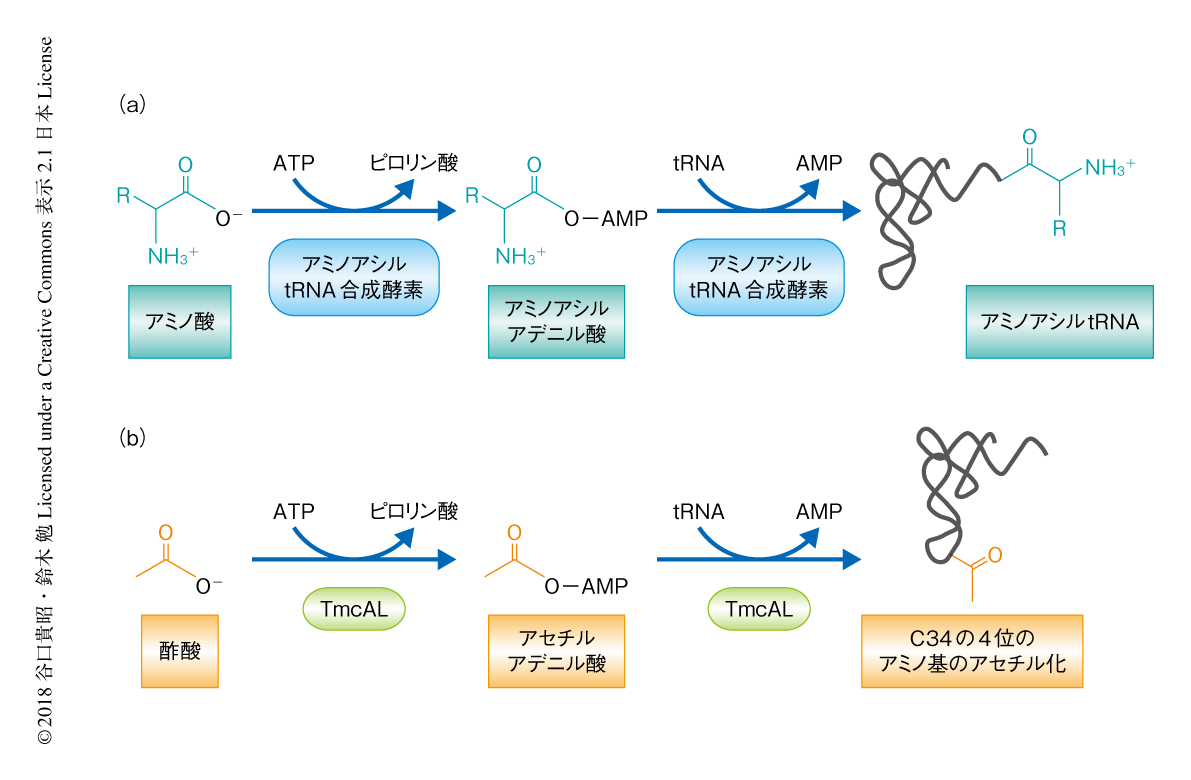
アミノ酸配列の解析から,TmcALはTmcAのもつNアセチルトランスフェラーゼドメインをもたず,代わりに,ATP結合ドメインであるRossmannフォールドをもち,アミノアシルtRNA合成酵素と同じヌクレオチジルトランスフェラーゼファミリーに分類されることが明らかにされた.アミノアシルtRNA合成酵素はATPを用いてアミノ酸を活性化し反応中間体としてアミノアシルアデニル酸を生成したのち,アミノアシル基をtRNAの3’末端に転移する(図1a).この反応と同様に,TmcALはATPを用いて酢酸を活性化し反応中間体としてアセチルアデニル酸を生成したのち,アセチル基をtRNAのアンチコドン1字目C34の4位のアミノ基に転移することによりac4C修飾を導入すると考えられた(図1b).実際に,酢酸とATPの代わりに化学合成したアセチルアデニル酸を用いるとac4C修飾が再構成されたことから,TmcALはアミノアシルtRNA合成酵素と同様の反応機構でac4C修飾を導入すると考えられた.
X線結晶構造解析法により枯草菌およびThermotoga maritimaに由来するTmcALの立体構造を決定した(PDB ID:5Y0Q,PDB ID:5Y0T).TmcALはN末端ドメイン,ミドルドメイン,C末端ドメイン,コイルドコイルドメインから形成されており,二量体として存在した(図2).N末端ドメインに特徴的なRossmannフォールドがみられ,ここにATPのアナログであるAMPcPPが馬の鞍型に曲がった状態で結合していた.しかし,基質として用いた酢酸の電子密度は観測されなかった.さらに,TmcALの表面電荷を計算したところ,正電荷に富む領域が存在し,この領域がtRNAとの結合に重要な役割をはたすと考えられた.実際に,正電荷を構成する塩基性アミノ酸残基は種のあいだで保存されており,これらのアミノ酸残基を変異させるとac4C修飾の活性は顕著に低下した.
1970年代に,生化学的な実験からac4C修飾はtRNAMetがAUAコドンを誤翻訳することを防止する役割のあることが報告された4).しかし,この実験はin vitroにおけるものであり,細胞におけるac4C修飾の役割は不明であった.
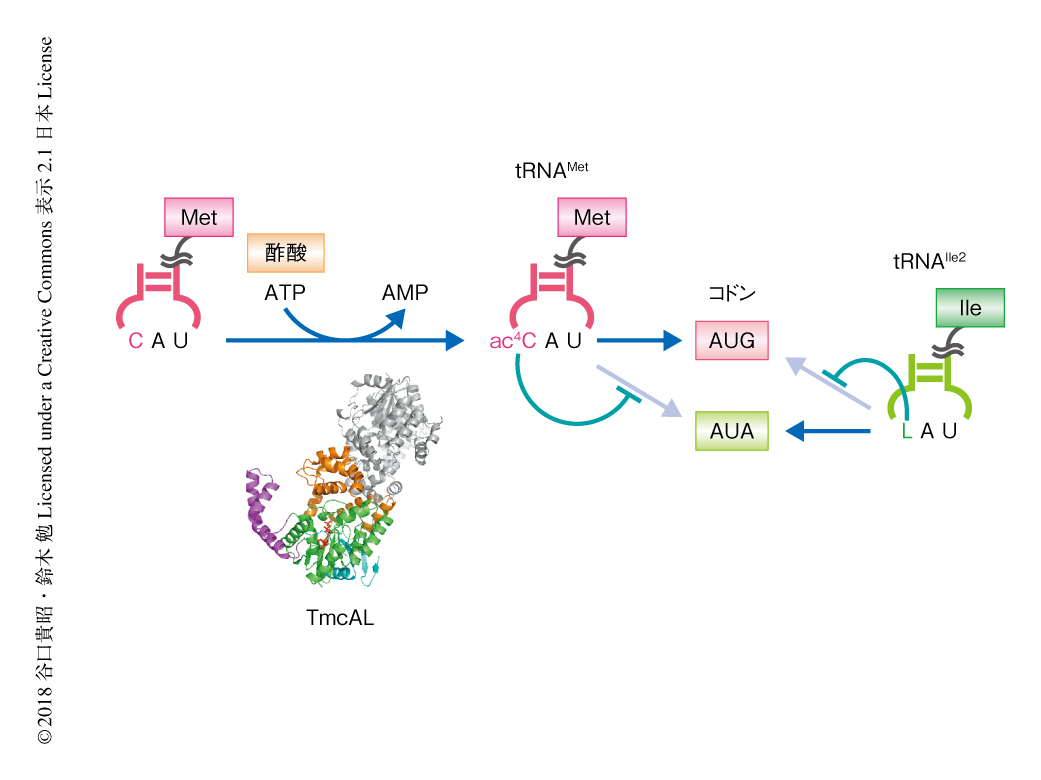
枯草菌のtmcAL欠損株は低温感受性を示したことから,ac4C修飾は低温における生育に重要な役割を担うことが判明した.ac4C修飾はAUAコドンの誤翻訳を防止する役割があることを想定すると,tRNAIle2のアンチコドン1文字目に存在するライシジン修飾とのかかわりが考えられた.実際に,tmcAL欠損株においてライシジン修飾酵素をコードするtilS遺伝子6) の発現を抑制すると顕著な生育の阻害が観察され,tmcAL遺伝子とtilS遺伝子には強い遺伝学的な相互作用のあることが示された.さらに,tmcAL欠損株においてtilS遺伝子の発現を抑制した状態で質量分析法を用いたプロテオーム解析を実施したところ,AUAコドンにMetがまちがって取り込まれたペプチドが多く検出され,実際に,ペプチドの定量により17.5%もの誤翻訳が観測された.この結果から,ac4C修飾はライシジン修飾と協同してAUAコドンの誤翻訳を防止し,タンパク質の合成の精度を維持することが判明した(図2).
ac4Cは細菌のtRNAにおいて広くみられる修飾であるが,大腸菌を含むガンマプロテオバクテリアにおいてはTmcAがアセチルCoAを基質としてac4C修飾を導入するのに対し,枯草菌やマイコプラズマを含む一群の細菌においてはTmcALが酢酸を基質としてac4C修飾を導入することが判明した.TmcAはヒストンアセチル化酵素にみられるNアセチルトランスフェラーゼドメインをもちアセチルCoAを基質とするのに対し,TmcALはRossmannフォールドをもち酢酸を基質として,tRNAのアミノアシル化と同様の反応機構によりac4C修飾を導入していた.細菌が進化の過程において,まったく異なる機構により同一のtRNA修飾を獲得したことは非常に興味深い.魚とイルカが水中を速く泳ぐために類似の体形を獲得したように,遺伝暗号を正確に解読するため異なる細菌の系統のあいだで同じtRNA修飾が選択された,まさに,分子レベルでの収斂進化といえよう.
略歴:2015年 東京大学大学院工学研究科博士課程 修了,同年より中外製薬 研究員.
研究テーマ:RNA修飾の生合成および機能.創薬探索.
関心事:海外での生活.
鈴木 勉(Tsutomu Suzuki)
東京大学大学院工学系研究科 教授.
研究室URL:http://rna.chem.t.u-tokyo.ac.jp/index.html
© 2018 谷口貴昭・鈴木 勉 Licensed under CC 表示 2.1 日本
(東京大学大学院工学系研究科 化学生命工学専攻)
email:谷口貴昭,鈴木 勉
DOI: 10.7875/first.author.2018.097
Acetate-dependent tRNA acetylation required for decoding fidelity in protein synthesis.
Takaaki Taniguchi, Kenjyo Miyauchi, Yuriko Sakaguchi, Seisuke Yamashita, Akiko Soma, Kozo Tomita, Tsutomu Suzuki
Nature Chemical Biology, 14, 1010-1020 (2018)
要 約
タンパク質が翻訳ののちアセチル化されるように,RNAも転写ののちアセチル化されることが知られている.RNAのアセチル化修飾であるN4-アセチルシチジンはtRNAやrRNAに存在する.大腸菌にはtRNAMetのアンチコドン1字目にN4-アセチルシチジン修飾が存在し,修飾酵素TmcAによりアセチルCoAを基質として導入されることが知られていた.この研究において,筆者らは,TmcAのホモログをもたない枯草菌においてもtRNAMetのアンチコドン1字目にN4-アセチルシチジン修飾が存在することを見い出した.比較ゲノム解析による遺伝子の探索の結果,枯草菌をはじめとする一群の細菌には酢酸を基質としてN4-アセチルシチジン修飾を導入するユニークな修飾酵素TmcALの存在が明らかにされた.生化学的な解析および構造生物学的な解析の結果,TmcALはアミノアシルtRNA合成酵素と同じファミリーに属し,tRNAのアミノアシル化と同様の反応機構でアセチル化することが判明した.さらに,遺伝学的な解析から,TmcALがイソロイシンの遺伝暗号の解読に必須なライシジン修飾を担う酵素であるTilSと遺伝学的な相互作用のあることが判明した.TmcALがない状態でTilSのはたらきを抑制すると,tRNAMetによりAUAコドンがまちがってメチオニンとして解読されたことから,N4-アセチルシチジン修飾が正確な遺伝暗号の解読に決定的な役割を担うことが明らかにされた.この研究は,N4-アセチルシチジン修飾の生物学的な役割を解明した最初の報告である.
はじめに
RNAは転写ののちさまざまな修飾をうけることが知られており,これまでに,140種類をこえるRNA修飾がさまざまな生物から報告されている1).最近では,エピトランスクリプトームとよばれ,転写後の段階における新しい遺伝子発現の制御機構として生命科学における大きな潮流を生み出している2).翻訳の過程において遺伝情報をアミノ酸配列へと変換するアダプター分子であるtRNAは多種多様な修飾を含むことが知られ,歴史的にも多くの研究がなされてきた.実際に,これまでに見い出されたRNA修飾の約8割はtRNAからみつかったものである.
N4-アセチルシチジン(ac4C)はシチジンの4位のアミノ基がアセチル化された修飾塩基であり,細菌,古細菌,真核生物にいたるすべての生物界において幅広くみつかっている.1972年,グラム陰性細菌である大腸菌においてtRNAMetのアンチコドン1字目にac4C修飾が発見された3).そして,1978年のin vitroにおける生化学的な実験により,ac4C修飾はAUAコドンの誤翻訳を防止することが示されたが4),その生物学的な機能は明らかにされていなかった.また,ac4C修飾の反応機構についてはながらく不明であったが,2008年,筆者らの研究室において,修飾酵素としてTmcAが同定された5).TmcAはヒストンアセチル化酵素にみられるNアセチルトランスフェラーゼドメインをもち,アセチルCoAを基質としてATPに依存的にac4C修飾を導入した.しかし,TmcAは一部のガンマプロテオバクテリアにおいてのみみつかっており,グラム陽性細菌である枯草菌などには存在しない.そのため,これまで,枯草菌などTmcAのホモログをもたない細菌にはac4C修飾は存在しないと考えられてきた.この研究において,筆者らは,枯草菌においてもtRNAMetのアンチコドン1字目にac4C修飾が存在することを見い出し,修飾酵素の探索および修飾の反応機構の解明を進めた.
1.枯草菌におけるac4C修飾酵素の発見
筆者らの研究室においては,さまざまな生物のtRNAを単離精製し,高感度な質量分析法であるRNA-MS法を用いて修飾構造を解析している.枯草菌のtRNAMetを単離精製し修飾構造を解析したところ,これまでの報告に反して,アンチコドン1字目C34にac4C修飾の存在することが判明した.しかしながら,枯草菌には大腸菌にてみつかったac4C修飾酵素であるTmcAのホモログは存在しない.そこで,未知の修飾酵素が存在すると考え,その遺伝子を探索することにした.まず,細菌の系統において枯草菌と比較的近くゲノムサイズの小さい5種のマイコプラズマにおいてac4C修飾の分布を調べた.その結果,ac4C修飾をもつ種ともたない種のあることが判明した.新規の修飾酵素はac4C修飾をもつ生物に共通に存在しac4C修飾をもたない生物はこの修飾酵素をもたないと予想されたことから,これらの情報をもとに,遺伝子データベースIMG/M(https://img.jgi.doe.gov/)を用いて比較ゲノム解析を実施した.その結果,ylbM遺伝子が候補遺伝子として絞り込まれた.そこで,枯草菌においてylbM欠損株を作製し,tRNAMetを単離精製しRNA-MS法により解析したところ,アンチコドン1字目C34のac4C修飾は完全に欠失していた.これにより,ylbM遺伝子は枯草菌におけるac4C修飾酵素をコードする遺伝子であると同定された.
2.TmcALは酢酸を用いてac4C修飾を導入する
枯草菌YlbMの組換えタンパク質を発現精製し,ac4C修飾のin vitroにおける再構成を試みた.基質となるtRNAとYlbMを混合しATP存在下において反応させると,わずかではあるがtRNAにac4C修飾が導入された.これは,反応液にアセチル基のドナーがわずかに混入していたためと考えられた.この反応系にアセチル基のドナーとしてアセチルCoAをくわえたところ,予想に反して,ac4C修飾は増加しなかった.この結果から,YlbMはアセチルCoAではない,別のアセチル基のドナーを使用する可能性が示唆された.そこで,反応液にATPとともに酢酸ナトリウムをくわえたところ,ac4C修飾が劇的に増加した.安定同位体により標識した酢酸を用いてYlbMによるac4C修飾反応を実施したところ,安定同位体に応じた質量数の増加がみられた.この結果より,酢酸が基質としてac4Cのアセチル基に直接的に取り込まれることが証明された.この反応は,酢酸を使ってRNAをアセチル化するはじめての例であった.以上の結果をふまえて,YlbMをTmcAL(tRNAMet cytidine acetate ligase)と命名した.
アミノ酸配列の解析から,TmcALはTmcAのもつNアセチルトランスフェラーゼドメインをもたず,代わりに,ATP結合ドメインであるRossmannフォールドをもち,アミノアシルtRNA合成酵素と同じヌクレオチジルトランスフェラーゼファミリーに分類されることが明らかにされた.アミノアシルtRNA合成酵素はATPを用いてアミノ酸を活性化し反応中間体としてアミノアシルアデニル酸を生成したのち,アミノアシル基をtRNAの3’末端に転移する(図1a).この反応と同様に,TmcALはATPを用いて酢酸を活性化し反応中間体としてアセチルアデニル酸を生成したのち,アセチル基をtRNAのアンチコドン1字目C34の4位のアミノ基に転移することによりac4C修飾を導入すると考えられた(図1b).実際に,酢酸とATPの代わりに化学合成したアセチルアデニル酸を用いるとac4C修飾が再構成されたことから,TmcALはアミノアシルtRNA合成酵素と同様の反応機構でac4C修飾を導入すると考えられた.
3.TmcALのX線結晶構造解析
X線結晶構造解析法により枯草菌およびThermotoga maritimaに由来するTmcALの立体構造を決定した(PDB ID:5Y0Q,PDB ID:5Y0T).TmcALはN末端ドメイン,ミドルドメイン,C末端ドメイン,コイルドコイルドメインから形成されており,二量体として存在した(図2).N末端ドメインに特徴的なRossmannフォールドがみられ,ここにATPのアナログであるAMPcPPが馬の鞍型に曲がった状態で結合していた.しかし,基質として用いた酢酸の電子密度は観測されなかった.さらに,TmcALの表面電荷を計算したところ,正電荷に富む領域が存在し,この領域がtRNAとの結合に重要な役割をはたすと考えられた.実際に,正電荷を構成する塩基性アミノ酸残基は種のあいだで保存されており,これらのアミノ酸残基を変異させるとac4C修飾の活性は顕著に低下した.
4.細胞におけるac4C修飾の機能
1970年代に,生化学的な実験からac4C修飾はtRNAMetがAUAコドンを誤翻訳することを防止する役割のあることが報告された4).しかし,この実験はin vitroにおけるものであり,細胞におけるac4C修飾の役割は不明であった.
枯草菌のtmcAL欠損株は低温感受性を示したことから,ac4C修飾は低温における生育に重要な役割を担うことが判明した.ac4C修飾はAUAコドンの誤翻訳を防止する役割があることを想定すると,tRNAIle2のアンチコドン1文字目に存在するライシジン修飾とのかかわりが考えられた.実際に,tmcAL欠損株においてライシジン修飾酵素をコードするtilS遺伝子6) の発現を抑制すると顕著な生育の阻害が観察され,tmcAL遺伝子とtilS遺伝子には強い遺伝学的な相互作用のあることが示された.さらに,tmcAL欠損株においてtilS遺伝子の発現を抑制した状態で質量分析法を用いたプロテオーム解析を実施したところ,AUAコドンにMetがまちがって取り込まれたペプチドが多く検出され,実際に,ペプチドの定量により17.5%もの誤翻訳が観測された.この結果から,ac4C修飾はライシジン修飾と協同してAUAコドンの誤翻訳を防止し,タンパク質の合成の精度を維持することが判明した(図2).
おわりに
ac4Cは細菌のtRNAにおいて広くみられる修飾であるが,大腸菌を含むガンマプロテオバクテリアにおいてはTmcAがアセチルCoAを基質としてac4C修飾を導入するのに対し,枯草菌やマイコプラズマを含む一群の細菌においてはTmcALが酢酸を基質としてac4C修飾を導入することが判明した.TmcAはヒストンアセチル化酵素にみられるNアセチルトランスフェラーゼドメインをもちアセチルCoAを基質とするのに対し,TmcALはRossmannフォールドをもち酢酸を基質として,tRNAのアミノアシル化と同様の反応機構によりac4C修飾を導入していた.細菌が進化の過程において,まったく異なる機構により同一のtRNA修飾を獲得したことは非常に興味深い.魚とイルカが水中を速く泳ぐために類似の体形を獲得したように,遺伝暗号を正確に解読するため異なる細菌の系統のあいだで同じtRNA修飾が選択された,まさに,分子レベルでの収斂進化といえよう.
文 献
- Boccaletto, P., Machnicka, M. A., Purta, E. et al.: MODOMICS: a database of RNA modification pathways. 2017 update. Nucleic Acid Res., 46, D303-D307 (2018)[PubMed]
- Frye, M., Jaffrey, S. R., Pan, T. et al.: RNA modifications: what have we learned and where are we headed? Nat. Rev. Genet., 17, 365-372 (2016)[PubMed]
- Ohashi, Z., Murao, K., Yahagi, T. et al.: Characterization of C+ located in the first position of the anticodon of Escherichia coli tRNAMet as N4-acetylcytidine. Biochim. Biophys. Acta, 262, 209-213 (1972)[PubMed]
- Stern, L. & Schulman, L. H.: The role of the minor base N4-acetylcytidine in the function of the Escherichia coli noninitiator methionine transfer RNA. J. Biol. Chem., 253, 6132-6139 (1978)[PubMed]
- Ikeuchi, Y., Kitahara, K. & Suzuki, T.: The RNA acetyltransferase driven by ATP hydrolysis synthesizes N4-acetylcytidine of tRNA anticodon. EMBO J., 27, 2194-2203 (2008)[PubMed]
- Soma, A., Ikeuchi, Y., Kanemasa, S. et al.: An RNA-modifying enzyme that governs both the codon and amino acid specificities of isoleucine tRNA. Mol. Cell, 12, 689-698 (2003)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2015年 東京大学大学院工学研究科博士課程 修了,同年より中外製薬 研究員.
研究テーマ:RNA修飾の生合成および機能.創薬探索.
関心事:海外での生活.
鈴木 勉(Tsutomu Suzuki)
東京大学大学院工学系研究科 教授.
研究室URL:http://rna.chem.t.u-tokyo.ac.jp/index.html
© 2018 谷口貴昭・鈴木 勉 Licensed under CC 表示 2.1 日本