ノシセプチン受容体およびμオピオイドペプチド受容体に対する2機能性のアゴニストは霊長類において有害な作用のない鎮痛薬になりうる
木口倫一・Huiping Ding・Mei-Chuan Ko
(米国Wake Forest School of Medicine,Department of Physiology and Pharmacology)
email:木口倫一
DOI: 10.7875/first.author.2018.091
A bifunctional nociceptin and mu opioid receptor agonist is analgesic without opioid side effects in nonhuman primates.
Huiping Ding, Norikazu Kiguchi, Dennis Yasuda, Pankaj R. Daga, Willma E. Polgar, James J. Lu, Paul W. Czoty, Shiroh Kishioka, Nurulain T. Zaveri, Mei-Chuan Ko
Science Translational Medicine, 10, eaar3483 (2018)
オピオイドの処方箋の誤用および乱用の問題から,依存性のない強力な鎮痛薬の開発が国際的にもとめられている.μオピオイドペプチド受容体のアゴニストは有効な鎮痛薬であるものの,有害な作用のため臨床の現場における使用が制限される場合も多い.これまでに,ノシセプチン受容体のアゴニストがμオピオイドペプチド受容体のアゴニストの鎮痛効果および強化効果を制御することが示されている.この研究において,筆者らは,ノシセプチン受容体およびμオピオイドペプチド受容体の両者に部分アゴニスト活性をもつ2機能性のアゴニストAT-121を開発した.AT-121はアカゲザルにおいてモルヒネと同等以上の鎮痛効果をもち,一方で,オキシコドンによる強化効果を抑制した.さらに,呼吸の抑制など有害な作用は生じず,痛覚の過敏や身体的な依存の形成も認められなかった.今回の発見により,ノシセプチン受容体およびμオピオイドペプチド受容体に対するアゴニスト活性の適切なバランスをもつ2機能性のアゴニストが,安全かつ依存を抑制する作用をもつ画期的な鎮痛薬となる可能性が示唆された.
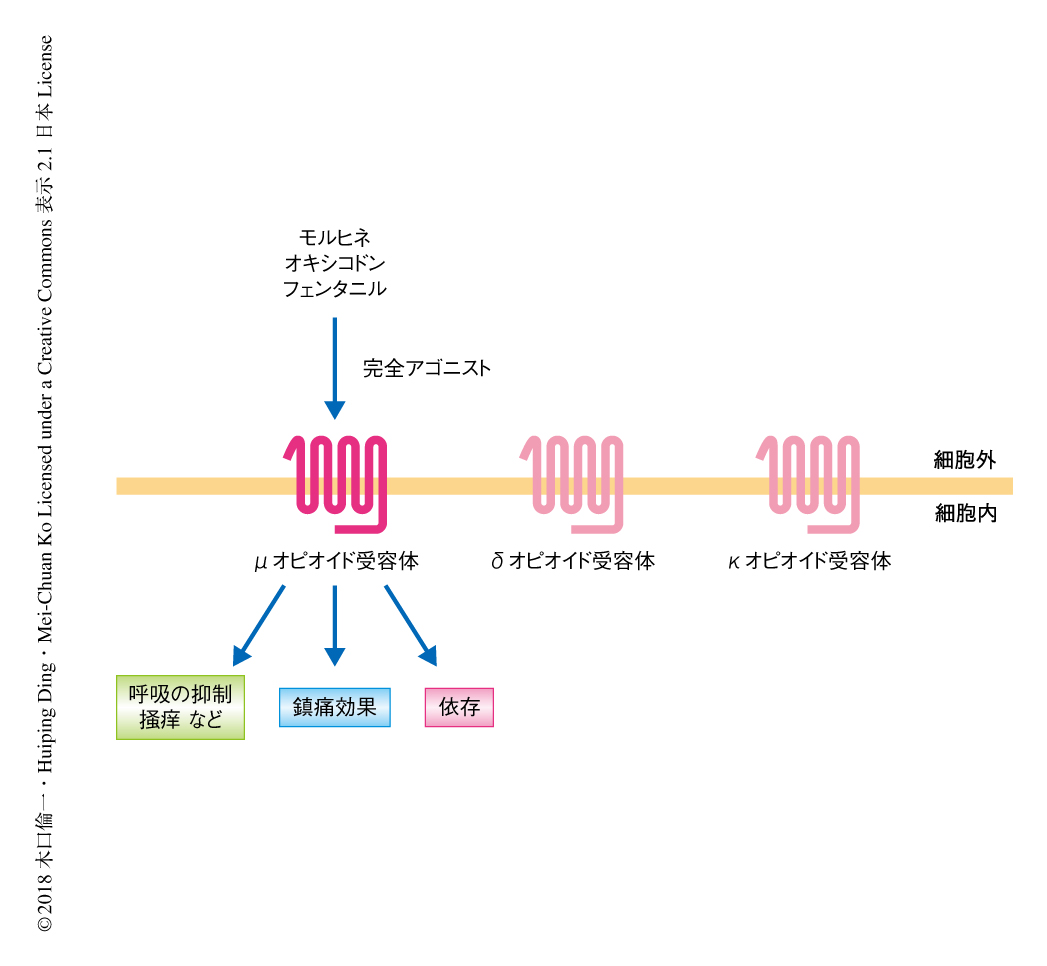
昨今のオピオイドの鎮痛薬の乱用や過量な投与による死亡率のいちじるしい上昇は国際社会に大きな影響をおよぼしている.μオピオイドペプチド受容体のアゴニストはもっとも有効かつ広く使用されている鎮痛薬であるが,それらによる依存の形成や呼吸の抑制などの有害な作用が医療および経済的な負担を増大させている(図1).この危機を解決するため,有害な作用を生じない安全なオピオイド鎮痛薬の開発が強く望まれている.κオピオイドペプチド受容体のアゴニストおよびδオピオイドペプチド受容体のアゴニストは鎮痛効果をもつものの,不快感やけいれんなどさまざまな有害な作用が問題になる1,2).一方,第4のオピオイド受容体ファミリーであるノシセプチン受容体のアゴニストは,μオピオイドペプチド受容体のアゴニストの鎮痛効果および強化効果を制御することが示されている3).ノシセプチン受容体はほかのオピオイド受容体と同様に神経系に発現するGタンパク質共役型受容体であり,Giシグナルを介して神経伝達を阻害する.ノシセプチン受容体のアゴニストは非ヒト霊長類において呼吸の抑制および強化効果を生じず,さらに,脊髄,脳,全身のレベルにおいてμオピオイドペプチド受容体のアゴニストによる鎮痛効果を増強することも報告されている4).そこで,筆者らは,ノシセプチン受容体およびμオピオイドペプチド受容体に対する2機能性のアゴニストが安全かつ依存性のない鎮痛薬の候補になるとの仮説をたてた.
これまでに,ノシセプチン受容体およびμオピオイドペプチド受容体に対する2機能性のアゴニストがいくつか開発されている5-7).そのうち,いくつかの化合物はげっ歯類において鎮痛効果を示したが,同時に報酬効果も示した.くわえて,げっ歯類における鎮痛効果に関する薬理作用はアカゲザルとは異なる点があった8,9).ノシセプチン受容体およびμオピオイドペプチド受容体の両方に対するアゴニスト作用のバランスが,μオピオイドペプチド受容体のアゴニストに特有の有害な作用を示さない鎮痛薬の開発に重要であることが考えられた.げっ歯類と霊長類とのあいだでは,ノシセプチン受容体のアゴニストあるいはμオピオイドペプチド受容体のアゴニストの鎮痛作用やそのほかの薬理作用が異なることが報告されている10,11).一方で,非ヒト霊長類は神経解剖学的,神経化学的,神経薬理学的にヒトと類似性の高いことが知られている.そこで,多様な生理学的な反応についてのトランスレーショナル研究の足がかりとして,アカゲザルを用いた.
同一の化学骨格にノシセプチン受容体およびμオピオイドペプチド受容体のおのおのに対し理想的な結合親和性および効力をもつ2機能性のアゴニストを設計するため,独自のノシセプチン受容体のリガンドのライブラリーから得られたリード化合物において構造活性を最適化した.最終的に得られた化合物AT-121は,ノシセプチン受容体およびμオピオイドペプチド受容体に対する阻害定数がそれぞれ3.67 nMおよび16.49 nMであった.in vitroにおけるGTPγSの結合試験により効力を評価したところ,ノシセプチン受容体に対し高い作用強度を示し,また,ノシセプチン受容体の完全アゴニストと比較して41.1%の部分アゴニスト活性をもつことも示された.また,μオピオイドペプチド受容体の完全アゴニストと比べ14.2%の部分アゴニスト活性を示した.一方で,κオピオイドペプチド受容体あるいはδオピオイドペプチド受容体に対する結合親和性は低く,アゴニスト活性は検出されなかった.これらの結果から,AT-121がノシセプチン受容体およびμオピオイドペプチド受容体の両者に対し高い作用強度および部分アゴニスト活性をもつことが示された.ラットに全身投与すると血液脳関門を透過したこと,アカゲザルに全身投与すると血中において安定であったことから,AT-121はin vivoにおける各種の解析にも適すると考えられた.
アカゲザルの尾を50℃の温浴にひたした際の逃避反応をもとに鎮痛効果について評価した.AT-121を全身投与すると用量に依存的な鎮痛効果が観察され,0.03 mg/kgの用量で得られる効果は3時間にわたり持続した.尾にカプサイシンを処置したのち46℃の温浴にひたした際の異痛症におよぼす影響について評価したところ,AT-121は用量に依存的に異痛症を減弱する効果を示した.AT-121による鎮痛効果はノシセプチン受容体のアンタゴニストあるいはμオピオイドペプチド受容体のアンタゴニストの前処置により抑制され,ノシセプチン受容体のアンタゴニストとμオピオイドペプチド受容体のアンタゴニストを併用すると効果はより強く抑制された.用量反応曲線から,全身投与したAT-121の50%効果濃度は0.01 mg/kgであり,モルヒネの約100倍も強力であった.ひっかき行動の回数をもとに掻痒感の有無について評価したところ,モルヒネの全身投与から1時間のちにひっかき行動がみられたが,AT-121を全身投与してもひっかき行動はみられなかった.これらの結果から,全身投与したAT-121はノシセプチン受容体およびμオピオイドペプチド受容体の両者を介して作用し,モルヒネなどの典型的なオピオイド鎮痛薬とは異なる性質をもつことが示された.
依存性の評価に用いられる累進比率スケジュールにそった自己投与モデルを使用して強化効果について検討した.アカゲザルが一定の回数だけレバーを押すと,コカイン,レミフェンタニル,オキシコドン,AT-121が自己の静脈に投与されるように設定した.その結果,コカイン,レミフェンタニル,オキシコドンは高い強化効果を示したが,AT-121は強化効果を示さなかった.オキシコドンの強化効果は,μオピオイドペプチド受容体のアンタゴニスト,μオピオイドペプチド受容体の部分アゴニスト,AT-121の前処置により抑制された.すなわち,AT-121は強化効果を生じず,さらに,オキシコドンの強化効果を抑制する作用をもつことが示された.
アカゲザルの腹部に留置したテレメトリー送信機により生理的な数値をリアルタイムに測定するよう設定し,AT-121の全身投与がそれらにおよぼす影響について観察した.完全な鎮痛作用を示した0.03 mg/kgのAT-121は,呼吸数および換気量,心拍数および血圧,体温に影響をおよぼさず,さらに,その10倍の用量を投与してもこれらの生理的な数値は変化しなかった.また,AT-121の投与により鎮静作用や運動に対する障害は生じなかった.これらの結果から,AT-121をアカゲザルに全身投与しても呼吸の機能あるいは循環器系への有害な作用は生じないことが示された.
通常,オピオイド鎮痛薬を長期間にわたり投与すると,すみやかに身体的な依存が生じる.そのような状況においてアンタゴニストを投与すると,呼吸の機能および循環器系の生理的な数値が顕著に変化する.アカゲザルにモルヒネを1日2回3日間にわたり反復投与したのち,μオピオイドペプチド受容体のアンタゴニストを投与すると離脱の症状が誘発され,呼吸数および換気量,心拍数および血圧が上昇した.一方,AT-121を1日2回3日間にわたり反復投与したのち,ノシセプチン受容体のアンタゴニストおよびμオピオイドペプチド受容体のアンタゴニストを投与しても,これらの生理的な数値に変化は認められなかった.したがって,モルヒネとは異なり,AT-121は反復投与しても身体的な依存は生じないことが示された.
オピオイド鎮痛薬を反復投与すると痛覚の過敏や耐性を生じることも知られている.アカゲザルにモルヒネを1日2回投与すると,その翌日にはカプサイシンにより誘発される異痛症が増強された.一方,AT-121を投与してもそのような増強効果は認められなかった.また,モルヒネを1日2回4週間にわたり反復投与すると鎮痛効果が減弱し耐性が形成された.対照的に,AT-121を同様に反復投与しても鎮痛効果に耐性は形成されなかった.これらの結果から,AT-121はオピオイドに誘発性の痛覚の過敏を生じず,モルヒネと比較して鎮痛に対する耐性の形成の遅いことが示された.
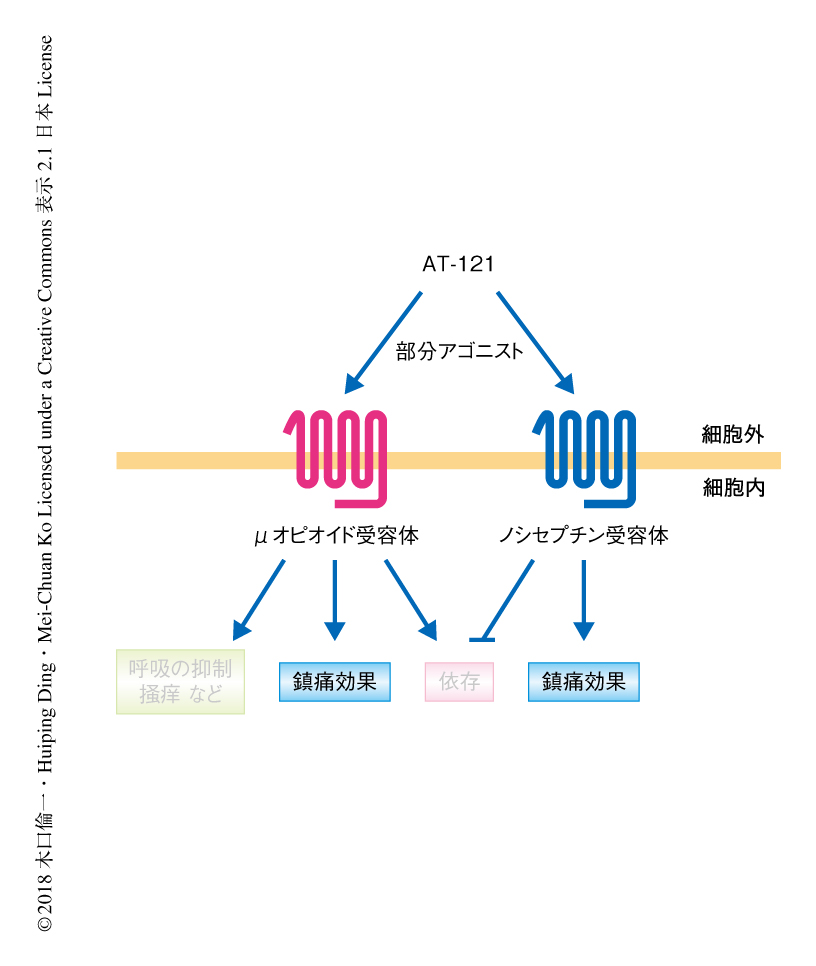
この研究において,ノシセプチン受容体およびμオピオイドペプチド受容体に対する2機能性のアゴニストであるAT-121は非ヒト霊長類に対し安全かつ依存性のない鎮痛薬であり,さらに,オピオイドの乱用を解決する可能性のあることが示された(図2).AT-121の機能的な有用性は,これまでに報告されていた2機能性のアゴニストをうわまわる.ノシセプチン受容体およびμオピオイドペプチド受容体の分子薬理学的なプロファイルを検討するさまざまな手法を用いて,それらの詳細な性質を明らかにすることが重要である.また,AT-121のみならず,ノシセプチン受容体およびμオピオイドペプチド受容体の両者にバランスよく作用する部分アゴニストが,鎮痛作用および薬物への依存の抑制という2つの作用をもつ画期的なオピオイド鎮痛薬となる可能性が期待される12).そして,非ヒト霊長類を用いたトランスレーショナル研究は,疼痛および薬物乱用の治療薬としてのノシセプチン受容体およびμオピオイドペプチド受容体に対する2機能性のアゴニストの研究および開発を促進するため,今後,より重要となるであろう.
略歴:2011年より和歌山県立医科大学医学部 講師,2014年~2016年 米国Wake Forest School of Medicine客員研究員.
Huiping Ding
米国Wake Forest School of MedicineにてResearch Associate.
Mei-Chuan Ko
米国Wake Forest School of MedicineにてProfessor.
© 2018 木口倫一・Huiping Ding・Mei-Chuan Ko Licensed under CC 表示 2.1 日本
(米国Wake Forest School of Medicine,Department of Physiology and Pharmacology)
email:木口倫一
DOI: 10.7875/first.author.2018.091
A bifunctional nociceptin and mu opioid receptor agonist is analgesic without opioid side effects in nonhuman primates.
Huiping Ding, Norikazu Kiguchi, Dennis Yasuda, Pankaj R. Daga, Willma E. Polgar, James J. Lu, Paul W. Czoty, Shiroh Kishioka, Nurulain T. Zaveri, Mei-Chuan Ko
Science Translational Medicine, 10, eaar3483 (2018)
要 約
オピオイドの処方箋の誤用および乱用の問題から,依存性のない強力な鎮痛薬の開発が国際的にもとめられている.μオピオイドペプチド受容体のアゴニストは有効な鎮痛薬であるものの,有害な作用のため臨床の現場における使用が制限される場合も多い.これまでに,ノシセプチン受容体のアゴニストがμオピオイドペプチド受容体のアゴニストの鎮痛効果および強化効果を制御することが示されている.この研究において,筆者らは,ノシセプチン受容体およびμオピオイドペプチド受容体の両者に部分アゴニスト活性をもつ2機能性のアゴニストAT-121を開発した.AT-121はアカゲザルにおいてモルヒネと同等以上の鎮痛効果をもち,一方で,オキシコドンによる強化効果を抑制した.さらに,呼吸の抑制など有害な作用は生じず,痛覚の過敏や身体的な依存の形成も認められなかった.今回の発見により,ノシセプチン受容体およびμオピオイドペプチド受容体に対するアゴニスト活性の適切なバランスをもつ2機能性のアゴニストが,安全かつ依存を抑制する作用をもつ画期的な鎮痛薬となる可能性が示唆された.
はじめに
昨今のオピオイドの鎮痛薬の乱用や過量な投与による死亡率のいちじるしい上昇は国際社会に大きな影響をおよぼしている.μオピオイドペプチド受容体のアゴニストはもっとも有効かつ広く使用されている鎮痛薬であるが,それらによる依存の形成や呼吸の抑制などの有害な作用が医療および経済的な負担を増大させている(図1).この危機を解決するため,有害な作用を生じない安全なオピオイド鎮痛薬の開発が強く望まれている.κオピオイドペプチド受容体のアゴニストおよびδオピオイドペプチド受容体のアゴニストは鎮痛効果をもつものの,不快感やけいれんなどさまざまな有害な作用が問題になる1,2).一方,第4のオピオイド受容体ファミリーであるノシセプチン受容体のアゴニストは,μオピオイドペプチド受容体のアゴニストの鎮痛効果および強化効果を制御することが示されている3).ノシセプチン受容体はほかのオピオイド受容体と同様に神経系に発現するGタンパク質共役型受容体であり,Giシグナルを介して神経伝達を阻害する.ノシセプチン受容体のアゴニストは非ヒト霊長類において呼吸の抑制および強化効果を生じず,さらに,脊髄,脳,全身のレベルにおいてμオピオイドペプチド受容体のアゴニストによる鎮痛効果を増強することも報告されている4).そこで,筆者らは,ノシセプチン受容体およびμオピオイドペプチド受容体に対する2機能性のアゴニストが安全かつ依存性のない鎮痛薬の候補になるとの仮説をたてた.
これまでに,ノシセプチン受容体およびμオピオイドペプチド受容体に対する2機能性のアゴニストがいくつか開発されている5-7).そのうち,いくつかの化合物はげっ歯類において鎮痛効果を示したが,同時に報酬効果も示した.くわえて,げっ歯類における鎮痛効果に関する薬理作用はアカゲザルとは異なる点があった8,9).ノシセプチン受容体およびμオピオイドペプチド受容体の両方に対するアゴニスト作用のバランスが,μオピオイドペプチド受容体のアゴニストに特有の有害な作用を示さない鎮痛薬の開発に重要であることが考えられた.げっ歯類と霊長類とのあいだでは,ノシセプチン受容体のアゴニストあるいはμオピオイドペプチド受容体のアゴニストの鎮痛作用やそのほかの薬理作用が異なることが報告されている10,11).一方で,非ヒト霊長類は神経解剖学的,神経化学的,神経薬理学的にヒトと類似性の高いことが知られている.そこで,多様な生理学的な反応についてのトランスレーショナル研究の足がかりとして,アカゲザルを用いた.
1.AT-121はノシセプチン受容体およびμオピオイドペプチド受容体に対する2機能性の部分アゴニストである
同一の化学骨格にノシセプチン受容体およびμオピオイドペプチド受容体のおのおのに対し理想的な結合親和性および効力をもつ2機能性のアゴニストを設計するため,独自のノシセプチン受容体のリガンドのライブラリーから得られたリード化合物において構造活性を最適化した.最終的に得られた化合物AT-121は,ノシセプチン受容体およびμオピオイドペプチド受容体に対する阻害定数がそれぞれ3.67 nMおよび16.49 nMであった.in vitroにおけるGTPγSの結合試験により効力を評価したところ,ノシセプチン受容体に対し高い作用強度を示し,また,ノシセプチン受容体の完全アゴニストと比較して41.1%の部分アゴニスト活性をもつことも示された.また,μオピオイドペプチド受容体の完全アゴニストと比べ14.2%の部分アゴニスト活性を示した.一方で,κオピオイドペプチド受容体あるいはδオピオイドペプチド受容体に対する結合親和性は低く,アゴニスト活性は検出されなかった.これらの結果から,AT-121がノシセプチン受容体およびμオピオイドペプチド受容体の両者に対し高い作用強度および部分アゴニスト活性をもつことが示された.ラットに全身投与すると血液脳関門を透過したこと,アカゲザルに全身投与すると血中において安定であったことから,AT-121はin vivoにおける各種の解析にも適すると考えられた.
2.AT-121は強力な鎮痛作用および異痛症を減弱する作用をもつ
アカゲザルの尾を50℃の温浴にひたした際の逃避反応をもとに鎮痛効果について評価した.AT-121を全身投与すると用量に依存的な鎮痛効果が観察され,0.03 mg/kgの用量で得られる効果は3時間にわたり持続した.尾にカプサイシンを処置したのち46℃の温浴にひたした際の異痛症におよぼす影響について評価したところ,AT-121は用量に依存的に異痛症を減弱する効果を示した.AT-121による鎮痛効果はノシセプチン受容体のアンタゴニストあるいはμオピオイドペプチド受容体のアンタゴニストの前処置により抑制され,ノシセプチン受容体のアンタゴニストとμオピオイドペプチド受容体のアンタゴニストを併用すると効果はより強く抑制された.用量反応曲線から,全身投与したAT-121の50%効果濃度は0.01 mg/kgであり,モルヒネの約100倍も強力であった.ひっかき行動の回数をもとに掻痒感の有無について評価したところ,モルヒネの全身投与から1時間のちにひっかき行動がみられたが,AT-121を全身投与してもひっかき行動はみられなかった.これらの結果から,全身投与したAT-121はノシセプチン受容体およびμオピオイドペプチド受容体の両者を介して作用し,モルヒネなどの典型的なオピオイド鎮痛薬とは異なる性質をもつことが示された.
3.AT-121はオキシコドンの強化効果を減弱させる
依存性の評価に用いられる累進比率スケジュールにそった自己投与モデルを使用して強化効果について検討した.アカゲザルが一定の回数だけレバーを押すと,コカイン,レミフェンタニル,オキシコドン,AT-121が自己の静脈に投与されるように設定した.その結果,コカイン,レミフェンタニル,オキシコドンは高い強化効果を示したが,AT-121は強化効果を示さなかった.オキシコドンの強化効果は,μオピオイドペプチド受容体のアンタゴニスト,μオピオイドペプチド受容体の部分アゴニスト,AT-121の前処置により抑制された.すなわち,AT-121は強化効果を生じず,さらに,オキシコドンの強化効果を抑制する作用をもつことが示された.
4.高用量のAT-121を投与しても生理的な機能は損なわれない
アカゲザルの腹部に留置したテレメトリー送信機により生理的な数値をリアルタイムに測定するよう設定し,AT-121の全身投与がそれらにおよぼす影響について観察した.完全な鎮痛作用を示した0.03 mg/kgのAT-121は,呼吸数および換気量,心拍数および血圧,体温に影響をおよぼさず,さらに,その10倍の用量を投与してもこれらの生理的な数値は変化しなかった.また,AT-121の投与により鎮静作用や運動に対する障害は生じなかった.これらの結果から,AT-121をアカゲザルに全身投与しても呼吸の機能あるいは循環器系への有害な作用は生じないことが示された.
5.AT-121を反復投与しても身体的な依存は生じない
通常,オピオイド鎮痛薬を長期間にわたり投与すると,すみやかに身体的な依存が生じる.そのような状況においてアンタゴニストを投与すると,呼吸の機能および循環器系の生理的な数値が顕著に変化する.アカゲザルにモルヒネを1日2回3日間にわたり反復投与したのち,μオピオイドペプチド受容体のアンタゴニストを投与すると離脱の症状が誘発され,呼吸数および換気量,心拍数および血圧が上昇した.一方,AT-121を1日2回3日間にわたり反復投与したのち,ノシセプチン受容体のアンタゴニストおよびμオピオイドペプチド受容体のアンタゴニストを投与しても,これらの生理的な数値に変化は認められなかった.したがって,モルヒネとは異なり,AT-121は反復投与しても身体的な依存は生じないことが示された.
6.AT-121はオピオイドに誘発性の痛覚の過敏を生じない
オピオイド鎮痛薬を反復投与すると痛覚の過敏や耐性を生じることも知られている.アカゲザルにモルヒネを1日2回投与すると,その翌日にはカプサイシンにより誘発される異痛症が増強された.一方,AT-121を投与してもそのような増強効果は認められなかった.また,モルヒネを1日2回4週間にわたり反復投与すると鎮痛効果が減弱し耐性が形成された.対照的に,AT-121を同様に反復投与しても鎮痛効果に耐性は形成されなかった.これらの結果から,AT-121はオピオイドに誘発性の痛覚の過敏を生じず,モルヒネと比較して鎮痛に対する耐性の形成の遅いことが示された.
おわりに
この研究において,ノシセプチン受容体およびμオピオイドペプチド受容体に対する2機能性のアゴニストであるAT-121は非ヒト霊長類に対し安全かつ依存性のない鎮痛薬であり,さらに,オピオイドの乱用を解決する可能性のあることが示された(図2).AT-121の機能的な有用性は,これまでに報告されていた2機能性のアゴニストをうわまわる.ノシセプチン受容体およびμオピオイドペプチド受容体の分子薬理学的なプロファイルを検討するさまざまな手法を用いて,それらの詳細な性質を明らかにすることが重要である.また,AT-121のみならず,ノシセプチン受容体およびμオピオイドペプチド受容体の両者にバランスよく作用する部分アゴニストが,鎮痛作用および薬物への依存の抑制という2つの作用をもつ画期的なオピオイド鎮痛薬となる可能性が期待される12).そして,非ヒト霊長類を用いたトランスレーショナル研究は,疼痛および薬物乱用の治療薬としてのノシセプチン受容体およびμオピオイドペプチド受容体に対する2機能性のアゴニストの研究および開発を促進するため,今後,より重要となるであろう.
文 献
- Corbett, A. D., Henderson, G., McKnight, A. T. et al.: 75 years of opioid research: theexciting but vain quest for the Holy Grail. Br. J. Pharmacol., 147, S153-S162 (2006)[PubMed]
- Lin, A. P. & Ko, M. -C.: The therapeutic potential of nociceptin/orphanin FQ receptor agonists as analgesics without abuse liability. ACS Chem. Neurosci., 4, 214-224 (2013)[PubMed]
- Lambert D. G.: The nociceptin/orphanin FQ receptor: a target with broad therapeutic potential. Nat. Rev. Drug Discov., 7, 694-710 (2008)[PubMed]
- Kiguchi, N., Ding, H. & Ko, M. -C.: Central N/OFQ-NOP receptor system in pain modulation. Adv. Pharmacol., 75, 217-243 (2016)[PubMed]
- Toll, L., Khroyan, T. V., Polgar, W. E. et al.: Comparison of the antinociceptive and antirewarding profiles of novel bifunctional nociception receptor/μ-opioid receptor ligands: implications for therapeutic applications. J. Pharmacol. Exp. Ther., 331, 954-964 (2009)[PubMed]
- Linz, K., Christoph, T., Tzschentke, T. M. et al.: Cebranopadol: a novel potent analgesic nociceptin/orphanin FQ peptide and opioid receptor agonist. J. Pharmacol. Exp. Ther., 349, 535-548 (2014)[PubMed]
- Khroyan, T. V., Polgar, W. E., Cami-Kobeci, G. et al.: The first universal opioid ligand, (2S)-2-[(5R,6R,7R,14S)-N-cyclopropylmethyl-4,5-epoxy-6,14-ethano-3-hydroxy-6-methoxymorphinan-7-yl]-3,3-dimethylpentan-2-ol (BU08028): characterization of the in vitro profile and in vivo behavioral effects in mouse models of acute pain and cocaine-induced reward. J. Pharmacol. Exp. Ther., 336, 952-961 (2011)[PubMed]
- Ding, H., Czoty, P. W., Kiguchi, N. et al.: A novel orvinol analog, BU08028, as a safe opioid analgesicwithout abuse liability in primates. Proc. Natl. Acad. Sci. USA, 113, E5511-E5518 (2016)[PubMed]
- Bowen, C. A., Fischer, B. D., Mello, N. K. et al.: Antagonism of the antinociceptive and discriminative stimulus effects of heroin and morphine by 3-methoxynaltrexone and naltrexone in rhesus monkeys. J. Pharmacol. Exp. Ther., 302, 264-273 (2002)[PubMed]
- Ko, M. C., Divin, M. F., Lee, H. et al.: Differential in vivo potencies of naltrexone and 6β-naltrexol in the monkey. J. Pharmacol. Exp. Ther., 316, 772-779 (2006)[PubMed]
- Phillips, K. A., Bales, K. L., Capitanio, J. P. et al.: Why primate models matter. Am. J. Primatol,. 76, 801-827 (2014)[PubMed]
- Zaveri, N. T.: Nociceptin opioid receptor (NOP) as a therapeutic target: progress in translation from preclinical research to clinical utility. J. Med. Chem., 59, 7011-7028 (2016)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2011年より和歌山県立医科大学医学部 講師,2014年~2016年 米国Wake Forest School of Medicine客員研究員.
Huiping Ding
米国Wake Forest School of MedicineにてResearch Associate.
Mei-Chuan Ko
米国Wake Forest School of MedicineにてProfessor.
© 2018 木口倫一・Huiping Ding・Mei-Chuan Ko Licensed under CC 表示 2.1 日本