ショウジョウバエにおける抗ウイルスシグナル伝達経路および新規の抗ウイルスタンパク質の発見
後藤 彰・岡戸 清
(フランスStrasbourg大学Insect Models of Innate Immunity)
email:後藤 彰,岡戸 清
DOI: 10.7875/first.author.2018.086
The kinase IKKβ regulates a STING- and NF-κB-dependent antiviral response pathway in Drosophila.
Akira Goto, Kiyoshi Okado, Nelson Martins, Hua Cai, Vincent Barbier, Olivier Lamiable, Laurent Troxler, Estelle Santiago, Lauriane Kuhn, Donggi Paik, Neal Silverman, Andreas Holleufer, Rune Hartmann, Jiyong Liu, Tao Peng, Jules A. Hoffmann, Carine Meignin, Laurent Daeffler, Jean-Luc Imler
Immunity, 49, 225-234.e4 (2018)
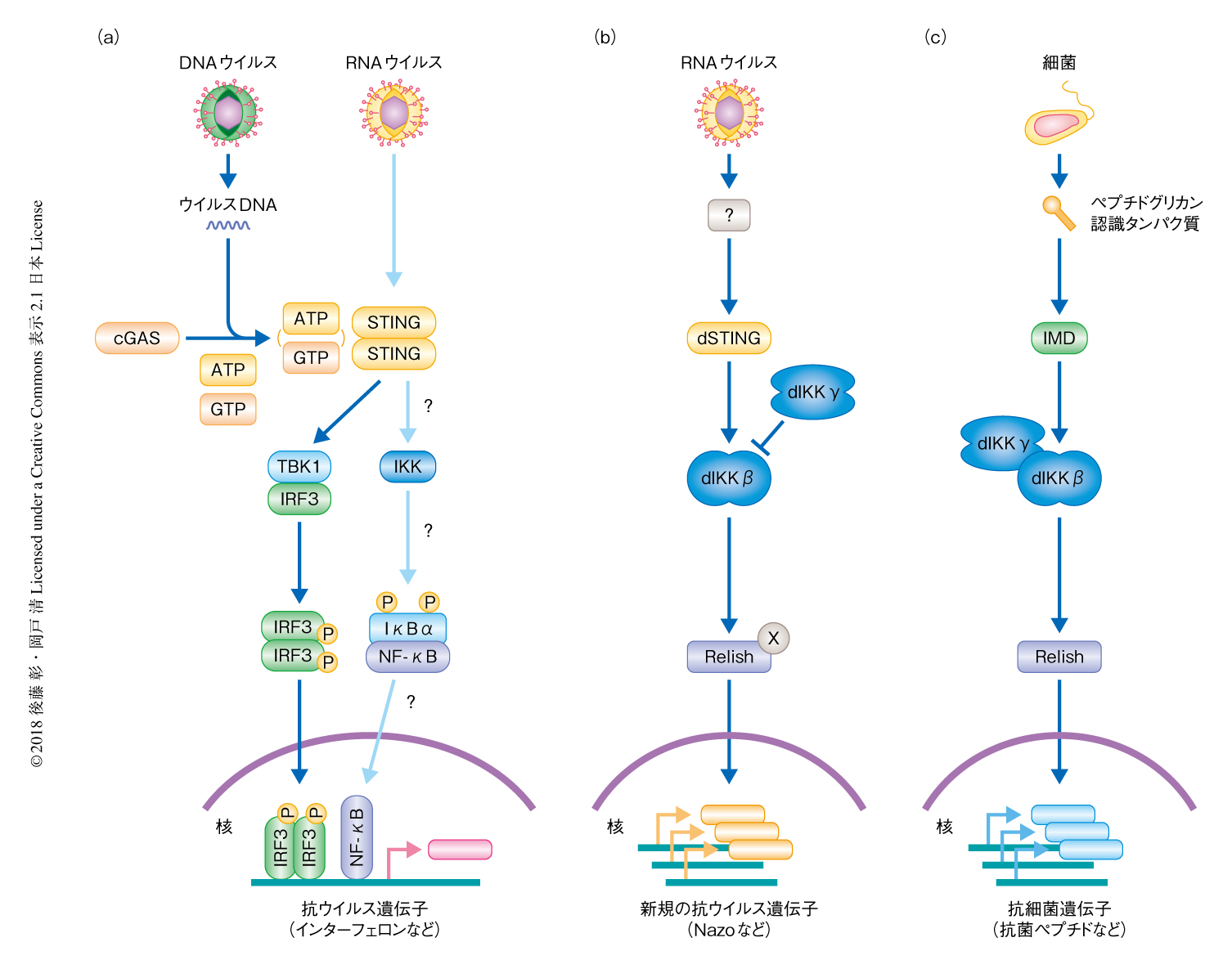
ショウジョウバエのウイルスに対する免疫応答には,RNAi機構のほか,ウイルスの感染にともないひき起こされる免疫機構のあることが知られている.この研究において,筆者らは,ショウジョウバエにおいて細菌の感染にともないひき起こされる免疫機構であるIMD経路の構成タンパク質であるdIKKβおよびRelishが,抗ウイルスシグナル伝達経路にも関与することを見い出した.この抗ウイルスシグナル伝達経路の活性化にはdSTINGも関与した.哺乳類においてSTINGはインターフェロン発現経路の要であり,細胞質においてウイルスの感染の情報をうけとり最終的にインターフェロンを発現させる.無脊椎動物であるショウジョウバエはこのインターフェロン発現経路はもたないが,dSTINGがdIKKβの上流において機能し,インターフェロンとは異なる抗ウイルスタンパク質Nazoを発現させた.以上の結果から,ショウジョウバエにおいて見い出された抗ウイルスシグナル伝達経路であるSTING-IKKβ-NF-κB経路の起源は非常に古く,哺乳類がほかの生物から分かれたとき,すでに機能していたことが示唆された.
ウイルスの感染はすべての生物にとり脅威である.ウイルスの遺伝子は高頻度に変異を起こし急速に進化して宿主の免疫系からのがれる.このようなウイルスと宿主とのイタチごっこにより宿主の免疫機構には多様性が生じる.したがって,さまざまなウイルスと宿主との相互作用を研究することにより,ウイルスに対する画期的な免疫機構の戦略が明らかにされる可能性がある1).哺乳類と昆虫は非常によく似た自然免疫の機構をもつことがショウジョウバエを用いた研究により明らかにされている.実際,ショウジョウバエにおいては細菌や菌類に対する感染防御にIMD経路やToll経路の関与することが知られているが,これらの経路は哺乳類のTNF受容体経路やインターロイキン1-Toll様受容体経路と類似する2,3).昆虫の場合,RNAi機構がウイルスに対する感染防御の主要な機構だと考えられている.しかし,ウイルスを感染させたショウジョウバエにおける転写の解析から,数百もの遺伝子の発現が変動することが示されている4,5).これらの転写応答はウイルスの種類により異なる4).おもにRNAi機構によりウイルスに対し感染防御をすると考えられている昆虫が,なぜこのように多くの遺伝子の発現を変動させるのか,その機構や発現の誘導される遺伝子の詳細な機能についてはほとんど解析されていない6).
最近,筆者らの研究グループは,IMD経路を抑制するdie遺伝子の機能について解析した7).いくつかの昆虫のDNAウイルスがdie遺伝子の相同遺伝子を発現することから,ウイルスがIMD経路を標的にして感染を成立させると考えられた8).そこで,この研究においては,IMD経路の抗ウイルス作用に注目した.
ウイルスに対する免疫機構におけるIMD経路の役割について明らかにするため,ショウジョウバエに由来するS2細胞を用いた.RNAi法によりIMD経路の構成タンパク質をひとつずつノックダウンし,ショウジョウバエCウイルスを感染させて感染に対する感受性を調べた.その結果,IKKβのショウジョウバエのホモログであるdIKKβ,あるいは,NF-κBのショウジョウバエのホモログであるRelishをノックダウンした細胞において,ショウジョウバエCウイルスのRNA量が増加した.一方,IKKβとともにIκB複合体を形成するIKKγのショウジョウバエのホモログであるdIKKγをノックダウンすると,逆に,ショウジョウバエCウイルスのRNA量は減少した.ショウジョウバエCウイルスと同じ科に属するコオロギ麻痺ウイルスに対しても同様の影響がみられた.また,同様の結果はin vivoにおいても確かめられた.すなわち,dIKKβあるいはRelishの欠損によりウイルスの感染に対する感受性が上昇した.
以上の結果から,IMD経路の構成タンパク質であるdIKKβおよびRelishは,細菌に対する感染防御のみならず,ウイルスの感染に対しても機能することが明らかにされた.
dIKKβを介した抗ウイルス遺伝子を同定するため,S2細胞およびショウジョウバエの個体を用いてマイクロアレイ法により遺伝子の発現を解析した.個体を用いた解析により,ウイルスの感染およびdIKKβに依存して発現の上昇する28個の遺伝子が同定された.S2細胞においては,ウイルスの感染およびdIKKβに依存して発現の上昇する遺伝子はなく,dIKKβをノックダウンした際に発現の低下する82個の遺伝子が同定された.これらの遺伝子を比較し,共通する10個の遺伝子に着目した.
この10個のdIKKβにより発現の制御される遺伝子の上流の配列を解析したところ,高い頻度でNF-κBの結合配列がみつかった.そこで,S2細胞においてRelishをノックダウンしたところ,少なくとも7つの遺伝子の発現の低下が定量PCR法により確認された.一方,dIKKγをノックダウンしたところ,逆に,少なくとも8つの遺伝子の発現が上昇した.この遺伝子の発現パターンは,ルシフェラーゼレポーター系によっても確かめられた.また,遺伝子プロモーターに存在するNF-κBの結合配列に変異を導入するとプロモーター活性はいちじるしく低下し,dIKKβ,Relish,dIKKγによる発現の制御も失われた.
以上の結果から,dIKKβおよびRelishはこれらの遺伝子の発現を正に,dIKKγは負に制御することがわかった.dIKKβをノックダウンするとウイルスに対する感受性が上昇し,dIKKγをノックダウンすると逆にウイルスの増殖が抑制されるという結果から,これら10個の遺伝子の産物がウイルスの増殖を直接に制御することが示唆された.
S2細胞においてRNAi法によりdIKKβにより発現の制御される10個の遺伝子をノックダウンしてウイルスの増殖について調べた.その結果,新規の遺伝子であるCG11671遺伝子あるいはCG1667遺伝子をノックダウンするとショウジョウバエCウイルスのRNA量が顕著に増加した.CG1667遺伝子は哺乳類のSTING遺伝子のホモログであり,dSTING遺伝子とよぶことにした.一方,CG11671遺伝子はこれまでに機能の知られていない遺伝子であったため,Nazo遺伝子と名づけた.S2細胞においてdSTING遺伝子を強制発現してウイルスを感染させると,ショウジョウバエCウイルスおよびコオロギ麻痺ウイルスの増殖が抑制された.しかし,この効果はフロックハウスウイルスではみられなかった.この結果は,dIKKβをノックダウンしたときとよく一致した.ヒトSTINGはウェスタンブロット法により約42 kDaのタンパク質として検出されるが,dSTINGの発現により約37 kDaおよび約42 kDaの2つのシグナルが認められた.この2つのシグナルについてエドマン分解法によりアミノ酸配列を決定したところ,約42 kDのタンパク質はmRNAの塩基配列から予想されるアミノ酸配列をもっていた一方,約37 kDaのタンパク質はN末端側の27アミノ酸残基が欠損していた.抗dSTING抗体を用いたウェスタン解析により,内在性のdSTINGにも短いタイプと長いタイプの存在することが確認された.
STINGは膜貫通タンパク質であり,細胞質に面したC末端側に活性化ドメインをもつ9).トポロジー解析の結果,短いタイプのdSTINGのC末端側が細胞質に面していた.dSTINGの短いタイプあるいは長いタイプをそれぞれS2細胞において強制発現させたところ,短いタイプにのみ抗ウイルス活性が認められた.
dSTINGを欠損したショウジョウバエの変異体を作製しウイルスに対する感受性について調べた.その結果,dSTING欠損変異体はショウジョウバエCウイルスに感染した際にウイルスのRNA量が増加し,感受性も高かった.さらに,dIKKβを欠損したショウジョウバエの変異体と同様に,ショウジョウバエCウイルスのみならずコオロギ麻痺ウイルスの感染に対する感受性も高くなった.一方,細菌や菌類の感染に対する感受性に変化はなく,抗菌ペプチドも正常に産生した.以上の結果から,dSTINGはショウジョウバエにおいてウイルスに対する免疫機構に関与するが,細菌や菌類の感染においては重要でないと考えられた.
dIKKβにより発現が制御される10個の遺伝子がdSTINGによっても発現が制御されるかどうか調べた.S2細胞においてdSTINGを強制発現させると7つの遺伝子の発現は上昇し,逆に,dSTINGをノックダウンすると4つの遺伝子の発現が低下した.このことから,dIKKβとdSTINGは同じシグナル伝達経路において機能することが示唆された.dSTINGのArg232あるいはPhe234をAlaに置換すると抗ウイルス作用が消失した.この2つの残基は,ヒトSTINGの環状ジヌクレオチド結合部位にあたっていた9).
dIKKβ,dIKKγ,Relish,dSTINGの上位性について調べた.dIKKβあるいはRelishをノックダウンすると,dSTINGを過剰発現させてもNazo遺伝子,CG16713遺伝子,CG33926遺伝子の発現は低下したままであり,ウイルスの増殖も抑制されなかった.以上の結果から,dSTINGは抗ウイルスシグナル伝達経路においてdIKKβおよびRelishの上流にて機能することが示唆された.さらに,dSTINGおよびdIKKβを介して発現が制御されるCG32268遺伝子,CG33926遺伝子,CG13641遺伝子の発現はAGO2に依存しないことから,RNAi機構とは別のウイルスに対する免疫機構であることも示唆された.
S2細胞においてNazo遺伝子あるいはそのパラログであるCG3740遺伝子を強制発現させてウイルスに対する感受性について調べた.その結果,Nazoの発現によりウイルスの感染はいちじるしく抑制された一方,CG3740の発現により抗ウイルス作用は認められなかった.このことから,Nazoはショウジョウバエの進化の過程において比較的新しく機能を獲得した抗ウイルスタンパク質であることが示唆された.
dSTINGをノックダウンするとNazoの発現も低下したことから,dSTINGはNazoの発現を正に制御することが示された.逆に,NazoをノックダウンしてもdSTINGの発現に影響はなかった.また,Nazo遺伝子を強制発現すると,dSTING,dIKKβ,Relishをノックダウンしてもひきつづき強い抗ウイルス作用が認められた.これらの結果から,NazoはdSTING,dIKKβ,Relishの下流において機能する抗ウイルスタンパク質であると考えられた.
この研究において,IMD経路の構成タンパク質であるdIKKβ,dIKKγ,Relishの関与する新しい抗ウイルスシグナル伝達経路が見い出された(図1).このシグナル伝達経路により発現が誘導されるタンパク質として,STINGのショウジョウバエにおけるホモログであるdSTINGがみつかったことがこの研究のポイントである.哺乳類においてSTINGはインターフェロン発現経路の要であるが,ショウジョウバエを含む無脊椎動物はこのインターフェロン発現経路をもたない.この研究により,ショウジョウバエにおいても哺乳類と同様に,STINGを介したウイルスに対する免疫機構が存在し,実際に抗ウイルス作用を示すことがわかった.このことから,哺乳類と昆虫の祖先が分かれた約5億年まえには,このウイルスに対する免疫機構がすでに機能していたことが示唆される.しかし,ショウジョウバエにおいては,インターフェロンとは異なる抗ウイルスタンパク質を発現した.この抗ウイルスタンパク質のひとつをNazoと名づけたが,その名のとおり機能は未知である.この研究においては,ほかにも複数のタンパク質が同定されており,これらの抗ウイルス作用を調べることにより新たな薬剤や治療への応用が考えられる.
略歴:2001年 名古屋大学大学院生命農学研究科 修了,2002年 フランスNational Centre for Scientific Research研究員,2005年 理化学研究所免疫・アレルギー科学総合研究センター 研究員,2006年 東北大学大学院薬学研究科 研究員,東北大学大学院生命農学研究科 特任助教を経て,2012年よりフランスNational Institute for Health and Medical Research主任パーマネント研究員.
研究テーマ:ショウジョウバエの自然免疫におけるシグナル伝達経路.
抱負:これからもショウジョウバエを用いた自然免疫の研究をつづけ,ウイルスの感染やがんにより苦しんでいる人たちの薬剤や治療法に対し新たな洞察をくわえたい.
岡戸 清(Kiyoshi Okado)
略歴:2009年 岐阜大学大学院連合獣医学研究科 修了,同年 帯広畜産大学原虫病研究センター 研究員,2011年 東京慈恵会医科大学 研究員,フランスNational Centre for Scientific Research研究員を経て,2017年より帯広畜産大学原虫病研究センター 特任研究員.
研究テーマ:ショウジョウバエの自然免疫の機構,節足動物による病原体の媒介の機構.
抱負:現在,日本において研究者の就職はむずかしい状況にあるが,今回の成果が活かせるようなアカデミックポストを獲得して,これからもレベルが高く,しかも,一般の人も重要だと感じるような研究をつづけたい.
© 2018 後藤 彰・岡戸 清 Licensed under CC 表示 2.1 日本
(フランスStrasbourg大学Insect Models of Innate Immunity)
email:後藤 彰,岡戸 清
DOI: 10.7875/first.author.2018.086
The kinase IKKβ regulates a STING- and NF-κB-dependent antiviral response pathway in Drosophila.
Akira Goto, Kiyoshi Okado, Nelson Martins, Hua Cai, Vincent Barbier, Olivier Lamiable, Laurent Troxler, Estelle Santiago, Lauriane Kuhn, Donggi Paik, Neal Silverman, Andreas Holleufer, Rune Hartmann, Jiyong Liu, Tao Peng, Jules A. Hoffmann, Carine Meignin, Laurent Daeffler, Jean-Luc Imler
Immunity, 49, 225-234.e4 (2018)
要 約
ショウジョウバエのウイルスに対する免疫応答には,RNAi機構のほか,ウイルスの感染にともないひき起こされる免疫機構のあることが知られている.この研究において,筆者らは,ショウジョウバエにおいて細菌の感染にともないひき起こされる免疫機構であるIMD経路の構成タンパク質であるdIKKβおよびRelishが,抗ウイルスシグナル伝達経路にも関与することを見い出した.この抗ウイルスシグナル伝達経路の活性化にはdSTINGも関与した.哺乳類においてSTINGはインターフェロン発現経路の要であり,細胞質においてウイルスの感染の情報をうけとり最終的にインターフェロンを発現させる.無脊椎動物であるショウジョウバエはこのインターフェロン発現経路はもたないが,dSTINGがdIKKβの上流において機能し,インターフェロンとは異なる抗ウイルスタンパク質Nazoを発現させた.以上の結果から,ショウジョウバエにおいて見い出された抗ウイルスシグナル伝達経路であるSTING-IKKβ-NF-κB経路の起源は非常に古く,哺乳類がほかの生物から分かれたとき,すでに機能していたことが示唆された.
はじめに
ウイルスの感染はすべての生物にとり脅威である.ウイルスの遺伝子は高頻度に変異を起こし急速に進化して宿主の免疫系からのがれる.このようなウイルスと宿主とのイタチごっこにより宿主の免疫機構には多様性が生じる.したがって,さまざまなウイルスと宿主との相互作用を研究することにより,ウイルスに対する画期的な免疫機構の戦略が明らかにされる可能性がある1).哺乳類と昆虫は非常によく似た自然免疫の機構をもつことがショウジョウバエを用いた研究により明らかにされている.実際,ショウジョウバエにおいては細菌や菌類に対する感染防御にIMD経路やToll経路の関与することが知られているが,これらの経路は哺乳類のTNF受容体経路やインターロイキン1-Toll様受容体経路と類似する2,3).昆虫の場合,RNAi機構がウイルスに対する感染防御の主要な機構だと考えられている.しかし,ウイルスを感染させたショウジョウバエにおける転写の解析から,数百もの遺伝子の発現が変動することが示されている4,5).これらの転写応答はウイルスの種類により異なる4).おもにRNAi機構によりウイルスに対し感染防御をすると考えられている昆虫が,なぜこのように多くの遺伝子の発現を変動させるのか,その機構や発現の誘導される遺伝子の詳細な機能についてはほとんど解析されていない6).
最近,筆者らの研究グループは,IMD経路を抑制するdie遺伝子の機能について解析した7).いくつかの昆虫のDNAウイルスがdie遺伝子の相同遺伝子を発現することから,ウイルスがIMD経路を標的にして感染を成立させると考えられた8).そこで,この研究においては,IMD経路の抗ウイルス作用に注目した.
1.dIKKβおよびRelishはウイルスの感染を抑制するがdIKKγは促進する
ウイルスに対する免疫機構におけるIMD経路の役割について明らかにするため,ショウジョウバエに由来するS2細胞を用いた.RNAi法によりIMD経路の構成タンパク質をひとつずつノックダウンし,ショウジョウバエCウイルスを感染させて感染に対する感受性を調べた.その結果,IKKβのショウジョウバエのホモログであるdIKKβ,あるいは,NF-κBのショウジョウバエのホモログであるRelishをノックダウンした細胞において,ショウジョウバエCウイルスのRNA量が増加した.一方,IKKβとともにIκB複合体を形成するIKKγのショウジョウバエのホモログであるdIKKγをノックダウンすると,逆に,ショウジョウバエCウイルスのRNA量は減少した.ショウジョウバエCウイルスと同じ科に属するコオロギ麻痺ウイルスに対しても同様の影響がみられた.また,同様の結果はin vivoにおいても確かめられた.すなわち,dIKKβあるいはRelishの欠損によりウイルスの感染に対する感受性が上昇した.
以上の結果から,IMD経路の構成タンパク質であるdIKKβおよびRelishは,細菌に対する感染防御のみならず,ウイルスの感染に対しても機能することが明らかにされた.
2.ウイルスの感染により発現の誘導される遺伝子はdIKKβとdIKKγにより反対の制御をうける
dIKKβを介した抗ウイルス遺伝子を同定するため,S2細胞およびショウジョウバエの個体を用いてマイクロアレイ法により遺伝子の発現を解析した.個体を用いた解析により,ウイルスの感染およびdIKKβに依存して発現の上昇する28個の遺伝子が同定された.S2細胞においては,ウイルスの感染およびdIKKβに依存して発現の上昇する遺伝子はなく,dIKKβをノックダウンした際に発現の低下する82個の遺伝子が同定された.これらの遺伝子を比較し,共通する10個の遺伝子に着目した.
この10個のdIKKβにより発現の制御される遺伝子の上流の配列を解析したところ,高い頻度でNF-κBの結合配列がみつかった.そこで,S2細胞においてRelishをノックダウンしたところ,少なくとも7つの遺伝子の発現の低下が定量PCR法により確認された.一方,dIKKγをノックダウンしたところ,逆に,少なくとも8つの遺伝子の発現が上昇した.この遺伝子の発現パターンは,ルシフェラーゼレポーター系によっても確かめられた.また,遺伝子プロモーターに存在するNF-κBの結合配列に変異を導入するとプロモーター活性はいちじるしく低下し,dIKKβ,Relish,dIKKγによる発現の制御も失われた.
以上の結果から,dIKKβおよびRelishはこれらの遺伝子の発現を正に,dIKKγは負に制御することがわかった.dIKKβをノックダウンするとウイルスに対する感受性が上昇し,dIKKγをノックダウンすると逆にウイルスの増殖が抑制されるという結果から,これら10個の遺伝子の産物がウイルスの増殖を直接に制御することが示唆された.
3.dIKKβにより発現の制御される抗ウイルス遺伝子の同定
S2細胞においてRNAi法によりdIKKβにより発現の制御される10個の遺伝子をノックダウンしてウイルスの増殖について調べた.その結果,新規の遺伝子であるCG11671遺伝子あるいはCG1667遺伝子をノックダウンするとショウジョウバエCウイルスのRNA量が顕著に増加した.CG1667遺伝子は哺乳類のSTING遺伝子のホモログであり,dSTING遺伝子とよぶことにした.一方,CG11671遺伝子はこれまでに機能の知られていない遺伝子であったため,Nazo遺伝子と名づけた.S2細胞においてdSTING遺伝子を強制発現してウイルスを感染させると,ショウジョウバエCウイルスおよびコオロギ麻痺ウイルスの増殖が抑制された.しかし,この効果はフロックハウスウイルスではみられなかった.この結果は,dIKKβをノックダウンしたときとよく一致した.ヒトSTINGはウェスタンブロット法により約42 kDaのタンパク質として検出されるが,dSTINGの発現により約37 kDaおよび約42 kDaの2つのシグナルが認められた.この2つのシグナルについてエドマン分解法によりアミノ酸配列を決定したところ,約42 kDのタンパク質はmRNAの塩基配列から予想されるアミノ酸配列をもっていた一方,約37 kDaのタンパク質はN末端側の27アミノ酸残基が欠損していた.抗dSTING抗体を用いたウェスタン解析により,内在性のdSTINGにも短いタイプと長いタイプの存在することが確認された.
STINGは膜貫通タンパク質であり,細胞質に面したC末端側に活性化ドメインをもつ9).トポロジー解析の結果,短いタイプのdSTINGのC末端側が細胞質に面していた.dSTINGの短いタイプあるいは長いタイプをそれぞれS2細胞において強制発現させたところ,短いタイプにのみ抗ウイルス活性が認められた.
dSTINGを欠損したショウジョウバエの変異体を作製しウイルスに対する感受性について調べた.その結果,dSTING欠損変異体はショウジョウバエCウイルスに感染した際にウイルスのRNA量が増加し,感受性も高かった.さらに,dIKKβを欠損したショウジョウバエの変異体と同様に,ショウジョウバエCウイルスのみならずコオロギ麻痺ウイルスの感染に対する感受性も高くなった.一方,細菌や菌類の感染に対する感受性に変化はなく,抗菌ペプチドも正常に産生した.以上の結果から,dSTINGはショウジョウバエにおいてウイルスに対する免疫機構に関与するが,細菌や菌類の感染においては重要でないと考えられた.
4.dSTINGはdIKKβおよびRelishの上流において機能する
dIKKβにより発現が制御される10個の遺伝子がdSTINGによっても発現が制御されるかどうか調べた.S2細胞においてdSTINGを強制発現させると7つの遺伝子の発現は上昇し,逆に,dSTINGをノックダウンすると4つの遺伝子の発現が低下した.このことから,dIKKβとdSTINGは同じシグナル伝達経路において機能することが示唆された.dSTINGのArg232あるいはPhe234をAlaに置換すると抗ウイルス作用が消失した.この2つの残基は,ヒトSTINGの環状ジヌクレオチド結合部位にあたっていた9).
dIKKβ,dIKKγ,Relish,dSTINGの上位性について調べた.dIKKβあるいはRelishをノックダウンすると,dSTINGを過剰発現させてもNazo遺伝子,CG16713遺伝子,CG33926遺伝子の発現は低下したままであり,ウイルスの増殖も抑制されなかった.以上の結果から,dSTINGは抗ウイルスシグナル伝達経路においてdIKKβおよびRelishの上流にて機能することが示唆された.さらに,dSTINGおよびdIKKβを介して発現が制御されるCG32268遺伝子,CG33926遺伝子,CG13641遺伝子の発現はAGO2に依存しないことから,RNAi機構とは別のウイルスに対する免疫機構であることも示唆された.
5.NazoはdSTINGおよびdIKKβにより発現の制御される抗ウイルスタンパク質である
S2細胞においてNazo遺伝子あるいはそのパラログであるCG3740遺伝子を強制発現させてウイルスに対する感受性について調べた.その結果,Nazoの発現によりウイルスの感染はいちじるしく抑制された一方,CG3740の発現により抗ウイルス作用は認められなかった.このことから,Nazoはショウジョウバエの進化の過程において比較的新しく機能を獲得した抗ウイルスタンパク質であることが示唆された.
dSTINGをノックダウンするとNazoの発現も低下したことから,dSTINGはNazoの発現を正に制御することが示された.逆に,NazoをノックダウンしてもdSTINGの発現に影響はなかった.また,Nazo遺伝子を強制発現すると,dSTING,dIKKβ,Relishをノックダウンしてもひきつづき強い抗ウイルス作用が認められた.これらの結果から,NazoはdSTING,dIKKβ,Relishの下流において機能する抗ウイルスタンパク質であると考えられた.
おわりに
この研究において,IMD経路の構成タンパク質であるdIKKβ,dIKKγ,Relishの関与する新しい抗ウイルスシグナル伝達経路が見い出された(図1).このシグナル伝達経路により発現が誘導されるタンパク質として,STINGのショウジョウバエにおけるホモログであるdSTINGがみつかったことがこの研究のポイントである.哺乳類においてSTINGはインターフェロン発現経路の要であるが,ショウジョウバエを含む無脊椎動物はこのインターフェロン発現経路をもたない.この研究により,ショウジョウバエにおいても哺乳類と同様に,STINGを介したウイルスに対する免疫機構が存在し,実際に抗ウイルス作用を示すことがわかった.このことから,哺乳類と昆虫の祖先が分かれた約5億年まえには,このウイルスに対する免疫機構がすでに機能していたことが示唆される.しかし,ショウジョウバエにおいては,インターフェロンとは異なる抗ウイルスタンパク質を発現した.この抗ウイルスタンパク質のひとつをNazoと名づけたが,その名のとおり機能は未知である.この研究においては,ほかにも複数のタンパク質が同定されており,これらの抗ウイルス作用を調べることにより新たな薬剤や治療への応用が考えられる.
文 献
- Marques, J. T. & Imler, J. L.: The diversity of insect antiviral immunity: insights from viruses. Curr. Opin. Microbiol., 32, 71-76 (2016)[PubMed]
- Hoffmann, J. A.: The immune response of Drosophila. Nature, 426, 33-38 (2003)[PubMed]
- Lemaitre, B. & Hoffmann, J.: The host defense of Drosophila melanogaster. Annu. Rev. Immunol., 25, 697-743 (2007)[PubMed]
- Kemp, C., Mueller, S., Goto, A. et al.: Broad RNA interference-mediated antiviral immunity and virus-specific inducible responses in Drosophila. J. Immunol., 190, 650-658 (2013)[PubMed]
- Merkling, S. H., Overheul, G. J., van Mierlo, J. T. et al.: The heat shock response restricts virus infection in Drosophila. Sci. Rep., 5, 12758 (2015)[PubMed]
- Lamiable, O. & Imler, J. L.: Induced antiviral innate immunity in Drosophila. Curr. Opin. Microbiol., 20, 62-68 (2014)[PubMed]
- Lamiable, O., Kellenberger, C., Kemp, C. et al.: Cytokine Diedeland a viral homologue suppress the IMD pathway in Drosophila. Proc. Natl. Acad. Sci. USA, 113, 698-703 (2016)[PubMed]
- Zaghloul, H., Hice, R., Arensburger, P. et al.: Transcriptome analysis of the Spodoptera frugiperda ascovirus in vivo provides insights into how its apoptosis inhibitors and caspase promote increased synthesis of viral vesicles and virion progeny. J. Virol., 91, e00874-17 (2017)[PubMed]
- Chen, Q., Sun, L. & Chen, Z. J.: Regulation and function of the cGAS-STING pathway of cytosolic DNA sensing. Nat. Immunol., 17, 1142-1149 (2016)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2001年 名古屋大学大学院生命農学研究科 修了,2002年 フランスNational Centre for Scientific Research研究員,2005年 理化学研究所免疫・アレルギー科学総合研究センター 研究員,2006年 東北大学大学院薬学研究科 研究員,東北大学大学院生命農学研究科 特任助教を経て,2012年よりフランスNational Institute for Health and Medical Research主任パーマネント研究員.
研究テーマ:ショウジョウバエの自然免疫におけるシグナル伝達経路.
抱負:これからもショウジョウバエを用いた自然免疫の研究をつづけ,ウイルスの感染やがんにより苦しんでいる人たちの薬剤や治療法に対し新たな洞察をくわえたい.
岡戸 清(Kiyoshi Okado)
略歴:2009年 岐阜大学大学院連合獣医学研究科 修了,同年 帯広畜産大学原虫病研究センター 研究員,2011年 東京慈恵会医科大学 研究員,フランスNational Centre for Scientific Research研究員を経て,2017年より帯広畜産大学原虫病研究センター 特任研究員.
研究テーマ:ショウジョウバエの自然免疫の機構,節足動物による病原体の媒介の機構.
抱負:現在,日本において研究者の就職はむずかしい状況にあるが,今回の成果が活かせるようなアカデミックポストを獲得して,これからもレベルが高く,しかも,一般の人も重要だと感じるような研究をつづけたい.
© 2018 後藤 彰・岡戸 清 Licensed under CC 表示 2.1 日本