多能性幹細胞から中胚葉の分化を誘導する転写因子Tbx6の発見
貞廣威太郎・家田真樹
(筑波大学医学医療系 循環器内科学)
email:貞廣威太郎,家田真樹
DOI: 10.7875/first.author.2018.085
Tbx6 induces nascent mesoderm from pluripotent stem cells and temporally controls cardiac versus somite lineage diversification.
Taketaro Sadahiro, Mari Isomi, Naoto Muraoka, Hidenori Kojima, Sho Haginiwa, Shota Kurotsu, Fumiya Tamura, Hidenori Tani, Shugo Tohyama, Jun Fujita, Hiroyuki Miyoshi, Yoshifumi Kawamura, Naoki Goshima, Yuka W. Iwasaki, Kensaku Murano, Kuniaki Saito, Mayumi Oda, Peter Andersen, Chulan Kwon, Hideki Uosaki, Hirofumi Nishizono, Keiichi Fukuda, Masaki Ieda
Cell Stem Cell, 23, 382-395.e5 (2018)
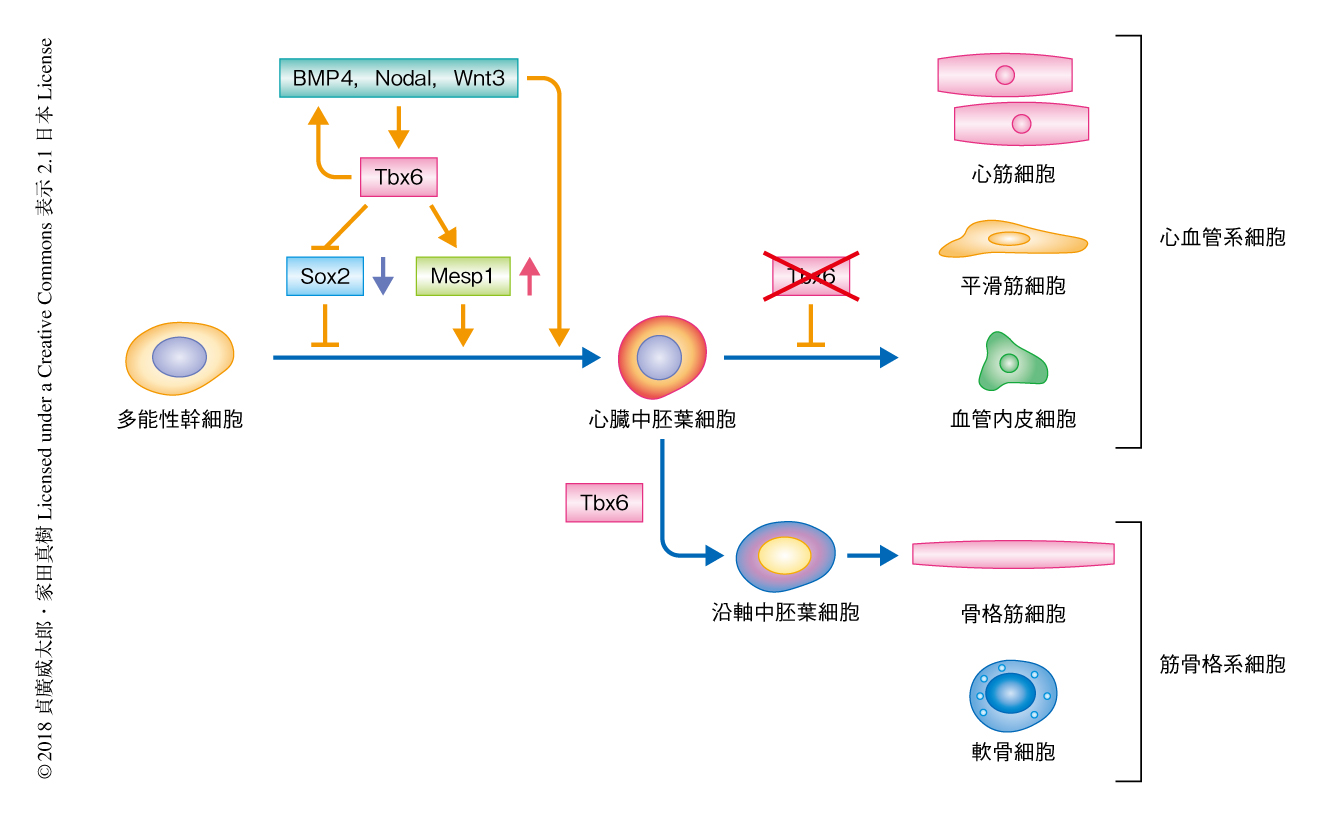
多能性幹細胞から心筋細胞の分化を誘導するには,複数の液性因子を使用し,心臓中胚葉細胞をへて心筋細胞に分化させる方法が一般的である.しかし,この方法には,工程が煩雑,効率が不安定,液性因子が高価,という課題がある.心臓中胚葉の分化の分子機構および心臓中胚葉の分化を誘導する転写因子については明らかにされておらず,この分子機構を解明し分化を誘導する転写因子を同定することにより,遺伝子の発現のみで多能性幹細胞から選択的に心臓中胚葉細胞の分化が可能になると考えた.ダイレクトリプログラミングを応用したスクリーニングにより線維芽細胞から心臓中胚葉細胞の分化を直接的に誘導するTbx6遺伝子を発見し,Tbx6遺伝子をマウスのES細胞あるいはヒトのiPS細胞といった多能性幹細胞に導入することにより,液性因子を使用せずに心臓中胚葉細胞の分化が可能であることが見い出された.さらに,Tbx6遺伝子の発現の期間を調整することにより,同じく中胚葉から分化する骨格筋や軟骨細胞の分化も可能であった.この研究により,Tbx6が心臓だけでなく多能性幹細胞からの中胚葉の分化の全体を制御する重要な転写因子であることが見い出されたとともに,その分子生物学的な機序が明らかにされた.
近年,多能性幹細胞から分化させた細胞を用いた再生医療が注目されている.目的の臓器の細胞へと選択的に分化させる手法は発生学の知見を応用しており,中胚葉の分化にはBMPシグナル,Nodal-Activinシグナル,Wntシグナルが重要であって,多能性幹細胞はこれらのシグナルの発現量や発現の時期にもとづき分化の方向性を決定する.しかし,この方法には高価な液性因子や低分子化合物を用いる煩雑な工程が必要であり,発現を制御するだけで中胚葉の分化が可能となるような遺伝子の存在は不明である1-4).さらに,標的となる遺伝子など分子生物学的な機序に関しては不明な点が多い.
この研究において,筆者らは,心臓に対する再生医療の飛躍的な前進のため,液性因子にたよらない,多能性幹細胞からの選択的な心臓中胚葉細胞および心筋細胞への新規の分化法の開発をめざした.幹細胞から心臓中胚葉細胞の分化を誘導する新規のタンパク質を同定し,その遺伝子の発現だけで心臓中胚葉細胞の分化が実現すれば,安定かつ簡便,さらに,安価に心筋細胞の作製が可能になる.その第一歩として,線維芽細胞を用いたダイレクトリプログラミングによるスクリーニングを計画した.
これまで,液性因子を用いず単一の遺伝子の発現のみで多能性幹細胞から心臓中胚葉細胞の分化が誘導されたとの報告はない.そこで,研究の要となるタンパク質のスクリーニングに関して,候補となる遺伝子をひとつずつ多能性幹細胞に導入する手法は困難であったことから,遺伝子の発現のみで心臓中胚葉細胞の分化を誘導する遺伝子は,細胞種を変えても心臓中胚葉細胞の分化を誘導するであろうと仮説をたてた.これまで,筆者らは,線維芽細胞にレトロウイルスベクターを用いて転写因子を導入し直接的に心筋細胞を作製する心筋細胞ダイレクトリプログラミング法を開発し,心筋細胞に特異的な3つの転写因子が線維芽細胞からiPS細胞をへずに直接に心筋細胞を分化させるリプログラミングタンパク質であることを示していた5,6)(文献5) は 新着論文レビュー でも掲載).そこで,幹細胞と比較して,容易かつ短期間で遺伝子の導入が可能な線維芽細胞を用いてスクリーニングを実施し,線維芽細胞から心臓中胚葉細胞をリプログラミングするタンパク質を同定することにした.結果的に,この方法は多数のタンパク質をスクリーニングする必要があるこの研究においてきわめて有効であった.
中胚葉から分化する最初の臓器が心臓である点に着目し,心臓中胚葉細胞の分化を誘導するタンパク質は中胚葉細胞と心臓中胚葉細胞の両者に発現する遺伝子にコードされているであろうと考えた.そこで,ES細胞から分化させた中胚葉細胞および心臓中胚葉細胞におけるマイクロアレイ法のデータを用いて,これらの時期に特異的に発現し,ノックアウトマウスにおいて心臓の発生の異常あるいは胎生致死の表現型を示す58個の遺伝子を候補として選定した.そして,候補となる遺伝子が導入された58種類のレトロウイルスベクターをマウスの胎仔線維芽細胞に個別に感染させ,遺伝子の過剰発現のみで心臓中胚葉細胞が分化されるかどうか検討した.遺伝子の導入から7日後に,中胚葉細胞および心臓中胚葉細胞に特異的に発現する転写因子であるMesp1のmRNAレベルでの発現を解析したところ,Tbx6遺伝子を導入した線維芽細胞でのみ発現が誘導されていた7).さらに,Mesp1を発現した細胞がGFPにより標識されるマウスから得た胎仔線維芽細胞にTbx6遺伝子を導入したところ,GFP陽性の細胞のコロニーが形成され,Tbx6遺伝子により分化したMesp1を発現する細胞が増殖能をもつことが示された.さらに,この細胞は中胚葉に関連する遺伝子であるT/Brachyury遺伝子を発現し,また,心臓中胚葉のマーカーであるFlk1およびPDGF受容体αを共発現しており,Tbx6遺伝子により線維芽細胞から分化した細胞が心臓中胚葉様の特徴をもつことが判明した1).しかし,この細胞を長期にわたり培養しても拍動する心筋細胞は分化しなかったため,中胚葉,心血管系,非心臓細胞に関連するmRNAの発現の経過を解析した.その結果,Tbx6遺伝子が導入された線維芽細胞は4週間を経過した時点でも中胚葉に関連する遺伝子および心臓前駆細胞に関連する遺伝子の発現が維持されていた一方,より分化した心臓前駆細胞や,筋骨格系などをはじめとする中胚葉に由来するほかの細胞に関連する遺伝子の発現の上昇は認められず,初期中胚葉の状態が維持されていることが示唆された.
従来,Tbx6遺伝子は骨格筋や軟骨などの原基となる沿軸中胚葉および体節に関連する遺伝子として認識されていた.マウスにおいては胎生7日目の原始線条においてTbx6遺伝子の発現が確認されている一方,初期中胚葉におけるその役割は明らかではなく,研究の中心は胎生8.5~12.5日の沿軸中胚葉における体節の分化に関するものであった.一方で,Tbx6ノックアウトマウスがTbx6によるSox2の制御機構を欠損することにより,存在するはずの沿軸中胚葉が脊髄になり3本の脊髄をもつ奇妙な表現型を示したことから,Tbx6の中胚葉の分化の全体への関与が示唆されていた8,9).そこで,胎生7.0~7.75日のマウスの生体の中胚葉における1細胞RNA-seq法のデータを用いてTbx6遺伝子を発現する細胞の局在を解析したところ,Tbx6遺伝子は胎生7.0日の初期中胚葉に発現していた.さらに,このTbx6遺伝子を発現する細胞は,初期中胚葉に関連する遺伝子だけでなく,心臓中胚葉や,より心臓にむけ分化した初期心臓前駆細胞に関連する遺伝子を発現することが判明した.しかし,後期心臓前駆細胞に関連する遺伝子は発現しておらず,発現が予想された沿軸中胚葉や体節に関連する遺伝子の発現は明らかではなかった.以上の結果より,初期中胚葉においてTbx6遺伝子は沿軸中胚葉や体節などではなく,心血管系において発現することが明らかにされた.
生体の初期中胚葉における心臓の発生との関連が明らかにされたTbx6遺伝子が,そののちの心血管系への分化に関してどのような役割をもつのか詳細に解析するため,マウスのES細胞から心筋細胞への分化において遺伝子の発現パターンを解析した.中胚葉に関連する遺伝子であるT遺伝子が発現するとGFPを発現するES細胞を用いて,液性因子によりES細胞から心筋細胞へと分化させたところ,Tbx6遺伝子がほかの中胚葉に関連する遺伝子の発現と同じ時期にGFP陽性の中胚葉細胞に限局して一過性に発現した.Tbx6遺伝子の心血管系の分化への寄与を評価する目的で,CRISPR-Cas9法によりTbx6を欠損したES細胞を作製し液性因子により心筋細胞に分化させたところ,中胚葉細胞および心臓中胚葉細胞への分化が抑制され,心筋細胞の分化の効率は約1/3に抑制された.以上の結果から,多能性幹細胞からの心筋細胞の分化の過程においても中胚葉細胞にTbx6遺伝子が発現し,以降の心筋細胞の分化に重要な役割をもつことが明らかにされた.
Tbx6の欠損により心臓中胚葉細胞および心筋細胞への分化が抑制されたことから,Tbx6遺伝子の過剰発現により液性因子を使用せずに多能性幹細胞から心臓中胚葉細胞の分化が誘導されるかどうか検討した.マウスのES細胞においてテトラサイクリンの添加によりTbx6遺伝子の発現を制御する系を確立し,液性因子を使用せずにTbx6遺伝子の発現のみで心臓中胚葉細胞の分化の誘導が可能であるかどうか検討した.その結果,Tbx6遺伝子の発現がない場合は中胚葉細胞へはまったく分化しない一方,液性因子を使用せずとも3日間のTbx6遺伝子の発現により約88%のES細胞が中胚葉細胞へと分化し,この中胚葉細胞の37.5%が心臓中胚葉細胞であった.そののち,約67%の細胞は心筋細胞に分化し,その効率は液性因子による分化よりも良好であった.また,培養条件の変更により,分化した心臓中胚葉細胞から平滑筋細胞や血管内皮細胞など心臓を構成するすべての細胞への分化が確認された.
マイクロアレイ法による遺伝子の発現の網羅的な解析の結果,Tbx6遺伝子の発現により早期からBMPシグナルや心臓の発生に関連する遺伝子の発現が上昇し,経過とともに中胚葉および心血管系の分化に関連するさらに多くの遺伝子の発現が上昇する一方,幹細胞からの中胚葉の分化において抑制される神経の発生にかかわる遺伝子の発現が早期から低下することが明らかにされた.このような中胚葉の分化の機序を解明するため,Mesp1遺伝子に着目して転写因子であるTbx6が直接的に結合する遺伝子を探索した.Mesp1は生体において,あるいは,幹細胞からの中胚葉細胞および心血管系細胞への分化に重要な転写因子であると同時に,線維芽細胞におけるスクリーニングにおいてもTbx6遺伝子により発現が誘導されていた.そこで,ChIP-PCR法によりMesp1遺伝子を解析したところ,Mesp1遺伝子のエンハンサー領域にTbx6の結合が認められ,Tbx6によるMesp1遺伝子への直接的な結合による発現の誘導が明らかにされた.Tbx6の直接の標的となる遺伝子が明らかにされたことでから,心血管系の分化に重要なシグナルであるBMPシグナル,Nodalシグナル,Wntシグナルに注目した.Tbx6による分化の過程においておのおののシグナルを解析したところ,Tbx6遺伝子の発現によりすべてのシグナルが活性化されるなか,とくにBMP4シグナルが分化の早期から活性化されていた.中胚葉の分化においてはBMP4によりNodalおよびWntの発現が誘導されることが知られており,さきのマイクロアレイ法の結果においてもBMPシグナルに関連する遺伝子の発現が分化の早期から上昇したことから,Tbx6の直接の標的となる遺伝子はBMP4遺伝子ではないかと仮定した10).そして,同様のChIP-PCR法による解析により,Tbx6がBMP4遺伝子の発現を直接に誘導することが明らかにされた.このように,ES細胞からの中胚葉細胞への分化において,Tbx6が直接的および間接的な機序により分化を制御することが明らかにされた.
筋骨格系との関連する知見の多いTbx6遺伝子であるが,その強制発現により多能性幹細胞からの筋骨格系細胞の分化が促進されるかどうかは明らかでなかった.そこで,マウスのES細胞においてテトラサイクリンの添加によりTbx6遺伝子の発現を制御する系において,3日間のTbx6遺伝子の発現により心臓中胚葉細胞が分化したのちもTbx6遺伝子を発現させつづけたところ,心臓中胚葉細胞が減少するとともに,沿軸中胚葉細胞が増加の傾向を示し沿軸中胚葉および体節のマーカー遺伝子の発現が上昇した.分化した沿軸中胚葉細胞を骨格筋の分化,あるいは,軟骨細胞の分化の条件にてそれぞれ培養を継続したところ,骨格筋細胞および軟骨細胞が分化した.このように,Tbx6遺伝子が一過性の発現により心血管系細胞の分化を誘導する一方で,心臓中胚葉細胞が分化したのちもTbx6遺伝子を発現しつづけると筋骨格系細胞への分化が誘導されることが明らかにされた.Tbx6遺伝子の発現する期間の変化による分化の制御機構について解明するため,沿軸中胚葉の分化に関与し,かつ,心臓中胚葉よりあとの心血管系の分化を阻害するWnt3シグナル,および,その下流のタンパク質であるMsx1およびCdx2の遺伝子発現を解析した11).その結果,Tbx6遺伝子の一過性の発現と比較し,持続的な発現によりWnt3遺伝子の発現が誘導され,そののち,Msx1遺伝子およびCdx2遺伝子の発現が誘導された.3日間のTbx6遺伝子の発現により分化させた心臓中胚葉細胞にMsx1遺伝子およびCdx2遺伝子を過剰発現させたところ,心筋細胞の分化が著明に抑制され,Tbx6遺伝子の持続的な発現によるWnt3遺伝子,Msx1遺伝子,Cdx2遺伝子の発現の誘導が心血管系への分化を阻害する機序の一部を担うことが判明した.
哺乳類において広く保存されているTbx6遺伝子の初期中胚葉における役割は種をこえて保存されているとの仮説をたてた.マウスとヒトでは幹細胞の発生のステージは異なるが,分化の制御に重要なシグナルは類似することが知られている.ヒトの多能性幹細胞においてTbx6遺伝子による心血管系細胞の分化の誘導について解析するため,液性因子および低分子化合物を用いてヒトのiPS細胞から心筋細胞を分化させた1).その結果,心筋細胞の分化の過程において,マウスのES細胞と同様に,ほかの心臓中胚葉に関連する遺伝子と同じ時期にTbx6遺伝子の一過性の発現の上昇が確認された.マウスのES細胞と同様に,ヒトのiPS細胞においてテトラサイクリンの添加によりTbx6遺伝子の発現を制御する系を確立しTbx6遺伝子の発現する期間について検討した結果,液性因子を使用せずに50%の中胚葉細胞の分化が誘導され,心筋細胞の分化の培養条件において15%の拍動心筋細胞が分化した.さらに,心筋細胞のほかにも平滑筋細胞および血管内皮細胞への分化も確認され,多能性幹細胞におけるTbx6遺伝子による中胚葉細胞および心血管系細胞への分化の制御機構が種をこえてヒトのiPS細胞においても保存されていることが確認された.
この研究により,これまで不明であった初期中胚葉の発生および心血管系の分化におけるTbx6の役割が明らかにされた.さらに,Tbx6が心臓だけでなく多能性幹細胞からの中胚葉の分化の全体を制御する重要な転写因子のひとつであることが見い出された(図1).この研究の成果は,さまざまな心臓疾患に対する再生医療への応用だけでなく,Tbx6遺伝子の導入による簡便かつ安価な心筋細胞の作製法の開発など多岐におよぶことが期待される.一方で,現時点ではマウスのES細胞と比較し,ヒトのiPS細胞からの心筋細胞の分化の効率には改善の余地があるが,この発見が心臓の新しい再生医療の実現を前進させる新たな一歩であると考えている.
略歴:2015年 慶應義塾大学医学部大学院医学研究科 修了,慶應義塾大学医学部 助教を経て,2018年より筑波大学附属病院 病院講師.
研究テーマ:ダイレクトリプログラミングによる心臓の再生.
関心事:心臓の発生学を応用した心臓の再生および心臓幹細胞の研究.
家田 真樹(Masaki Ieda)
筑波大学医学医療系 教授.
研究室URL:http://www.md.tsukuba.ac.jp/clinical-med/cardiology/index.html
© 2018 貞廣威太郎・家田真樹 Licensed under CC 表示 2.1 日本
(筑波大学医学医療系 循環器内科学)
email:貞廣威太郎,家田真樹
DOI: 10.7875/first.author.2018.085
Tbx6 induces nascent mesoderm from pluripotent stem cells and temporally controls cardiac versus somite lineage diversification.
Taketaro Sadahiro, Mari Isomi, Naoto Muraoka, Hidenori Kojima, Sho Haginiwa, Shota Kurotsu, Fumiya Tamura, Hidenori Tani, Shugo Tohyama, Jun Fujita, Hiroyuki Miyoshi, Yoshifumi Kawamura, Naoki Goshima, Yuka W. Iwasaki, Kensaku Murano, Kuniaki Saito, Mayumi Oda, Peter Andersen, Chulan Kwon, Hideki Uosaki, Hirofumi Nishizono, Keiichi Fukuda, Masaki Ieda
Cell Stem Cell, 23, 382-395.e5 (2018)
要 約
多能性幹細胞から心筋細胞の分化を誘導するには,複数の液性因子を使用し,心臓中胚葉細胞をへて心筋細胞に分化させる方法が一般的である.しかし,この方法には,工程が煩雑,効率が不安定,液性因子が高価,という課題がある.心臓中胚葉の分化の分子機構および心臓中胚葉の分化を誘導する転写因子については明らかにされておらず,この分子機構を解明し分化を誘導する転写因子を同定することにより,遺伝子の発現のみで多能性幹細胞から選択的に心臓中胚葉細胞の分化が可能になると考えた.ダイレクトリプログラミングを応用したスクリーニングにより線維芽細胞から心臓中胚葉細胞の分化を直接的に誘導するTbx6遺伝子を発見し,Tbx6遺伝子をマウスのES細胞あるいはヒトのiPS細胞といった多能性幹細胞に導入することにより,液性因子を使用せずに心臓中胚葉細胞の分化が可能であることが見い出された.さらに,Tbx6遺伝子の発現の期間を調整することにより,同じく中胚葉から分化する骨格筋や軟骨細胞の分化も可能であった.この研究により,Tbx6が心臓だけでなく多能性幹細胞からの中胚葉の分化の全体を制御する重要な転写因子であることが見い出されたとともに,その分子生物学的な機序が明らかにされた.
はじめに
近年,多能性幹細胞から分化させた細胞を用いた再生医療が注目されている.目的の臓器の細胞へと選択的に分化させる手法は発生学の知見を応用しており,中胚葉の分化にはBMPシグナル,Nodal-Activinシグナル,Wntシグナルが重要であって,多能性幹細胞はこれらのシグナルの発現量や発現の時期にもとづき分化の方向性を決定する.しかし,この方法には高価な液性因子や低分子化合物を用いる煩雑な工程が必要であり,発現を制御するだけで中胚葉の分化が可能となるような遺伝子の存在は不明である1-4).さらに,標的となる遺伝子など分子生物学的な機序に関しては不明な点が多い.
この研究において,筆者らは,心臓に対する再生医療の飛躍的な前進のため,液性因子にたよらない,多能性幹細胞からの選択的な心臓中胚葉細胞および心筋細胞への新規の分化法の開発をめざした.幹細胞から心臓中胚葉細胞の分化を誘導する新規のタンパク質を同定し,その遺伝子の発現だけで心臓中胚葉細胞の分化が実現すれば,安定かつ簡便,さらに,安価に心筋細胞の作製が可能になる.その第一歩として,線維芽細胞を用いたダイレクトリプログラミングによるスクリーニングを計画した.
1.ダイレクトリプログラミングによるスクリーニングにより心臓中胚葉細胞の分化を誘導する新規のタンパク質Tbx6を発見した
これまで,液性因子を用いず単一の遺伝子の発現のみで多能性幹細胞から心臓中胚葉細胞の分化が誘導されたとの報告はない.そこで,研究の要となるタンパク質のスクリーニングに関して,候補となる遺伝子をひとつずつ多能性幹細胞に導入する手法は困難であったことから,遺伝子の発現のみで心臓中胚葉細胞の分化を誘導する遺伝子は,細胞種を変えても心臓中胚葉細胞の分化を誘導するであろうと仮説をたてた.これまで,筆者らは,線維芽細胞にレトロウイルスベクターを用いて転写因子を導入し直接的に心筋細胞を作製する心筋細胞ダイレクトリプログラミング法を開発し,心筋細胞に特異的な3つの転写因子が線維芽細胞からiPS細胞をへずに直接に心筋細胞を分化させるリプログラミングタンパク質であることを示していた5,6)(文献5) は 新着論文レビュー でも掲載).そこで,幹細胞と比較して,容易かつ短期間で遺伝子の導入が可能な線維芽細胞を用いてスクリーニングを実施し,線維芽細胞から心臓中胚葉細胞をリプログラミングするタンパク質を同定することにした.結果的に,この方法は多数のタンパク質をスクリーニングする必要があるこの研究においてきわめて有効であった.
中胚葉から分化する最初の臓器が心臓である点に着目し,心臓中胚葉細胞の分化を誘導するタンパク質は中胚葉細胞と心臓中胚葉細胞の両者に発現する遺伝子にコードされているであろうと考えた.そこで,ES細胞から分化させた中胚葉細胞および心臓中胚葉細胞におけるマイクロアレイ法のデータを用いて,これらの時期に特異的に発現し,ノックアウトマウスにおいて心臓の発生の異常あるいは胎生致死の表現型を示す58個の遺伝子を候補として選定した.そして,候補となる遺伝子が導入された58種類のレトロウイルスベクターをマウスの胎仔線維芽細胞に個別に感染させ,遺伝子の過剰発現のみで心臓中胚葉細胞が分化されるかどうか検討した.遺伝子の導入から7日後に,中胚葉細胞および心臓中胚葉細胞に特異的に発現する転写因子であるMesp1のmRNAレベルでの発現を解析したところ,Tbx6遺伝子を導入した線維芽細胞でのみ発現が誘導されていた7).さらに,Mesp1を発現した細胞がGFPにより標識されるマウスから得た胎仔線維芽細胞にTbx6遺伝子を導入したところ,GFP陽性の細胞のコロニーが形成され,Tbx6遺伝子により分化したMesp1を発現する細胞が増殖能をもつことが示された.さらに,この細胞は中胚葉に関連する遺伝子であるT/Brachyury遺伝子を発現し,また,心臓中胚葉のマーカーであるFlk1およびPDGF受容体αを共発現しており,Tbx6遺伝子により線維芽細胞から分化した細胞が心臓中胚葉様の特徴をもつことが判明した1).しかし,この細胞を長期にわたり培養しても拍動する心筋細胞は分化しなかったため,中胚葉,心血管系,非心臓細胞に関連するmRNAの発現の経過を解析した.その結果,Tbx6遺伝子が導入された線維芽細胞は4週間を経過した時点でも中胚葉に関連する遺伝子および心臓前駆細胞に関連する遺伝子の発現が維持されていた一方,より分化した心臓前駆細胞や,筋骨格系などをはじめとする中胚葉に由来するほかの細胞に関連する遺伝子の発現の上昇は認められず,初期中胚葉の状態が維持されていることが示唆された.
2.マウスの初期中胚葉においてTbx6遺伝子を発現する細胞は心臓に関連する遺伝子を共発現する
従来,Tbx6遺伝子は骨格筋や軟骨などの原基となる沿軸中胚葉および体節に関連する遺伝子として認識されていた.マウスにおいては胎生7日目の原始線条においてTbx6遺伝子の発現が確認されている一方,初期中胚葉におけるその役割は明らかではなく,研究の中心は胎生8.5~12.5日の沿軸中胚葉における体節の分化に関するものであった.一方で,Tbx6ノックアウトマウスがTbx6によるSox2の制御機構を欠損することにより,存在するはずの沿軸中胚葉が脊髄になり3本の脊髄をもつ奇妙な表現型を示したことから,Tbx6の中胚葉の分化の全体への関与が示唆されていた8,9).そこで,胎生7.0~7.75日のマウスの生体の中胚葉における1細胞RNA-seq法のデータを用いてTbx6遺伝子を発現する細胞の局在を解析したところ,Tbx6遺伝子は胎生7.0日の初期中胚葉に発現していた.さらに,このTbx6遺伝子を発現する細胞は,初期中胚葉に関連する遺伝子だけでなく,心臓中胚葉や,より心臓にむけ分化した初期心臓前駆細胞に関連する遺伝子を発現することが判明した.しかし,後期心臓前駆細胞に関連する遺伝子は発現しておらず,発現が予想された沿軸中胚葉や体節に関連する遺伝子の発現は明らかではなかった.以上の結果より,初期中胚葉においてTbx6遺伝子は沿軸中胚葉や体節などではなく,心血管系において発現することが明らかにされた.
3.Tbx6遺伝子は多能性幹細胞からの心臓中胚葉細胞および心筋細胞の分化の過程に関与する
生体の初期中胚葉における心臓の発生との関連が明らかにされたTbx6遺伝子が,そののちの心血管系への分化に関してどのような役割をもつのか詳細に解析するため,マウスのES細胞から心筋細胞への分化において遺伝子の発現パターンを解析した.中胚葉に関連する遺伝子であるT遺伝子が発現するとGFPを発現するES細胞を用いて,液性因子によりES細胞から心筋細胞へと分化させたところ,Tbx6遺伝子がほかの中胚葉に関連する遺伝子の発現と同じ時期にGFP陽性の中胚葉細胞に限局して一過性に発現した.Tbx6遺伝子の心血管系の分化への寄与を評価する目的で,CRISPR-Cas9法によりTbx6を欠損したES細胞を作製し液性因子により心筋細胞に分化させたところ,中胚葉細胞および心臓中胚葉細胞への分化が抑制され,心筋細胞の分化の効率は約1/3に抑制された.以上の結果から,多能性幹細胞からの心筋細胞の分化の過程においても中胚葉細胞にTbx6遺伝子が発現し,以降の心筋細胞の分化に重要な役割をもつことが明らかにされた.
4.Tbx6遺伝子の一過性の発現により液性因子を使用せずに心臓中胚葉細胞の分化が誘導された
Tbx6の欠損により心臓中胚葉細胞および心筋細胞への分化が抑制されたことから,Tbx6遺伝子の過剰発現により液性因子を使用せずに多能性幹細胞から心臓中胚葉細胞の分化が誘導されるかどうか検討した.マウスのES細胞においてテトラサイクリンの添加によりTbx6遺伝子の発現を制御する系を確立し,液性因子を使用せずにTbx6遺伝子の発現のみで心臓中胚葉細胞の分化の誘導が可能であるかどうか検討した.その結果,Tbx6遺伝子の発現がない場合は中胚葉細胞へはまったく分化しない一方,液性因子を使用せずとも3日間のTbx6遺伝子の発現により約88%のES細胞が中胚葉細胞へと分化し,この中胚葉細胞の37.5%が心臓中胚葉細胞であった.そののち,約67%の細胞は心筋細胞に分化し,その効率は液性因子による分化よりも良好であった.また,培養条件の変更により,分化した心臓中胚葉細胞から平滑筋細胞や血管内皮細胞など心臓を構成するすべての細胞への分化が確認された.
マイクロアレイ法による遺伝子の発現の網羅的な解析の結果,Tbx6遺伝子の発現により早期からBMPシグナルや心臓の発生に関連する遺伝子の発現が上昇し,経過とともに中胚葉および心血管系の分化に関連するさらに多くの遺伝子の発現が上昇する一方,幹細胞からの中胚葉の分化において抑制される神経の発生にかかわる遺伝子の発現が早期から低下することが明らかにされた.このような中胚葉の分化の機序を解明するため,Mesp1遺伝子に着目して転写因子であるTbx6が直接的に結合する遺伝子を探索した.Mesp1は生体において,あるいは,幹細胞からの中胚葉細胞および心血管系細胞への分化に重要な転写因子であると同時に,線維芽細胞におけるスクリーニングにおいてもTbx6遺伝子により発現が誘導されていた.そこで,ChIP-PCR法によりMesp1遺伝子を解析したところ,Mesp1遺伝子のエンハンサー領域にTbx6の結合が認められ,Tbx6によるMesp1遺伝子への直接的な結合による発現の誘導が明らかにされた.Tbx6の直接の標的となる遺伝子が明らかにされたことでから,心血管系の分化に重要なシグナルであるBMPシグナル,Nodalシグナル,Wntシグナルに注目した.Tbx6による分化の過程においておのおののシグナルを解析したところ,Tbx6遺伝子の発現によりすべてのシグナルが活性化されるなか,とくにBMP4シグナルが分化の早期から活性化されていた.中胚葉の分化においてはBMP4によりNodalおよびWntの発現が誘導されることが知られており,さきのマイクロアレイ法の結果においてもBMPシグナルに関連する遺伝子の発現が分化の早期から上昇したことから,Tbx6の直接の標的となる遺伝子はBMP4遺伝子ではないかと仮定した10).そして,同様のChIP-PCR法による解析により,Tbx6がBMP4遺伝子の発現を直接に誘導することが明らかにされた.このように,ES細胞からの中胚葉細胞への分化において,Tbx6が直接的および間接的な機序により分化を制御することが明らかにされた.
5.Tbx6遺伝子の発現する期間を延長すると心血管系細胞への分化が阻害され筋骨格系細胞が分化する
筋骨格系との関連する知見の多いTbx6遺伝子であるが,その強制発現により多能性幹細胞からの筋骨格系細胞の分化が促進されるかどうかは明らかでなかった.そこで,マウスのES細胞においてテトラサイクリンの添加によりTbx6遺伝子の発現を制御する系において,3日間のTbx6遺伝子の発現により心臓中胚葉細胞が分化したのちもTbx6遺伝子を発現させつづけたところ,心臓中胚葉細胞が減少するとともに,沿軸中胚葉細胞が増加の傾向を示し沿軸中胚葉および体節のマーカー遺伝子の発現が上昇した.分化した沿軸中胚葉細胞を骨格筋の分化,あるいは,軟骨細胞の分化の条件にてそれぞれ培養を継続したところ,骨格筋細胞および軟骨細胞が分化した.このように,Tbx6遺伝子が一過性の発現により心血管系細胞の分化を誘導する一方で,心臓中胚葉細胞が分化したのちもTbx6遺伝子を発現しつづけると筋骨格系細胞への分化が誘導されることが明らかにされた.Tbx6遺伝子の発現する期間の変化による分化の制御機構について解明するため,沿軸中胚葉の分化に関与し,かつ,心臓中胚葉よりあとの心血管系の分化を阻害するWnt3シグナル,および,その下流のタンパク質であるMsx1およびCdx2の遺伝子発現を解析した11).その結果,Tbx6遺伝子の一過性の発現と比較し,持続的な発現によりWnt3遺伝子の発現が誘導され,そののち,Msx1遺伝子およびCdx2遺伝子の発現が誘導された.3日間のTbx6遺伝子の発現により分化させた心臓中胚葉細胞にMsx1遺伝子およびCdx2遺伝子を過剰発現させたところ,心筋細胞の分化が著明に抑制され,Tbx6遺伝子の持続的な発現によるWnt3遺伝子,Msx1遺伝子,Cdx2遺伝子の発現の誘導が心血管系への分化を阻害する機序の一部を担うことが判明した.
6.Tbx6遺伝子の発現による心血管系細胞の分化はヒトのiPS細胞においても保存されている
哺乳類において広く保存されているTbx6遺伝子の初期中胚葉における役割は種をこえて保存されているとの仮説をたてた.マウスとヒトでは幹細胞の発生のステージは異なるが,分化の制御に重要なシグナルは類似することが知られている.ヒトの多能性幹細胞においてTbx6遺伝子による心血管系細胞の分化の誘導について解析するため,液性因子および低分子化合物を用いてヒトのiPS細胞から心筋細胞を分化させた1).その結果,心筋細胞の分化の過程において,マウスのES細胞と同様に,ほかの心臓中胚葉に関連する遺伝子と同じ時期にTbx6遺伝子の一過性の発現の上昇が確認された.マウスのES細胞と同様に,ヒトのiPS細胞においてテトラサイクリンの添加によりTbx6遺伝子の発現を制御する系を確立しTbx6遺伝子の発現する期間について検討した結果,液性因子を使用せずに50%の中胚葉細胞の分化が誘導され,心筋細胞の分化の培養条件において15%の拍動心筋細胞が分化した.さらに,心筋細胞のほかにも平滑筋細胞および血管内皮細胞への分化も確認され,多能性幹細胞におけるTbx6遺伝子による中胚葉細胞および心血管系細胞への分化の制御機構が種をこえてヒトのiPS細胞においても保存されていることが確認された.
おわりに
この研究により,これまで不明であった初期中胚葉の発生および心血管系の分化におけるTbx6の役割が明らかにされた.さらに,Tbx6が心臓だけでなく多能性幹細胞からの中胚葉の分化の全体を制御する重要な転写因子のひとつであることが見い出された(図1).この研究の成果は,さまざまな心臓疾患に対する再生医療への応用だけでなく,Tbx6遺伝子の導入による簡便かつ安価な心筋細胞の作製法の開発など多岐におよぶことが期待される.一方で,現時点ではマウスのES細胞と比較し,ヒトのiPS細胞からの心筋細胞の分化の効率には改善の余地があるが,この発見が心臓の新しい再生医療の実現を前進させる新たな一歩であると考えている.
文 献
- Kattman, S. J., Witty, A. D., Gagliardi, M. et al.: Stage-specific optimization of activin/nodal and BMP signaling promotes cardiac differentiation of mouse and human pluripotent stem cell lines. Cell Stem Cell, 8, 228-240 (2011)[PubMed]
- Loh, K. M., Chen, A., Koh, P. W. et al.: Mapping the pairwise choices leading from pluripotency to human bone, heart, and other mesoderm cell types. Cell, 166, 451-467 (2016)[PubMed]
- Burridge, P. W., Matsa, E., Shukla, P. et al.: Chemically defined generation of human cardiomyocytes. Nat. Methods, 11, 855-860 (2014)[PubMed]
- Lian, X., Hsiao, C., Wilson, G. et al.: Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proc. Natl. Acad. Sci. USA, 109, E1848-E1857 (2012)[PubMed]
- Ieda, M., Fu, J. D., Delgado-Olguin, P. et al.: Direct reprogramming of fibroblasts into functional cardiomyocytes by defined factors. Cell, 142, 375-386 (2010)[PubMed] [新着論文レビュー]
- Sadahiro, T., Yamanaka, S. & Ieda, M.: Direct cardiac reprogramming: progress and challenges in basic biology and clinical applications. Circ. Res., 116, 1378-1391 (2015)[PubMed]
- Saga, Y., Hata, N., Kobayashi, S. et al.: MesP1: a novel basic helix-loop-helix protein expressed in the nascent mesodermal cells during mouse gastrulation. Development, 122, 2769-2778 (1996)[PubMed]
- Chapman, D. L., Agulnik, I., Hancock, S. et al.: Tbx6, a mouse T-Box gene implicated in paraxial mesoderm formation at gastrulation. Dev. Biol., 180, 534-542 (1996)[PubMed]
- Takemoto, T., Uchikawa, M, Yoshida, M. et al.: Tbx6-dependent Sox2 regulation determines neural or mesodermal fate in axial stem cells. Nature, 470, 394-398 (2011)[PubMed] [新着論文レビュー]
- Murry, C. E. & Keller, G.: Differentiation of embryonic stem cells to clinically relevant populations: lessons from embryonic development. Cell, 132, 661-680 (2008)[PubMed]
- Rao, J., Pfeiffer, M. J., Frank, S. et al.: Stepwise clearance of repressive roadblocks drives cardiac induction in human ESCs. Cell Stem Cell, 18, 341-353 (2016)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2015年 慶應義塾大学医学部大学院医学研究科 修了,慶應義塾大学医学部 助教を経て,2018年より筑波大学附属病院 病院講師.
研究テーマ:ダイレクトリプログラミングによる心臓の再生.
関心事:心臓の発生学を応用した心臓の再生および心臓幹細胞の研究.
家田 真樹(Masaki Ieda)
筑波大学医学医療系 教授.
研究室URL:http://www.md.tsukuba.ac.jp/clinical-med/cardiology/index.html
© 2018 貞廣威太郎・家田真樹 Licensed under CC 表示 2.1 日本