ヒトの脊髄神経幹細胞の作製および損傷した脊髄における動態
熊丸浩仁・Mark H. Tuszynski
(米国California大学San Diego校Department of Neurosciences)
email:熊丸浩仁
DOI: 10.7875/first.author.2018.084
Generation and post-injury integration of human spinal cord neural stem cells.
Hiromi Kumamaru, Ken Kadoya, Andrew F. Adler, Yoshio Takashima, Lori Graham, Giovanni Coppola, Mark H. Tuszynski
Nature Methods, 15, 723-731 (2018)
脊髄神経幹細胞は脊髄損傷において断裂した神経回路を再構築する能力をもち,今後の臨床への応用が期待されるが,ヒトの多能性幹細胞から作製する方法は確立されていなかった.この研究において,筆者らは,ヒトの多能性幹細胞から脊髄神経幹細胞の分化を誘導し長期にわたり培養する方法を確立した.この方法により作製された脊髄神経幹細胞はさまざまな介在ニューロンおよび運動ニューロンへと分化する能力をもち,ラットの損傷した脊髄に移植したところ,大部分がニューロンへと分化したのち,多数の軸索を伸ばし宿主のニューロンとシナプスを形成した.さらに,宿主に移植された細胞において大脳皮質運動野の1次運動ニューロンの軸索が再生し,移植された細胞は運動および感覚をつかさどる主要な神経回路のすべてに組み込まれていた.また,脊髄損傷ののちの下肢の運動機能が改善した.ヒトの多能性幹細胞に由来する脊髄神経幹細胞は疾患モデルや薬剤のスクリーニングといった広範囲なin vitroにおける研究のみならず,さまざまな脊髄疾患に対する再生医療における細胞の供給源として臨床への応用が期待される.
哺乳類において,いちど失われた中枢神経は再生しないと長く信じられてきたが,損傷した中枢神経でも微小環境が整えれば再生することが明らかにされ1),神経幹細胞の移植による中枢神経の再生が脚光をあびている.近年,中枢神経の欠損した部位と同様の組織をつくりだす神経幹細胞が神経回路の再構築や軸索の再生に有利にはたらくことが明らかにされ2,3),脊髄損傷や筋萎縮性側索硬化症といった脊髄疾患に対し脊髄の組織をつくりだすことのできるヒトの脊髄神経幹細胞は有益と考えられるが,この細胞を多能性幹細胞から作製し長期にわたり培養する方法は確立されていない.以前に,筆者らは,ヒトの随意運動機能および巧緻運動機能においてもっとも重要とされる大脳皮質運動野の1次運動ニューロンの軸索は,脊髄に由来する神経幹細胞においては再生するものの,脳に由来する神経幹細胞においては再生しないことを明らかにしたが2),その際に使用した細胞は胎児の脊髄から作製されたものであり,細胞療法を臨床へと応用するためには細胞の供給源および倫理的な問題を解決する必要がある.
これまで,脳および脊髄を含む中枢神経の組織はすべて同じ細胞から発生すると考えられていたが,近年の発生学の進歩により,脳および脊髄は異なる場所および異なる細胞から発生し4),脳神経幹細胞は頭側に位置するSOX2陽性PAX陽性の神経上皮前駆細胞,脊髄神経幹細胞は尾側に位置するSOX2陽性TBXT陽性の神経中胚葉前駆細胞から発生することが明らかにされた4,5).多能性幹細胞から通常のプロトコールにより作製される神経幹細胞は脳の細胞であり,これまで,脊髄の細胞を得るためにレチノイン酸による脳神経幹細胞の尾側化が行われてきた.しかしながら,レチノイン酸は脳幹から上位の頚髄に発現するHOX1遺伝子~HOX5遺伝子のみしか発現させることができず6),高濃度のレチノイン酸の処理により脊髄の細胞を得ることは可能であったが,大部分は脳幹までしか尾側化されず,純粋な脊髄の細胞の培養ではなかった.それに比べ,WNTシグナルおよびFGFシグナルは脊髄の前駆細胞である神経中胚葉前駆細胞の発生に必要不可欠であり,さらに,この細胞から発生する神経幹細胞は脊髄に特異的に発現するHOX6遺伝子~HOX13遺伝子を発現しており,頚髄から腰髄の脊髄組織へと分化する5).
この研究において,筆者らは,WNTシグナルおよびFGFシグナルの活性化とSMADシグナルの二重阻害7) とを組み合わせることにより,ヒトの多能性幹細胞から神経中胚葉前駆細胞を経由した脊髄幹細胞の分化を誘導し,さらに,この細胞を長期にわたり培養することに成功した.
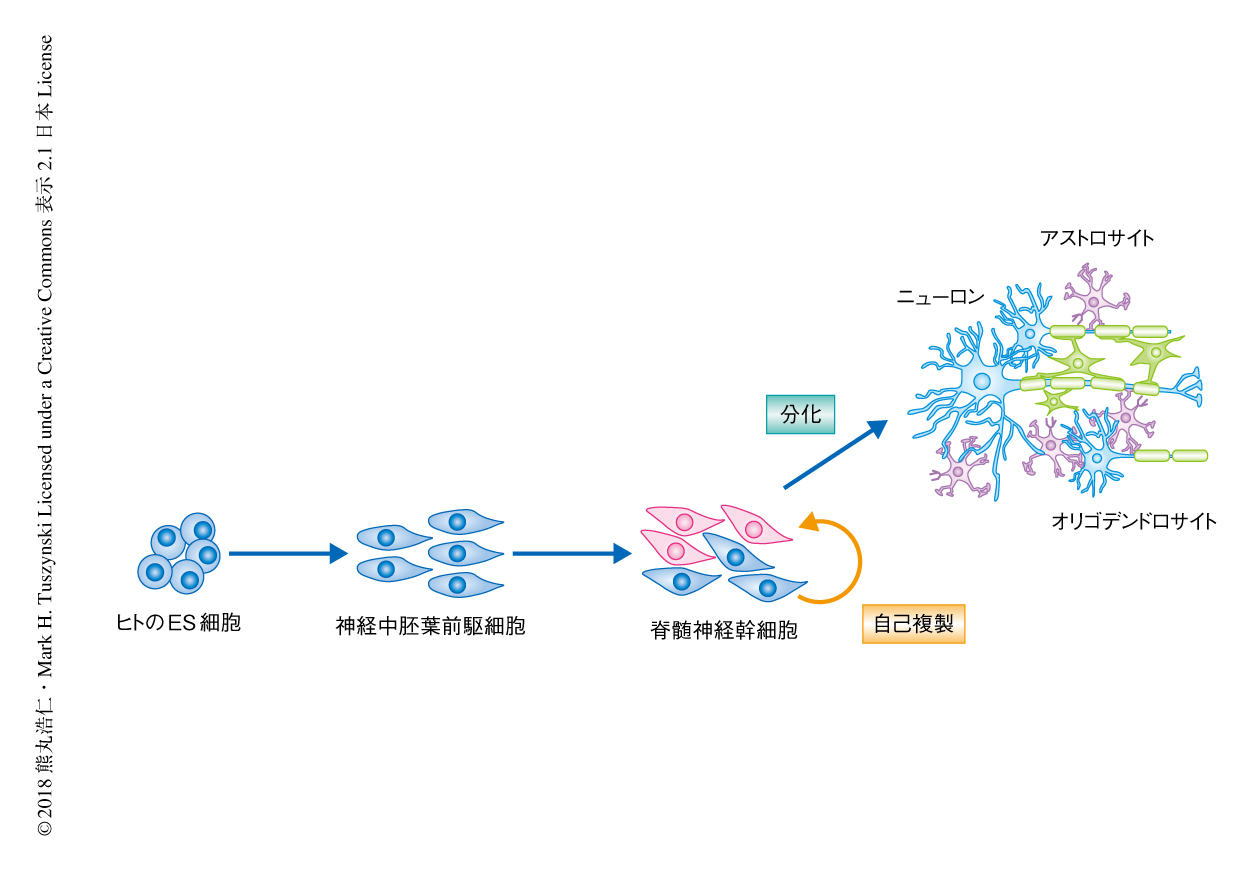
単層培養されたヒトのES細胞を,脊髄幹細胞の分化を誘導する培地としてBMPシグナル阻害剤,アクチビンシグナルおよびTGFβシグナル阻害剤,WNTシグナルの促進作用をもつGSK3β阻害剤,FGF2,FGF8,Notchシグナルの阻害作用をもつγセクレターゼの阻害剤を含む培地にて培養したところ,3日目には神経中胚葉前駆細胞に分化し,10日目には90%以上が脊髄神経幹細胞に分化した(図1).これらの細胞は脊髄に特異的に発現するHOX6遺伝子~HOX9遺伝子を発現していたが,神経上皮前駆細胞のマーカー遺伝子や前脳のマーカー遺伝子の発現は認められず,中胚葉系の細胞や内肺葉系の細胞など,ほかの系統の細胞のマーカー遺伝子の有意な発現の上昇もみられなかった.
脊髄損傷に対し細胞療法を応用するためには,損傷した脊髄の空洞という過酷な環境にて生存できること,および,その巨大な空洞を充填するだけの十分な量の細胞を確保することが必要である.その目的において,幹細胞の増殖能および分化能の維持は非常に重要な課題である.脊髄の発生においてWNTシグナルおよびSHHシグナルは細胞分裂の促進にはたらき,アクチビンシグナルおよびTGFβシグナルは中胚葉系の細胞の分化および維持に中心的な役割をはたすことが知られている.そこで,WNTシグナルおよびSHHシグナルの活性化およびアクチビンシグナルおよびTGFβシグナルの阻害により,高純度の脊髄神経幹細胞を長期にわたり培養できるのではないかと考えた.脊髄幹細胞の分化を誘導する培地における培養の10日目に,維持培地としてアクチビンシグナルおよびTGFβシグナルの阻害剤,WNTシグナルの促進作用をもつGSK3β阻害剤,SHHのアゴニストを含む培地に変更した.その結果,脊髄神経幹細胞は増殖能および分化能をもったまま6カ月以上にわたり継代された(図1).WNTシグナルの活性化は中胚葉の分化を誘導するとされているが,中胚葉のマーカー遺伝子の発現は認められず,培養の初期からの持続的なアクチビンシグナルおよびTGFβシグナルの阻害により中胚葉の分化は抑制されることが確認された8).さらに,RNA-seq法により遺伝子の発現を網羅的に解析した結果,これらの細胞は神経幹細胞のマーカー遺伝子および脊髄に特異的に発現するHOX遺伝子を強く発現していたものの,前脳,多能性細胞,中肺葉系の細胞,神経堤細胞などのマーカー遺伝子の発現は認められず,さらに,階層的クラスタリング解析により胎児に由来する脊髄幹細胞に非常に近い性質をもつことが示された.
ほぼ同様の結果は,ほかのヒトのES細胞,および,ヒトのiPS細胞からも得られ,再現性が確認された.
脊髄損傷により神経回路は断裂し脳と損傷より遠位とのあいだで電気信号の伝達が絶たれ運動および知覚は障害される.完全な損傷の場合には損傷より遠位の運動機能および感覚機能は完全に失われ,臨床の現場においても効果的な治療法は存在しない.細胞療法の目的のひとつは,この断裂した神経回路を移植された細胞に由来する介在ニューロンによりリレーさせ失われた電気伝達をとりもどすことである.ヒトのES細胞に由来する脊髄神経幹細胞の損傷した脊髄における生着および分化能を解析するため,脊髄損傷から2週間のちに脊髄神経幹細胞を損傷した脊髄の空洞に移植した.その結果,移植された細胞は空洞を充填し,移植から6カ月のちまでにニューロン,アストロサイト,オリゴデンドロサイトに分化した(図1).移植された細胞の約80%は介在ニューロンあるいは運動ニューロンへと分化し,損傷より遠位に多数の軸索を伸ばし,さらに,免疫電子顕微鏡法により宿主のニューロンと多数のシナプスを形成することが確認された.
移植された細胞とシナプスを介して接続した宿主のニューロンを網羅的に同定するため,G遺伝子欠損狂犬病ウイルスを用いて移植された細胞から逆行性の標識を行った.そのため,GFP,TVA受容体,Gタンパク質を発現したヒトのES細胞に由来する脊髄神経幹細胞を作製し,損傷した脊髄に移植したのち,G遺伝子欠損狂犬病ウイルスを注入した9,10).G遺伝子欠損狂犬病ウイルスが細胞に感染するにはTVA受容体が必要であり,宿主のニューロンはTVA受容体をもたないため,G遺伝子欠損狂犬病ウイルスはTVA受容体を発現する移植された細胞に選択的に感染する(1次感染).また,G遺伝子欠損狂犬病ウイルスが前シナプス細胞に感染するにはGタンパク質が必要であるが,宿主のニューロンはGタンパク質をもたないため,Gタンパク質をもつ移植された細胞から宿主のニューロンへは感染(2次感染)するが,宿主のニューロンから宿主のニューロンへの感染(3次感染)は起こらず,そのため,移植された細胞に単シナプス的に接続した宿主のニューロンが選択的に標識される9).その結果,移植された細胞から逆行性に標識された宿主のニューロンは,大脳運動野の1次運動ニューロン,脳幹から脊髄に投射する神経核のニューロン,頚髄から腰髄を含む脊髄の全体の介在ニューロン,後根神経節の感覚ニューロンであり,これらの宿主のニューロンが移植された細胞と直接にシナプスを形成し,移植された細胞は運動および感覚をつかさどる主要な神経回路のすべてに組み込まれることが明らかにされた.
以前に,筆者らは,ヒトの随意運動機能および巧緻運動機能をつかさどるもっとも重要な神経回路である皮質脊髄路は,移植された脳神経幹細胞においては再生しないが,脊髄神経幹細胞においては再生することを明らかにした2).そこで,さらに脳神経幹細胞,脳幹神経幹細胞,脊髄神経幹細胞を同一のヒトのES細胞から作製し,これらの皮質脊髄路への再生能を比較した.その結果,皮質脊髄路は脳神経幹細胞においては再生せず,脳幹神経幹細胞においては少量の再生が認められたのに対し,脊髄神経幹細胞においては多数の皮質脊髄路が再生した.現在,皮質脊髄路の再生をひき起こす細胞は脊髄神経幹細胞だけであり,この結果から,ヒトのES細胞に由来する脊髄神経幹細胞は脊髄の性質をもつことが示されるとともに,この細胞の再生医療における有用性が示された.
ヒトの脊髄損傷にもっとも近いとされる圧座損傷をラットの第10胸髄にコンピューターによる制御のもと作製し,ヒトのES細胞に由来する脊髄神経幹細胞を移植した.その結果,対照と比べ,下肢運動機能評価法および自動歩行解析系の2種類の解析において下肢の運動機能の有意な回復が認められた.
この研究において,筆者らは,ヒトの多能性幹細胞から脊髄神経幹細胞の分化を誘導し長期にわたり培養する方法を確立した.この方法により作製された脊髄神経幹細胞は,in vitroにおいてこれまで同定されているすべての介在ニューロン,運動ニューロン,グリア細胞に分化する能力をもち,疾患モデルや薬剤のスクリーニングといった広範囲なin vitroにおける研究への応用が期待される.さらに,損傷した脊髄という非常に過酷な環境においても生存かつ分化し,宿主の軸索の再生および神経回路の再構築を可能にしたことから,さまざまな脊髄疾患に対する将来的な再生医療における主要な細胞源としての応用が期待される.
略歴:2012年 九州大学大学院医学系学府 修了,2014年より米国California大学San Diego校Postdoctoral fellow.
Mark H. Tuszynski
米国California大学San Diego校Professor.
研究室URL:https://neurosciences.ucsd.edu/CENTERS/NEURAL-REPAIR/Pages/default.aspx
© 2018 熊丸浩仁・Mark H. Tuszynski Licensed under CC 表示 2.1 日本
(米国California大学San Diego校Department of Neurosciences)
email:熊丸浩仁
DOI: 10.7875/first.author.2018.084
Generation and post-injury integration of human spinal cord neural stem cells.
Hiromi Kumamaru, Ken Kadoya, Andrew F. Adler, Yoshio Takashima, Lori Graham, Giovanni Coppola, Mark H. Tuszynski
Nature Methods, 15, 723-731 (2018)
要 約
脊髄神経幹細胞は脊髄損傷において断裂した神経回路を再構築する能力をもち,今後の臨床への応用が期待されるが,ヒトの多能性幹細胞から作製する方法は確立されていなかった.この研究において,筆者らは,ヒトの多能性幹細胞から脊髄神経幹細胞の分化を誘導し長期にわたり培養する方法を確立した.この方法により作製された脊髄神経幹細胞はさまざまな介在ニューロンおよび運動ニューロンへと分化する能力をもち,ラットの損傷した脊髄に移植したところ,大部分がニューロンへと分化したのち,多数の軸索を伸ばし宿主のニューロンとシナプスを形成した.さらに,宿主に移植された細胞において大脳皮質運動野の1次運動ニューロンの軸索が再生し,移植された細胞は運動および感覚をつかさどる主要な神経回路のすべてに組み込まれていた.また,脊髄損傷ののちの下肢の運動機能が改善した.ヒトの多能性幹細胞に由来する脊髄神経幹細胞は疾患モデルや薬剤のスクリーニングといった広範囲なin vitroにおける研究のみならず,さまざまな脊髄疾患に対する再生医療における細胞の供給源として臨床への応用が期待される.
はじめに
哺乳類において,いちど失われた中枢神経は再生しないと長く信じられてきたが,損傷した中枢神経でも微小環境が整えれば再生することが明らかにされ1),神経幹細胞の移植による中枢神経の再生が脚光をあびている.近年,中枢神経の欠損した部位と同様の組織をつくりだす神経幹細胞が神経回路の再構築や軸索の再生に有利にはたらくことが明らかにされ2,3),脊髄損傷や筋萎縮性側索硬化症といった脊髄疾患に対し脊髄の組織をつくりだすことのできるヒトの脊髄神経幹細胞は有益と考えられるが,この細胞を多能性幹細胞から作製し長期にわたり培養する方法は確立されていない.以前に,筆者らは,ヒトの随意運動機能および巧緻運動機能においてもっとも重要とされる大脳皮質運動野の1次運動ニューロンの軸索は,脊髄に由来する神経幹細胞においては再生するものの,脳に由来する神経幹細胞においては再生しないことを明らかにしたが2),その際に使用した細胞は胎児の脊髄から作製されたものであり,細胞療法を臨床へと応用するためには細胞の供給源および倫理的な問題を解決する必要がある.
これまで,脳および脊髄を含む中枢神経の組織はすべて同じ細胞から発生すると考えられていたが,近年の発生学の進歩により,脳および脊髄は異なる場所および異なる細胞から発生し4),脳神経幹細胞は頭側に位置するSOX2陽性PAX陽性の神経上皮前駆細胞,脊髄神経幹細胞は尾側に位置するSOX2陽性TBXT陽性の神経中胚葉前駆細胞から発生することが明らかにされた4,5).多能性幹細胞から通常のプロトコールにより作製される神経幹細胞は脳の細胞であり,これまで,脊髄の細胞を得るためにレチノイン酸による脳神経幹細胞の尾側化が行われてきた.しかしながら,レチノイン酸は脳幹から上位の頚髄に発現するHOX1遺伝子~HOX5遺伝子のみしか発現させることができず6),高濃度のレチノイン酸の処理により脊髄の細胞を得ることは可能であったが,大部分は脳幹までしか尾側化されず,純粋な脊髄の細胞の培養ではなかった.それに比べ,WNTシグナルおよびFGFシグナルは脊髄の前駆細胞である神経中胚葉前駆細胞の発生に必要不可欠であり,さらに,この細胞から発生する神経幹細胞は脊髄に特異的に発現するHOX6遺伝子~HOX13遺伝子を発現しており,頚髄から腰髄の脊髄組織へと分化する5).
この研究において,筆者らは,WNTシグナルおよびFGFシグナルの活性化とSMADシグナルの二重阻害7) とを組み合わせることにより,ヒトの多能性幹細胞から神経中胚葉前駆細胞を経由した脊髄幹細胞の分化を誘導し,さらに,この細胞を長期にわたり培養することに成功した.
1.ヒトのES細胞からの脊髄神経幹細胞の分化の誘導
単層培養されたヒトのES細胞を,脊髄幹細胞の分化を誘導する培地としてBMPシグナル阻害剤,アクチビンシグナルおよびTGFβシグナル阻害剤,WNTシグナルの促進作用をもつGSK3β阻害剤,FGF2,FGF8,Notchシグナルの阻害作用をもつγセクレターゼの阻害剤を含む培地にて培養したところ,3日目には神経中胚葉前駆細胞に分化し,10日目には90%以上が脊髄神経幹細胞に分化した(図1).これらの細胞は脊髄に特異的に発現するHOX6遺伝子~HOX9遺伝子を発現していたが,神経上皮前駆細胞のマーカー遺伝子や前脳のマーカー遺伝子の発現は認められず,中胚葉系の細胞や内肺葉系の細胞など,ほかの系統の細胞のマーカー遺伝子の有意な発現の上昇もみられなかった.
2.ヒトのES細胞に由来する脊髄神経幹細胞の長期にわたる培養
脊髄損傷に対し細胞療法を応用するためには,損傷した脊髄の空洞という過酷な環境にて生存できること,および,その巨大な空洞を充填するだけの十分な量の細胞を確保することが必要である.その目的において,幹細胞の増殖能および分化能の維持は非常に重要な課題である.脊髄の発生においてWNTシグナルおよびSHHシグナルは細胞分裂の促進にはたらき,アクチビンシグナルおよびTGFβシグナルは中胚葉系の細胞の分化および維持に中心的な役割をはたすことが知られている.そこで,WNTシグナルおよびSHHシグナルの活性化およびアクチビンシグナルおよびTGFβシグナルの阻害により,高純度の脊髄神経幹細胞を長期にわたり培養できるのではないかと考えた.脊髄幹細胞の分化を誘導する培地における培養の10日目に,維持培地としてアクチビンシグナルおよびTGFβシグナルの阻害剤,WNTシグナルの促進作用をもつGSK3β阻害剤,SHHのアゴニストを含む培地に変更した.その結果,脊髄神経幹細胞は増殖能および分化能をもったまま6カ月以上にわたり継代された(図1).WNTシグナルの活性化は中胚葉の分化を誘導するとされているが,中胚葉のマーカー遺伝子の発現は認められず,培養の初期からの持続的なアクチビンシグナルおよびTGFβシグナルの阻害により中胚葉の分化は抑制されることが確認された8).さらに,RNA-seq法により遺伝子の発現を網羅的に解析した結果,これらの細胞は神経幹細胞のマーカー遺伝子および脊髄に特異的に発現するHOX遺伝子を強く発現していたものの,前脳,多能性細胞,中肺葉系の細胞,神経堤細胞などのマーカー遺伝子の発現は認められず,さらに,階層的クラスタリング解析により胎児に由来する脊髄幹細胞に非常に近い性質をもつことが示された.
ほぼ同様の結果は,ほかのヒトのES細胞,および,ヒトのiPS細胞からも得られ,再現性が確認された.
3.ヒトのES細胞に由来する脊髄神経幹細胞の損傷した脊髄における生着およびシナプスの形成
脊髄損傷により神経回路は断裂し脳と損傷より遠位とのあいだで電気信号の伝達が絶たれ運動および知覚は障害される.完全な損傷の場合には損傷より遠位の運動機能および感覚機能は完全に失われ,臨床の現場においても効果的な治療法は存在しない.細胞療法の目的のひとつは,この断裂した神経回路を移植された細胞に由来する介在ニューロンによりリレーさせ失われた電気伝達をとりもどすことである.ヒトのES細胞に由来する脊髄神経幹細胞の損傷した脊髄における生着および分化能を解析するため,脊髄損傷から2週間のちに脊髄神経幹細胞を損傷した脊髄の空洞に移植した.その結果,移植された細胞は空洞を充填し,移植から6カ月のちまでにニューロン,アストロサイト,オリゴデンドロサイトに分化した(図1).移植された細胞の約80%は介在ニューロンあるいは運動ニューロンへと分化し,損傷より遠位に多数の軸索を伸ばし,さらに,免疫電子顕微鏡法により宿主のニューロンと多数のシナプスを形成することが確認された.
移植された細胞とシナプスを介して接続した宿主のニューロンを網羅的に同定するため,G遺伝子欠損狂犬病ウイルスを用いて移植された細胞から逆行性の標識を行った.そのため,GFP,TVA受容体,Gタンパク質を発現したヒトのES細胞に由来する脊髄神経幹細胞を作製し,損傷した脊髄に移植したのち,G遺伝子欠損狂犬病ウイルスを注入した9,10).G遺伝子欠損狂犬病ウイルスが細胞に感染するにはTVA受容体が必要であり,宿主のニューロンはTVA受容体をもたないため,G遺伝子欠損狂犬病ウイルスはTVA受容体を発現する移植された細胞に選択的に感染する(1次感染).また,G遺伝子欠損狂犬病ウイルスが前シナプス細胞に感染するにはGタンパク質が必要であるが,宿主のニューロンはGタンパク質をもたないため,Gタンパク質をもつ移植された細胞から宿主のニューロンへは感染(2次感染)するが,宿主のニューロンから宿主のニューロンへの感染(3次感染)は起こらず,そのため,移植された細胞に単シナプス的に接続した宿主のニューロンが選択的に標識される9).その結果,移植された細胞から逆行性に標識された宿主のニューロンは,大脳運動野の1次運動ニューロン,脳幹から脊髄に投射する神経核のニューロン,頚髄から腰髄を含む脊髄の全体の介在ニューロン,後根神経節の感覚ニューロンであり,これらの宿主のニューロンが移植された細胞と直接にシナプスを形成し,移植された細胞は運動および感覚をつかさどる主要な神経回路のすべてに組み込まれることが明らかにされた.
4.ヒトのES細胞に由来する脊髄神経幹細胞による皮質脊髄路の再生
以前に,筆者らは,ヒトの随意運動機能および巧緻運動機能をつかさどるもっとも重要な神経回路である皮質脊髄路は,移植された脳神経幹細胞においては再生しないが,脊髄神経幹細胞においては再生することを明らかにした2).そこで,さらに脳神経幹細胞,脳幹神経幹細胞,脊髄神経幹細胞を同一のヒトのES細胞から作製し,これらの皮質脊髄路への再生能を比較した.その結果,皮質脊髄路は脳神経幹細胞においては再生せず,脳幹神経幹細胞においては少量の再生が認められたのに対し,脊髄神経幹細胞においては多数の皮質脊髄路が再生した.現在,皮質脊髄路の再生をひき起こす細胞は脊髄神経幹細胞だけであり,この結果から,ヒトのES細胞に由来する脊髄神経幹細胞は脊髄の性質をもつことが示されるとともに,この細胞の再生医療における有用性が示された.
5.ヒトのES細胞に由来する脊髄神経幹細胞による脊髄損傷ののちの下肢の運動機能の改善
ヒトの脊髄損傷にもっとも近いとされる圧座損傷をラットの第10胸髄にコンピューターによる制御のもと作製し,ヒトのES細胞に由来する脊髄神経幹細胞を移植した.その結果,対照と比べ,下肢運動機能評価法および自動歩行解析系の2種類の解析において下肢の運動機能の有意な回復が認められた.
おわりに
この研究において,筆者らは,ヒトの多能性幹細胞から脊髄神経幹細胞の分化を誘導し長期にわたり培養する方法を確立した.この方法により作製された脊髄神経幹細胞は,in vitroにおいてこれまで同定されているすべての介在ニューロン,運動ニューロン,グリア細胞に分化する能力をもち,疾患モデルや薬剤のスクリーニングといった広範囲なin vitroにおける研究への応用が期待される.さらに,損傷した脊髄という非常に過酷な環境においても生存かつ分化し,宿主の軸索の再生および神経回路の再構築を可能にしたことから,さまざまな脊髄疾患に対する将来的な再生医療における主要な細胞源としての応用が期待される.
文 献
- Lu, P., Wang, Y., Graham, L. et al.: Long-distance growth and connectivity of neural stem cells after severe spinal cord injury. Cell, 150, 1264-1273 (2012)[PubMed]
- Kadoya, K., Lu, P., Nguyen, K. et al.: Spinal cord reconstitution with homologous neural grafts enables robust corticospinal regeneration. Nat. Med., 22, 479-487 (2016)[PubMed]
- Ma, L. X., Hu, B., Liu, Y. et al.: Human embryonic stem cell-derived GABA neurons correct locomotion deficits in quinolinic acid-lesioned mice. Cell Stem Cell, 10, 455-464 (2012)[PubMed]
- Henrique, D., Abranches, E., Verrier, L. et al.: Neuromesodermal progenitors and the making of the spinal cord. Development, 142, 2864-2875 (2015)[PubMed]
- Gouti, M., Metzis, V. & Briscoe, J.: The route to spinal cord cell types: a tale of signals and switches. Trends Genet., 31, 282-289 (2015)[PubMed]
- Mazzoni, E. O., Mahony, S., Peljto, M. et al.: Saltatory remodeling of Hox chromatin in response to rostrocaudal patterning signals. Nat. Neurosci., 16, 1191-1198 (2013)[PubMed]
- Chambers, S. M., Fasano, C. A., Papapetrou, E. P. et al.: Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nat. Biotechnol., 27, 485-485 (2009)[PubMed]
- Takemoto, T., Uchikawa, M., Yoshida, M. et al.: Tbx6-dependent Sox2 regulation determines neural or mesodermal fate in axial stem cells. Nature, 470, 394-398 (2011)[PubMed] [新着論文レビュー]
- Callaway, E. M. & Luo, L. Q.: Monosynaptic circuit tracing with glycoprotein-deleted rabies viruses. J. Neurosci., 35, 8979-8985 (2015)[PubMed]
- Adler, A. F., Lee-Kubli, C., Kumamaru, H. et al.: Comprehensive monosynaptic rabies virus mapping of host connectivity with neural progenitor grafts after spinal cord injury. Stem Cell Rep., 8, 1525-1533 (2017)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2012年 九州大学大学院医学系学府 修了,2014年より米国California大学San Diego校Postdoctoral fellow.
Mark H. Tuszynski
米国California大学San Diego校Professor.
研究室URL:https://neurosciences.ucsd.edu/CENTERS/NEURAL-REPAIR/Pages/default.aspx
© 2018 熊丸浩仁・Mark H. Tuszynski Licensed under CC 表示 2.1 日本