miR-310クラスターはショウジョウバエの筋接合部におけるシナプス強度を抑制的に制御する
鶴留 一也
(カナダMcGill大学Department of Physiology)
email:鶴留一也
DOI: 10.7875/first.author.2011.009
The Drosophila miR-310 cluster negatively regulates synaptic strength at the neuromuscular junction.
Kazuya Tsurudome, Karen Tsang, Edward H. Liao, Robin Ball, Jay Penney, Jr-Shiuan Yang, Fatima Elazzouzi, Tao He, Athar Chishti, Greg Lnenicka, Eric C. Lai, A. Pejmun Haghighi
Neuron, 68, 879-893 (2010)
ニューロンにおいてほかの細胞との情報の伝達部位であるシナプスの形成および機能の制御機構は,神経回路を構築し情報処理を行ううえで欠かせない本質的な性質である.形成されたシナプスにおいて,シナプス後細胞に適当な大きさの反応をひき起こすためにシナプス前細胞からの神経伝達物質の放出量を制御する機構は,その重要性にもかかわらずいまだその全容は解明されていない.この論文で筆者らは,遺伝子スクリーニングにより神経伝達物質の放出量の制御にかかわる新規の遺伝子を特定した.この遺伝子にはmiR-310からmiR-313の4つのマイクロRNAが含まれており,これらmiR-310クラスターがKhc-73の発現を抑制することにより神経伝達物質の放出量を抑制的に制御していることを示した.さらに,シナプス後細胞の神経伝達物質の放出に対する反応が通常より小さくなった場合にはmiR-310クラスターのはたらきを弱めることによって神経伝達物質の放出量を増加させ,シナプスの伝達強度を補償していることを明らかにした.これらの結果は,マイクロRNAがシナプスの機能制御においても重要な役割を担っている可能性を示唆した.
マイクロRNA(microRNA:miRNA)は線虫においてその機能が発見されて以来1),詳細な作用機序やさまざまな生物種また組織における多彩な役割が明らかにされてきており,生命現象の解明においてその重要性をますます高めつつある2).ニューロンのシナプス形成においてもその形態的な制御にマイクロRNAの関与が示されているが3),シナプス伝達物質の放出の制御にどのようにかかわっているかについては不明な点が多い.
ショウジョウバエ幼虫の筋接合部についてはシナプスの形態と機能における恒常性の維持機構のモデルとして多くの研究が行われている4).筋接合部シナプスではおもにグルタミン酸が神経伝達物質として放出されており,シナプス後細胞に存在するグルタミン酸作動性チャネルがシナプス伝達を介在している.グルタミン酸作動性チャネルのサブユニットをコードする遺伝子のうちGluRIIA遺伝子に変異が起こるとこのチャネルを介したシナプス伝達は大きく阻害をうけ,同じ量のグルタミン酸の放出に対しておよそ半分の反応(膜電位の上昇)しか示さなくなる.ところが,GluRIIA変異体の神経伝達物質の放出を調べたところ,放出量を増加することによってシナプス後細胞における反応を補償するというシナプス機能の恒常性の維持機構のはたらいていることが発見された5).今日にいたるまで,この恒常性の維持機構にかかわるさまざまな分子が同定されまた検証されてきたが4,6,7),神経伝達物質の放出を制御する機構の全容はいまだ解明にはいたっていない.
この研究では,データベースの解析によりおもにマイクロRNAをコードしていると推測された遺伝子領域について,遺伝学的なスクリーニングにより神経伝達物質の放出の制御にかかわる遺伝子の同定を試みた.
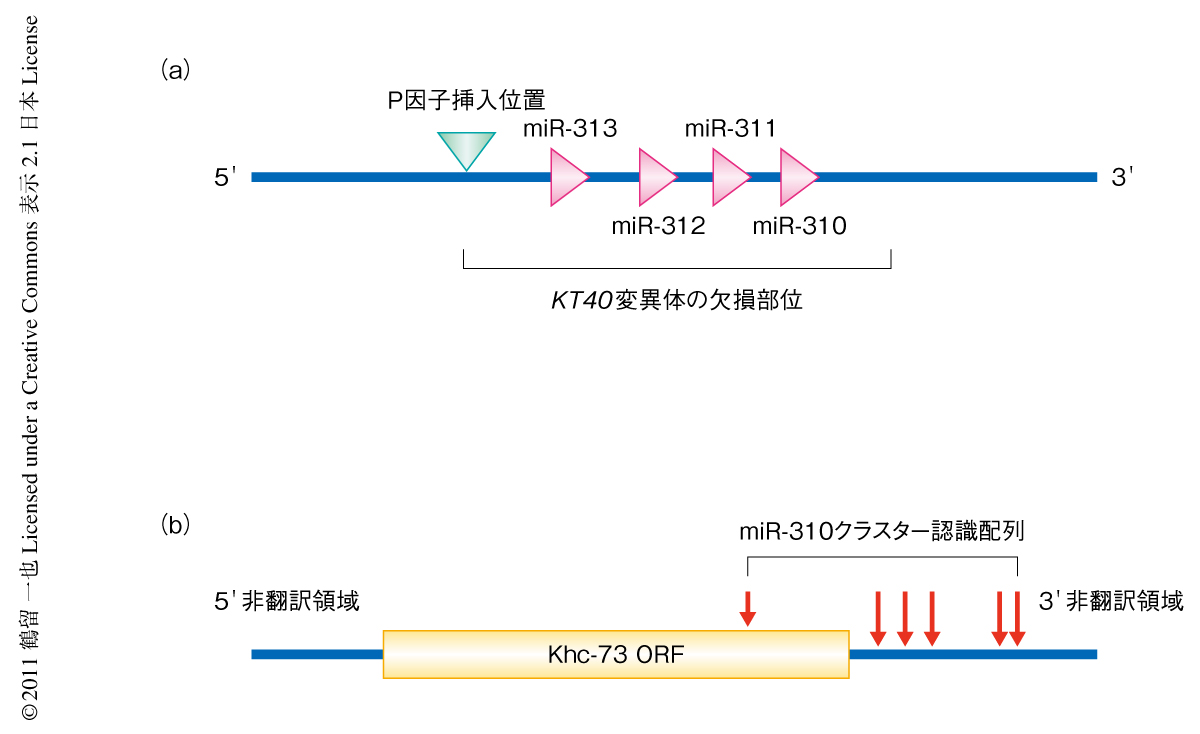
筆者らは,ショウジョウバエにおける遺伝学的なスクリーニングによって,遺伝子産物が発達段階のニューロンにおいて特異的に発現するような遺伝子を見い出した.この遺伝子にはmiR-310,miR-311,miR-312,miR-313の4つのマイクロRNAが含まれており,これら4つをまとめてmiR-310クラスターとよぶ(図1a).このmiR-310クラスターの神経伝達物質の放出に対する影響を調べるため,まずmiR-310クラスターの欠損変異体を作製し3令幼虫の筋接合部シナプスにおいて電気生理学的な手法により神経伝達物質の放出量を測定した.その結果,miR-310クラスター欠損変異体では神経伝達物質の放出量が野生型に比べ有意に増加していることが明らかになった.これは,シナプス前細胞(運動ニューロン)において特異的にmiR-310クラスターを発現させることにより回復した.このことから,miR-310クラスターの前シナプス細胞における活動が正常な神経伝達物質の放出量の制御に必要であることが示唆された.
マイクロRNAの理論的な標的遺伝子は数百に及ぶこともめずらしくなく,ひとつのマイクロRNAの生体における影響を調べるのは非常に困難であると予想される2).しかし近年の報告では,特定のマイクロRNAの変異によりひき起こされる表現型はひとつか非常に少数の標的遺伝子に帰結することが示されている8).miR-310クラスターには最大で350の標的遺伝子の候補があった.認識配列の数や保存の度合いを指標とするマイクロRNA標的遺伝子の検索において上位にランクされた遺伝子のうち,miR-310クラスターが発現する発達段階のニューロンではたらいていると考えられる3つの遺伝子,crebA遺伝子,lap遺伝子,khc-73遺伝子について検討した.遺伝的な相互作用実験により3つの遺伝子のうちkhc-73遺伝子だけがmiR-310クラスター欠損変異体における神経伝達物質の過剰放出を抑制することが示された.さらに,miR-310クラスター欠損変異体では野生型に比べKhc-73タンパク質の発現量の増加していることが明らかになった.Khc-73の発現をRNAi法によりノックダウンしたところmiR-310クラスター欠損変異体における神経伝達物質の過剰放出も抑制された.これらの結果から,Khc-73の発現量の増加が神経伝達物質の放出量の増加に必要であることが示唆された.このことは,野生型においてKhc-73をニューロンで過剰発現させると神経伝達物質の過剰放出の起こることからも確認された.
Khc-73をコードするmRNAは3’側非翻訳領域に5つのmiR-310クラスター認識配列をもっていた(図1b).そこで,Khc-73をコードするmRNAから3’側非翻訳領域を取り除いたものをニューロンにおいて発現させたところ,miR-310クラスターによるKhc-73発現の抑制効果は激減したものの完全には消失しなかった.そこで,あらためてkhc-73遺伝子の構造を解析したところ,タンパク質をコードするORFにおいて1つのmiR-310クラスター認識配列を発見した.この認識配列に含まれる塩基配列のうち2つの塩基をコードするアミノ酸の変わらないよう変異させ認識配列を無効化したところ,miR-310クラスターの影響は完全に消失しKhc-73は発現抑制をうけなくなった.このことから,Khc-73タンパク質がなんらかの制御をうけているのではなく,Khc-73をコードするmRNAが複数の認識部位においてmiR-310クラスターのはたらきをうけることで発現抑制の起こっていることが確認された.またこの結果は,3’側非翻訳領域にかぎらずORFに存在するマイクロRNA認識配列も生体において実際にマイクロRNAの標的となりうるという具体的な証拠を提示した.
khc-73遺伝子がmiR-310クラスターによって制御される標的遺伝子であることがわかったが,Khc-73はどのように神経伝達物質の放出量の増加に寄与しているのであろうか? Khc-73の属するKinesinファミリーはモータータンパク質として軸索でもさまざまな分子を輸送していることが知られており9),その機能が阻害されるとシナプスの成長に必要な分子が輸送されずシナプスの構造や機能に障害をもたらす10).したがって,miR-310クラスターの欠失がシナプスを形成する分子の分布に影響を及ぼしている可能性を考え,miR-310クラスター欠損変異体の運動ニューロンの軸索末端を免疫染色法により調べた.多くの分子については野生型と変わりなかったものの,神経伝達物質の放出にかかわりのある活性帯(active zone)の関連遺伝子であるbruchpilot 11)(brp)のタンパク質レベルが有意に増加していることを発見した.この増加したBrpはmiR-310クラスター欠損変異体で増加しているKhc-73をRNAi法でノックダウンすると野生型のレベルまでもどることが確認された.さらに,Brpをニューロンにおいて過剰発現させるとKhc-73の過剰発現やmiR-310クラスター欠損変異体と同様に神経伝達物質の過剰放出が起こった.Brpの過剰発現とkhc-73遺伝子,そして,miR-310クラスター欠損変異体とbrp遺伝子とのあいだにはそれぞれ遺伝的な相互作用が認められ,miR-310クラスター,khc-73遺伝子,そして,brp遺伝子は互いに遺伝子レベルで密接な関係をもつことが示された.
Brpは電子顕微鏡で観察される活性帯に関連した高電子密度の構造体(T-bar)の形成に関与しているとされる11).miR-310クラスター欠損変異体,および,Khc-73をニューロンに過剰発現させた3令幼虫の筋接合部を電子顕微鏡にて観察したところ,シナプスにおけるT-barはどちらも野生型に比べ増加していることがわかった.このことは,miR-310クラスター欠損変異体のシナプス前膜におけるBrpの集積によりシナプス前膜の神経伝達物質の放出にかかわる構造体が過剰に形成されていることを示唆していた.
Brpはシナプス前膜において電位依存性Ca2+チャネルやシナプス伝達物質の封入したシナプス小胞などと集合した立体的な構造をとるものと考えられている11).このモデルにしたがえば,miR-310クラスター欠損変異体でみられるようにシナプス前膜でのBrpの集積度が高まれば電位依存性Ca2+チャネルの集合も促進され,シナプス前細胞へのCa2+の流入量が増加しより多くのシナプス小胞がシナプス前膜と融合して,大規模な伝達物質の放出の起こることと推察された.この仮説を確かめるため,まず,電位依存性Ca2+チャネルのサブユニットをコードするcacophony(cac)遺伝子とmiR-310クラスターとの遺伝的な相互作用を調べたところ,cac遺伝子は野生型と機能欠損変異型とのヘテロ接合型でもmiR-310クラスター欠損変異体での神経伝達物質の過剰放出を有意に抑制することが明らかになり,両者のあいだに強い遺伝的な相関があることが示された.さらに,筋接合部の運動ニューロンの軸索末端へのCa2+の流入量をCa2+イメージング法により直接的に測定したところ,miR-310クラスター欠損変異体では野生型より有意に大きなCa2+の流入が観察された.以上の結果から,miR-310クラスター欠損変異体における神経伝達物質の過剰放出は,シナプス前膜におけるBrpの過剰集積が電位依存性Ca2+チャネルの集合を促進し,シナプス前細胞におけるCa2+の流入を増大させることによって起こっているものと結論づけられた.すなわち,野生型ではmiR-310クラスターがはたらくことによりKhc-73を介してBrpの量を制御し,神経伝達物質の放出量を適切なレベルに抑制していることが明らかになった.
GluRIIA変異体のショウジョウバエの筋接合部では恒常性の維持機構がはたらいてシナプスにおける神経伝達物質の放出量の増加の起こることが明らかになっている5).miR-310クラスターによる神経伝達物質の放出量の制御がこの恒常性の維持機構によって制御されているかどうかはmiR-310クラスターのシナプス機能の制御機構への寄与を知るうえで重要である.まず,GluRIIA変異体においてmiR-310クラスターも欠損させた二重変異体を作製したところ,神経伝達物質の放出量の増加はGluRIIA変異体におけるものと変わりなく2つの遺伝子の変異による加算的な相乗効果は現われなかった.このことからGluRIIA変異体においてはmiR-310クラスターのはたらきが強く抑制されていることが予想されたため,GluRIIA変異体のニューロンにおいてmiR-310クラスターを過剰発現させたところGluRIIA変異体における神経伝達物質の放出量の増加は消失した.この現象はKhc-73をRNAi法によりノックダウンすることにより再現された.これらの結果から,GluRIIA変異体における神経伝達物質の放出量の増加はmiR-310クラスターによるKhc-73の制御を抑制することによりひき起こされていることが示された.
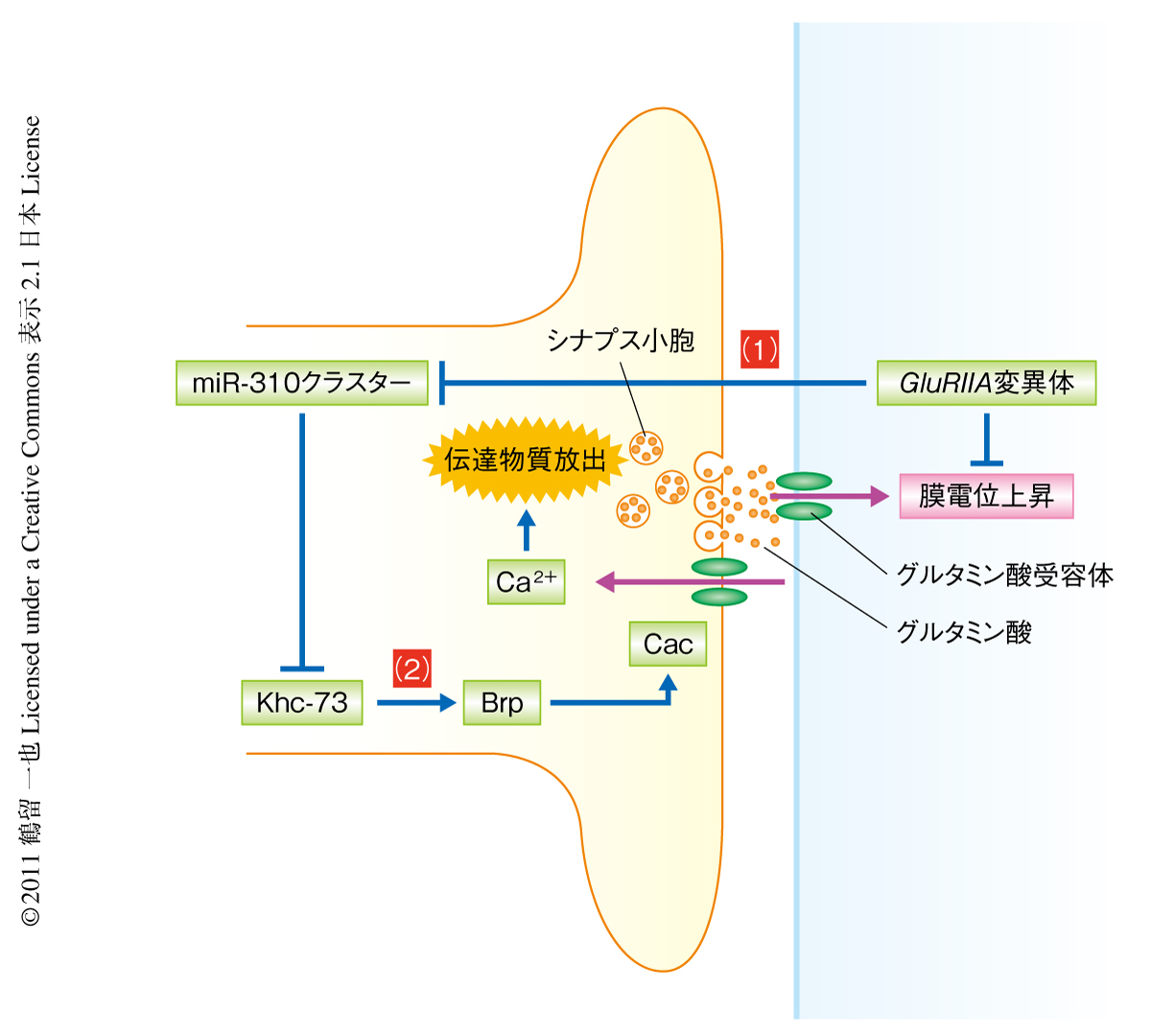
この研究では,ショウジョウバエ幼虫の筋接合部シナプスにおいてマイクロRNAが神経伝達物質の放出量の制御にかかわっていることを明らかにした.筋接合部シナプスではシナプス後細胞に発現するGluRIIA遺伝子の変異が逆行性のシグナル伝達をひき起こしシナプス機能の恒常性の維持機構を担っていることがわかっている5).今回,その機能の明らかになったmiR-310クラスターはシナプス前細胞ではたらきシナプス後細胞からの逆行性のシグナル伝達をうけてそのはたらきの制御されていることが示された(図2).この研究の成果のひとつには,逆行性のシグナル伝達経路がマイクロRNAを介して特定のタンパク質の翻訳を阻害することによりその機能を実現していることを示したことがあげられる.最近の研究で,逆行性のシグナル伝達が特定の遺伝子の転写を制御することで運動ニューロンの末端の発達を促すことが報告されているが7),転写段階にくわえ翻訳段階でも制御が行なわれ多様な方法で機能の制御されていることが明らかにされた.
逆行性のシグナル伝達の正体としてBMPシグナル伝達経路7) やEph受容体6) を介したシグナル伝達などが考えられており,複数のシグナル伝達経路を用いた複合的な機構をもつ可能性もあるがいまだ結論はでていない.また,miR-310クラスターがKhc-73の発現を抑制することが示されたが,Khc-73がどのようにBrpのシナプス前膜への局在を制御しているのかは明らかにすることができなかった.今後の課題として,miR-310クラスターがどの逆行性のシグナル伝達をうけてどのようなしくみで制御されているのか,また,Khc-73がいかにしてBrpのシナプス前膜への局在を促進しているのか,といった点を解明し(図2),シナプス伝達物質の放出量の制御の全容を明らかにする必要がある.
略歴:2006年 九州工業大学大学院生命体工学研究科博士課程 修了,同年よりカナダMcGill大学 博士研究員.
研究テーマ:ショウジョウバエの筋接合部におけるシナプス機能の制御機構の解明.
抱負:基礎的な分野の研究にたずさわっているが,医学的あるいは工学的な応用を視野に入れた広がりのある研究をめざしたい.
© 2011 鶴留 一也 Licensed under CC 表示 2.1 日本
(カナダMcGill大学Department of Physiology)
email:鶴留一也
DOI: 10.7875/first.author.2011.009
The Drosophila miR-310 cluster negatively regulates synaptic strength at the neuromuscular junction.
Kazuya Tsurudome, Karen Tsang, Edward H. Liao, Robin Ball, Jay Penney, Jr-Shiuan Yang, Fatima Elazzouzi, Tao He, Athar Chishti, Greg Lnenicka, Eric C. Lai, A. Pejmun Haghighi
Neuron, 68, 879-893 (2010)
要 約
ニューロンにおいてほかの細胞との情報の伝達部位であるシナプスの形成および機能の制御機構は,神経回路を構築し情報処理を行ううえで欠かせない本質的な性質である.形成されたシナプスにおいて,シナプス後細胞に適当な大きさの反応をひき起こすためにシナプス前細胞からの神経伝達物質の放出量を制御する機構は,その重要性にもかかわらずいまだその全容は解明されていない.この論文で筆者らは,遺伝子スクリーニングにより神経伝達物質の放出量の制御にかかわる新規の遺伝子を特定した.この遺伝子にはmiR-310からmiR-313の4つのマイクロRNAが含まれており,これらmiR-310クラスターがKhc-73の発現を抑制することにより神経伝達物質の放出量を抑制的に制御していることを示した.さらに,シナプス後細胞の神経伝達物質の放出に対する反応が通常より小さくなった場合にはmiR-310クラスターのはたらきを弱めることによって神経伝達物質の放出量を増加させ,シナプスの伝達強度を補償していることを明らかにした.これらの結果は,マイクロRNAがシナプスの機能制御においても重要な役割を担っている可能性を示唆した.
はじめに
マイクロRNA(microRNA:miRNA)は線虫においてその機能が発見されて以来1),詳細な作用機序やさまざまな生物種また組織における多彩な役割が明らかにされてきており,生命現象の解明においてその重要性をますます高めつつある2).ニューロンのシナプス形成においてもその形態的な制御にマイクロRNAの関与が示されているが3),シナプス伝達物質の放出の制御にどのようにかかわっているかについては不明な点が多い.
ショウジョウバエ幼虫の筋接合部についてはシナプスの形態と機能における恒常性の維持機構のモデルとして多くの研究が行われている4).筋接合部シナプスではおもにグルタミン酸が神経伝達物質として放出されており,シナプス後細胞に存在するグルタミン酸作動性チャネルがシナプス伝達を介在している.グルタミン酸作動性チャネルのサブユニットをコードする遺伝子のうちGluRIIA遺伝子に変異が起こるとこのチャネルを介したシナプス伝達は大きく阻害をうけ,同じ量のグルタミン酸の放出に対しておよそ半分の反応(膜電位の上昇)しか示さなくなる.ところが,GluRIIA変異体の神経伝達物質の放出を調べたところ,放出量を増加することによってシナプス後細胞における反応を補償するというシナプス機能の恒常性の維持機構のはたらいていることが発見された5).今日にいたるまで,この恒常性の維持機構にかかわるさまざまな分子が同定されまた検証されてきたが4,6,7),神経伝達物質の放出を制御する機構の全容はいまだ解明にはいたっていない.
この研究では,データベースの解析によりおもにマイクロRNAをコードしていると推測された遺伝子領域について,遺伝学的なスクリーニングにより神経伝達物質の放出の制御にかかわる遺伝子の同定を試みた.
1.miR-310クラスターは正常な神経伝達物質の放出量の制御に必要である
筆者らは,ショウジョウバエにおける遺伝学的なスクリーニングによって,遺伝子産物が発達段階のニューロンにおいて特異的に発現するような遺伝子を見い出した.この遺伝子にはmiR-310,miR-311,miR-312,miR-313の4つのマイクロRNAが含まれており,これら4つをまとめてmiR-310クラスターとよぶ(図1a).このmiR-310クラスターの神経伝達物質の放出に対する影響を調べるため,まずmiR-310クラスターの欠損変異体を作製し3令幼虫の筋接合部シナプスにおいて電気生理学的な手法により神経伝達物質の放出量を測定した.その結果,miR-310クラスター欠損変異体では神経伝達物質の放出量が野生型に比べ有意に増加していることが明らかになった.これは,シナプス前細胞(運動ニューロン)において特異的にmiR-310クラスターを発現させることにより回復した.このことから,miR-310クラスターの前シナプス細胞における活動が正常な神経伝達物質の放出量の制御に必要であることが示唆された.
2.miR-310クラスターはkhc-73遺伝子を標的遺伝子とする
マイクロRNAの理論的な標的遺伝子は数百に及ぶこともめずらしくなく,ひとつのマイクロRNAの生体における影響を調べるのは非常に困難であると予想される2).しかし近年の報告では,特定のマイクロRNAの変異によりひき起こされる表現型はひとつか非常に少数の標的遺伝子に帰結することが示されている8).miR-310クラスターには最大で350の標的遺伝子の候補があった.認識配列の数や保存の度合いを指標とするマイクロRNA標的遺伝子の検索において上位にランクされた遺伝子のうち,miR-310クラスターが発現する発達段階のニューロンではたらいていると考えられる3つの遺伝子,crebA遺伝子,lap遺伝子,khc-73遺伝子について検討した.遺伝的な相互作用実験により3つの遺伝子のうちkhc-73遺伝子だけがmiR-310クラスター欠損変異体における神経伝達物質の過剰放出を抑制することが示された.さらに,miR-310クラスター欠損変異体では野生型に比べKhc-73タンパク質の発現量の増加していることが明らかになった.Khc-73の発現をRNAi法によりノックダウンしたところmiR-310クラスター欠損変異体における神経伝達物質の過剰放出も抑制された.これらの結果から,Khc-73の発現量の増加が神経伝達物質の放出量の増加に必要であることが示唆された.このことは,野生型においてKhc-73をニューロンで過剰発現させると神経伝達物質の過剰放出の起こることからも確認された.
Khc-73をコードするmRNAは3’側非翻訳領域に5つのmiR-310クラスター認識配列をもっていた(図1b).そこで,Khc-73をコードするmRNAから3’側非翻訳領域を取り除いたものをニューロンにおいて発現させたところ,miR-310クラスターによるKhc-73発現の抑制効果は激減したものの完全には消失しなかった.そこで,あらためてkhc-73遺伝子の構造を解析したところ,タンパク質をコードするORFにおいて1つのmiR-310クラスター認識配列を発見した.この認識配列に含まれる塩基配列のうち2つの塩基をコードするアミノ酸の変わらないよう変異させ認識配列を無効化したところ,miR-310クラスターの影響は完全に消失しKhc-73は発現抑制をうけなくなった.このことから,Khc-73タンパク質がなんらかの制御をうけているのではなく,Khc-73をコードするmRNAが複数の認識部位においてmiR-310クラスターのはたらきをうけることで発現抑制の起こっていることが確認された.またこの結果は,3’側非翻訳領域にかぎらずORFに存在するマイクロRNA認識配列も生体において実際にマイクロRNAの標的となりうるという具体的な証拠を提示した.
3.Khc-73はBrpのシナプス前膜への局在を促進する
khc-73遺伝子がmiR-310クラスターによって制御される標的遺伝子であることがわかったが,Khc-73はどのように神経伝達物質の放出量の増加に寄与しているのであろうか? Khc-73の属するKinesinファミリーはモータータンパク質として軸索でもさまざまな分子を輸送していることが知られており9),その機能が阻害されるとシナプスの成長に必要な分子が輸送されずシナプスの構造や機能に障害をもたらす10).したがって,miR-310クラスターの欠失がシナプスを形成する分子の分布に影響を及ぼしている可能性を考え,miR-310クラスター欠損変異体の運動ニューロンの軸索末端を免疫染色法により調べた.多くの分子については野生型と変わりなかったものの,神経伝達物質の放出にかかわりのある活性帯(active zone)の関連遺伝子であるbruchpilot 11)(brp)のタンパク質レベルが有意に増加していることを発見した.この増加したBrpはmiR-310クラスター欠損変異体で増加しているKhc-73をRNAi法でノックダウンすると野生型のレベルまでもどることが確認された.さらに,Brpをニューロンにおいて過剰発現させるとKhc-73の過剰発現やmiR-310クラスター欠損変異体と同様に神経伝達物質の過剰放出が起こった.Brpの過剰発現とkhc-73遺伝子,そして,miR-310クラスター欠損変異体とbrp遺伝子とのあいだにはそれぞれ遺伝的な相互作用が認められ,miR-310クラスター,khc-73遺伝子,そして,brp遺伝子は互いに遺伝子レベルで密接な関係をもつことが示された.
Brpは電子顕微鏡で観察される活性帯に関連した高電子密度の構造体(T-bar)の形成に関与しているとされる11).miR-310クラスター欠損変異体,および,Khc-73をニューロンに過剰発現させた3令幼虫の筋接合部を電子顕微鏡にて観察したところ,シナプスにおけるT-barはどちらも野生型に比べ増加していることがわかった.このことは,miR-310クラスター欠損変異体のシナプス前膜におけるBrpの集積によりシナプス前膜の神経伝達物質の放出にかかわる構造体が過剰に形成されていることを示唆していた.
4.Brpのシナプス前膜への局在が神経伝達物質の放出量を左右する
Brpはシナプス前膜において電位依存性Ca2+チャネルやシナプス伝達物質の封入したシナプス小胞などと集合した立体的な構造をとるものと考えられている11).このモデルにしたがえば,miR-310クラスター欠損変異体でみられるようにシナプス前膜でのBrpの集積度が高まれば電位依存性Ca2+チャネルの集合も促進され,シナプス前細胞へのCa2+の流入量が増加しより多くのシナプス小胞がシナプス前膜と融合して,大規模な伝達物質の放出の起こることと推察された.この仮説を確かめるため,まず,電位依存性Ca2+チャネルのサブユニットをコードするcacophony(cac)遺伝子とmiR-310クラスターとの遺伝的な相互作用を調べたところ,cac遺伝子は野生型と機能欠損変異型とのヘテロ接合型でもmiR-310クラスター欠損変異体での神経伝達物質の過剰放出を有意に抑制することが明らかになり,両者のあいだに強い遺伝的な相関があることが示された.さらに,筋接合部の運動ニューロンの軸索末端へのCa2+の流入量をCa2+イメージング法により直接的に測定したところ,miR-310クラスター欠損変異体では野生型より有意に大きなCa2+の流入が観察された.以上の結果から,miR-310クラスター欠損変異体における神経伝達物質の過剰放出は,シナプス前膜におけるBrpの過剰集積が電位依存性Ca2+チャネルの集合を促進し,シナプス前細胞におけるCa2+の流入を増大させることによって起こっているものと結論づけられた.すなわち,野生型ではmiR-310クラスターがはたらくことによりKhc-73を介してBrpの量を制御し,神経伝達物質の放出量を適切なレベルに抑制していることが明らかになった.
5.miR-310クラスターによる抑制的な制御はシナプス機能の恒常性の維持機構により弱められる
GluRIIA変異体のショウジョウバエの筋接合部では恒常性の維持機構がはたらいてシナプスにおける神経伝達物質の放出量の増加の起こることが明らかになっている5).miR-310クラスターによる神経伝達物質の放出量の制御がこの恒常性の維持機構によって制御されているかどうかはmiR-310クラスターのシナプス機能の制御機構への寄与を知るうえで重要である.まず,GluRIIA変異体においてmiR-310クラスターも欠損させた二重変異体を作製したところ,神経伝達物質の放出量の増加はGluRIIA変異体におけるものと変わりなく2つの遺伝子の変異による加算的な相乗効果は現われなかった.このことからGluRIIA変異体においてはmiR-310クラスターのはたらきが強く抑制されていることが予想されたため,GluRIIA変異体のニューロンにおいてmiR-310クラスターを過剰発現させたところGluRIIA変異体における神経伝達物質の放出量の増加は消失した.この現象はKhc-73をRNAi法によりノックダウンすることにより再現された.これらの結果から,GluRIIA変異体における神経伝達物質の放出量の増加はmiR-310クラスターによるKhc-73の制御を抑制することによりひき起こされていることが示された.
おわりに
この研究では,ショウジョウバエ幼虫の筋接合部シナプスにおいてマイクロRNAが神経伝達物質の放出量の制御にかかわっていることを明らかにした.筋接合部シナプスではシナプス後細胞に発現するGluRIIA遺伝子の変異が逆行性のシグナル伝達をひき起こしシナプス機能の恒常性の維持機構を担っていることがわかっている5).今回,その機能の明らかになったmiR-310クラスターはシナプス前細胞ではたらきシナプス後細胞からの逆行性のシグナル伝達をうけてそのはたらきの制御されていることが示された(図2).この研究の成果のひとつには,逆行性のシグナル伝達経路がマイクロRNAを介して特定のタンパク質の翻訳を阻害することによりその機能を実現していることを示したことがあげられる.最近の研究で,逆行性のシグナル伝達が特定の遺伝子の転写を制御することで運動ニューロンの末端の発達を促すことが報告されているが7),転写段階にくわえ翻訳段階でも制御が行なわれ多様な方法で機能の制御されていることが明らかにされた.
逆行性のシグナル伝達の正体としてBMPシグナル伝達経路7) やEph受容体6) を介したシグナル伝達などが考えられており,複数のシグナル伝達経路を用いた複合的な機構をもつ可能性もあるがいまだ結論はでていない.また,miR-310クラスターがKhc-73の発現を抑制することが示されたが,Khc-73がどのようにBrpのシナプス前膜への局在を制御しているのかは明らかにすることができなかった.今後の課題として,miR-310クラスターがどの逆行性のシグナル伝達をうけてどのようなしくみで制御されているのか,また,Khc-73がいかにしてBrpのシナプス前膜への局在を促進しているのか,といった点を解明し(図2),シナプス伝達物質の放出量の制御の全容を明らかにする必要がある.
文 献
- Lee, R. C., Feinbaum, R. L. & Ambros, V.: The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell, 75, 843-854 (1993)[PubMed]
- Bartel, D. P.: MicroRNAs: target recognition and regulatory functions. Cell, 136, 215-233 (2009)[PubMed]
- Schratt, G. M., Tuebing, F., Nigh, E. A. et al.: A brain-specific microRNA regulates dendritic spine development. Nature, 439, 283-289 (2006)[PubMed]
- Davis, G. W.: Homeostatic control of neural activity: from phenomenology to molecular design. Annu. Rev. Neurosci., 29, 307-323 (2006)[PubMed]
- Petersen, S. A., Fetter, R. D., Noordermeer, J. N. et al.: Genetic analysis of glutamate receptors in Drosophila reveals a retrograde signal regulating presynaptic transmitter release. Neuron, 19, 1237-1248 (1997)[PubMed]
- Frank, C. A., Pielage, J. & Davis, G. W.: A presynaptic homeostatic signaling system composed of the Eph receptor, ephexin, Cdc42, and CaV2.1 calcium channels. Neuron, 61, 556-569 (2009)[PubMed]
- Ball, R. W., Warren-Paquin, M., Tsurudome, K. et al.: Retrograde BMP signalling controls synaptic growth at the NMJ by regulating trio expression in motor neurons. Neuron, 66, 536-549 (2010)[PubMed]
- Flynt, A. S. & Lai, E. C.: Biological principles of microRNA-mediated regulation: shared themes amid diversity. Nat. Rev. Genet., 9, 831-842 (2008)[PubMed]
- Hirokawa, N., Noda, Y., Tanaka, Y. et al.: Kinesin superfamily motor proteins and intracellular transport. Nat. Rev. Mol. Cell Biol., 10, 682-696 (2009)[PubMed]
- Hurd, D. D. & Saxton, W. M.: Kinesin mutations cause motor neuron disease phenotypes by disrupting fast axonal transport in Drosophila. Genetics, 144, 1075-1085 (1996)[PubMed]
- Fouquet, W., Owald, D., Wichmann, C. et al.: Maturation of active zone assembly by Drosophila Bruchpilot. J. Cell Biol., 186, 129-145 (2009)[PubMed]
著者プロフィール
略歴:2006年 九州工業大学大学院生命体工学研究科博士課程 修了,同年よりカナダMcGill大学 博士研究員.
研究テーマ:ショウジョウバエの筋接合部におけるシナプス機能の制御機構の解明.
抱負:基礎的な分野の研究にたずさわっているが,医学的あるいは工学的な応用を視野に入れた広がりのある研究をめざしたい.
© 2011 鶴留 一也 Licensed under CC 表示 2.1 日本