植物の細胞壁の成分であるペクチンの生合成にかかわるラムノース転移酵素の同定および陸上植物に特異的な新規の糖転移酵素ファミリーの発見
竹中悠人・石水 毅
(立命館大学生命科学部 生物工学科)
email:竹中悠人,石水 毅
DOI: 10.7875/first.author.2018.080
Pectin RG-I rhamnosyltransferases represent a novel plant-specific glycosyltransferase family.
Yuto Takenaka, Kohei Kato, Mari Ogawa-Ohnishi, Kana Tsuruhama, Hiroyuki Kajiura, Kenta Yagyu, Atsushi Takeda, Yoichi Takeda, Tadashi Kunieda, Ikuko Hara-Nishimura, Takeshi Kuroha, Kazuhiko Nishitani, Yoshikatsu Matsubayashi, Takeshi Ishimizu
Nature Plants, 4, 669-676 (2018)
植物の細胞壁を構成する多糖成分であるペクチンは,細胞のかたちや大きさの決定,および,細胞の接着にかかわると考えられており,日常生活においてはゲル化剤や増粘多糖類として利用されている.ペクチンは多種の糖が複雑に連なることで構成されており,その生合成には糖と糖とを結合する糖転移酵素がかかわる.しかし,ペクチンの生合成にかかわる糖転移酵素はほとんど同定されておらず,ペクチンの生合成や機能については未知なことが多い.この研究において,筆者らは,シロイヌナズナからペクチンの主鎖の生合成にかかわる糖転移酵素であるラムノガラクツロナンIラムノース転移酵素RRT1~RRT4を発見した.この酵素は植物に特異的な新規の糖転移酵素のファミリーに分類された.このGT106ファミリーはシロイヌナズナにおいては34個の遺伝子を含む大きなファミリーであり,植物に特異的な機能,たとえば,ペクチンの生合成にかかわる機能未知の遺伝子を多く含むと考えられた.水生植物はこのファミリーをもたず,陸上植物にのみ見い出されたことから,ペクチンの生合成は植物の陸上への進出の鍵をにぎるしくみであることが示唆された.
植物の細胞壁はセルロース,ヘミセルロース,ペクチンといった多糖から構成される.セルロースが骨格を形成し,ヘミセルロースがそれをささえる鉄筋,ペクチンがそれらのすき間をうめるコンクリートとして機能するとイメージされている.この複雑に入り組んだ構造により,細胞壁を強固にし,植物に強度をもたせ,重力にさからって直立する性質を付与する1).また,細胞壁は細胞および植物のからだをかたちづくる役割もあるため,構造のしなやかさがもとめられる.このような細胞壁は複雑な構造をしているため,その生合成の機構には不明な点が多く,このため,細胞壁に関連した研究は発展の途上にある.
ペクチンは植物の伸長の際に合成される1次細胞壁や細胞の間隙にある中葉に多く存在する.ペクチンはおもに3つのドメインから形成される.ガラクツロン酸が連なったホモガラクツロナン,ガラクツロン酸の重合体を主鎖に6つの側鎖が結合したラムノガラクツロナンII,ラムノースとガラクツロン酸の2糖くり返し構造を主鎖にガラクトース残基が連なったガラクタン側鎖やアラビノース残基が連なったアラビナン側鎖をもつラムノガラクツロナンIである.糖と糖の結合様式を考えると,ペクチンの生合成には約30種類の糖転移酵素がかかわると予想されている.これまでの研究においては,ホモガラクツロナンガラクツロン酸転移酵素であるGAUT4 2),および,いくつかの側鎖を合成する糖転移酵素3) が見い出されているのみであった.ペクチンの生合成に関連する糖転移酵素の同定が進んでいないのは,遺伝子に重複があるため変異体を解析しても表現型が現われない,また,表現型が現われても植物のからだをつくる細胞壁に影響するため表現型が多岐にわたる,など,逆遺伝学的な手法による同定が困難であったためである.そのため,糖転移酵素の活性の検出にもとづく生化学的な手法が有効であるが,基質の調製が困難であるため,ペクチンの主鎖の生合成にかかわる糖転移酵素ですら活性が未検出なものがある.この研究において,筆者らは,この現状を打破すべく,独自に構築した酵素活性を測定する実験系を利用し,ペクチンの主鎖の生合成にかかわるラムノース転移酵素の同定を試みた.
ペクチンの主鎖の生合成にかかわるラムノガラクツロナンIラムノース転移酵素(rhamnogalacturonan-I rhamnosyltransferase:RRT)に焦点をあてた.注目したのは,シロイヌナズナの種子に存在するムシレージの多糖である.ムシレージは種子が発達する過程において合成され,最外層にあたる種皮を構成する細胞にため込まれた状態で存在し,水分の保持による発芽の促進や種子の物理的な保護に役割をもつと考えられている.このムシレージは成分の90%以上がラムノガラクツロナンIから構成されている4).ムシレージが合成される時期にはラムノガラクツロナンIラムノース転移酵素をコードする遺伝子の発現が上昇すると予測し,種子の発達の段階におけるマイクロアレイのデータから遺伝子の候補をしぼり込んだ.シロイヌナズナのもつ約530個の糖転移酵素の遺伝子のうち,種子の発達の段階に発現が上昇していたのは87個あった.このなかから機能が既知の遺伝子を除き,ムシレージが合成される時期にとくに高く発現するAt5g15740遺伝子を候補としてRRT1遺伝子とした.
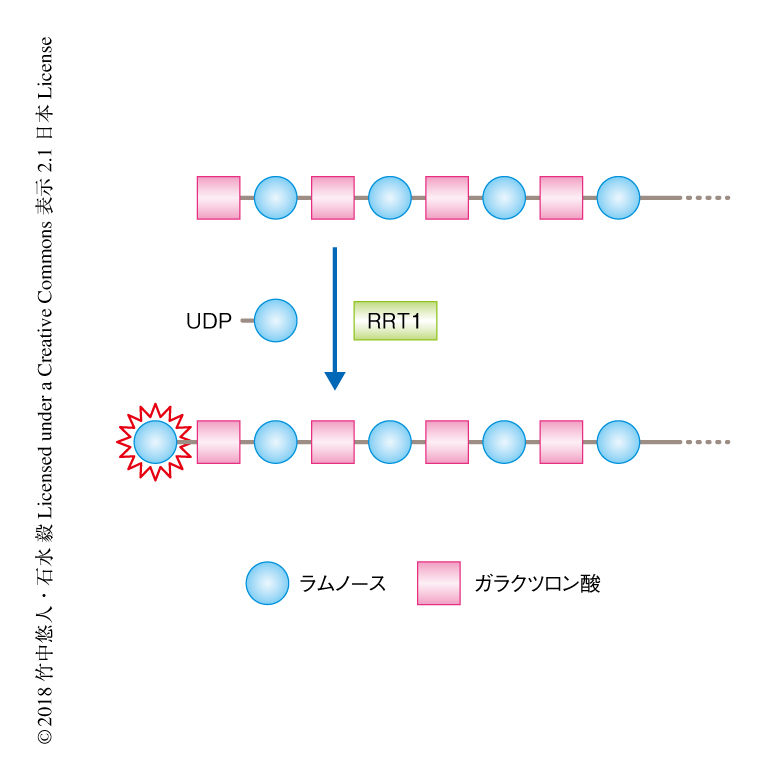
RRT1タンパク質はタバコの培養細胞BY-2株を宿主として発現させたものを精製して使用した.ラムノガラクツロナンIラムノース転移酵素の活性の測定にあたっては基質が必要になる.アクセプター基質は,市販のジャガイモに由来するラムノガラクツロナンIを加水分解することにより得たラムノガラクツロナンIオリゴ糖を蛍光標識することにより調製した5).また,ドナー基質であるUDP-ラムノースは酵素合成により調製した.精製した候補タンパク質をこれらと反応させ,アクセプター基質にラムノースを1つ転移させるラムノガラクツロナンIラムノース転移酵素の活性を検出した.その結果,RRT1はラムノガラクツロナンIラムノース転移酵素であることが確認された(図1).RRT1は,ドナー基質としてUDP-β-ラムノースのみを認識し,アクセプター基質として5糖以上のある程度の長さをもつラムノガラクツロナンIオリゴ糖を認識した.このようにして,ラムノガラクツロナンIの主鎖の生合成にかかわる糖転移酵素がはじめて見い出された.
RRT1欠損変異体においては種子におけるムシレージの体積が野生型と比較して減少していた.種皮の細胞にはコルメラとよばれる火山状の形状の構造体があり,コルメラの形状とムシレージの蓄積には関連がある.RRT1欠損変異体において,ムシレージの減少にともないコルメラの幅が広がっていた.さらに,ムシレージを構成する単糖について,ラムノースおよびガラクツロン酸の量が顕著に減少していた.発達の過程の種子を含む鞘においてRRT1遺伝子の高い発現がみられたこととあわせて,RRT1遺伝子がムシレージのラムノガラクツロナンIの生合成にかかわることが明らかにされた.また,RRT1はゴルジ体に局在しており,ペクチンがゴルジ体で合成されたのち小胞により細胞壁へと輸送されるというこれまでの知見3) と一致した.これらの結果から,RRT1が植物においてラムノガラクツロナンIの生合成にかかわることが支持された.
RRT1のアミノ酸配列をもとにデータベースを検索したところ,シロイヌナズナにおいてRRT1のほかに3つのホモログが見い出され,RRT2,RRT3,RRT4と名づけられた.これらも同様にタバコの培養細胞BY-2株にて発現させたところ,それぞれにラムノガラクツロナンIラムノース転移酵素の活性が検出された.遺伝子の発現する領域をデータベースにて解析したところ,RRT1~RRT4は植物のほぼすべての器官において発現しており,とくに,RRT1は鞘,RRT2は花茎,RRT3およびRRT4は花弁における発現量が多かった.RRT1~RRT4が協調的にはたらくことにより,植物においてペクチンのラムノガラクツロナンIが生合成されることが示された.
データベースにてホモログの検索をすすめたところ,RRT1~RRT4のアミノ酸配列に類似性をもつ遺伝子がみつかった.RRT1~RRT4は機能未知のドメインをもち,GT65ファミリーにやや類似していたものの,既存の糖転移酵素のファミリーには分類されなかった.このファミリーには,糖質に関連する酵素のデータベースであるCAZyデータベースより,新たにGT106の番号が付与された6).GT106ファミリーはシロイヌナズナにおいては34個の遺伝子から構成される大きなファミリーであり,RRT1~RRT4のほかには酵素活性が検出されたものはなかった.系統樹を作成すると,RRT1~RRT4はひとつのクレードを形成した.細胞の接着に関与すると考えられているFRB 7) や,マンナンの生合成にかかわると考えられているAtMSR 8) を含み,ペクチンや非セルロース性の多糖の生合成にかかわる糖転移酵素が多く含まれると考えられた.そのため,GT106ファミリーは認識する基質のバリエーションが広いユニークな特徴をもつと予想された.動物や微生物はGT106ファミリーをもたず,植物に特異的であることもわかった.とくに,陸上植物と車軸藻類を含むストレプト植物に特異的であり,水中で生活する緑藻類においてはRRT1遺伝子~RRT4遺伝子に類似する遺伝子もGT106ファミリーに分類される遺伝子も見い出されなかった.一方で,進化において陸上植物にもっとも近縁な車軸藻類やコケ植物はGT106ファミリーに分類される遺伝子をもち,RRT1遺伝子~RRT4遺伝子に類似する遺伝子を1つずつ保持していた.シダ植物および裸子植物はRRT1遺伝子~RRT4遺伝子に類似する複数の遺伝子をもっていた.進化の観点からみると,植物は車軸藻類を境に,水中から生存圏を拡大して陸上へと進出したと考えられている9).陸上においては重力の影響を強くうけるため,植物は重力にさからって直立する強靭さおよび細胞を成長させる柔軟さをかね備えた細胞壁の獲得が必要であったと考えられている.この研究においては,RRT1遺伝子~RRT4遺伝子の出現にともなうペクチンの生合成能の獲得と植物の陸上への進出との関連が示され(図2),ペクチンを獲得することが,陸上における生活により適した細胞壁の形成に寄与し,植物の陸上への進出に貢献したことが示唆された.
糖転移酵素の生化学的な解析をベースとして,ペクチンの主鎖の生合成にかかわるラムノガラクツロナンIラムノース転移酵素をコードするRRT1遺伝子~RRT4遺伝子が見い出された.また,それらの解析をつうじ,糖転移酵素の新規のファミリーであるGT106ファミリーの存在が明らかにされ,ペクチンの生合成にかかわることの予想される多くの遺伝子が見い出された.この成果は,ペクチンの生合成の一端を明らかにし,今後のペクチンの研究の展開に道を拓いたことから,細胞壁の生合成の研究におけるブレイクスルーであるといってよい10).この研究が起点となり,ペクチンの生合成に関連する多数の糖転移酵素の同定が進むことを大いに期待している.RRT1~RRT4の機能を包括的に解析することにより,ラムノガラクツロナンIに関連した生化学的な性質や,ラムノガラクツロナンIの植物における生理的な機能が明らかにされると期待している.さらに,ペクチンは成長している細胞において積極的に生合成されることから,RRT1遺伝子~RRT4遺伝子の発現量を制御することにより,植物の成長の制御や収量の増大といった育種への貢献が期待される.また,ペクチンは増粘多糖類としてさまざまな食品に利用されていることから,ペクチンの生合成を制御することにより,新たな性質をもつゲル化剤の開発も期待される.
略歴:2016年 奈良先端科学技術大学院大学バイオサイエンス研究科博士後期課程 修了,同年より立命館大学立命館グローバル・イノベーション研究機構 研究員.
研究テーマ:細胞壁および植物のからだづくり.
石水 毅(Takeshi Ishimizu)
立命館大学生命科学部 准教授.
研究室URL:http://www.ismz.sk.ritsumei.ac.jp/
© 2018 竹中悠人・石水 毅 Licensed under CC 表示 2.1 日本
(立命館大学生命科学部 生物工学科)
email:竹中悠人,石水 毅
DOI: 10.7875/first.author.2018.080
Pectin RG-I rhamnosyltransferases represent a novel plant-specific glycosyltransferase family.
Yuto Takenaka, Kohei Kato, Mari Ogawa-Ohnishi, Kana Tsuruhama, Hiroyuki Kajiura, Kenta Yagyu, Atsushi Takeda, Yoichi Takeda, Tadashi Kunieda, Ikuko Hara-Nishimura, Takeshi Kuroha, Kazuhiko Nishitani, Yoshikatsu Matsubayashi, Takeshi Ishimizu
Nature Plants, 4, 669-676 (2018)
要 約
植物の細胞壁を構成する多糖成分であるペクチンは,細胞のかたちや大きさの決定,および,細胞の接着にかかわると考えられており,日常生活においてはゲル化剤や増粘多糖類として利用されている.ペクチンは多種の糖が複雑に連なることで構成されており,その生合成には糖と糖とを結合する糖転移酵素がかかわる.しかし,ペクチンの生合成にかかわる糖転移酵素はほとんど同定されておらず,ペクチンの生合成や機能については未知なことが多い.この研究において,筆者らは,シロイヌナズナからペクチンの主鎖の生合成にかかわる糖転移酵素であるラムノガラクツロナンIラムノース転移酵素RRT1~RRT4を発見した.この酵素は植物に特異的な新規の糖転移酵素のファミリーに分類された.このGT106ファミリーはシロイヌナズナにおいては34個の遺伝子を含む大きなファミリーであり,植物に特異的な機能,たとえば,ペクチンの生合成にかかわる機能未知の遺伝子を多く含むと考えられた.水生植物はこのファミリーをもたず,陸上植物にのみ見い出されたことから,ペクチンの生合成は植物の陸上への進出の鍵をにぎるしくみであることが示唆された.
はじめに
植物の細胞壁はセルロース,ヘミセルロース,ペクチンといった多糖から構成される.セルロースが骨格を形成し,ヘミセルロースがそれをささえる鉄筋,ペクチンがそれらのすき間をうめるコンクリートとして機能するとイメージされている.この複雑に入り組んだ構造により,細胞壁を強固にし,植物に強度をもたせ,重力にさからって直立する性質を付与する1).また,細胞壁は細胞および植物のからだをかたちづくる役割もあるため,構造のしなやかさがもとめられる.このような細胞壁は複雑な構造をしているため,その生合成の機構には不明な点が多く,このため,細胞壁に関連した研究は発展の途上にある.
ペクチンは植物の伸長の際に合成される1次細胞壁や細胞の間隙にある中葉に多く存在する.ペクチンはおもに3つのドメインから形成される.ガラクツロン酸が連なったホモガラクツロナン,ガラクツロン酸の重合体を主鎖に6つの側鎖が結合したラムノガラクツロナンII,ラムノースとガラクツロン酸の2糖くり返し構造を主鎖にガラクトース残基が連なったガラクタン側鎖やアラビノース残基が連なったアラビナン側鎖をもつラムノガラクツロナンIである.糖と糖の結合様式を考えると,ペクチンの生合成には約30種類の糖転移酵素がかかわると予想されている.これまでの研究においては,ホモガラクツロナンガラクツロン酸転移酵素であるGAUT4 2),および,いくつかの側鎖を合成する糖転移酵素3) が見い出されているのみであった.ペクチンの生合成に関連する糖転移酵素の同定が進んでいないのは,遺伝子に重複があるため変異体を解析しても表現型が現われない,また,表現型が現われても植物のからだをつくる細胞壁に影響するため表現型が多岐にわたる,など,逆遺伝学的な手法による同定が困難であったためである.そのため,糖転移酵素の活性の検出にもとづく生化学的な手法が有効であるが,基質の調製が困難であるため,ペクチンの主鎖の生合成にかかわる糖転移酵素ですら活性が未検出なものがある.この研究において,筆者らは,この現状を打破すべく,独自に構築した酵素活性を測定する実験系を利用し,ペクチンの主鎖の生合成にかかわるラムノース転移酵素の同定を試みた.
1.ペクチンのラムノガラクツロナンIラムノース転移酵素をコードする遺伝子の同定
ペクチンの主鎖の生合成にかかわるラムノガラクツロナンIラムノース転移酵素(rhamnogalacturonan-I rhamnosyltransferase:RRT)に焦点をあてた.注目したのは,シロイヌナズナの種子に存在するムシレージの多糖である.ムシレージは種子が発達する過程において合成され,最外層にあたる種皮を構成する細胞にため込まれた状態で存在し,水分の保持による発芽の促進や種子の物理的な保護に役割をもつと考えられている.このムシレージは成分の90%以上がラムノガラクツロナンIから構成されている4).ムシレージが合成される時期にはラムノガラクツロナンIラムノース転移酵素をコードする遺伝子の発現が上昇すると予測し,種子の発達の段階におけるマイクロアレイのデータから遺伝子の候補をしぼり込んだ.シロイヌナズナのもつ約530個の糖転移酵素の遺伝子のうち,種子の発達の段階に発現が上昇していたのは87個あった.このなかから機能が既知の遺伝子を除き,ムシレージが合成される時期にとくに高く発現するAt5g15740遺伝子を候補としてRRT1遺伝子とした.
RRT1タンパク質はタバコの培養細胞BY-2株を宿主として発現させたものを精製して使用した.ラムノガラクツロナンIラムノース転移酵素の活性の測定にあたっては基質が必要になる.アクセプター基質は,市販のジャガイモに由来するラムノガラクツロナンIを加水分解することにより得たラムノガラクツロナンIオリゴ糖を蛍光標識することにより調製した5).また,ドナー基質であるUDP-ラムノースは酵素合成により調製した.精製した候補タンパク質をこれらと反応させ,アクセプター基質にラムノースを1つ転移させるラムノガラクツロナンIラムノース転移酵素の活性を検出した.その結果,RRT1はラムノガラクツロナンIラムノース転移酵素であることが確認された(図1).RRT1は,ドナー基質としてUDP-β-ラムノースのみを認識し,アクセプター基質として5糖以上のある程度の長さをもつラムノガラクツロナンIオリゴ糖を認識した.このようにして,ラムノガラクツロナンIの主鎖の生合成にかかわる糖転移酵素がはじめて見い出された.
2.シロイヌナズナのRRT1~RRT4はペクチンのラムノガラクツロナンIの生合成にかかわる
RRT1欠損変異体においては種子におけるムシレージの体積が野生型と比較して減少していた.種皮の細胞にはコルメラとよばれる火山状の形状の構造体があり,コルメラの形状とムシレージの蓄積には関連がある.RRT1欠損変異体において,ムシレージの減少にともないコルメラの幅が広がっていた.さらに,ムシレージを構成する単糖について,ラムノースおよびガラクツロン酸の量が顕著に減少していた.発達の過程の種子を含む鞘においてRRT1遺伝子の高い発現がみられたこととあわせて,RRT1遺伝子がムシレージのラムノガラクツロナンIの生合成にかかわることが明らかにされた.また,RRT1はゴルジ体に局在しており,ペクチンがゴルジ体で合成されたのち小胞により細胞壁へと輸送されるというこれまでの知見3) と一致した.これらの結果から,RRT1が植物においてラムノガラクツロナンIの生合成にかかわることが支持された.
RRT1のアミノ酸配列をもとにデータベースを検索したところ,シロイヌナズナにおいてRRT1のほかに3つのホモログが見い出され,RRT2,RRT3,RRT4と名づけられた.これらも同様にタバコの培養細胞BY-2株にて発現させたところ,それぞれにラムノガラクツロナンIラムノース転移酵素の活性が検出された.遺伝子の発現する領域をデータベースにて解析したところ,RRT1~RRT4は植物のほぼすべての器官において発現しており,とくに,RRT1は鞘,RRT2は花茎,RRT3およびRRT4は花弁における発現量が多かった.RRT1~RRT4が協調的にはたらくことにより,植物においてペクチンのラムノガラクツロナンIが生合成されることが示された.
3.ペクチンの生合成と植物の陸上への進出
データベースにてホモログの検索をすすめたところ,RRT1~RRT4のアミノ酸配列に類似性をもつ遺伝子がみつかった.RRT1~RRT4は機能未知のドメインをもち,GT65ファミリーにやや類似していたものの,既存の糖転移酵素のファミリーには分類されなかった.このファミリーには,糖質に関連する酵素のデータベースであるCAZyデータベースより,新たにGT106の番号が付与された6).GT106ファミリーはシロイヌナズナにおいては34個の遺伝子から構成される大きなファミリーであり,RRT1~RRT4のほかには酵素活性が検出されたものはなかった.系統樹を作成すると,RRT1~RRT4はひとつのクレードを形成した.細胞の接着に関与すると考えられているFRB 7) や,マンナンの生合成にかかわると考えられているAtMSR 8) を含み,ペクチンや非セルロース性の多糖の生合成にかかわる糖転移酵素が多く含まれると考えられた.そのため,GT106ファミリーは認識する基質のバリエーションが広いユニークな特徴をもつと予想された.動物や微生物はGT106ファミリーをもたず,植物に特異的であることもわかった.とくに,陸上植物と車軸藻類を含むストレプト植物に特異的であり,水中で生活する緑藻類においてはRRT1遺伝子~RRT4遺伝子に類似する遺伝子もGT106ファミリーに分類される遺伝子も見い出されなかった.一方で,進化において陸上植物にもっとも近縁な車軸藻類やコケ植物はGT106ファミリーに分類される遺伝子をもち,RRT1遺伝子~RRT4遺伝子に類似する遺伝子を1つずつ保持していた.シダ植物および裸子植物はRRT1遺伝子~RRT4遺伝子に類似する複数の遺伝子をもっていた.進化の観点からみると,植物は車軸藻類を境に,水中から生存圏を拡大して陸上へと進出したと考えられている9).陸上においては重力の影響を強くうけるため,植物は重力にさからって直立する強靭さおよび細胞を成長させる柔軟さをかね備えた細胞壁の獲得が必要であったと考えられている.この研究においては,RRT1遺伝子~RRT4遺伝子の出現にともなうペクチンの生合成能の獲得と植物の陸上への進出との関連が示され(図2),ペクチンを獲得することが,陸上における生活により適した細胞壁の形成に寄与し,植物の陸上への進出に貢献したことが示唆された.
おわりに
糖転移酵素の生化学的な解析をベースとして,ペクチンの主鎖の生合成にかかわるラムノガラクツロナンIラムノース転移酵素をコードするRRT1遺伝子~RRT4遺伝子が見い出された.また,それらの解析をつうじ,糖転移酵素の新規のファミリーであるGT106ファミリーの存在が明らかにされ,ペクチンの生合成にかかわることの予想される多くの遺伝子が見い出された.この成果は,ペクチンの生合成の一端を明らかにし,今後のペクチンの研究の展開に道を拓いたことから,細胞壁の生合成の研究におけるブレイクスルーであるといってよい10).この研究が起点となり,ペクチンの生合成に関連する多数の糖転移酵素の同定が進むことを大いに期待している.RRT1~RRT4の機能を包括的に解析することにより,ラムノガラクツロナンIに関連した生化学的な性質や,ラムノガラクツロナンIの植物における生理的な機能が明らかにされると期待している.さらに,ペクチンは成長している細胞において積極的に生合成されることから,RRT1遺伝子~RRT4遺伝子の発現量を制御することにより,植物の成長の制御や収量の増大といった育種への貢献が期待される.また,ペクチンは増粘多糖類としてさまざまな食品に利用されていることから,ペクチンの生合成を制御することにより,新たな性質をもつゲル化剤の開発も期待される.
文 献
- Soga, K.: Resistance of plants to gravitational force. J. Plant Res., 126, 589-596 (2013)[PubMed]
- Biswal, A. K., Atmodjo, M. A., Li, M. et al.: Sugar release and growth of biofuel crops are improved by downregulation of pectin biosynthesis. Nat. Biotechnol., 36, 249-257 (2018)[PubMed]
- Atmodjo, M. A., Hao, Z. & Mohnen, D.: Evolving views of pectin biosynthesis. Annu. Rev. Plant Biol., 64, 747-779 (2013)[PubMed]
- Western, T. L., Skkiner, D. J. & Haughn, G. W.: Differentiation of mucilage secretory cells of the Arabidopsis seed coat. Plant Physiol., 122, 345-355 (2000)[PubMed]
- Uehara, Y., Tamura, S., Maki, Y. et al.: Biochemical characterization of rhamnosyltransferase involved in biosynthesis of pectic rhamnogalacturonan I in plant cell wall. Biochem. Biophys. Res. Commun., 486, 130-136 (2017)[PubMed]
- Coutinho, P. M., Deleury, E., Davies, G. J. et al.: An evolving hierarchical family classification for glycosyltransferases. J. Mol. Biol., 328, 307-317 (2003)[PubMed]
- Neumetzler, L., Humphrey, T., Lumba, S. et al.: The FRIABLE1 gene product affects cell adhesion in Arabidopsis. PLoS One, 7, e42914 (2012)[PubMed]
- Wang, Y., Mortimer, J. C., Davis, J. et al.: Identification of an additional protein involved in mannan biosynthesis. Plant J., 73, 105-117 (2013)[PubMed]
- Harholt, J., Moestrup, O. & Ulvskov, P.: Why plants were terrestrial from the beginning. Trends Plant Sci., 21, 96-101 (2016)[PubMed]
- Ulvskov, P. & Scheller, H. V.: Cell walls have a new family. Nat. Plants, 4, 635-636 (2018)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2016年 奈良先端科学技術大学院大学バイオサイエンス研究科博士後期課程 修了,同年より立命館大学立命館グローバル・イノベーション研究機構 研究員.
研究テーマ:細胞壁および植物のからだづくり.
石水 毅(Takeshi Ishimizu)
立命館大学生命科学部 准教授.
研究室URL:http://www.ismz.sk.ritsumei.ac.jp/
© 2018 竹中悠人・石水 毅 Licensed under CC 表示 2.1 日本