乱流は血小板の産生を活性化し生体外における臨床の規模での産生を可能にする
伊東幸敬・江藤浩之
(京都大学iPS細胞研究所 臨床応用研究部門)
email:伊東幸敬,江藤浩之
DOI: 10.7875/first.author.2018.079
Turbulence activates platelet biogenesis to enable clinical scale ex vivo production.
Yukitaka Ito, Sou Nakamura, Naoshi Sugimoto, Tomohiro Shigemori, Yoshikazu Kato, Mikiko Ohno, Shinya Sakuma, Keitaro Ito, Hiroki Kumon, Hidenori Hirose, Haruki Okamoto, Masayuki Nogawa, Mio Iwasaki, Shunsuke Kihara, Kosuke Fujio, Takuya Matsumoto, Natsumi Higashi, Kazuya Hashimoto, Akira Sawaguchi, Ken-ichi Harimoto, Masato Nakagawa, Takuya Yamamoto, Makoto Handa, Naohide Watanabe, Eiichiro Nishi, Fumihito Arai, Satoshi Nishimura, Koji Eto
Cell, 174, 636-648.e18 (2018)
血小板の輸血は血小板の減少に対する治療法として有効であるものの,その供給すべてを献血に依存するため安定な供給を可能にする代替法が希求されている.しかしながら,実際に臨床で使用する量の血小板を培養により得た例はなかった.この研究において,筆者らは,芳香族炭化水素受容体の拮抗剤およびROCKの阻害剤の共添加により,iPS細胞を由来とする不死化巨核球株の浮遊培養系を構築した.さらに,培養の規模を拡大するうえで必要な物理的な要素を見い出すため,マウスの骨髄において血液の流体解析を実施したところ,乱流により血小板の産生が促進されることが示唆された.乱流を効率よく発生させる上下かくはん方式の培養装置を用いたところ機能的な血小板の産生が認められたため,さまざまなかくはん速度における培養槽での流体解析および血小板の産生量について2つの異なる培養スケールのあいだで比較したところ,血小板の収量が最大となる条件において一致する物理的な指標として乱流エネルギーおよびせん断応力が見い出された.この2つのパラメーターをスケールアップファクターとして8リットルスケールにて培養したところ,iPS細胞に由来する血小板が1バッチあたり1000億個以上も得られた.こうして得られた血小板はin vitroおよびin vivoにおける特性解析において献血に由来する血小板と同等の活性をもっていた.この研究により,臨床への応用の可能なスケールでiPS細胞に由来する血小板を産生させる方法が見い出されたのと同時に,巨核球には乱流という物理的な刺激により血小板の産生に必要なNRDC,マクロファージ遊走阻害因子,IGFBP2などを分泌して血小板の産生量を増大させる機序が存在することも明らかにされた.
血小板製剤は血小板の減少や血小板の機能の異常に起因する出血の予防および治療のため輸血されるが,1回の輸血において使用される血小板は2000~3000億個と多く,生体外における培養により血小板を大量に産生するためには拡張性のある培養方式の構築および産生の効率の向上を達成する必要がある.血小板は生体において骨髄,肺,脾に存在する巨核球から産生されるが,巨核球は成熟する過程で多核化および肥大化して微小管の構造を裏打ちとする胞体突起が発達した形状へと形態が変化し,血流により生じるせん断応力が胞体突起に作用することにより血小板が巨核球よりせん断されて血中へと放出されると想定されてきた.世界的な競争においては,骨髄におけるせん断応力に依存的な血小板の産生の様式を再構築するマイクロデバイスを開発することが中心であった1-5).一方,筆者らは,工業規模での生産をみすえるとマイクロデバイスでは培養の規模の拡張に限界があることを予測し,独自に開発した不死化巨核球株(immortalized megakaryocyte progenitor cell line:imMKCL)を利用し6,7),容積効率のよいタンク方式による培養法の開発をめざした.
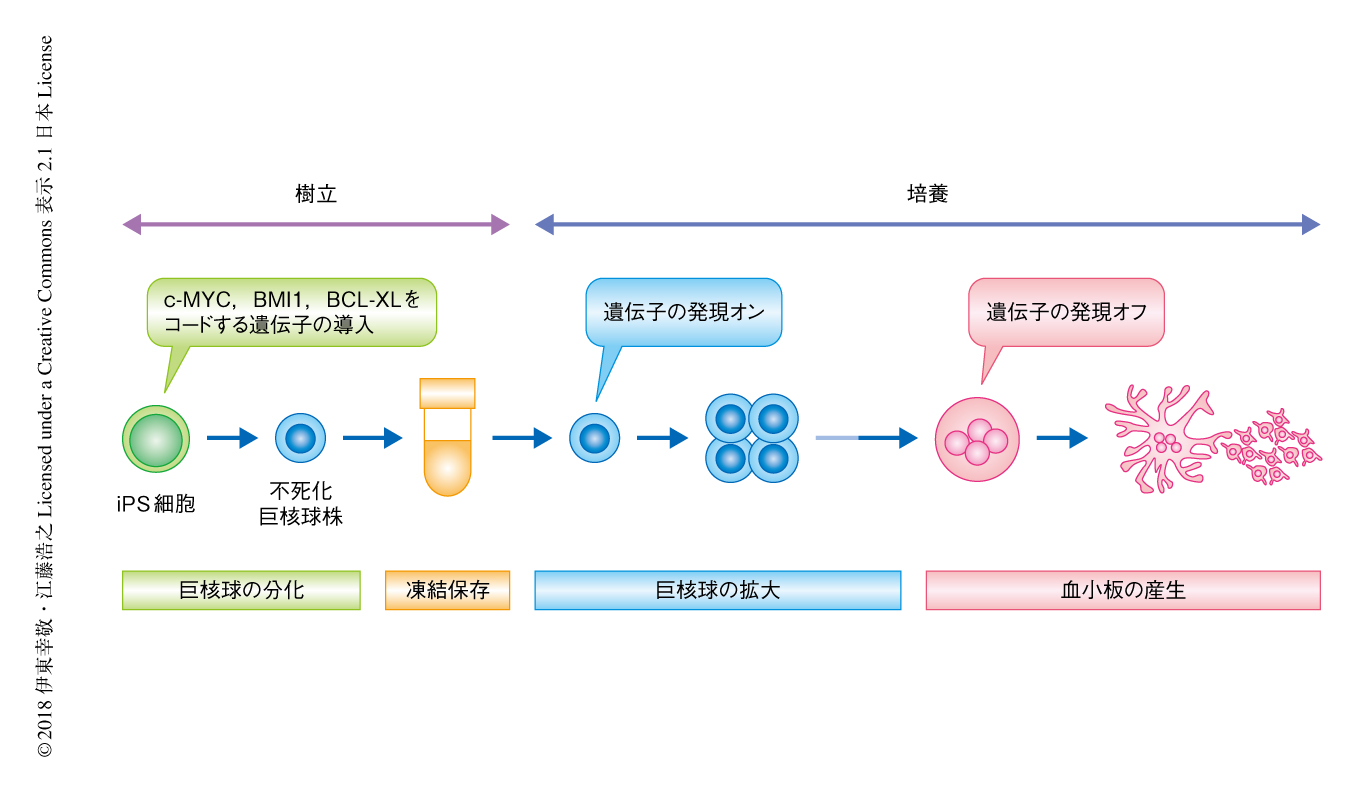
筆者らの研究グループは,iPS細胞より分化させた造血前駆細胞にc-MYC,BMI1,BCL-XLを過剰に発現させると巨核球前駆細胞の状態で自己複製することを報告した6).この株化された細胞を不死化巨核球株と命名し,c-MYC,BMI1,BCL-XLの発現を消失させると分化および成熟が進み血小板が産生されることを示した.この系においては,ドキシサイクリンの添加によりにc-MYC,BMI1,BCL-XLをコードする外因性の遺伝子の発現が誘導され,ドキシサイクリンを除去すると発現の誘導が解除される.つまり,ドキシサイクリンの添加の有無により不死化巨核球株の増殖および分化を制御し,2ステップの培養により血小板が産生される系が構築された(図1).しかしながら,この2014年の時点において,すべての培養はフィーダー細胞に依存的であり,静置培養を基本とした培養系でしか血小板は産生されていなかった.したがって,振とう培養による大量培養を可能にするためにはフィーダー細胞に非依存的な培養法を構築する必要があった.不死化巨核球株がもつ安定した増殖の特性に起因して,増殖培養は容易に浮遊系に適応され一般的なかくはん方式により大量培養が可能であった一方,分化・成熟培養はフィーダー細胞に依存していた.そこで,フィーダー細胞への依存性を克服する薬剤を探索した結果,芳香族炭化水素受容体の拮抗剤であるSR1およびROCKの阻害剤であるY-27632の共添加が相乗的にはたらき,もっとも効果的にフィーダー細胞に非依存的に巨核球を成熟させることが明らかにされた.この培養系においては,巨核球の多核化および肥大化,および,血小板の分離膜の形成が促進されることも確認された.以上,浮遊培養系の構築によりフラスコを用いた振とう培養が実現したが,さらに,静置培養に比べ血小板の収量および機能が改善されることが明らかにされた.
SR1およびY27632の共添加により浮遊系での振とう培養が可能になったものの,不死化巨核球株の増殖培養と同一の振とう式の培養法では血小板は高効率で産生されなかった.これは,複雑な構造への形態の変化をともなう巨核球の分化・成熟培養において,単にかくはんするだけでは正常な血小板は産生されないことを意味した.そこで,生体における血小板の産生を観察するため,2光子顕微鏡を用いてマウスの頭蓋骨の骨髄をライブイメージングし取得された画像の血流の流体解析を実施することにより,巨核球の分化・成熟培養の際に要求される要素の抽出を試みた.その結果,巨核球から血小板が産生された部位の近傍において血流の流速や方向がいちじるしく変動し,せん断応力だけでなく乱流が発生していることが見い出された.これは,静止期の血小板を産生していない骨髄の巨核球においては観察されなかった.せん断応力に依存性の血小板の産生という古典的な概念をこえて8),血小板の産生には乱流が関与することが示唆された.
乱流を効率よく発生させるため,かくはん翼が上下に往復運動することによりかくはん力を発生させる培養装置を用いて検討したところ,血小板が効率よく産生された.さらに,0.3リットルおよび2.4リットルの異なるスケールの培養において培養槽での流体解析を実施したところ,乱流の負荷条件のなかでも,とくに乱流エネルギーおよびせん断応力だけが血小板の収量が最大となる至適な範囲で一致することが見い出された.この2つの指標がスケールアップファクターとなりうるかどうかを検証するため,2つの指標の値が至適な範囲におさまるよう設定したかくはん条件において,さらに8リットルにスケールを拡大して培養したところ,血小板の産生の効率は維持され1000億個以上の血小板が得られた.こうして得られた血小板は,電子顕微鏡による形態の観察の結果,ミトコンドリア,α顆粒,グリコーゲン顆粒,解放小管系の構造をもち,正常な血小板としての所見が得られた.また,in vitroにおける特性解析の結果,血小板の表面のホスファチジルセリンが低値の健全な血小板であり,顆粒の放出,1次凝集,血餅の退縮が認められた.さらに,マウスおよびウサギへ投与したところ,血中における循環能および出血時間を短縮する効果が認められ,献血に由来する血小板と同等の薬効が確認された.
乱流の環境下において血小板の産生量が増大する機序について解析するため,上下かくはん式の培養装置により得られた培養上清をプロテオーム解析したところ,静置条件の培養上清と比較して6つのタンパク質の分泌量が増加していた.この6つのタンパク質は,乱流が発生するものの微弱なフラスコ培養や,乱流が発生しないせん断応力に依存的に血小板を産生させるマイクロデバイス培養に添加したところ,血小板の産生量を増加させた.このことから,乱流により分泌の亢進した6つのタンパク質が細胞に作用することにより血小板の産生が増加するという機序が推察された.しかしながら,6つのタンパク質を含むコンディショニング培地を静置条件に添加しても血小板の産生量は増加しなかったことから,6つのタンパク質だけではなく,せん断応力を主とする物理的な条件も必要であることが示唆された.
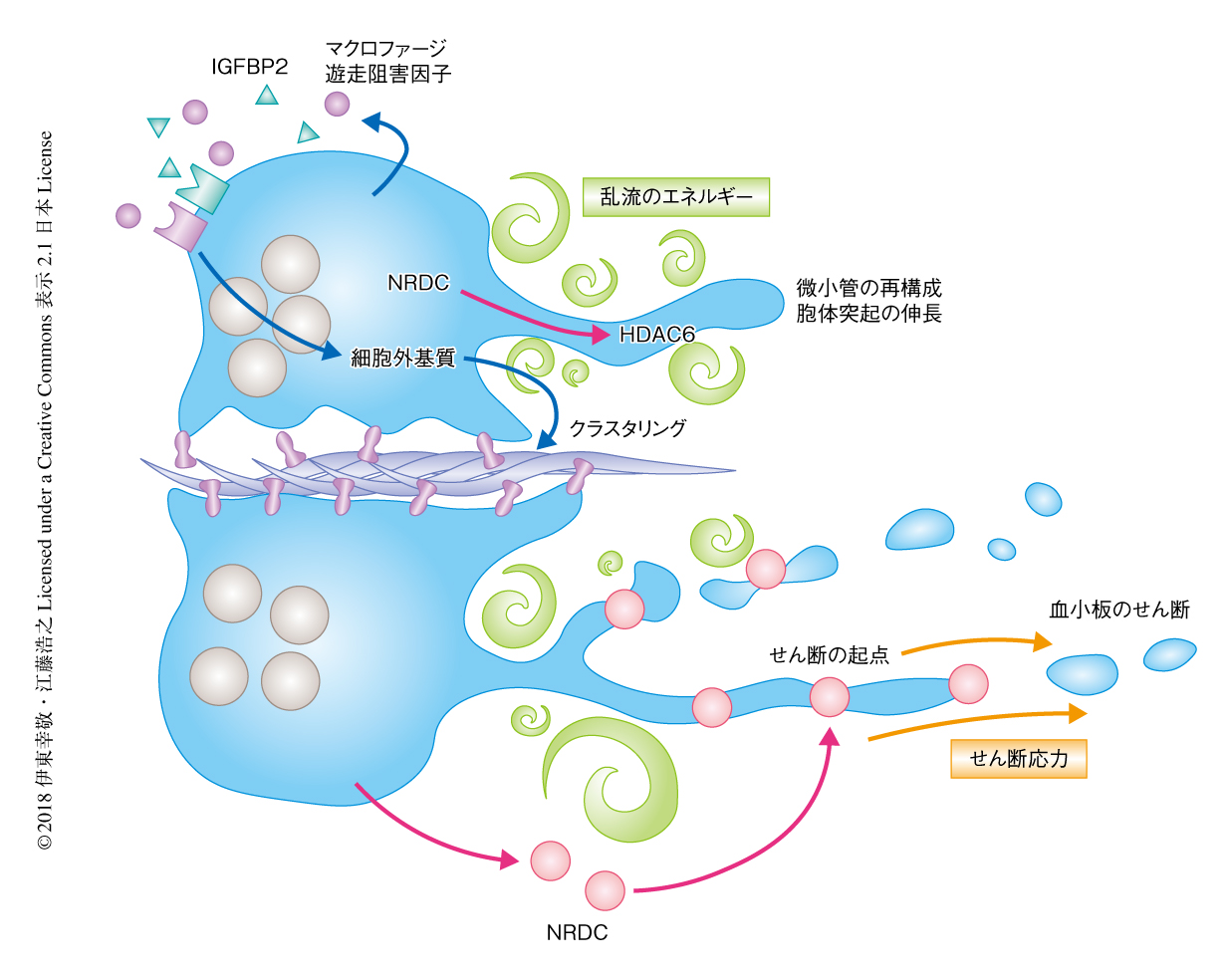
6つのタンパク質の機能を検討するため,マイクロデバイス培養を用いて血小板の産生を評価した結果,NRDC,マクロファージ遊走阻害因子,IGFBP2の非添加の条件において血小板の産生量が低下し,乱流エネルギーの負荷により分泌量の増加したこの3つのタンパク質が血小板の産生を促進することが強く示唆された.マイクロデバイス培養において血小板が産生されるようすを顕微鏡により観察した結果,および,巨核球における細胞外基質の発現を評価した結果,マクロファージ遊走阻害因子およびIGFBP2の非存在下においてvWFおよびVCAM1の分泌が低下したことから,血小板の産生量が増大する機序として細胞の粘着性の低下に起因する胞体突起の形成の不全が示唆された.一方,放出されたNRDCは胞体突起の細胞膜の外側でスポット状に集積した局在を示し,最終的な血小板のせん断に関与することが強く推察された.さらに,巨核球のNRDCは成熟にしたがい細胞核から細胞質さらに細胞膜の直下へと移動し,最終的にはα4Aチューブリンおよびβ1チューブリンと直接的に相互作用することが免疫沈降によるNRDCの共沈物の質量分析から明らかにされた.胞体突起はチューブリンヘテロ二量体より構成される微小管を裏打ちとして伸長することから9),NRDCが微小管の構造におよぼす影響について検討した結果,NRDCはαチューブリンの脱アセチル化に関与するHDAC6 10) とも相互作用することが明らかにされた.一方,HDAC6の阻害剤を添加することにより血小板の産生がいちじるしく減少したことから,巨核球においてNRDCはHDAC6によるαチューブリンの脱アセチル化を介して微小管の動的な不安定性に干渉し,微小管の伸長反応を促進することにより胞体突起の形成を促進する可能性が示唆された(図2).
この研究において,筆者らは,血小板の産生に乱流という新しい概念を見い出し,iPS細胞に由来する血小板を臨床へと応用する際の最大の課題であった臨床の規模での血小板の産生を達成した.さらに,マウスおよびウサギにおいて薬効が確認され,臨床にむけた概念を実証するデータが得られた.これは,生体において観察される現象と培養の結果を流体解析により結びつけることにより,in vivoとin vitroとのあいだにおける血小板の産生の効率の解離が縮められたと考えられる.今後,血小板のみならず,ほかの再生医療品において大量培養法を開発する際にも有効なスケールアップのモデルになると考えられる.くわえて,薬理的な作用をもつ血小板が産生されたことから,乱流を介した機序は生体にも存在することが示唆され,生理学的な現象の一端が明らかにされたと考えられる.また,乱流によりNRDC,マクロファージ遊走阻害因子,IGFBP2を介した細胞自律的な応答が促進されたことから,巨核球には乱流を感知するセンサーが存在することが示唆され,さらなる研究により血小板の産生の機構の解明につながるものと期待される.
略歴:2004年 大阪大学大学院生命機能研究科 修了,2014年よりメガカリオン 主任研究員.
研究テーマ:巨核球の成熟を制御する分子機構.
関心事:1日も早くiPS細胞に由来する血小板を患者にとどけること.
江藤 浩之(Koji Eto)
京都大学iPS細胞研究所 教授.
研究室URL:http://www.cira.kyoto-u.ac.jp/eto/
© 2018 伊東幸敬・江藤浩之 Licensed under CC 表示 2.1 日本
(京都大学iPS細胞研究所 臨床応用研究部門)
email:伊東幸敬,江藤浩之
DOI: 10.7875/first.author.2018.079
Turbulence activates platelet biogenesis to enable clinical scale ex vivo production.
Yukitaka Ito, Sou Nakamura, Naoshi Sugimoto, Tomohiro Shigemori, Yoshikazu Kato, Mikiko Ohno, Shinya Sakuma, Keitaro Ito, Hiroki Kumon, Hidenori Hirose, Haruki Okamoto, Masayuki Nogawa, Mio Iwasaki, Shunsuke Kihara, Kosuke Fujio, Takuya Matsumoto, Natsumi Higashi, Kazuya Hashimoto, Akira Sawaguchi, Ken-ichi Harimoto, Masato Nakagawa, Takuya Yamamoto, Makoto Handa, Naohide Watanabe, Eiichiro Nishi, Fumihito Arai, Satoshi Nishimura, Koji Eto
Cell, 174, 636-648.e18 (2018)
要 約
血小板の輸血は血小板の減少に対する治療法として有効であるものの,その供給すべてを献血に依存するため安定な供給を可能にする代替法が希求されている.しかしながら,実際に臨床で使用する量の血小板を培養により得た例はなかった.この研究において,筆者らは,芳香族炭化水素受容体の拮抗剤およびROCKの阻害剤の共添加により,iPS細胞を由来とする不死化巨核球株の浮遊培養系を構築した.さらに,培養の規模を拡大するうえで必要な物理的な要素を見い出すため,マウスの骨髄において血液の流体解析を実施したところ,乱流により血小板の産生が促進されることが示唆された.乱流を効率よく発生させる上下かくはん方式の培養装置を用いたところ機能的な血小板の産生が認められたため,さまざまなかくはん速度における培養槽での流体解析および血小板の産生量について2つの異なる培養スケールのあいだで比較したところ,血小板の収量が最大となる条件において一致する物理的な指標として乱流エネルギーおよびせん断応力が見い出された.この2つのパラメーターをスケールアップファクターとして8リットルスケールにて培養したところ,iPS細胞に由来する血小板が1バッチあたり1000億個以上も得られた.こうして得られた血小板はin vitroおよびin vivoにおける特性解析において献血に由来する血小板と同等の活性をもっていた.この研究により,臨床への応用の可能なスケールでiPS細胞に由来する血小板を産生させる方法が見い出されたのと同時に,巨核球には乱流という物理的な刺激により血小板の産生に必要なNRDC,マクロファージ遊走阻害因子,IGFBP2などを分泌して血小板の産生量を増大させる機序が存在することも明らかにされた.
はじめに
血小板製剤は血小板の減少や血小板の機能の異常に起因する出血の予防および治療のため輸血されるが,1回の輸血において使用される血小板は2000~3000億個と多く,生体外における培養により血小板を大量に産生するためには拡張性のある培養方式の構築および産生の効率の向上を達成する必要がある.血小板は生体において骨髄,肺,脾に存在する巨核球から産生されるが,巨核球は成熟する過程で多核化および肥大化して微小管の構造を裏打ちとする胞体突起が発達した形状へと形態が変化し,血流により生じるせん断応力が胞体突起に作用することにより血小板が巨核球よりせん断されて血中へと放出されると想定されてきた.世界的な競争においては,骨髄におけるせん断応力に依存的な血小板の産生の様式を再構築するマイクロデバイスを開発することが中心であった1-5).一方,筆者らは,工業規模での生産をみすえるとマイクロデバイスでは培養の規模の拡張に限界があることを予測し,独自に開発した不死化巨核球株(immortalized megakaryocyte progenitor cell line:imMKCL)を利用し6,7),容積効率のよいタンク方式による培養法の開発をめざした.
1.不死化巨核球株を用いたフィーダー細胞に非依存的な培養系の構築
筆者らの研究グループは,iPS細胞より分化させた造血前駆細胞にc-MYC,BMI1,BCL-XLを過剰に発現させると巨核球前駆細胞の状態で自己複製することを報告した6).この株化された細胞を不死化巨核球株と命名し,c-MYC,BMI1,BCL-XLの発現を消失させると分化および成熟が進み血小板が産生されることを示した.この系においては,ドキシサイクリンの添加によりにc-MYC,BMI1,BCL-XLをコードする外因性の遺伝子の発現が誘導され,ドキシサイクリンを除去すると発現の誘導が解除される.つまり,ドキシサイクリンの添加の有無により不死化巨核球株の増殖および分化を制御し,2ステップの培養により血小板が産生される系が構築された(図1).しかしながら,この2014年の時点において,すべての培養はフィーダー細胞に依存的であり,静置培養を基本とした培養系でしか血小板は産生されていなかった.したがって,振とう培養による大量培養を可能にするためにはフィーダー細胞に非依存的な培養法を構築する必要があった.不死化巨核球株がもつ安定した増殖の特性に起因して,増殖培養は容易に浮遊系に適応され一般的なかくはん方式により大量培養が可能であった一方,分化・成熟培養はフィーダー細胞に依存していた.そこで,フィーダー細胞への依存性を克服する薬剤を探索した結果,芳香族炭化水素受容体の拮抗剤であるSR1およびROCKの阻害剤であるY-27632の共添加が相乗的にはたらき,もっとも効果的にフィーダー細胞に非依存的に巨核球を成熟させることが明らかにされた.この培養系においては,巨核球の多核化および肥大化,および,血小板の分離膜の形成が促進されることも確認された.以上,浮遊培養系の構築によりフラスコを用いた振とう培養が実現したが,さらに,静置培養に比べ血小板の収量および機能が改善されることが明らかにされた.
2.マウスの骨髄における血液の流体解析
SR1およびY27632の共添加により浮遊系での振とう培養が可能になったものの,不死化巨核球株の増殖培養と同一の振とう式の培養法では血小板は高効率で産生されなかった.これは,複雑な構造への形態の変化をともなう巨核球の分化・成熟培養において,単にかくはんするだけでは正常な血小板は産生されないことを意味した.そこで,生体における血小板の産生を観察するため,2光子顕微鏡を用いてマウスの頭蓋骨の骨髄をライブイメージングし取得された画像の血流の流体解析を実施することにより,巨核球の分化・成熟培養の際に要求される要素の抽出を試みた.その結果,巨核球から血小板が産生された部位の近傍において血流の流速や方向がいちじるしく変動し,せん断応力だけでなく乱流が発生していることが見い出された.これは,静止期の血小板を産生していない骨髄の巨核球においては観察されなかった.せん断応力に依存性の血小板の産生という古典的な概念をこえて8),血小板の産生には乱流が関与することが示唆された.
3.乱流エネルギーおよびせん断応力の制御による培養系のスケールアップ
乱流を効率よく発生させるため,かくはん翼が上下に往復運動することによりかくはん力を発生させる培養装置を用いて検討したところ,血小板が効率よく産生された.さらに,0.3リットルおよび2.4リットルの異なるスケールの培養において培養槽での流体解析を実施したところ,乱流の負荷条件のなかでも,とくに乱流エネルギーおよびせん断応力だけが血小板の収量が最大となる至適な範囲で一致することが見い出された.この2つの指標がスケールアップファクターとなりうるかどうかを検証するため,2つの指標の値が至適な範囲におさまるよう設定したかくはん条件において,さらに8リットルにスケールを拡大して培養したところ,血小板の産生の効率は維持され1000億個以上の血小板が得られた.こうして得られた血小板は,電子顕微鏡による形態の観察の結果,ミトコンドリア,α顆粒,グリコーゲン顆粒,解放小管系の構造をもち,正常な血小板としての所見が得られた.また,in vitroにおける特性解析の結果,血小板の表面のホスファチジルセリンが低値の健全な血小板であり,顆粒の放出,1次凝集,血餅の退縮が認められた.さらに,マウスおよびウサギへ投与したところ,血中における循環能および出血時間を短縮する効果が認められ,献血に由来する血小板と同等の薬効が確認された.
4.乱流の刺激はNRDC,マクロファージ遊走阻害因子,IGFBP2の分泌を促進し血小板の産生を活性化する
乱流の環境下において血小板の産生量が増大する機序について解析するため,上下かくはん式の培養装置により得られた培養上清をプロテオーム解析したところ,静置条件の培養上清と比較して6つのタンパク質の分泌量が増加していた.この6つのタンパク質は,乱流が発生するものの微弱なフラスコ培養や,乱流が発生しないせん断応力に依存的に血小板を産生させるマイクロデバイス培養に添加したところ,血小板の産生量を増加させた.このことから,乱流により分泌の亢進した6つのタンパク質が細胞に作用することにより血小板の産生が増加するという機序が推察された.しかしながら,6つのタンパク質を含むコンディショニング培地を静置条件に添加しても血小板の産生量は増加しなかったことから,6つのタンパク質だけではなく,せん断応力を主とする物理的な条件も必要であることが示唆された.
6つのタンパク質の機能を検討するため,マイクロデバイス培養を用いて血小板の産生を評価した結果,NRDC,マクロファージ遊走阻害因子,IGFBP2の非添加の条件において血小板の産生量が低下し,乱流エネルギーの負荷により分泌量の増加したこの3つのタンパク質が血小板の産生を促進することが強く示唆された.マイクロデバイス培養において血小板が産生されるようすを顕微鏡により観察した結果,および,巨核球における細胞外基質の発現を評価した結果,マクロファージ遊走阻害因子およびIGFBP2の非存在下においてvWFおよびVCAM1の分泌が低下したことから,血小板の産生量が増大する機序として細胞の粘着性の低下に起因する胞体突起の形成の不全が示唆された.一方,放出されたNRDCは胞体突起の細胞膜の外側でスポット状に集積した局在を示し,最終的な血小板のせん断に関与することが強く推察された.さらに,巨核球のNRDCは成熟にしたがい細胞核から細胞質さらに細胞膜の直下へと移動し,最終的にはα4Aチューブリンおよびβ1チューブリンと直接的に相互作用することが免疫沈降によるNRDCの共沈物の質量分析から明らかにされた.胞体突起はチューブリンヘテロ二量体より構成される微小管を裏打ちとして伸長することから9),NRDCが微小管の構造におよぼす影響について検討した結果,NRDCはαチューブリンの脱アセチル化に関与するHDAC6 10) とも相互作用することが明らかにされた.一方,HDAC6の阻害剤を添加することにより血小板の産生がいちじるしく減少したことから,巨核球においてNRDCはHDAC6によるαチューブリンの脱アセチル化を介して微小管の動的な不安定性に干渉し,微小管の伸長反応を促進することにより胞体突起の形成を促進する可能性が示唆された(図2).
おわりに
この研究において,筆者らは,血小板の産生に乱流という新しい概念を見い出し,iPS細胞に由来する血小板を臨床へと応用する際の最大の課題であった臨床の規模での血小板の産生を達成した.さらに,マウスおよびウサギにおいて薬効が確認され,臨床にむけた概念を実証するデータが得られた.これは,生体において観察される現象と培養の結果を流体解析により結びつけることにより,in vivoとin vitroとのあいだにおける血小板の産生の効率の解離が縮められたと考えられる.今後,血小板のみならず,ほかの再生医療品において大量培養法を開発する際にも有効なスケールアップのモデルになると考えられる.くわえて,薬理的な作用をもつ血小板が産生されたことから,乱流を介した機序は生体にも存在することが示唆され,生理学的な現象の一端が明らかにされたと考えられる.また,乱流によりNRDC,マクロファージ遊走阻害因子,IGFBP2を介した細胞自律的な応答が促進されたことから,巨核球には乱流を感知するセンサーが存在することが示唆され,さらなる研究により血小板の産生の機構の解明につながるものと期待される.
文 献
- Thon, J. N., Mazutis, L., Wu, S. et al.: Platelet bioreactor-on-a-chip. Blood, 124, 1857-1867 (2014)[PubMed]
- Blin, A., Le Goff, A., Magniez, A. et al.: Microfluidic model of the platelet-generating organ: beyond bone marrow biomimetics. Sci. Rep., 6, 21700 (2016)[PubMed]
- Di Buduo, C. A., Wray, L. S., Tozzi, L. et al.: Programmable 3D silk bone marrow niche for platelet generation ex vivo and modeling of megakaryopoiesis pathologies. Blood, 125, 2254-2264 (2015)[PubMed]
- Nakagawa, Y., Nakamura, S., Nakajima, M. et al.: Two differential flows in a bioreactor promoted platelet generation from human pluripotent stem cell-derived megakaryocytes. Exp. Hematol., 41, 742-748 (2013)[PubMed]
- Avanzi, M. P., Oluwadara, O. E., Cushing, M. M. et al.: A novel bioreactor and culture method drives high yields of platelets from stem cells. Transfusion, 56, 170-178 (2016)[PubMed]
- Takayama, N., Nishimura, S., Nakamura, S. et al.: Transient activation of c-MYC expression is critical for efficient platelet generation from human induced pluripotent stem cells. J. Exp. Med., 207, 2817-2830 (2010)[PubMed]
- Nakamura, S., Takayama, N., Hirata, S. et al.: Expandable megakaryocyte cell lines enable clinically applicable generation of platelets from human induced pluripotent stem cells. Cell Stem Cell, 14, 535-548 (2014)[PubMed]
- Junt, T., Schulze, H., Chen, Z. et al.: Dynamic visualization of thrombopoiesis within bone marrow. Science, 317, 1767-1770 (2007)[PubMed]
- Bender, M., Thon. J. N., Ehrlicher, A. J. et al.: Microtubule sliding drives proplatelet elongation and is dependent on cytoplasmic dynein. Blood, 125, 860-868 (2015)[PubMed]
- Hubbert, C., Guardiola, A., Shao, R. et al.: HDAC6 is a microtubule-associated deacetylase. Nature, 417, 455-458 (2002)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2004年 大阪大学大学院生命機能研究科 修了,2014年よりメガカリオン 主任研究員.
研究テーマ:巨核球の成熟を制御する分子機構.
関心事:1日も早くiPS細胞に由来する血小板を患者にとどけること.
江藤 浩之(Koji Eto)
京都大学iPS細胞研究所 教授.
研究室URL:http://www.cira.kyoto-u.ac.jp/eto/
© 2018 伊東幸敬・江藤浩之 Licensed under CC 表示 2.1 日本