長鎖非コードRNAであるNEAT1の機能ドメインは相分離を介して核内構造体であるパラスペックルの形成をひき起こす
山崎智弘・廣瀬哲郎
(北海道大学遺伝子病制御研究所 RNA生体機能分野)
email:山崎智弘,廣瀬哲郎
DOI: 10.7875/first.author.2018.070
Functional domains of NEAT1 architectural lncRNA induce paraspeckle assembly through phase separation.
Tomohiro Yamazaki, Sylvie Souquere, Takeshi Chujo, Simon Kobelke, Yee Seng Chong, Archa H. Fox, Charles S. Bond, Shinichi Nakagawa, Gerard Pierron, Tetsuro Hirose
Molecular Cell, 70, 1038-1053.e7 (2018)
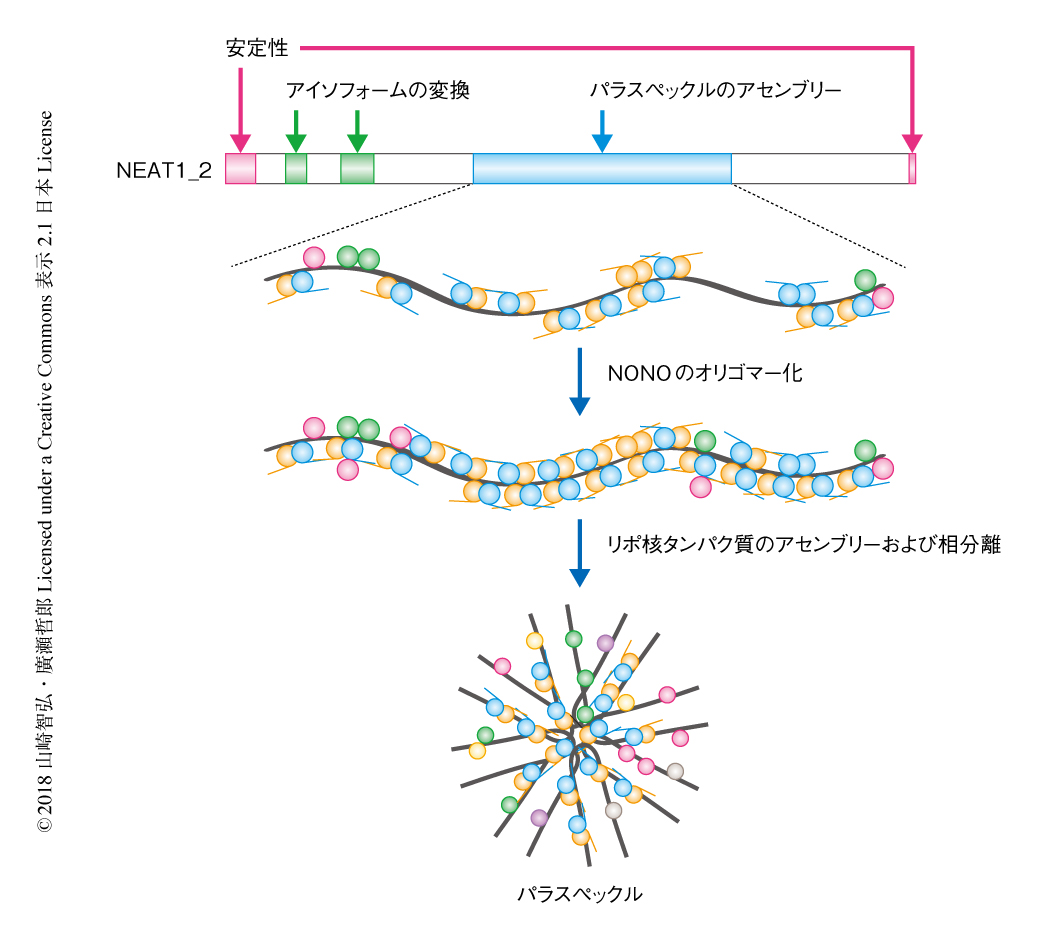
長鎖非コードRNAであるNEAT1は核内構造体であるパラスペックルの形成に必須である.NEAT1がいかにしてその機能を発揮するかを理解するため,その機能ドメインおよび機能ドメインと相互作用するタンパク質を同定しそれらの機能を解析した.その結果,NEAT1には,1)安定性,2)アイソフォームの変換,3)パラスペックルのアセンブリー,に必須の機能ドメインが存在し,モジュールドメイン構造をもっていた.また,NEAT1の中央領域はパラスペックルのアセンブリーに必要十分であり,この中央領域にはNONOなどパラスペックルの形成に必須のタンパク質が結合し,それらが二量体さらにはオリゴマーを形成することにより相分離したパラスペックルが形成されることが明らかにされた.この研究により,長鎖非コードRNAにより核内構造体が形成されるための分子基盤の一端が明らかにされた.
長鎖非コードRNA(long non-coding RNA:lncRNA)は200塩基以上の長さをもつタンパク質をコードしないRNAの総称である.たとえば,ヒトにおいては15,000個の遺伝子から25,000種類以上もの長鎖非コードRNAがゲノムの7割以上の領域から産生され,遺伝子の発現の制御などの機能を担うことが明らかにされつつある.これまでの解析により,長鎖非コードRNAは基本的にはタンパク質と複合体を形成して機能することがわかっている.しかしながら,長鎖非コードRNAの機能ドメインとそこに結合する因子(おもに,タンパク質)の同定はほとんど進んでおらず,そのため,長鎖非コードRNAの体系的な理解および機能の予測はむずかしい状況にある.長鎖非コードRNAの研究を加速するためには,その機能ドメインの同定がこれからの重要な課題である.
筆者らは,長鎖非コードRNAのうち核内構造体の構造の骨格として機能するarchitectural RNA(arcRNA)を発見し,その作用機構を研究してきた.NEAT1は代表的なarcRNAであり,核内構造体であるパラスペックルの形成に必須である1-3).一方,最近では,このような核内構造体をはじめ,細胞における種々の構造が相分離により形成されることが明らかにされ大きな注目をあつめている.そこで,筆者らは,NEAT1をarcRNAのモデルとして,RNAが起点となり相分離がひき起こされ構造体が構築される分子機構を明らかにすることを試みた.
パラスペックルは,もともと,核スペックルとよばれる核内構造体の近傍に形成される別の構造体として同定された4).この構造の骨格になるのがNEAT1である.NEAT1には2つのアイソフォームが存在し,短いNEAT1_1(ヒトでは,3.7 kb)および長いNEAT1_2(ヒトでは,23 kb)は3’側の選択的なプロセシング機構により産生される.また,パラスペックルの形成にはNEAT1_2のみが必須である5).パラスペックルは60種類以上ものタンパク質から構成されており,そのほとんどがRNA結合タンパク質である.これらの多くにはプリオン様ドメインやLCドメインとよばれる凝集しやすい性質をもつアミノ酸配列が含まれており,その性質がパラスペックルの形成に必須であることが明らかにされている5,6).パラスペックルは直径が400 nm近くにもなる巨大な構造体であるが,RNAおよびタンパク質がランダムに凝集したものではなく規則正しい構造をとる.つまり,NEAT1_2の5’側および3’側の領域はパラスペックルの表面(シェル)に配置しており,一方,中央領域はパラスペックルの中心(コア)に配置したコア-シェル構造をとる7,8).筆者らは,このようなユニークな特徴をもつパラスペックルが,NEAT1を骨格としてどのように構築されるのかその分子機構の解明を試みた.
これまで,NEAT1の機能ドメインについてはまったく知見がなかったことから,まず,1 kb程度の欠失を系統的にNEAT1に導入しその表現型を観察した.このとき,ヒトの1倍体細胞株であるHAP1細胞株にCRISPR-Cas9系を利用したゲノム編集法を組み合わせることにより,内在する1コピーのNEAT1遺伝子の一部を欠失させて,パラスペックルの形成およびNEAT1の発現などに対する影響について観察した(図1).その結果,いくつかの変異株においてパラスペックルの消失が認められ,その原因を解析したところ,NEAT1が不安定化されている場合,および,パラスペックルの形成に必須のNEAT1_2の発現が抑制されNEAT1_1が優先的に産生されている場合があった.これらの結果から,NEAT1にはそれ自体の安定性に影響をおよぼす領域,および,NEAT1_1の形成を促進しNEAT1_2の産生を抑制するアイソフォームの変換にかかわる領域が存在することが明らかにされた.
1 kb程度の欠失を導入する方法のほかに,より大きな領域を欠失させその表現型を観察した.NEAT1の中央領域を大きく欠失させた変異株のパラスペックルを超解像度顕微鏡および電子顕微鏡を用いて観察したところ,通常の規則的なコア-シェル構造が崩壊し矮小化した構造をとっていた.一方で,ほかの領域を同様に大きく欠失させた細胞株においてはこのような表現型は認められなかったことから,中央領域にはパラスペックルの形成のための特異的な機能が備わっていることが示唆された.このとき,NEAT1の発現はほとんど影響をうけなかったことから,この機能はパラスペックルのアセンブリーにかかわるものであることが示唆された.
NEAT1の中央領域がパラスペックルの形成に“必要”であることが明らかにされたが,つぎに,パラスペックルが巨大な構造を形成するために“必要十分”な領域を明らかにすることを試みた.NEAT1の中央領域およびNEAT1_2の安定な維持に必要な5’側および3’側の領域のみをもつ変異株を作製したところ,このNEAT1変異体は,NEAT1_2が23 kbあるのに対し,10 kb弱の長さであるにもかかわらず,規則的なコア-シェル構造をもつパラスペックルが形成された.
さらに,NEAT1の中央領域を大きく欠失させた変異体において,どの領域がとくに重要であるのか,NEAT1の中央領域およびNEAT1_2に安定な維持に必要な5’側および3’側の領域のみをもつ変異体の絞り込みにより探索した.その結果,NEAT1の中央領域には重複した機能をもつ複数のサブドメインが存在し,それらが機能することによりパラスペックルが形成されることが明らかにされた.
NEAT1の中央領域およびNEAT1_2に安定な維持に必要な5’側および3’側の領域のみをもつ変異体にさらに欠失を導入することにより,パラスペックルが形成されなくなった変異株が得られた.この変異体において欠失した領域はパラスペックルの形成に必須なタンパク質と相互作用する部位を含むと考え,この変異体にMS2系を用いてタンパク質を人為的に繋留し,どのタンパク質が欠失の影響を相補できるか調べた.その結果,NONO,SFPQ,FUSといったパラスペックルの形成に必須のタンパク質を繋留させるとパラスペックルの形成がひき起こされた.さらに,NONOについては,NOPSドメインとよばれる二量体の形成に必須の領域が相補の活性に重要であった.NONOはSFPQとヘテロ二量体を形成し,さらに,二量体どうしがオリゴマー化する性質をもつことが知られており,また,さきに述べた相補の活性にはNEAT1への繋留が必須であったことから,NEAT1においてNONOがオリゴマー化することがパラスペックルの初期の形成に必須であることが示唆された.
これまで,光退色後蛍光回復(fluorescence recovery after photobleaching:FRAP)法などによる解析からパラスペックルはダイナミックな構造体であり9),また,その形成にはプリオン様ドメインを介した相互作用が重要であることが明らかにされている6).これらの性質は,相分離したほかの核内構造体の特徴と合致したことから,疎水性の相互作用を弱めることにより相分離した構造体を崩壊させる試薬として用いられる1,6-ヘキサンジオールを用いて,パラスペックルの構造への影響について観察した.その結果,1,6-ヘキサンジオールの処理により,野生株,NEAT1の中央領域およびNEAT1_2に安定な維持に必要な5’側および3’側の領域のみをもつ変異株において,さらには,タンパク質の繋留により形成されたパラスペックルは一様に消失したことから,パラスペックルは相分離した構造体であることが強く示唆された.
HAP1細胞株を用いた解析により,NEAT1の中央領域の複数のサブドメインがパラスペックルの形成に必要であり,また,タンパク質の繋留によりNONOやSFPQがこれらの領域と相互作用して機能する可能性が示唆された.そこで,これらの領域に結合するタンパク質を同定した.まず,ビオチン化したRNAと核抽出物を用いたin vitro RNAプルダウン法により,中央領域の多くの領域にNONOおよびSFPQとの特異的な相互作用が認められ,とくに,機能的に重要であるNEAT1_2のサブドメインにNONOおよびSFPQがもっとも強く結合することが明らかにされた.一方で,NONOあるいはSFPQに対する抗体を用いたPAR-CLIP法によりin vivoにおいてNEAT1との結合部位を解析したところ,in vitro RNAプルダウン法により強い結合がみられたサブドメインに結合のピークが認められた.以上の結果から,in vitroおよびin vivoにおいて,パラスペックルの形成に必要なNEAT1のサブドメインがNONOおよびSFPQをリクルートしパラスペックルの形成をひき起こすことが示唆された.
RNAプルダウン法においては磁性ビーズを用いてNEAT1の機能ドメインと結合するタンパク質を回収していたが,このとき,NONOおよびSFPQが強く結合するRNA断片においては磁性ビーズが凝集することに気がついた.つまりこれは,NEAT1にNONOおよびSFPQが結合してリボ核タンパク質を形成し,それらがさらにアセンブリーすることによりパラスペックルを形成する過程の一部をin vitroにおいて再現している可能性が考えられた.NONOおよびSFPQとの結合がみられないアンチセンス鎖ではそのような現象は確認されなかった.さらに,NONOおよびSFPQを除いた核抽出物を用いるとその凝集が弱まったことから,NONOおよびSFPQがNEAT1と結合し,相転移をともなうリボ核タンパク質どうしの凝集をひき起こすことが強く示唆された.
この研究において,筆者らは,長鎖非コードRNAであるNEAT1をarcRNAのモデルとしてその機能ドメインを探索し,複数のモジュールドメイン構造をもつことを明らかにした(図2).さらに,NEAT1の中央領域には巨大な構造体であるパラスペックルのコアを形成する原動力となるNONOやSFPQなどのタンパク質が集積することにより,リボ核タンパク質どうしがアセンブリーし構造体を形成すると考えられた.また,NEAT1のさまざまな変異体を作製したが,もともと23 kbあるNEAT1_2を大きく欠失させてもパラスペックル様の構造体が形成されることは驚くべき結果であった.今後さらに,機能ドメインにある重要なRNA配列および2次構造を明らかにすることにより,長鎖非コードRNAにかくされた暗号を読み解きたいと考えている.また,この研究において樹立された細胞株は,NEAT1の構造体の形成機能や生理機能とそれを担う機能ドメインをつなぐうえで有用なリソースとなることが期待される.X染色体の不活性化にかかわる長鎖非コードRNAであるXISTの研究においても,2002年にXISTの機能ドメインが解析され10),そののちの多くの研究に影響をおよぼした.この研究が,NEAT1の研究における機能因子の同定の端緒となれば幸いである.また,パラスペックルを構成する因子については,NEAT1をはじめその多くがすでに明らかにされており,研究において非常によいモデル系である.このパラスペックルをモデルとして,RNAによる相分離の機構の解明などさまざまな生物学的な問いに対する重要な知見が得られることを期待している.
略歴:2010年 京都大学大学院生命科学研究科 修了,2011年 米国Harvard Medical School博士研究員を経て,2014年より北海道大学遺伝子病制御研究所 助教.
研究テーマ:長鎖非コードRNAによる分子作用の機構.現在,とくに,arcRNAによる核内構造体の構築の機構およびその機能の解明に注力している.
関心事:学生のリクルート.
廣瀬 哲郎(Tetsuro Hirose)
北海道大学遺伝子病制御研究所 教授.
研究室URL:http://www.igm.hokudai.ac.jp/rna/index.html
© 2018 山崎智弘・廣瀬哲郎 Licensed under CC 表示 2.1 日本
(北海道大学遺伝子病制御研究所 RNA生体機能分野)
email:山崎智弘,廣瀬哲郎
DOI: 10.7875/first.author.2018.070
Functional domains of NEAT1 architectural lncRNA induce paraspeckle assembly through phase separation.
Tomohiro Yamazaki, Sylvie Souquere, Takeshi Chujo, Simon Kobelke, Yee Seng Chong, Archa H. Fox, Charles S. Bond, Shinichi Nakagawa, Gerard Pierron, Tetsuro Hirose
Molecular Cell, 70, 1038-1053.e7 (2018)
要 約
長鎖非コードRNAであるNEAT1は核内構造体であるパラスペックルの形成に必須である.NEAT1がいかにしてその機能を発揮するかを理解するため,その機能ドメインおよび機能ドメインと相互作用するタンパク質を同定しそれらの機能を解析した.その結果,NEAT1には,1)安定性,2)アイソフォームの変換,3)パラスペックルのアセンブリー,に必須の機能ドメインが存在し,モジュールドメイン構造をもっていた.また,NEAT1の中央領域はパラスペックルのアセンブリーに必要十分であり,この中央領域にはNONOなどパラスペックルの形成に必須のタンパク質が結合し,それらが二量体さらにはオリゴマーを形成することにより相分離したパラスペックルが形成されることが明らかにされた.この研究により,長鎖非コードRNAにより核内構造体が形成されるための分子基盤の一端が明らかにされた.
はじめに
長鎖非コードRNA(long non-coding RNA:lncRNA)は200塩基以上の長さをもつタンパク質をコードしないRNAの総称である.たとえば,ヒトにおいては15,000個の遺伝子から25,000種類以上もの長鎖非コードRNAがゲノムの7割以上の領域から産生され,遺伝子の発現の制御などの機能を担うことが明らかにされつつある.これまでの解析により,長鎖非コードRNAは基本的にはタンパク質と複合体を形成して機能することがわかっている.しかしながら,長鎖非コードRNAの機能ドメインとそこに結合する因子(おもに,タンパク質)の同定はほとんど進んでおらず,そのため,長鎖非コードRNAの体系的な理解および機能の予測はむずかしい状況にある.長鎖非コードRNAの研究を加速するためには,その機能ドメインの同定がこれからの重要な課題である.
筆者らは,長鎖非コードRNAのうち核内構造体の構造の骨格として機能するarchitectural RNA(arcRNA)を発見し,その作用機構を研究してきた.NEAT1は代表的なarcRNAであり,核内構造体であるパラスペックルの形成に必須である1-3).一方,最近では,このような核内構造体をはじめ,細胞における種々の構造が相分離により形成されることが明らかにされ大きな注目をあつめている.そこで,筆者らは,NEAT1をarcRNAのモデルとして,RNAが起点となり相分離がひき起こされ構造体が構築される分子機構を明らかにすることを試みた.
パラスペックルは,もともと,核スペックルとよばれる核内構造体の近傍に形成される別の構造体として同定された4).この構造の骨格になるのがNEAT1である.NEAT1には2つのアイソフォームが存在し,短いNEAT1_1(ヒトでは,3.7 kb)および長いNEAT1_2(ヒトでは,23 kb)は3’側の選択的なプロセシング機構により産生される.また,パラスペックルの形成にはNEAT1_2のみが必須である5).パラスペックルは60種類以上ものタンパク質から構成されており,そのほとんどがRNA結合タンパク質である.これらの多くにはプリオン様ドメインやLCドメインとよばれる凝集しやすい性質をもつアミノ酸配列が含まれており,その性質がパラスペックルの形成に必須であることが明らかにされている5,6).パラスペックルは直径が400 nm近くにもなる巨大な構造体であるが,RNAおよびタンパク質がランダムに凝集したものではなく規則正しい構造をとる.つまり,NEAT1_2の5’側および3’側の領域はパラスペックルの表面(シェル)に配置しており,一方,中央領域はパラスペックルの中心(コア)に配置したコア-シェル構造をとる7,8).筆者らは,このようなユニークな特徴をもつパラスペックルが,NEAT1を骨格としてどのように構築されるのかその分子機構の解明を試みた.
1.ヒトの1倍体細胞株を用いたNEAT1の変異株の樹立およびその表現型の観察
これまで,NEAT1の機能ドメインについてはまったく知見がなかったことから,まず,1 kb程度の欠失を系統的にNEAT1に導入しその表現型を観察した.このとき,ヒトの1倍体細胞株であるHAP1細胞株にCRISPR-Cas9系を利用したゲノム編集法を組み合わせることにより,内在する1コピーのNEAT1遺伝子の一部を欠失させて,パラスペックルの形成およびNEAT1の発現などに対する影響について観察した(図1).その結果,いくつかの変異株においてパラスペックルの消失が認められ,その原因を解析したところ,NEAT1が不安定化されている場合,および,パラスペックルの形成に必須のNEAT1_2の発現が抑制されNEAT1_1が優先的に産生されている場合があった.これらの結果から,NEAT1にはそれ自体の安定性に影響をおよぼす領域,および,NEAT1_1の形成を促進しNEAT1_2の産生を抑制するアイソフォームの変換にかかわる領域が存在することが明らかにされた.
2.NEAT1の中央領域は複数のサブドメインからなりパラスペックルのアセンブリーに必要十分である
1 kb程度の欠失を導入する方法のほかに,より大きな領域を欠失させその表現型を観察した.NEAT1の中央領域を大きく欠失させた変異株のパラスペックルを超解像度顕微鏡および電子顕微鏡を用いて観察したところ,通常の規則的なコア-シェル構造が崩壊し矮小化した構造をとっていた.一方で,ほかの領域を同様に大きく欠失させた細胞株においてはこのような表現型は認められなかったことから,中央領域にはパラスペックルの形成のための特異的な機能が備わっていることが示唆された.このとき,NEAT1の発現はほとんど影響をうけなかったことから,この機能はパラスペックルのアセンブリーにかかわるものであることが示唆された.
NEAT1の中央領域がパラスペックルの形成に“必要”であることが明らかにされたが,つぎに,パラスペックルが巨大な構造を形成するために“必要十分”な領域を明らかにすることを試みた.NEAT1の中央領域およびNEAT1_2の安定な維持に必要な5’側および3’側の領域のみをもつ変異株を作製したところ,このNEAT1変異体は,NEAT1_2が23 kbあるのに対し,10 kb弱の長さであるにもかかわらず,規則的なコア-シェル構造をもつパラスペックルが形成された.
さらに,NEAT1の中央領域を大きく欠失させた変異体において,どの領域がとくに重要であるのか,NEAT1の中央領域およびNEAT1_2に安定な維持に必要な5’側および3’側の領域のみをもつ変異体の絞り込みにより探索した.その結果,NEAT1の中央領域には重複した機能をもつ複数のサブドメインが存在し,それらが機能することによりパラスペックルが形成されることが明らかにされた.
3.NONO,SFPQ,FUSのNEAT1への人為的な繋留により相分離したパラスペックルの形成がひき起こされる
NEAT1の中央領域およびNEAT1_2に安定な維持に必要な5’側および3’側の領域のみをもつ変異体にさらに欠失を導入することにより,パラスペックルが形成されなくなった変異株が得られた.この変異体において欠失した領域はパラスペックルの形成に必須なタンパク質と相互作用する部位を含むと考え,この変異体にMS2系を用いてタンパク質を人為的に繋留し,どのタンパク質が欠失の影響を相補できるか調べた.その結果,NONO,SFPQ,FUSといったパラスペックルの形成に必須のタンパク質を繋留させるとパラスペックルの形成がひき起こされた.さらに,NONOについては,NOPSドメインとよばれる二量体の形成に必須の領域が相補の活性に重要であった.NONOはSFPQとヘテロ二量体を形成し,さらに,二量体どうしがオリゴマー化する性質をもつことが知られており,また,さきに述べた相補の活性にはNEAT1への繋留が必須であったことから,NEAT1においてNONOがオリゴマー化することがパラスペックルの初期の形成に必須であることが示唆された.
これまで,光退色後蛍光回復(fluorescence recovery after photobleaching:FRAP)法などによる解析からパラスペックルはダイナミックな構造体であり9),また,その形成にはプリオン様ドメインを介した相互作用が重要であることが明らかにされている6).これらの性質は,相分離したほかの核内構造体の特徴と合致したことから,疎水性の相互作用を弱めることにより相分離した構造体を崩壊させる試薬として用いられる1,6-ヘキサンジオールを用いて,パラスペックルの構造への影響について観察した.その結果,1,6-ヘキサンジオールの処理により,野生株,NEAT1の中央領域およびNEAT1_2に安定な維持に必要な5’側および3’側の領域のみをもつ変異株において,さらには,タンパク質の繋留により形成されたパラスペックルは一様に消失したことから,パラスペックルは相分離した構造体であることが強く示唆された.
4.NEAT1の中央領域のサブドメインはNONOおよびSFPQと強く相互作用する
HAP1細胞株を用いた解析により,NEAT1の中央領域の複数のサブドメインがパラスペックルの形成に必要であり,また,タンパク質の繋留によりNONOやSFPQがこれらの領域と相互作用して機能する可能性が示唆された.そこで,これらの領域に結合するタンパク質を同定した.まず,ビオチン化したRNAと核抽出物を用いたin vitro RNAプルダウン法により,中央領域の多くの領域にNONOおよびSFPQとの特異的な相互作用が認められ,とくに,機能的に重要であるNEAT1_2のサブドメインにNONOおよびSFPQがもっとも強く結合することが明らかにされた.一方で,NONOあるいはSFPQに対する抗体を用いたPAR-CLIP法によりin vivoにおいてNEAT1との結合部位を解析したところ,in vitro RNAプルダウン法により強い結合がみられたサブドメインに結合のピークが認められた.以上の結果から,in vitroおよびin vivoにおいて,パラスペックルの形成に必要なNEAT1のサブドメインがNONOおよびSFPQをリクルートしパラスペックルの形成をひき起こすことが示唆された.
5.NEAT1の中央領域のサブドメインはin vitroにおいてNONOおよびSFPQとの結合を介してリボ核タンパク質の凝集をひき起こす
RNAプルダウン法においては磁性ビーズを用いてNEAT1の機能ドメインと結合するタンパク質を回収していたが,このとき,NONOおよびSFPQが強く結合するRNA断片においては磁性ビーズが凝集することに気がついた.つまりこれは,NEAT1にNONOおよびSFPQが結合してリボ核タンパク質を形成し,それらがさらにアセンブリーすることによりパラスペックルを形成する過程の一部をin vitroにおいて再現している可能性が考えられた.NONOおよびSFPQとの結合がみられないアンチセンス鎖ではそのような現象は確認されなかった.さらに,NONOおよびSFPQを除いた核抽出物を用いるとその凝集が弱まったことから,NONOおよびSFPQがNEAT1と結合し,相転移をともなうリボ核タンパク質どうしの凝集をひき起こすことが強く示唆された.
おわりに
この研究において,筆者らは,長鎖非コードRNAであるNEAT1をarcRNAのモデルとしてその機能ドメインを探索し,複数のモジュールドメイン構造をもつことを明らかにした(図2).さらに,NEAT1の中央領域には巨大な構造体であるパラスペックルのコアを形成する原動力となるNONOやSFPQなどのタンパク質が集積することにより,リボ核タンパク質どうしがアセンブリーし構造体を形成すると考えられた.また,NEAT1のさまざまな変異体を作製したが,もともと23 kbあるNEAT1_2を大きく欠失させてもパラスペックル様の構造体が形成されることは驚くべき結果であった.今後さらに,機能ドメインにある重要なRNA配列および2次構造を明らかにすることにより,長鎖非コードRNAにかくされた暗号を読み解きたいと考えている.また,この研究において樹立された細胞株は,NEAT1の構造体の形成機能や生理機能とそれを担う機能ドメインをつなぐうえで有用なリソースとなることが期待される.X染色体の不活性化にかかわる長鎖非コードRNAであるXISTの研究においても,2002年にXISTの機能ドメインが解析され10),そののちの多くの研究に影響をおよぼした.この研究が,NEAT1の研究における機能因子の同定の端緒となれば幸いである.また,パラスペックルを構成する因子については,NEAT1をはじめその多くがすでに明らかにされており,研究において非常によいモデル系である.このパラスペックルをモデルとして,RNAによる相分離の機構の解明などさまざまな生物学的な問いに対する重要な知見が得られることを期待している.
文 献
- Sasaki, Y. T., Ideue, T., Sano, M. et al.: MENε/β noncoding RNAs are essential for structural integrity of nuclear paraspeckle. Proc. Natl. Acad. Sci. USA, 106, 2525-2530 (2009)[PubMed]
- Sunwoo, H., Dinger, M. E., Wilusz, J. E. et al.: MEN ε/β nuclear-retained non-coding RNAs are up-regulated upon muscle differentiation and are essential component of paraspeckles. Genome Res., 19, 347-359 (2009)[PubMed]
- Clemson, C. M., Hutchinson, J. N., Sara, S. A. et al.: An architectural role for a nuclear non-coding RNA: NEAT1 RNA is essential for the structure of paraspeckles. Mol. Cell, 33, 717-726 (2009)[PubMed]
- Fox, A. H., Lam, Y. W., Leung, A. K. et al.: Paraspeckles: A novel nuclear domain. Curr. Biol., 12, 13-25 (2002)[PubMed]
- Naganuma, T., Nakagawa, S., Tanigawa, A. et al.: Alternative 3’-end processing of long noncoding RNA initiates construction of nuclear paraspeckles. EMBO J., 31, 4020-4034 (2012)[PubMed]
- Hennig, S., Kong, G., Mannen, T. et al.: Prion-like domains in RNA binding proteins are essential for building subnuclear paraspeckles. J. Cell Biol., 210, 529-539 (2015)[PubMed]
- Souquere, S., Beauclair, G., Harper, F. et al.: Highly ordered spatial organization of the structural long noncoding NEAT1 RNAs within paraspeckle nuclear bodies. Mol. Biol. Cell, 21, 4020-4027 (2012)[PubMed]
- West, J. A., Mito, M., Kurosaka, S. et al.: Structural, super-resolution microscopy analysis of paraspeckle nuclear body organization. J. Cell Biol., 214, 817-830 (2016)[PubMed]
- Mao, Y. S., Sunwoo, H., Zhang, B. et al.: Direct visualization of the co-transcriptional assembly of a nuclear body by noncoding RNAs. Nat. Cell Biol., 13, 95-101 (2011)[PubMed]
- Wutz, A., Rasmussen, T. P. & Jaenisch, R.: Chromosomal silencing and localizationare mediated by different domains of Xist RNA. Nat. Genet., 30, 167-174 (2002)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2010年 京都大学大学院生命科学研究科 修了,2011年 米国Harvard Medical School博士研究員を経て,2014年より北海道大学遺伝子病制御研究所 助教.
研究テーマ:長鎖非コードRNAによる分子作用の機構.現在,とくに,arcRNAによる核内構造体の構築の機構およびその機能の解明に注力している.
関心事:学生のリクルート.
廣瀬 哲郎(Tetsuro Hirose)
北海道大学遺伝子病制御研究所 教授.
研究室URL:http://www.igm.hokudai.ac.jp/rna/index.html
© 2018 山崎智弘・廣瀬哲郎 Licensed under CC 表示 2.1 日本