クライオ電子顕微鏡によるμオピオイド受容体とGiタンパク質との複合体の構造解析
前田将司・Antoine Koehl・Brian K. Kobilka
(米国Stanford大学School of Medicine,Department of Molecular and Cellular Physiology)
email:前田将司
DOI: 10.7875/first.author.2018.068
Structure of the μ-opioid receptor-Gi protein complex.
Antoine Koehl, Hongli Hu, Shoji Maeda, Yan Zhang, Qianhui Qu, Joseph M. Paggi, Naomi R. Latorraca, Daniel Hilger, Roger Dawson, Hugues Matile, Gebhard F. X. Schertler, Sebastien Granier, William I. Weis, Ron O. Dror, Aashish Manglik, Georgios Skiniotis, Brian K. Kobilka
Nature, 558, 547-552 (2018)
μオピオイド受容体はGタンパク質共役受容体のひとつであり,医療などに使用されるオピオイドの標的である.μオピオイド受容体の活性化による効果としては鎮痛作用や陶酔作用があげられるが,これらの効果は,μオピオイド受容体によるGiタンパク質におけるGDP-GTP交換反応,および,その下流のアデニル酸シクラーゼの活性の抑制によりもたらされる.この研究において,筆者らは,クライオ電子顕微鏡による解析により,アゴニストであるDAMGOの結合したμオピオイド受容体とGiタンパク質との複合体の構造を3.5Å分解能で決定した.DAMGOはそのN末端側がオピオイド受容体ファミリーに保存されたリガンド結合ポケットにはまり込み,C末端側はオピオイド受容体ファミリーのあいだの選択性にかかわる領域と相互作用していた.Gタンパク質共役受容体とGsタンパク質との複合体との構造の比較により,異なるGタンパク質と共役するGタンパク質共役受容体のそれぞれの特徴,とくに,Gタンパク質共役受容体の膜貫通ヘリックス6の位置,および,Gタンパク質のα5ヘリックスを介した相互作用の様式の違いが明らかにされた.
オピオイドとは鎮痛作用や陶酔作用をもつアルカロイド,合成化合物,内在性の化合物の総称である.すぐれた鎮痛作用をもつため,手術の際の麻酔として,あるいは,がんの末期にともなうような強い痛みを緩和するために用いられる.その一方で,強い依存性や呼吸器の抑制作用といった副作用もともなう.米国においては,比較的入手しやすいこともあり,近年,オピオイドの過剰摂取が大きな社会問題となっている.こうした背景もあり,より副作用の低い安全なオピオイド化合物の開発への期待が大きく高まっている.
オピオイドはGタンパク質共役受容体であるμ,δ,κの3つのオピオイド受容体に作用し,鎮痛作用の発現はおもにμオピオイド受容体を介する.ほかのGタンパク質共役受容体と同じく,μオピオイド受容体もGタンパク質を介したシグナル伝達経路およびアレスチンを介したシグナル伝達経路の両方を活性化する.このうち,薬理的に有用な鎮痛作用はGiタンパク質を介したシグナル伝達経路が寄与し,副作用とされる呼吸の障害はアレスチンを経由したシグナル伝達経路によることが近年の研究により明らかにされてきた1).アレスチンを介したシグナル伝達経路を活性化せずGiタンパク質を介したシグナル伝達経路のみを選択的に活性化することができれば,副作用を抑えた有益な効果のみを発揮することが期待される2).
Gタンパク質共役受容体とGタンパク質との複合体の構造は,2011年にβ2アドレナリン受容体とGsタンパク質との複合体の構造がX線結晶構造解析により解かれて以降,これまでに,2種類のファミリーBに属するGタンパク質共役受容体とGsタンパク質との複合体の構造がクライオ電子顕微鏡により解かれたのみである3-5).Gタンパク質にはいくつかのファミリーが存在するなか,Gタンパク質共役受容体がいかにして特定のGタンパク質を選択的に認識するのかについての構造的な基盤についてはいまだ全容は解明されていない.μオピオイド受容体はGi/oファミリーとのみ共役するGタンパク質共役受容体であり,それらの複合体の構造は異なるGタンパク質への選択性を議論するうえで非常に有用な情報となる.
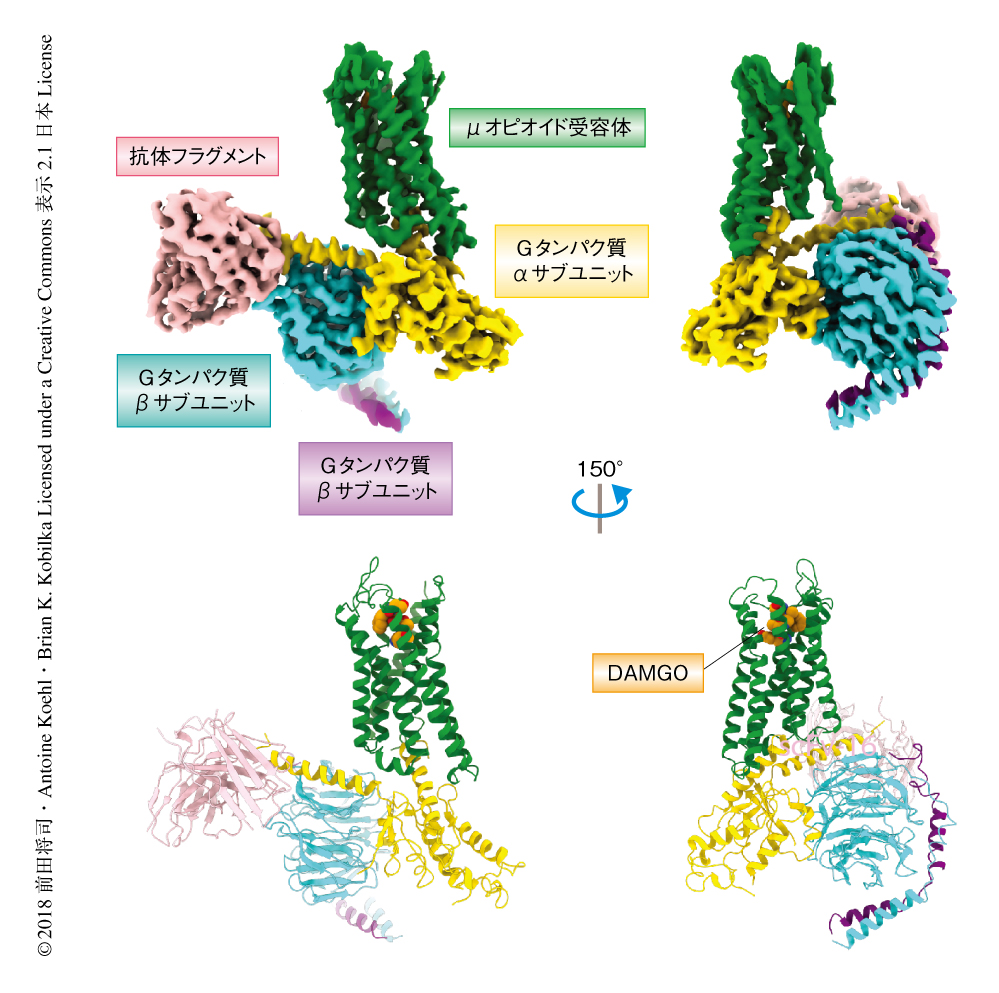
昆虫細胞を用いた発現系により発現させたマウスに由来するμオピオイド受容体,および,ヒトに由来するGi1をそれぞれ個別に精製し,アゴニストであるDAMGOの存在下において混合することにより複合体を調製した.この過程において,ジホスホヒドロラーゼであるアピラーゼをくわえることにより,Gi1から放出されたGDPをGMPへと加水分解し,GDPがμオピオイド受容体-Gi1複合体と再結合し解離させるのをふせいだ.さらに,複合体を安定化させる効果をもつ抗体フラグメントをくわえたのち,非晶質の氷に包埋してクライオ電子顕微鏡にて複合体の画像を収集し,単粒子解析法により最終的に3.5Å分解能のマップを取得した.使用した抗体フラグメントはGタンパク質のαサブユニットとβサブユニットから構成される表面構造をエピトープにもち,分子量の増大に寄与しただけでなく,分子に非対称的な概形をあたえることにより単粒子解析にも寄与した.マップの精密化の過程においては,Gタンパク質のαヘリカルドメインに相当する領域のマップを除いた.これは,一連の先行研究により,Gタンパク質共役受容体と結合しGDPを放出した状態のGタンパク質はこの領域がRas様ドメインから解離しフレキシブルな状態をとることが知られていたためである3-5).実際に,初期のマップの時点ではこの領域に相当する部分はほかの領域に比べて弱いシグナルをあたえるのみであった.活性型μオピオイド受容体および三量体Gタンパク質のそれぞれの構造はすでにX線結晶構造解析により解かれており,これらを参照してマップにあてはめ精密化しμオピオイド受容体とGi1との複合体の構造を決定した(図1,PDB ID:6DDE).得られた全体構造は,さきに構造が解かれていたβ2アドレナリン受容体とGsタンパク質との複合体とよく似ており,Gタンパク質の異なるファミリーともに共通した活性化の機構をもつことが示唆された.
以前に構造が決定された活性型μオピオイド受容体は,BU72という多環構造をもつ強固な低分子アゴニストを用いて結晶化された6).DAMGOはこれとは対称的に,ペプチドからなる柔軟な構造をもつアゴニストである.このように,非常に異なる構造をもつ2つのアゴニストであるが,μオピオイド受容体とGiタンパク質との複合体の構造のリガンド結合部位をBU72結合型の構造と比較したところ,アミノ酸側鎖の部位および配置が非常によく似ていた.このことから,μオピオイド受容体はアゴニストの構造にかかわらず,それらのなかで鍵となる構造的な特徴を同じ結合様式により認識する可能性が示唆された.
μオピオイド受容体とGiタンパク質との複合体においてDAMGOはN末端側がBU72と同じ部位をしめ,C末端側は細胞外にむけてそこからさらに8Åほどつき出ていた.このC末端側に位置するN(Me)Pheは細胞外ループ1の近くに位置する疎水性のポケットにはまり込んでおり,つぎのGly-OHはDAMGOの側へともどりこむ構造をしていた.DAMGOはほかのオピオイド受容体のメンバーに比べてμオピオイド受容体への選択性が500倍ほど高く,これまでの研究により,この選択性は細胞外ループ1からの寄与によるものであることがわかっていた7).μオピオイド受容体とGiタンパク質との複合体の構造から,その選択性をあたえる上記のような構造の基盤がみえてきた.
DAMGOのN末端に位置するチロシン基またはそれに相当する化学構造はBU72をはじめとしたほかのリガンドにも存在し,結晶構造において同様の位置をしめていた.この結合様式は分子動力学シミュレーションによる解析によっても1μ秒以上にわたり安定して存在し,あらためてこの相互作用の強固さが支持された.分子動力学シミュレーションにおいては同時に,このチロシン基を基盤として水分子を介した水素結合ネットワークが膜貫通ヘリックス6のHis297へとつながることが確認された.同様の水分子は2.2Å分解能とより高分解能なBU72結合型の結晶構造においては電子密度として確認され,この水分子を介したフェノール基とHis297の結合様式はオピオイド受容体がモルフィンや類似する化合物あるいはペプチドを認識する際に共通する機構であると考えられた.
以前に得られた活性型μオピオイド受容体の結晶構造は,細胞の内側のGタンパク質結合部位をこれに類似したナノボディNb39がしめることにより構造を固定していた6).μオピオイド受容体とGiタンパク質との複合体の構造をナノボディ結合型の構造と比較すると,活性型のGタンパク質共役受容体に特徴的な膜貫通ヘリックス6が外側に大きく開いた状態,また,Gタンパク質共役受容体において高度に保存されその活性化に重要な役割をもつ膜貫通ヘリックス3のDRY(Asp-Arg-Tyr)モチーフ,膜貫通ヘリックス7のNPXXY(Asn-Pro-X-X-Tyr)モチーフ,および,受容体コア領域において形成される膜貫通ヘリックス5のPro,膜貫通ヘリックス3のIle,膜貫通ヘリックス6のPheからなるPIFモチーフは,ほぼ同一であった.2つの別個なパートナーとの結合により類似した構造が得られたことから,これらの大きな構造の変化が細胞内結合タンパク質によりひき起こされたものではなく,アゴニストとの結合によりひき起こされたものであることが示された.
μオピオイド受容体とGiタンパク質との複合体の構造とナノボディ結合型の構造は非常に類似していたが,詳細な部分では2つの違いがみられた.1つ目は外側に大きく開いた膜貫通ヘリックス6がその細胞質の内側の部位を膜貫通ヘリックス7の側に3Åほどさらに移動していたこと,2つ目は細胞内ループ3の構造がやや異なることであった.この2つの違いについては,それが細胞の内部に位置してそれぞれの結合のパートナーとの接触面にあったことから,結合のパートナーであるナノボディとGiタンパク質との違いに起因するものであると考えられた.のちに述べるように,この細胞内ループ3と膜貫通ヘリックス6によるGiタンパク質との相互作用は,β2アドレナリン受容体とGsタンパク質との複合体における相互作用とは異なるものであった.
Gタンパク質にはGs,Gi/o,Gq/11,G12/13の大きく4つのファミリーが存在する.多くの場合,ひとつのGタンパク質共役受容体は1種類以上のGタンパク質と共役し,よく研究された代表的な例として,Gsタンパク質およびGiタンパク質と共役するβ2アドレナリン受容体があげられる.一方で,μオピオイド受容体はGi/oファミリーとのみ選択的に共役することが知られている8).以前のGタンパク質共役受容体のアミノ酸配列からGタンパク質との共役の特異性を解明しようとする試みは明確な答えを見い出すことにはつながらず,このことから,特異性を決定するのは1次構造ではなくより複雑な立体構造における相互作用ネットワークであることが示唆された.μオピオイド受容体とGiタンパク質との複合体の全体構造はβ2アドレナリン受容体とGsタンパク質との複合体とよく似ていたが,そのなかできわだった違いがみられたのは,Gタンパク質のα5ヘリックスの位置および向きであった.2つのGタンパク質共役複合体を受容体をもとに重ね合わせると,Giタンパク質のα5ヘリックスはGsタンパク質と比べ21度ほど回転しており,そのため,その末端はGsタンパク質の先端に比べ5Åほど膜貫通ヘリックス7の側(膜貫通ヘリックス6からはなれる方向)にむけ移動していた.このα5ヘリックスの移動にともない,Gタンパク質共役受容体の膜貫通ヘリックス6の外側への開きぐあいがμオピオイド受容体においてはβ2アドレナリン受容体よりも9Åほど小さくなっていた.Gsタンパク質のα5ヘリックスを形成するアミノ酸残基はGiタンパク質と比べ側鎖が大きく,C末端から-3位と-4位に位置する残基は,Giタンパク質ではGlyとCysであるのに対し,Gsタンパク質ではGluとTyrである.μオピオイド受容体とGiタンパク質との複合体においてこれらの残基をGsタンパク質の対応する残基と置換すると,置換された残基の側鎖が立体障害を起こしGタンパク質結合ポケットに入り込むことができない.一方,β2アドレナリン受容体のほかGsタンパク質との複合体の構造が解かれているカルシトニン受容体およびグルカゴン様ペプチド1受容体は,μオピオイド受容体やβ2アドレナリン受容体とは異なりファミリーBに属する.これらのGタンパク質共役受容体においては,膜貫通ヘリックス6はさらに大きく外側に折れ曲がりポケットへのGsタンパク質の挿入が可能になっている.
Gタンパク質共役受容体とGタンパク質とのおのおのの相互作用の部位に注目としたところ,細胞内ループ2においてはいくつかの異なる相互作用が貢献していた.第1には,Asp177がα1-β1ループのArg32とイオン性の相互作用を形成しており,このAsp177に相当する位置はオピオイド受容体のあいだではAspが保存されていたものの,Giタンパク質と共役するほかのGタンパク質共役受容体では多様であった.第2には,Arg179が膜貫通ヘリックス3のAsp164およびα5ヘリックスのAsp350とイオン性の相互作用を形成していた.μオピオイド受容体の多形バリアントであるArg179Cys変異体はGiタンパク質へのシグナル伝達能に欠けることや9),このArg179に相当する位置は多くのGiタンパク質と共役するほかのGタンパク質共役受容体ではArgあるいはLysであることから,このイオン性の相互作用がGiタンパク質との共役に重要な役割をはたすことが示唆された.この位置に対応する残基はGsタンパク質と共役するGタンパク質共役受容体ではほかの残基に置換されており,Gqタンパク質と共役するGタンパク質共役受容体では塩基性残基の保存はまばらである.これらにくわえ,Pro172およびVal173がGiタンパク質のα1-β1ループ,β2-β3ループ,α5ヘリックスにより形成されるポケットと疎水性の相互作用を形成していた.同様の疎水性の相互作用はβ2アドレナリン受容体とGsタンパク質との複合体においてもみられた.
細胞内ループ3においては,大きく2つの相互作用がμオピオイド受容体とGiタンパク質とのあいだで形成されていた.ひとつはVal262,Met264,Leu265とα5ヘリックスの疎水性の側面とが形成する相互作用である.これは,細胞内ループの構成や側鎖の種類は異なるものの,同様の疎水性の相互作用がβ2アドレナリン受容体とGsタンパク質との複合体においても形成されていた.もうひとつはArg263とGiタンパク質のβ6ストランドにあるIle319の主鎖カルボニル基との極性の相互作用である.このArg263の変異体はGiタンパク質へのシグナル伝達が低下すること,また,β2アドレナリン受容体とGsタンパク質との複合体においては同様の相互作用がみられないことから,この認識の機構がGiタンパク質へのシグナル伝達において重要な役割をはたす可能性が示唆された.Gsタンパク質に比べGiタンパク質は自発的なGDPの放出の遅いことが知られており,この極性の相互作用が効率のよいGDPの放出にかかわるのかもしれない.
Gタンパク質共役受容体の膜貫通ヘリックス3,膜貫通ヘリックス5,膜貫通ヘリックス6の細胞の内側の領域もまたGiタンパク質,とりわけ,α5ヘリックスとの相互作用を担っていた.膜貫通ヘリックス3はGiタンパク質のCys351と非常に近接しており,膜貫通ヘリックス5あるいは膜貫通ヘリックス6に位置するMet255,Ile278,Met281,Val282はGiタンパク質のLeu353と疎水性の相互作用を形成していた.Giタンパク質のCys351は百日咳毒素がADP-リボース化によりGタンパク質共役受容体からGiタンパク質へのシグナル伝達を阻害する際の標的となる残基である.この部位に大きなADP-リボースが結合することは膜貫通ヘリックス3への近接,ひいては,α5ヘリックスのGタンパク質共役受容体のGタンパク質結合ポケットへの挿入を阻害することになる.Met255,Met281はNMRによる観測によりDAMGOに依存的にその化学シフトを変化させることが示されており10),これらの位置する膜貫通ヘリックス5および膜貫通ヘリックス6がGタンパク質への共役にさきだち構造変化を起こすことが示唆された.膜貫通ヘリックス6からはさらにArg277がGiタンパク質のIle355の主鎖カルボニル基とのあいだで極性の相互作用を形成する.これらα5ヘリックスを介したμオピオイド受容体との相互作用のパターンはβ2アドレナリン受容体とGsタンパク質との複合体とはまったく異なっており,こうした違いもまた,異なるGタンパク質への共役の特異性を担うものと考えられた.
今回の研究により,μオピオイド受容体とGiタンパク質との複合体とGsタンパク質との複合体との比較においては合理的な説明をあたえるモデルが得られたが,現在のところ,これが包括的あるいは普遍的に説明されるモデルをたてるまでにはいたっていない.今後,さらなる複合体の構造が明らかになるにつれ,Gタンパク質のファミリーごとのGタンパク質共役受容体の共通の認識パターンがみえてくるかもしれない.あるいは,Gタンパク質共役受容体とGタンパク質との特異性は,Gタンパク質からGDPが放出される以前の段階で決定される可能性も考えられる11).このような非常に一過性の状態をとらえるためには,構造解析の手法のみならず,より時間分解能の高い手法との組合せが効果的であると思われる.また,残るほかのGタンパク質のファミリー,とくにGqタンパク質とGタンパク質共役受容体との特異性の決定の機構も大きな課題として残されている.
略歴:米国Stanford大学School of MedicineにてBasic Life Science Research Scientist.
研究テーマ:Gタンパク質共役受容体シグナルの分子作動機構.
Antoine Koehl
米国Stanford大学School of MedicineにてPh.D Student.
Brian K. Kobilka
米国Stanford大学School of MedicineにてProfessor.
研究室URL:http://kobilkalab.stanford.edu/
© 2018 前田将司・Antoine Koehl・Brian K. Kobilka Licensed under CC 表示 2.1 日本
(米国Stanford大学School of Medicine,Department of Molecular and Cellular Physiology)
email:前田将司
DOI: 10.7875/first.author.2018.068
Structure of the μ-opioid receptor-Gi protein complex.
Antoine Koehl, Hongli Hu, Shoji Maeda, Yan Zhang, Qianhui Qu, Joseph M. Paggi, Naomi R. Latorraca, Daniel Hilger, Roger Dawson, Hugues Matile, Gebhard F. X. Schertler, Sebastien Granier, William I. Weis, Ron O. Dror, Aashish Manglik, Georgios Skiniotis, Brian K. Kobilka
Nature, 558, 547-552 (2018)
要 約
μオピオイド受容体はGタンパク質共役受容体のひとつであり,医療などに使用されるオピオイドの標的である.μオピオイド受容体の活性化による効果としては鎮痛作用や陶酔作用があげられるが,これらの効果は,μオピオイド受容体によるGiタンパク質におけるGDP-GTP交換反応,および,その下流のアデニル酸シクラーゼの活性の抑制によりもたらされる.この研究において,筆者らは,クライオ電子顕微鏡による解析により,アゴニストであるDAMGOの結合したμオピオイド受容体とGiタンパク質との複合体の構造を3.5Å分解能で決定した.DAMGOはそのN末端側がオピオイド受容体ファミリーに保存されたリガンド結合ポケットにはまり込み,C末端側はオピオイド受容体ファミリーのあいだの選択性にかかわる領域と相互作用していた.Gタンパク質共役受容体とGsタンパク質との複合体との構造の比較により,異なるGタンパク質と共役するGタンパク質共役受容体のそれぞれの特徴,とくに,Gタンパク質共役受容体の膜貫通ヘリックス6の位置,および,Gタンパク質のα5ヘリックスを介した相互作用の様式の違いが明らかにされた.
はじめに
オピオイドとは鎮痛作用や陶酔作用をもつアルカロイド,合成化合物,内在性の化合物の総称である.すぐれた鎮痛作用をもつため,手術の際の麻酔として,あるいは,がんの末期にともなうような強い痛みを緩和するために用いられる.その一方で,強い依存性や呼吸器の抑制作用といった副作用もともなう.米国においては,比較的入手しやすいこともあり,近年,オピオイドの過剰摂取が大きな社会問題となっている.こうした背景もあり,より副作用の低い安全なオピオイド化合物の開発への期待が大きく高まっている.
オピオイドはGタンパク質共役受容体であるμ,δ,κの3つのオピオイド受容体に作用し,鎮痛作用の発現はおもにμオピオイド受容体を介する.ほかのGタンパク質共役受容体と同じく,μオピオイド受容体もGタンパク質を介したシグナル伝達経路およびアレスチンを介したシグナル伝達経路の両方を活性化する.このうち,薬理的に有用な鎮痛作用はGiタンパク質を介したシグナル伝達経路が寄与し,副作用とされる呼吸の障害はアレスチンを経由したシグナル伝達経路によることが近年の研究により明らかにされてきた1).アレスチンを介したシグナル伝達経路を活性化せずGiタンパク質を介したシグナル伝達経路のみを選択的に活性化することができれば,副作用を抑えた有益な効果のみを発揮することが期待される2).
Gタンパク質共役受容体とGタンパク質との複合体の構造は,2011年にβ2アドレナリン受容体とGsタンパク質との複合体の構造がX線結晶構造解析により解かれて以降,これまでに,2種類のファミリーBに属するGタンパク質共役受容体とGsタンパク質との複合体の構造がクライオ電子顕微鏡により解かれたのみである3-5).Gタンパク質にはいくつかのファミリーが存在するなか,Gタンパク質共役受容体がいかにして特定のGタンパク質を選択的に認識するのかについての構造的な基盤についてはいまだ全容は解明されていない.μオピオイド受容体はGi/oファミリーとのみ共役するGタンパク質共役受容体であり,それらの複合体の構造は異なるGタンパク質への選択性を議論するうえで非常に有用な情報となる.
1.μオピオイド受容体とGiタンパク質との複合体の全体構造
昆虫細胞を用いた発現系により発現させたマウスに由来するμオピオイド受容体,および,ヒトに由来するGi1をそれぞれ個別に精製し,アゴニストであるDAMGOの存在下において混合することにより複合体を調製した.この過程において,ジホスホヒドロラーゼであるアピラーゼをくわえることにより,Gi1から放出されたGDPをGMPへと加水分解し,GDPがμオピオイド受容体-Gi1複合体と再結合し解離させるのをふせいだ.さらに,複合体を安定化させる効果をもつ抗体フラグメントをくわえたのち,非晶質の氷に包埋してクライオ電子顕微鏡にて複合体の画像を収集し,単粒子解析法により最終的に3.5Å分解能のマップを取得した.使用した抗体フラグメントはGタンパク質のαサブユニットとβサブユニットから構成される表面構造をエピトープにもち,分子量の増大に寄与しただけでなく,分子に非対称的な概形をあたえることにより単粒子解析にも寄与した.マップの精密化の過程においては,Gタンパク質のαヘリカルドメインに相当する領域のマップを除いた.これは,一連の先行研究により,Gタンパク質共役受容体と結合しGDPを放出した状態のGタンパク質はこの領域がRas様ドメインから解離しフレキシブルな状態をとることが知られていたためである3-5).実際に,初期のマップの時点ではこの領域に相当する部分はほかの領域に比べて弱いシグナルをあたえるのみであった.活性型μオピオイド受容体および三量体Gタンパク質のそれぞれの構造はすでにX線結晶構造解析により解かれており,これらを参照してマップにあてはめ精密化しμオピオイド受容体とGi1との複合体の構造を決定した(図1,PDB ID:6DDE).得られた全体構造は,さきに構造が解かれていたβ2アドレナリン受容体とGsタンパク質との複合体とよく似ており,Gタンパク質の異なるファミリーともに共通した活性化の機構をもつことが示唆された.
2.アゴニストDAMGOの結合様式
以前に構造が決定された活性型μオピオイド受容体は,BU72という多環構造をもつ強固な低分子アゴニストを用いて結晶化された6).DAMGOはこれとは対称的に,ペプチドからなる柔軟な構造をもつアゴニストである.このように,非常に異なる構造をもつ2つのアゴニストであるが,μオピオイド受容体とGiタンパク質との複合体の構造のリガンド結合部位をBU72結合型の構造と比較したところ,アミノ酸側鎖の部位および配置が非常によく似ていた.このことから,μオピオイド受容体はアゴニストの構造にかかわらず,それらのなかで鍵となる構造的な特徴を同じ結合様式により認識する可能性が示唆された.
μオピオイド受容体とGiタンパク質との複合体においてDAMGOはN末端側がBU72と同じ部位をしめ,C末端側は細胞外にむけてそこからさらに8Åほどつき出ていた.このC末端側に位置するN(Me)Pheは細胞外ループ1の近くに位置する疎水性のポケットにはまり込んでおり,つぎのGly-OHはDAMGOの側へともどりこむ構造をしていた.DAMGOはほかのオピオイド受容体のメンバーに比べてμオピオイド受容体への選択性が500倍ほど高く,これまでの研究により,この選択性は細胞外ループ1からの寄与によるものであることがわかっていた7).μオピオイド受容体とGiタンパク質との複合体の構造から,その選択性をあたえる上記のような構造の基盤がみえてきた.
DAMGOのN末端に位置するチロシン基またはそれに相当する化学構造はBU72をはじめとしたほかのリガンドにも存在し,結晶構造において同様の位置をしめていた.この結合様式は分子動力学シミュレーションによる解析によっても1μ秒以上にわたり安定して存在し,あらためてこの相互作用の強固さが支持された.分子動力学シミュレーションにおいては同時に,このチロシン基を基盤として水分子を介した水素結合ネットワークが膜貫通ヘリックス6のHis297へとつながることが確認された.同様の水分子は2.2Å分解能とより高分解能なBU72結合型の結晶構造においては電子密度として確認され,この水分子を介したフェノール基とHis297の結合様式はオピオイド受容体がモルフィンや類似する化合物あるいはペプチドを認識する際に共通する機構であると考えられた.
3.μオピオイド受容体の構造の変化
以前に得られた活性型μオピオイド受容体の結晶構造は,細胞の内側のGタンパク質結合部位をこれに類似したナノボディNb39がしめることにより構造を固定していた6).μオピオイド受容体とGiタンパク質との複合体の構造をナノボディ結合型の構造と比較すると,活性型のGタンパク質共役受容体に特徴的な膜貫通ヘリックス6が外側に大きく開いた状態,また,Gタンパク質共役受容体において高度に保存されその活性化に重要な役割をもつ膜貫通ヘリックス3のDRY(Asp-Arg-Tyr)モチーフ,膜貫通ヘリックス7のNPXXY(Asn-Pro-X-X-Tyr)モチーフ,および,受容体コア領域において形成される膜貫通ヘリックス5のPro,膜貫通ヘリックス3のIle,膜貫通ヘリックス6のPheからなるPIFモチーフは,ほぼ同一であった.2つの別個なパートナーとの結合により類似した構造が得られたことから,これらの大きな構造の変化が細胞内結合タンパク質によりひき起こされたものではなく,アゴニストとの結合によりひき起こされたものであることが示された.
μオピオイド受容体とGiタンパク質との複合体の構造とナノボディ結合型の構造は非常に類似していたが,詳細な部分では2つの違いがみられた.1つ目は外側に大きく開いた膜貫通ヘリックス6がその細胞質の内側の部位を膜貫通ヘリックス7の側に3Åほどさらに移動していたこと,2つ目は細胞内ループ3の構造がやや異なることであった.この2つの違いについては,それが細胞の内部に位置してそれぞれの結合のパートナーとの接触面にあったことから,結合のパートナーであるナノボディとGiタンパク質との違いに起因するものであると考えられた.のちに述べるように,この細胞内ループ3と膜貫通ヘリックス6によるGiタンパク質との相互作用は,β2アドレナリン受容体とGsタンパク質との複合体における相互作用とは異なるものであった.
4.特異的なGタンパク質との共役をもたらす構造的な基盤
Gタンパク質にはGs,Gi/o,Gq/11,G12/13の大きく4つのファミリーが存在する.多くの場合,ひとつのGタンパク質共役受容体は1種類以上のGタンパク質と共役し,よく研究された代表的な例として,Gsタンパク質およびGiタンパク質と共役するβ2アドレナリン受容体があげられる.一方で,μオピオイド受容体はGi/oファミリーとのみ選択的に共役することが知られている8).以前のGタンパク質共役受容体のアミノ酸配列からGタンパク質との共役の特異性を解明しようとする試みは明確な答えを見い出すことにはつながらず,このことから,特異性を決定するのは1次構造ではなくより複雑な立体構造における相互作用ネットワークであることが示唆された.μオピオイド受容体とGiタンパク質との複合体の全体構造はβ2アドレナリン受容体とGsタンパク質との複合体とよく似ていたが,そのなかできわだった違いがみられたのは,Gタンパク質のα5ヘリックスの位置および向きであった.2つのGタンパク質共役複合体を受容体をもとに重ね合わせると,Giタンパク質のα5ヘリックスはGsタンパク質と比べ21度ほど回転しており,そのため,その末端はGsタンパク質の先端に比べ5Åほど膜貫通ヘリックス7の側(膜貫通ヘリックス6からはなれる方向)にむけ移動していた.このα5ヘリックスの移動にともない,Gタンパク質共役受容体の膜貫通ヘリックス6の外側への開きぐあいがμオピオイド受容体においてはβ2アドレナリン受容体よりも9Åほど小さくなっていた.Gsタンパク質のα5ヘリックスを形成するアミノ酸残基はGiタンパク質と比べ側鎖が大きく,C末端から-3位と-4位に位置する残基は,Giタンパク質ではGlyとCysであるのに対し,Gsタンパク質ではGluとTyrである.μオピオイド受容体とGiタンパク質との複合体においてこれらの残基をGsタンパク質の対応する残基と置換すると,置換された残基の側鎖が立体障害を起こしGタンパク質結合ポケットに入り込むことができない.一方,β2アドレナリン受容体のほかGsタンパク質との複合体の構造が解かれているカルシトニン受容体およびグルカゴン様ペプチド1受容体は,μオピオイド受容体やβ2アドレナリン受容体とは異なりファミリーBに属する.これらのGタンパク質共役受容体においては,膜貫通ヘリックス6はさらに大きく外側に折れ曲がりポケットへのGsタンパク質の挿入が可能になっている.
Gタンパク質共役受容体とGタンパク質とのおのおのの相互作用の部位に注目としたところ,細胞内ループ2においてはいくつかの異なる相互作用が貢献していた.第1には,Asp177がα1-β1ループのArg32とイオン性の相互作用を形成しており,このAsp177に相当する位置はオピオイド受容体のあいだではAspが保存されていたものの,Giタンパク質と共役するほかのGタンパク質共役受容体では多様であった.第2には,Arg179が膜貫通ヘリックス3のAsp164およびα5ヘリックスのAsp350とイオン性の相互作用を形成していた.μオピオイド受容体の多形バリアントであるArg179Cys変異体はGiタンパク質へのシグナル伝達能に欠けることや9),このArg179に相当する位置は多くのGiタンパク質と共役するほかのGタンパク質共役受容体ではArgあるいはLysであることから,このイオン性の相互作用がGiタンパク質との共役に重要な役割をはたすことが示唆された.この位置に対応する残基はGsタンパク質と共役するGタンパク質共役受容体ではほかの残基に置換されており,Gqタンパク質と共役するGタンパク質共役受容体では塩基性残基の保存はまばらである.これらにくわえ,Pro172およびVal173がGiタンパク質のα1-β1ループ,β2-β3ループ,α5ヘリックスにより形成されるポケットと疎水性の相互作用を形成していた.同様の疎水性の相互作用はβ2アドレナリン受容体とGsタンパク質との複合体においてもみられた.
細胞内ループ3においては,大きく2つの相互作用がμオピオイド受容体とGiタンパク質とのあいだで形成されていた.ひとつはVal262,Met264,Leu265とα5ヘリックスの疎水性の側面とが形成する相互作用である.これは,細胞内ループの構成や側鎖の種類は異なるものの,同様の疎水性の相互作用がβ2アドレナリン受容体とGsタンパク質との複合体においても形成されていた.もうひとつはArg263とGiタンパク質のβ6ストランドにあるIle319の主鎖カルボニル基との極性の相互作用である.このArg263の変異体はGiタンパク質へのシグナル伝達が低下すること,また,β2アドレナリン受容体とGsタンパク質との複合体においては同様の相互作用がみられないことから,この認識の機構がGiタンパク質へのシグナル伝達において重要な役割をはたす可能性が示唆された.Gsタンパク質に比べGiタンパク質は自発的なGDPの放出の遅いことが知られており,この極性の相互作用が効率のよいGDPの放出にかかわるのかもしれない.
Gタンパク質共役受容体の膜貫通ヘリックス3,膜貫通ヘリックス5,膜貫通ヘリックス6の細胞の内側の領域もまたGiタンパク質,とりわけ,α5ヘリックスとの相互作用を担っていた.膜貫通ヘリックス3はGiタンパク質のCys351と非常に近接しており,膜貫通ヘリックス5あるいは膜貫通ヘリックス6に位置するMet255,Ile278,Met281,Val282はGiタンパク質のLeu353と疎水性の相互作用を形成していた.Giタンパク質のCys351は百日咳毒素がADP-リボース化によりGタンパク質共役受容体からGiタンパク質へのシグナル伝達を阻害する際の標的となる残基である.この部位に大きなADP-リボースが結合することは膜貫通ヘリックス3への近接,ひいては,α5ヘリックスのGタンパク質共役受容体のGタンパク質結合ポケットへの挿入を阻害することになる.Met255,Met281はNMRによる観測によりDAMGOに依存的にその化学シフトを変化させることが示されており10),これらの位置する膜貫通ヘリックス5および膜貫通ヘリックス6がGタンパク質への共役にさきだち構造変化を起こすことが示唆された.膜貫通ヘリックス6からはさらにArg277がGiタンパク質のIle355の主鎖カルボニル基とのあいだで極性の相互作用を形成する.これらα5ヘリックスを介したμオピオイド受容体との相互作用のパターンはβ2アドレナリン受容体とGsタンパク質との複合体とはまったく異なっており,こうした違いもまた,異なるGタンパク質への共役の特異性を担うものと考えられた.
おわりに
今回の研究により,μオピオイド受容体とGiタンパク質との複合体とGsタンパク質との複合体との比較においては合理的な説明をあたえるモデルが得られたが,現在のところ,これが包括的あるいは普遍的に説明されるモデルをたてるまでにはいたっていない.今後,さらなる複合体の構造が明らかになるにつれ,Gタンパク質のファミリーごとのGタンパク質共役受容体の共通の認識パターンがみえてくるかもしれない.あるいは,Gタンパク質共役受容体とGタンパク質との特異性は,Gタンパク質からGDPが放出される以前の段階で決定される可能性も考えられる11).このような非常に一過性の状態をとらえるためには,構造解析の手法のみならず,より時間分解能の高い手法との組合せが効果的であると思われる.また,残るほかのGタンパク質のファミリー,とくにGqタンパク質とGタンパク質共役受容体との特異性の決定の機構も大きな課題として残されている.
文 献
- Raehal, K. M., Walker, J. K. & Bohn, L. M.: Morphine side effects in β-arrestin 2 knockout mice. J. Pharmacol. Exp. Ther., 314, 1195-1201 (2005)[PubMed]
- Manglik, A., Lin, H., Aryal, D. K. et al.: Structure-based discovery of opioid analgesics with reduced side effects. Nature, 537, 185-190 (2016)[PubMed]
- Rasmussen, S. G., DeVree, B. T., Zou, Y. et al.: Crystal structure of the β2 adrenergic receptor-Gs protein complex. Nature, 477, 549-555 (2011)[PubMed]
- Zhang, Y., Sun, B., Feng, D. et al.: Cryo-EM structure of the activated GLP-1 receptor in complex with a G protein. Nature, 546, 248-253 (2017)[PubMed]
- Liang, Y. L., Khoshouei, M., Radjainia, M. et al.: Phase-plate cryo-EM structure of a class B GPCR-G-protein complex. Nature, 546, 118-123 (2017)[PubMed]
- Huang, W., Manglik, A., Venkatakrishnan, A. J. et al.: Structural insights into μ-opioid receptor activation. Nature, 524, 315-321 (2015)[PubMed]
- Minami, M., Onogi, T., Nakagawa, T. et al.: DAMGO, a μ-opioid receptor selective ligand, distinguishes between μ-and κ-opioid receptors at a different region from that for the distinction between μ- and δ-opioid receptors. FEBS Lett., 364, 23-27 (2000)[PubMed]
- Connor, M. & Christie, M. J.: Opioid receptor signalling mechanisms. Clin. Exp. Pharmacol. Physiol., 26, 493-499 (1999)[PubMed]
- Ravindranathan, A., Joslyn, G., Robertson, M. et al.: Functional characterization of human variants of the mu-opioid receptor gene. Proc. Natl. Acad. Sci. USA, 106, 10811-10816 (2009)[PubMed]
- Sounier, R., Mas, C., Steyaert, J. et al.: Propagation of conformational changes during μ-opioid receptor activation. Nature, 524, 375-378 (2015)[PubMed]
- Qin, K., Dong, C., Wu, G. et al.: Inactive-state preassembly of Gq-coupled receptors and Gq heterotrimers. Nat. Chem. Biol., 7, 740-747 (2011)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:米国Stanford大学School of MedicineにてBasic Life Science Research Scientist.
研究テーマ:Gタンパク質共役受容体シグナルの分子作動機構.
Antoine Koehl
米国Stanford大学School of MedicineにてPh.D Student.
Brian K. Kobilka
米国Stanford大学School of MedicineにてProfessor.
研究室URL:http://kobilkalab.stanford.edu/
© 2018 前田将司・Antoine Koehl・Brian K. Kobilka Licensed under CC 表示 2.1 日本