自己組織化により生じる多細胞からなる構造の人工的な形成
戸田 聡・Leonardo Morsut・Wendell A. Lim
(米国California大学San Francisco校Center for Systems and Synthetic Biology)
email:戸田 聡
DOI: 10.7875/first.author.2018.065
Programming self-organizing multicellular structures with synthetic cell-cell signaling.
Satoshi Toda, Lucas R. Blauch, Sindy K. Y. Tang, Leonardo Morsut, Wendell A. Lim
Science, 361, 156-162 (2018)
動物の発生の過程において,細胞は互いにコミュニケーションしながら複雑な組織や器官を形成する.では,どのような細胞間シグナル伝達ネットワークを構築すれば組織の形態形成を十分にひき起こすことができるだろうか.この研究において,筆者らは,synNotchとよばれる人工受容体を用いて細胞接着分子の発現を制御する人工的な細胞間シグナル伝達ネットワークを設計した.この比較的単純な細胞間コミュニケーションにより,発生の過程において重要な特徴である,細胞自律的な自己組織化,多段階からなる連続的な形態形成の過程,細胞の種類の増加,多層の構造や非対称な構造の形成,物理的な切断ののちの再生,といった現象がひき起こされた.これは,細胞どうしのシグナル伝達により細胞に空間的な配置換えをひき起こすと,新たに隣接した細胞のあいだで新たなシグナル伝達および配置換えが起こるため,複雑な自己組織化の過程の形成が可能になったことによる.以上の結果は,単細胞生物が多細胞生物へと進化するための十分条件の探索や,自己組織化する生体材料や人工組織の作製に役だつと考えられる.
多細胞生物の発生はひとつの受精卵にはじまり,細胞が多様な細胞種へと分化し,増殖,細胞死,パターン形成などをへて複雑な組織や臓器の構造が自律的に形成される.このような自己組織化により生じる多細胞からなる構造は,設計図にしたがい部品を組み立てることにより形成される人工物とは大きく異なり,外部からの操作に依存せず,ゲノムにプログラムされた連続的な形態形成の過程をへて形成される.これまでの発生生物学においては,さまざまなモデル生物を用いて組織の発生の過程が解析され,細胞間シグナル伝達や形態変化を制御する遺伝子が明らかにされてきた.この研究においては,ある特定の生物を用いてどのような細胞間シグナル伝達が組織の形成をひき起こすのかを解析するのではなく,形態変化をひき起こす細胞間シグナル伝達ネットワークを人工的に設計し,それらが十分に多細胞からなる構造を自己組織化するかどうかを検討した.魚や鳥の群れなどの巨視的な動物の集団行動においては個体のあいだの単純な相互作用が巨大な構造をつくりだすことが知られている.そこで,微視的な細胞のレベルにおいても,特定の構造を自己組織化する細胞間コミュニケーションを明確にすることにより組織の形成の基本原理を理解することをめざした1-3).
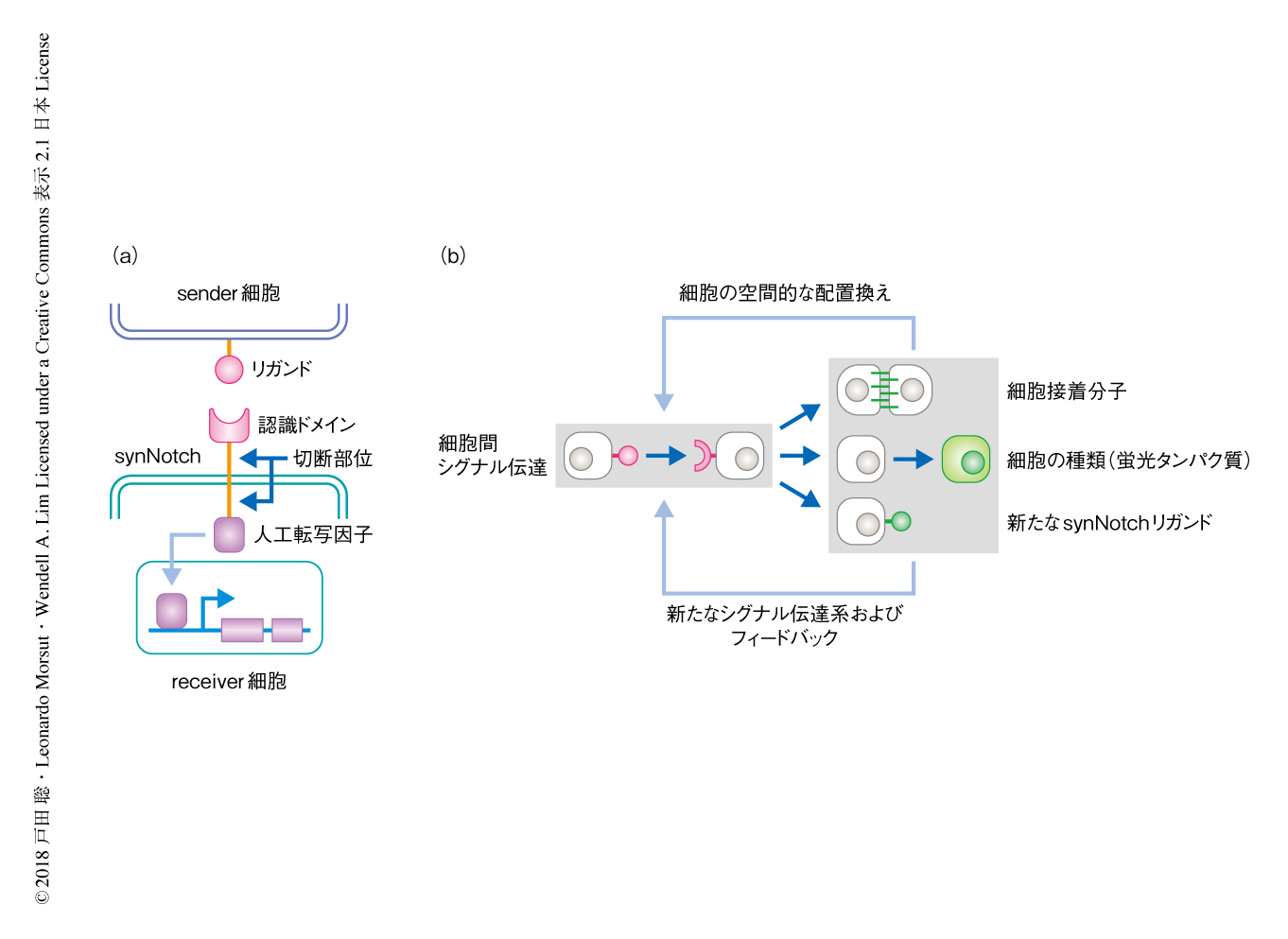
細胞間コミュニケーションを自在に設計するのに人工受容体であるsynNotchを用いた4)(図1a).受容体であるNotchは,リガンドである膜タンパク質Deltaと結合すると細胞膜の付近で切断され,細胞内ドメインが核へと移行し遺伝子の転写をひき起こす.synNotchは,Notchの細胞外ドメインを任意のリガンドを認識する配列に置き換え,さらに,細胞内ドメインを特定の転写因子に置き換えることにより,任意のリガンドを認識して任意の遺伝子の発現を誘導することができる.この研究においては,リガンドとしてCD19,および,膜貫通ドメインとGFPとの融合タンパク質であるGFPligを用い,synNotchの細胞外ドメインとしてCD19あるいはGFPに対する1本鎖抗体を用いた.また,synNotchの細胞内ドメインとして人工転写因子であるtTAを用い,テトラサイクリン応答配列の下流に挿入した遺伝子の発現を特異的に誘導した.よって,synNotchを発現する“receiver細胞”は,“sender細胞”の発現するsynNotchのリガンドを認識することにより,特定の遺伝子の発現を誘導する.このsynNotch系により,内在性のシグナル伝達経路に影響することなく,人工的な細胞間コミュニケーションによる任意の遺伝子の発現を誘導することが可能になった.
synNotchシグナルの下流において,細胞の種類を示す蛍光タンパク質,細胞の配置換えをひき起こす細胞接着分子カドヘリン5),シグナル伝達系をひき起こす新たなsynNotchのリガンド,の3種類のアウトプットの発現を誘導することにより,細胞の集団行動により多細胞からなる構造を形成するプログラムを設計し(図1b),このプログラムをマウスの線維芽細胞株であるL929細胞に導入した.L929細胞はもともと特定の構造に自己組織化する能力をもたず,超低接着性の表面をもつ丸底ウェルにおいて細胞間の弱い親和性により細胞がゆるく結合したスフェロイドを形成する.そこで,L929細胞が人工的な形態形成のプログラムによりどのような構造を形成するか共焦点顕微鏡により観察した.
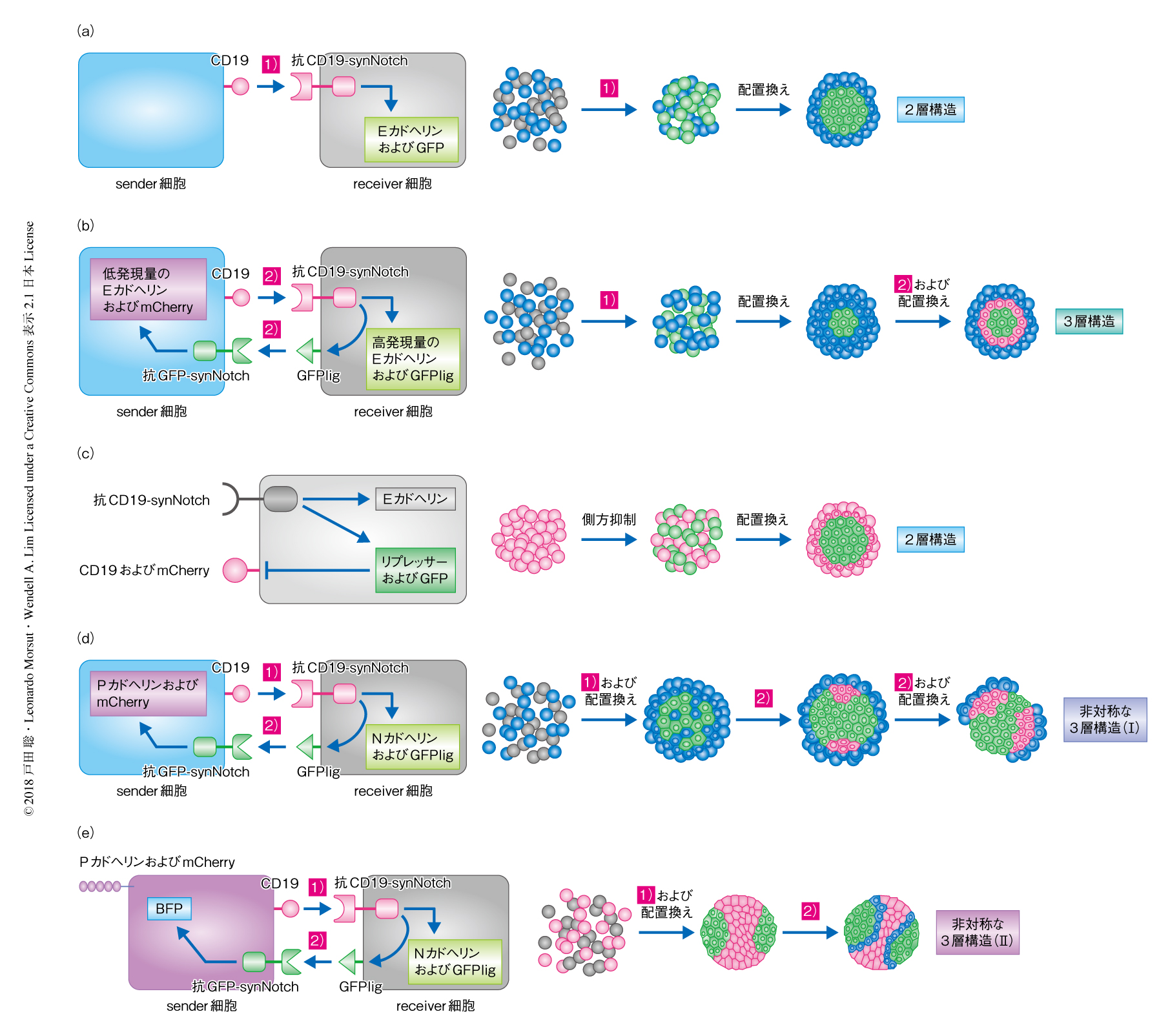
CD19を発現させた100個のsender細胞と,細胞外ドメインとして抗CD19抗体をもつsynNotchを発現させた100個のreceiver細胞を共培養し,synNotchシグナルの標的として細胞接着分子であるEカドヘリンおよびGFPの発現を誘導した.すると,receiver細胞はEカドヘリンの発現により互いに強く結合しスフェロイドの中心部にGFPを発現するコアを形成した.一方,Eカドヘリンを発現しないsender細胞はコアの周辺に押し出され,最終的に2層構造が形成された(図2a).
人工的な細胞間コミュニケーションによる形態形成が可能なことがわかったので,より複雑な構造を形成するため,この2層構造にさらなる細胞間コミュニケーションを追加した(図2b).まず,sender細胞に発現するCD19によりreceiver細胞に発現する細胞外ドメインとして抗CD19抗体をもつsynNotchが活性化されEカドヘリンの高い発現およびGFPligの発現が誘導される.つづいて,GFPligによりsender細胞に発現する細胞外ドメインとして抗GFP抗体をもつsynNotchが活性化されEカドヘリンとmCherryの融合タンパク質の低い発現が誘導される.その結果,まず1段階目のシグナル伝達によりreceiver細胞においてEカドヘリンおよびGFPligが発現してコアを形成し,sender細胞は外層を形成した.おくれて2段階目のシグナル伝達によりコアに接するsender細胞に発現するsynNotchのみがGFPligにより活性化され,EカドヘリンとmCherryの融合タンパク質を発現した中間層が形成された.最終的に,sender細胞およびreceiver細胞の2種類の細胞から,コア,中間層,外層からなる3層構造が自己組織化された(図2b).
synNotchの活性化はNotchを切断するγセクレターゼの阻害剤であるDAPTにより阻害できる.そこで,DAPTの存在下においてsender細胞とreceiver細胞を共培養したところ,GFPlig,Eカドヘリン,EカドヘリンとmCherryの融合タンパク質の発現はみられず,細胞の配置換えも起こらなかった.よって,synNotchによる人工的なシグナル伝達系により3層構造が形成されたことが確認された.
多くの生体組織は物理的な損傷をうけても再生する.そこで,マイクロギロチンとよばれるマイクロ流路系6) を用いてこの3層構造を物理的に切断し,のちの構造の変化を観察した.切断の直後にはコアの部分はスフェロイドの表面に露出していたが,24時間以内に中間層および外層によりふたたびおおわれ,3層構造の再生が可能であることが示された.
動物の胚発生の初期において,受精卵は細胞分裂をくり返したのち,細胞の運命が枝分かれし異なる細胞種からなる胚盤胞を形成する.そこで,人工の細胞間コミュニケーションにより,1種類の細胞が細胞種を増加させながら形態形成する過程をつくりだすことをめざした.これまでの研究により,側方抑制とよばれる細胞間シグナル経路により均一な細胞集団から相反する2種類の細胞の状態が生じることが知られている7).たとえば,隣接する細胞のあいだでNotchを介してDeltaの発現を抑制する側方抑制のシグナル経路を導入すると,均一な細胞集団がDelta陽性かつNotch不活性の細胞とDelta陰性かつNotch活性化の細胞に二極化する8).そこで,L929細胞にCD19および細胞外ドメインとして抗CD19抗体をもつsynNotchを用いた側方抑制のシグナル経路を導入したところ,細胞がCD19陽性かつsynNotch不活性の細胞とCD19陰性かつsynNotch活性化の細胞に二極化した.そこで,側方抑制のシグナル経路のsynNotchの標的としてEカドヘリンを追加し,synNotchが活性化した細胞においてのみEカドヘリンの発現が誘導されるようにした.その結果,細胞はCD19陽性細胞とCD19陰性かつsynNotch活性化かつEカドヘリン陽性細胞に自発的に二極化し,後者の細胞はEカドヘリンにより互いに強く結合してコアを形成した.そして,CD19陽性細胞は外層に押し出され,最終的に1種類の均一な細胞集団から2層構造が自己組織化された(図2c).
ここまで,同心状に対称な2層構造および3層構造が形成されたが,多細胞生物の発生の過程においては,体軸の形成など,自発的に対称性が破れ極性をもつ非対称な構造が形成される.そこで,異なるカドヘリンの組合せを用いることにより非対称な構造を形成させることをめざした.カドヘリンファミリーに属するPカドヘリンおよびNカドヘリンは,PカドヘリンどうしあるいはNカドヘリンどうしの同種の親和性は強いが,PカドヘリンとNカドヘリンのあいだの異種の親和性は弱いことが報告されている9).Pカドヘリン陽性細胞とNカドヘリン陽性細胞とを共培養するとPカドヘリン陽性の領域とNカドヘリン陽性の領域に分離することが確認されたことから,synNotch系においてPカドヘリンおよびNカドヘリンの発現を誘導して形態形成の過程を観察した.
同心状の3層構造が形成された細胞間コミュニケーションにおいて,Eカドヘリンの代わりに,sender細胞においてPカドヘリン,receiver細胞においてNカドヘリンの発現を誘導した.その結果,まず1段階目のシグナル伝達によりreceiver細胞においてNカドヘリンおよびGFPligが発現してコアを形成し,sender細胞は外層を形成した.おくれて2段階目のシグナル伝達によりコアに接するsender細胞に発現するsynNotchのみがGFPligにより活性化され,PカドヘリンおよびmCherryの発現が誘導された.Pカドヘリン陽性となったsender細胞はNカドヘリン陽性のreceiver細胞から分離し,複数の突起に集約された.ここで,突起のうえに存在するsender細胞は活性化されないまま残るため,最終的に非対称な3層構造が形成された(図2d).共培養する細胞の数をより少なくすると,小さなスフェロイドにおいては突起を形成するスペースもせまくなるため,Pカドヘリン陽性の細胞が1つの突起となり頭部-尾部の極性をもつ3層構造が形成された.
PカドヘリンおよびNカドヘリンを発現するタイミングを変えることにより,異なる形態をもつ非対称の3層構造が形成された.まず,恒常的にPカドヘリンおよびCD19を発現するsender細胞が,1段階目のシグナル伝達によりreceiver細胞にNカドヘリンおよびGFPligの発現を誘導することで,Pカドヘリン陽性のsender細胞とNカドヘリン陽性になったreceiver細胞が分離した.つぎに,2段階目のシグナル伝達により,receiver細胞に接するsender細胞に発現するsynNotchのみがGFPligにより活性化され,BFPの発現が誘導された.その結果,2種類の細胞の分離およびその境界の細胞の活性化により非対称な3層構造が形成された(図2e).
以上より,単純な2段階のシグナル伝達系において,異なるカドヘリンの発現を誘導する,カドヘリンの発現を誘導するタイミングを変える,スフェロイドを構成する細胞の数を変える,ことにより,多様な形態の3層構造が形成された.
この研究において,細胞接着分子であるカドヘリンの発現を制御する細胞間コミュニケーションを設計することにより,自己組織化するさまざまな構造がプログラムされた.そして,この自己組織化の過程の観察から,細胞のあいだでのシグナル伝達→細胞接着による細胞の配置換え→新たに隣接した細胞のあいだでのシグナル伝達,のサイクルにより,細胞種の増加をともなう複雑な構造の形成が可能になると結論された.
この研究において設計された細胞間コミュニケーションは,動物の形態形成において重要な要素,たとえば,拡散するモルフォゲン,細胞の増殖あるいは細胞死の制御,細胞の遊走,エピジェネティクスなどを含まないにもかかわらず,多様な3次元構造を形成した.よって,このような新たな要素をくわえた細胞間コミュニケーションを設計すれば,さらに複雑で巧妙な組織の構造を人工的に形成することができると考えられた.
個々の細胞が集団行動により多細胞からなる構造を形成する過程を創出することは,多細胞性の進化の原理にも深くかかわる.動物にもっとも近い単細胞生物と考えられる襟鞭毛虫は,原始的なカドヘリンおよびNotchをもつことが報告されている10).襟鞭毛虫の発現するカドヘリンは環境中の細菌を付着し捕食する役割が示唆されており,さらに,細菌の代謝産物がロゼッタとよばれる集合体の形成を促進するシグナルとして機能することも報告されている.よって,もし,細胞と細菌とのあいだの接着が細胞間の接着へと進化し,細胞と細菌とのあいだのシグナル伝達が細胞間のシグナル伝達へと進化すれば,細胞間シグナル伝達と接着の組合せにより多細胞からなる複雑な構造への進化をひき起こすことができると考えられた.
合成生物学の分野は,“understand by building”の発想にもとづき,機能をもつ生体分子や細胞のような生命系を人工的に創出する過程をとおしてその動作原理を理解し,新技術として医療や産業へと応用することを目標としている.細胞が自己組織化する過程を人工的につくりだすアプローチは,組織の形成の基本原理を体系的に理解するのに有用であると同時に,自己組織化する生体材料や人工組織を作製する技術開発にも直結する.
略歴:2014年 京都大学大学院医学研究科博士後期課程 修了,同年 同 博士研究員を経て,2015年より米国California大学San Francisco校 博士研究員.
研究テーマ:タンパク質間あるいは細胞間のシグナル伝達ネットワークの設計による新たな細胞機能の創出.
関心事:細胞の機能を正確に制御できる分子ツールの開発.
Leonardo Morsut
米国Southern California大学Assistant Professor.
Wendell A. Lim
米国California大学San Francisco校Professor.
研究室URL:http://limlab.ucsf.edu/
© 2018 戸田 聡・Leonardo Morsut・Wendell A. Lim Licensed under CC 表示 2.1 日本
(米国California大学San Francisco校Center for Systems and Synthetic Biology)
email:戸田 聡
DOI: 10.7875/first.author.2018.065
Programming self-organizing multicellular structures with synthetic cell-cell signaling.
Satoshi Toda, Lucas R. Blauch, Sindy K. Y. Tang, Leonardo Morsut, Wendell A. Lim
Science, 361, 156-162 (2018)
要 約
動物の発生の過程において,細胞は互いにコミュニケーションしながら複雑な組織や器官を形成する.では,どのような細胞間シグナル伝達ネットワークを構築すれば組織の形態形成を十分にひき起こすことができるだろうか.この研究において,筆者らは,synNotchとよばれる人工受容体を用いて細胞接着分子の発現を制御する人工的な細胞間シグナル伝達ネットワークを設計した.この比較的単純な細胞間コミュニケーションにより,発生の過程において重要な特徴である,細胞自律的な自己組織化,多段階からなる連続的な形態形成の過程,細胞の種類の増加,多層の構造や非対称な構造の形成,物理的な切断ののちの再生,といった現象がひき起こされた.これは,細胞どうしのシグナル伝達により細胞に空間的な配置換えをひき起こすと,新たに隣接した細胞のあいだで新たなシグナル伝達および配置換えが起こるため,複雑な自己組織化の過程の形成が可能になったことによる.以上の結果は,単細胞生物が多細胞生物へと進化するための十分条件の探索や,自己組織化する生体材料や人工組織の作製に役だつと考えられる.
はじめに
多細胞生物の発生はひとつの受精卵にはじまり,細胞が多様な細胞種へと分化し,増殖,細胞死,パターン形成などをへて複雑な組織や臓器の構造が自律的に形成される.このような自己組織化により生じる多細胞からなる構造は,設計図にしたがい部品を組み立てることにより形成される人工物とは大きく異なり,外部からの操作に依存せず,ゲノムにプログラムされた連続的な形態形成の過程をへて形成される.これまでの発生生物学においては,さまざまなモデル生物を用いて組織の発生の過程が解析され,細胞間シグナル伝達や形態変化を制御する遺伝子が明らかにされてきた.この研究においては,ある特定の生物を用いてどのような細胞間シグナル伝達が組織の形成をひき起こすのかを解析するのではなく,形態変化をひき起こす細胞間シグナル伝達ネットワークを人工的に設計し,それらが十分に多細胞からなる構造を自己組織化するかどうかを検討した.魚や鳥の群れなどの巨視的な動物の集団行動においては個体のあいだの単純な相互作用が巨大な構造をつくりだすことが知られている.そこで,微視的な細胞のレベルにおいても,特定の構造を自己組織化する細胞間コミュニケーションを明確にすることにより組織の形成の基本原理を理解することをめざした1-3).
1.形態形成をひき起こす人工的な細胞間シグナル伝達ネットワークの設計
細胞間コミュニケーションを自在に設計するのに人工受容体であるsynNotchを用いた4)(図1a).受容体であるNotchは,リガンドである膜タンパク質Deltaと結合すると細胞膜の付近で切断され,細胞内ドメインが核へと移行し遺伝子の転写をひき起こす.synNotchは,Notchの細胞外ドメインを任意のリガンドを認識する配列に置き換え,さらに,細胞内ドメインを特定の転写因子に置き換えることにより,任意のリガンドを認識して任意の遺伝子の発現を誘導することができる.この研究においては,リガンドとしてCD19,および,膜貫通ドメインとGFPとの融合タンパク質であるGFPligを用い,synNotchの細胞外ドメインとしてCD19あるいはGFPに対する1本鎖抗体を用いた.また,synNotchの細胞内ドメインとして人工転写因子であるtTAを用い,テトラサイクリン応答配列の下流に挿入した遺伝子の発現を特異的に誘導した.よって,synNotchを発現する“receiver細胞”は,“sender細胞”の発現するsynNotchのリガンドを認識することにより,特定の遺伝子の発現を誘導する.このsynNotch系により,内在性のシグナル伝達経路に影響することなく,人工的な細胞間コミュニケーションによる任意の遺伝子の発現を誘導することが可能になった.
synNotchシグナルの下流において,細胞の種類を示す蛍光タンパク質,細胞の配置換えをひき起こす細胞接着分子カドヘリン5),シグナル伝達系をひき起こす新たなsynNotchのリガンド,の3種類のアウトプットの発現を誘導することにより,細胞の集団行動により多細胞からなる構造を形成するプログラムを設計し(図1b),このプログラムをマウスの線維芽細胞株であるL929細胞に導入した.L929細胞はもともと特定の構造に自己組織化する能力をもたず,超低接着性の表面をもつ丸底ウェルにおいて細胞間の弱い親和性により細胞がゆるく結合したスフェロイドを形成する.そこで,L929細胞が人工的な形態形成のプログラムによりどのような構造を形成するか共焦点顕微鏡により観察した.
2.多層からなる構造の形成
CD19を発現させた100個のsender細胞と,細胞外ドメインとして抗CD19抗体をもつsynNotchを発現させた100個のreceiver細胞を共培養し,synNotchシグナルの標的として細胞接着分子であるEカドヘリンおよびGFPの発現を誘導した.すると,receiver細胞はEカドヘリンの発現により互いに強く結合しスフェロイドの中心部にGFPを発現するコアを形成した.一方,Eカドヘリンを発現しないsender細胞はコアの周辺に押し出され,最終的に2層構造が形成された(図2a).
人工的な細胞間コミュニケーションによる形態形成が可能なことがわかったので,より複雑な構造を形成するため,この2層構造にさらなる細胞間コミュニケーションを追加した(図2b).まず,sender細胞に発現するCD19によりreceiver細胞に発現する細胞外ドメインとして抗CD19抗体をもつsynNotchが活性化されEカドヘリンの高い発現およびGFPligの発現が誘導される.つづいて,GFPligによりsender細胞に発現する細胞外ドメインとして抗GFP抗体をもつsynNotchが活性化されEカドヘリンとmCherryの融合タンパク質の低い発現が誘導される.その結果,まず1段階目のシグナル伝達によりreceiver細胞においてEカドヘリンおよびGFPligが発現してコアを形成し,sender細胞は外層を形成した.おくれて2段階目のシグナル伝達によりコアに接するsender細胞に発現するsynNotchのみがGFPligにより活性化され,EカドヘリンとmCherryの融合タンパク質を発現した中間層が形成された.最終的に,sender細胞およびreceiver細胞の2種類の細胞から,コア,中間層,外層からなる3層構造が自己組織化された(図2b).
synNotchの活性化はNotchを切断するγセクレターゼの阻害剤であるDAPTにより阻害できる.そこで,DAPTの存在下においてsender細胞とreceiver細胞を共培養したところ,GFPlig,Eカドヘリン,EカドヘリンとmCherryの融合タンパク質の発現はみられず,細胞の配置換えも起こらなかった.よって,synNotchによる人工的なシグナル伝達系により3層構造が形成されたことが確認された.
多くの生体組織は物理的な損傷をうけても再生する.そこで,マイクロギロチンとよばれるマイクロ流路系6) を用いてこの3層構造を物理的に切断し,のちの構造の変化を観察した.切断の直後にはコアの部分はスフェロイドの表面に露出していたが,24時間以内に中間層および外層によりふたたびおおわれ,3層構造の再生が可能であることが示された.
3.1種類の細胞からの2層構造の形成
動物の胚発生の初期において,受精卵は細胞分裂をくり返したのち,細胞の運命が枝分かれし異なる細胞種からなる胚盤胞を形成する.そこで,人工の細胞間コミュニケーションにより,1種類の細胞が細胞種を増加させながら形態形成する過程をつくりだすことをめざした.これまでの研究により,側方抑制とよばれる細胞間シグナル経路により均一な細胞集団から相反する2種類の細胞の状態が生じることが知られている7).たとえば,隣接する細胞のあいだでNotchを介してDeltaの発現を抑制する側方抑制のシグナル経路を導入すると,均一な細胞集団がDelta陽性かつNotch不活性の細胞とDelta陰性かつNotch活性化の細胞に二極化する8).そこで,L929細胞にCD19および細胞外ドメインとして抗CD19抗体をもつsynNotchを用いた側方抑制のシグナル経路を導入したところ,細胞がCD19陽性かつsynNotch不活性の細胞とCD19陰性かつsynNotch活性化の細胞に二極化した.そこで,側方抑制のシグナル経路のsynNotchの標的としてEカドヘリンを追加し,synNotchが活性化した細胞においてのみEカドヘリンの発現が誘導されるようにした.その結果,細胞はCD19陽性細胞とCD19陰性かつsynNotch活性化かつEカドヘリン陽性細胞に自発的に二極化し,後者の細胞はEカドヘリンにより互いに強く結合してコアを形成した.そして,CD19陽性細胞は外層に押し出され,最終的に1種類の均一な細胞集団から2層構造が自己組織化された(図2c).
4.非対称な構造の形成
ここまで,同心状に対称な2層構造および3層構造が形成されたが,多細胞生物の発生の過程においては,体軸の形成など,自発的に対称性が破れ極性をもつ非対称な構造が形成される.そこで,異なるカドヘリンの組合せを用いることにより非対称な構造を形成させることをめざした.カドヘリンファミリーに属するPカドヘリンおよびNカドヘリンは,PカドヘリンどうしあるいはNカドヘリンどうしの同種の親和性は強いが,PカドヘリンとNカドヘリンのあいだの異種の親和性は弱いことが報告されている9).Pカドヘリン陽性細胞とNカドヘリン陽性細胞とを共培養するとPカドヘリン陽性の領域とNカドヘリン陽性の領域に分離することが確認されたことから,synNotch系においてPカドヘリンおよびNカドヘリンの発現を誘導して形態形成の過程を観察した.
同心状の3層構造が形成された細胞間コミュニケーションにおいて,Eカドヘリンの代わりに,sender細胞においてPカドヘリン,receiver細胞においてNカドヘリンの発現を誘導した.その結果,まず1段階目のシグナル伝達によりreceiver細胞においてNカドヘリンおよびGFPligが発現してコアを形成し,sender細胞は外層を形成した.おくれて2段階目のシグナル伝達によりコアに接するsender細胞に発現するsynNotchのみがGFPligにより活性化され,PカドヘリンおよびmCherryの発現が誘導された.Pカドヘリン陽性となったsender細胞はNカドヘリン陽性のreceiver細胞から分離し,複数の突起に集約された.ここで,突起のうえに存在するsender細胞は活性化されないまま残るため,最終的に非対称な3層構造が形成された(図2d).共培養する細胞の数をより少なくすると,小さなスフェロイドにおいては突起を形成するスペースもせまくなるため,Pカドヘリン陽性の細胞が1つの突起となり頭部-尾部の極性をもつ3層構造が形成された.
PカドヘリンおよびNカドヘリンを発現するタイミングを変えることにより,異なる形態をもつ非対称の3層構造が形成された.まず,恒常的にPカドヘリンおよびCD19を発現するsender細胞が,1段階目のシグナル伝達によりreceiver細胞にNカドヘリンおよびGFPligの発現を誘導することで,Pカドヘリン陽性のsender細胞とNカドヘリン陽性になったreceiver細胞が分離した.つぎに,2段階目のシグナル伝達により,receiver細胞に接するsender細胞に発現するsynNotchのみがGFPligにより活性化され,BFPの発現が誘導された.その結果,2種類の細胞の分離およびその境界の細胞の活性化により非対称な3層構造が形成された(図2e).
以上より,単純な2段階のシグナル伝達系において,異なるカドヘリンの発現を誘導する,カドヘリンの発現を誘導するタイミングを変える,スフェロイドを構成する細胞の数を変える,ことにより,多様な形態の3層構造が形成された.
おわりに
この研究において,細胞接着分子であるカドヘリンの発現を制御する細胞間コミュニケーションを設計することにより,自己組織化するさまざまな構造がプログラムされた.そして,この自己組織化の過程の観察から,細胞のあいだでのシグナル伝達→細胞接着による細胞の配置換え→新たに隣接した細胞のあいだでのシグナル伝達,のサイクルにより,細胞種の増加をともなう複雑な構造の形成が可能になると結論された.
この研究において設計された細胞間コミュニケーションは,動物の形態形成において重要な要素,たとえば,拡散するモルフォゲン,細胞の増殖あるいは細胞死の制御,細胞の遊走,エピジェネティクスなどを含まないにもかかわらず,多様な3次元構造を形成した.よって,このような新たな要素をくわえた細胞間コミュニケーションを設計すれば,さらに複雑で巧妙な組織の構造を人工的に形成することができると考えられた.
個々の細胞が集団行動により多細胞からなる構造を形成する過程を創出することは,多細胞性の進化の原理にも深くかかわる.動物にもっとも近い単細胞生物と考えられる襟鞭毛虫は,原始的なカドヘリンおよびNotchをもつことが報告されている10).襟鞭毛虫の発現するカドヘリンは環境中の細菌を付着し捕食する役割が示唆されており,さらに,細菌の代謝産物がロゼッタとよばれる集合体の形成を促進するシグナルとして機能することも報告されている.よって,もし,細胞と細菌とのあいだの接着が細胞間の接着へと進化し,細胞と細菌とのあいだのシグナル伝達が細胞間のシグナル伝達へと進化すれば,細胞間シグナル伝達と接着の組合せにより多細胞からなる複雑な構造への進化をひき起こすことができると考えられた.
合成生物学の分野は,“understand by building”の発想にもとづき,機能をもつ生体分子や細胞のような生命系を人工的に創出する過程をとおしてその動作原理を理解し,新技術として医療や産業へと応用することを目標としている.細胞が自己組織化する過程を人工的につくりだすアプローチは,組織の形成の基本原理を体系的に理解するのに有用であると同時に,自己組織化する生体材料や人工組織を作製する技術開発にも直結する.
文 献
- Davies, J.: Using synthetic biology to explore principles of development. Development, 144, 1146-1158 (2017)[PubMed]
- Elowitz, M. & Lim, W. A.: Build life to understand it. Nature, 468, 889-890 (2010)[PubMed]
- Rubenstein, M., Cornejo, A. & Nagpal, R.: Programmable self-assembly in a thousand-robot swarm. Science, 345, 795-799 (2014)[PubMed]
- Morsut, L., Roybal, K. T., Xiong, X. et al.: Engineering customized cell sensing and response behaviors using synthetic Notch receptors. Cell, 164, 780-791 (2016)[PubMed]
- Nose, A., Nagafuchi, A. & Takeichi M.: Expressed recombinant cadherins mediate cell sorting in model systems. Cell, 54, 993-1001 (1988)[PubMed]
- Blauch, L. R., Gai, Y., Khor, J. W. et al.: Microfluidic guillotine for single-cell wound repair studies. Proc. Natl. Acad. Sci. USA, 114, 7283-7288 (2017)[PubMed]
- Collier, J. R., Monk, N. A., Maini, P. K. et al.: Pattern formation by lateral inhibition with feedback: a mathematical model of Delta-Notch intercellular signalling. J. Theor. Biol., 183, 429-446 (1996)[PubMed]
- Matsuda, M., Koga, M., Woltjen, K. et al.: Synthetic lateral inhibition governs cell-type bifurcation with robust ratios. Nat. Commun., 6, 6195 (2015)[PubMed]
- Vendome, J., Felsovalyi, K., Song, H. et al.: Structural and energetic determinants of adhesive binding specificity in type I cadherins. Proc. Natl. Acad. Sci. USA, 111, E4175-E4184 (2014)[PubMed]
- King, N., Westbrook, M. J., Young, S. L. et al.: The genome of the choanoflagellate Monosiga brevicollis and the origin of metazoans. Nature, 451, 783-788 (2008)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2014年 京都大学大学院医学研究科博士後期課程 修了,同年 同 博士研究員を経て,2015年より米国California大学San Francisco校 博士研究員.
研究テーマ:タンパク質間あるいは細胞間のシグナル伝達ネットワークの設計による新たな細胞機能の創出.
関心事:細胞の機能を正確に制御できる分子ツールの開発.
Leonardo Morsut
米国Southern California大学Assistant Professor.
Wendell A. Lim
米国California大学San Francisco校Professor.
研究室URL:http://limlab.ucsf.edu/
© 2018 戸田 聡・Leonardo Morsut・Wendell A. Lim Licensed under CC 表示 2.1 日本