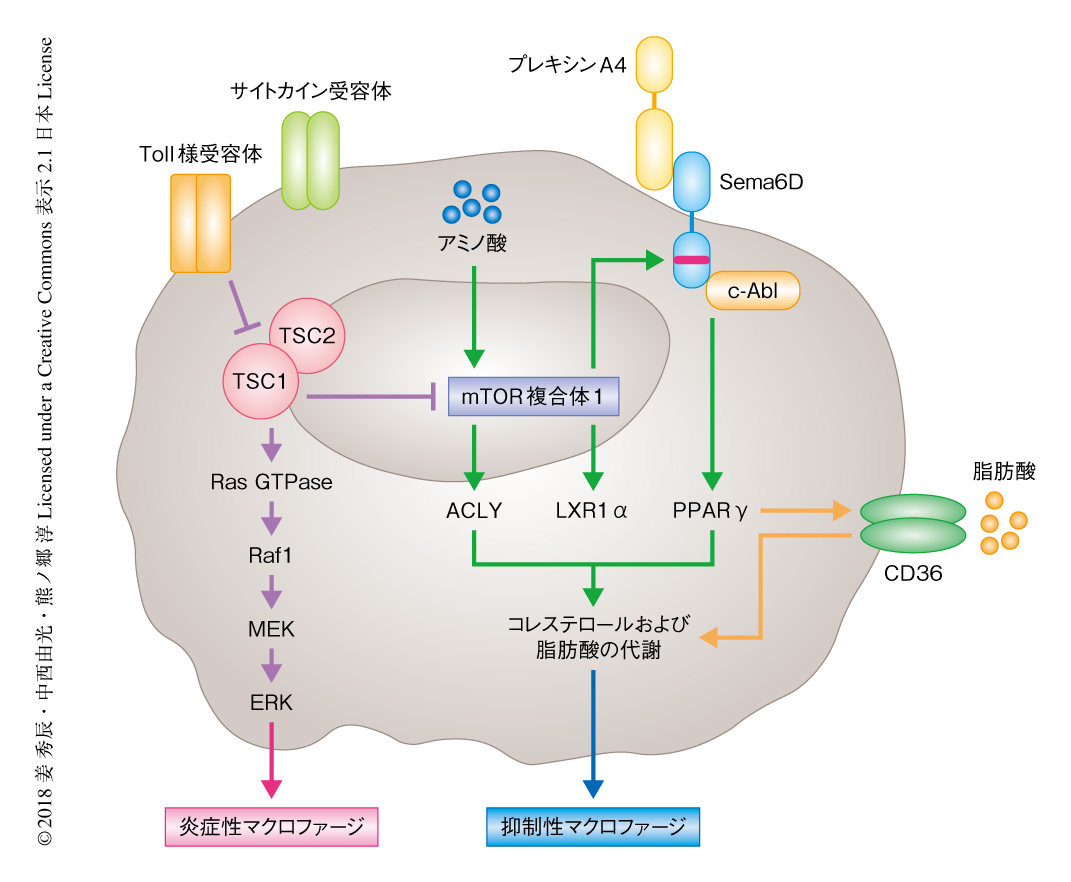
Sema6D逆行性シグナルによる脂質代謝の制御は抑制性マクロファージの分化に必須である
姜 秀辰・中西由光・熊ノ郷 淳
(大阪大学大学院医学系研究科 呼吸器・免疫内科学)
email:熊ノ郷 淳
DOI: 10.7875/first.author.2018.063
Semaphorin 6D reverse signaling controls macrophage lipid metabolism and anti-inflammatory polarization.
Sujin Kang, Yoshimitsu Nakanishi, Yoshiyuki Kioi, Daisuke Okuzaki, Tetsuya Kimura, Hyota Takamatsu, Shohei Koyama, Satoshi Nojima, Masayuki Nishide, Yoshitomo Hayama, Yuhei Kinehara, Yasuhiro Kato, Takeshi Nakatani, Tomomi Shimogori, Junichi Takagi, Toshihiko Toyofuku, Atsushi Kumanogoh
Nature Immunology, 19, 561-570 (2018)
炎症性マクロファージあるいは抑制性マクロファージへの分化にはmTORシグナルを介した代謝系の適切な活性化が必要であるが,その詳細な機構は解明されていない.この研究において,筆者らは,mTOR-Sema6D-PPARγシグナルが抑制性マクロファージへの分化に必須であることを明らかにした.mTORの阻害あるいはSema6Dの欠損によりPPARγの発現は低下し,脂肪酸の取り込みおよびβ酸化が低下した結果,抑制性マクロファージへの分化は阻害された.また,プレキシンA4とSema6Dとの結合により抑制性マクロファージへの分化は促進され,Srcファミリーチロシンキナーゼの一員であるc-AblとSema6Dの細胞内領域との相互作用がPPARγの発現に必要であった.さらに,Sema6Dは腸管マクロファージの恒常性の維持および腸炎の発症の抑制に重要であった.以上の結果より,Sema6D逆行性シグナルはPPARγを介して免疫系と代謝系とを共役させ,抑制性マクロファージへの分化を促進することが明らかにされた.
近年,代謝系の変化が免疫細胞の分化および活性化において重要な役割をはたすことが明らかにされつつあり,免疫代謝(immunometabolism)として注目をあつめている.一例として,リポ多糖およびインターフェロンγによる炎症性マクロファージへの分化においては好気的解糖が亢進するのに対し,インターロイキン4による抑制性マクロファージへの分化においては酸化的リン酸化が亢進する1).免疫代謝を制御する中枢として研究が進められているのがmTORである2,3).代謝のセンサーであるmTORは細胞の内外の栄養素を感知し多様な代謝経路を活性化させる.筆者らは,先行研究において,細胞内のアミノ酸によるmTORの活性化が炎症性マクロファージへの分化に必須であることを発見した4).しかし,mTORシグナルの詳細な分子機構についてはいまだ不明な点が多い.また,筆者らは,抑制性マクロファージへの分化においてmTORに依存してSema6Dの発現が誘導されることを発見したが,その機能については不明であった.
セマフォリンは軸索ガイダンスにおける反発タンパク質として同定されたが,そののち,血管の新生,腫瘍の増殖,骨代謝,免疫応答など多様な機能をもつことが明らかにされた.クラス6の膜型セマフォリンであるセマフォリン6D(Sema6D)は,プレキシンA1のリガンドとして心血管系の形態形成や免疫応答にかかわることが知られている5)(Sema6D正行性シグナル).同時に,Sema6Dはニワトリの心血管系の発生において受容体として機能することも報告されている6)(Sema6D逆行性シグナル).しかし,Sema6D逆行性シグナルの機能についてはいまだ不明な点が多い.この研究において,筆者らは,抑制性マクロファージの分化におけるSema6D逆行性シグナルの機能について,その解明をめざした.
mTORの活性化による抑制性マクロファージへの分化の制御機構について明らかにするため,mTORの阻害剤であるTorin1の存在下において抑制性マクロファージへの分化を誘導し,DNAマイクロアレイ法を用いて遺伝子の発現を解析した.その結果,mTORの活性の阻害によりSema6Dの発現が低下することが明らかにされ,Sema6Dの発現はmTORシグナルにより制御されることが示された.マクロファージの分化の制御におけるSema6Dの機能について明らかにするため,Sema6Dノックアウトマウスを用いてマクロファージの分化能を評価した.野生型のマクロファージに比べ,Sema6Dを欠損したマクロファージにおいてはインターロイキン4の刺激に対する抑制性マクロファージのマーカーの発現が顕著に減弱した.一方で,Sema6Dを欠損したマクロファージにおいては,リポ多糖やインターフェロンγの刺激に対しインターロイキン6やTNFなどの炎症性サイトカインの産生が亢進し,炎症性マクロファージへの過剰な分化を示した.これらの結果から,in vitroにおいてSema6Dは抑制性マクロファージへの分化に必要であることが明らかにされた.さらに,Sema6Dによる抑制性マクロファージへの分化の制御をin vivoにおいても検討するため,キチンの腹腔内投与により抑制性マクロファージへの分化を誘導した.キチンは腹腔においてインターロイキン4を産生する細胞の分化を誘導し抑制性マクロファージの分化を促進するが,野生型のマウスと比較して,Sema6Dノックアウトマウスにおいては抑制性マクロファージのマーカーの発現が顕著に低下した.また,リポ多糖の腹腔内投与によるエンドトキシンショックモデルにおいて,Sema6Dノックアウトマウスは野生型のマウスよりも血清中の炎症性サイトカインの濃度が高く,致死率も高いことが確認された.以上の結果から,in vitroのみならずin vivoにおいても,mTORの活性に依存して発現するSema6Dが抑制性マクロファージの分化に重要であることが明らかにされた.
抑制性マクロファージへの分化におけるSema6Dシグナルの分子機構について明らかにするため,野生型のマクロファージおよびSema6Dを欠損したマクロファージにおける遺伝子の発現をRNA-seq法により解析した.その結果,Sema6Dを欠損したマクロファージにおいてはPparg遺伝子およびPPARγシグナルに関連する遺伝子の発現の低下が認められた.実際に,抑制性マクロファージが分化する条件において,Sema6Dを欠損したマクロファージにおけるPPARγの発現は顕著に低下した.さらに,Sema6Dを欠損したマクロファージにPparg遺伝子を導入すると抑制性マクロファージのマーカーの発現が上昇した.一方で,PPARγの阻害剤の存在下において,Sema6Dを欠損したマクロファージにSema6d遺伝子を導入しても抑制性マクロファージのマーカーの発現は回復しなかった.以上より,PPARγは抑制性マクロファージへの分化においてSema6Dの下流の主要なタンパク質であることが明らかにされた.
PPARγはおもに脂肪細胞の分化に関与し,脂質代謝の鍵タンパク質として知られている.免疫系においてはとくに単球やマクロファージに発現し,抗炎症作用を発揮することが報告されている.さきに述べたとおり,Sema6DシグナルによりPPARγの発現が制御されたことから,抑制性マクロファージの分化においてSema6Dが脂質代謝を制御している可能性について検討した.脂質代謝に関連する遺伝子であるCd36遺伝子およびFabp4遺伝子の発現について調べたところ,Sema6Dを欠損したマクロファージにおいて発現が顕著に低下していた.細胞への脂質の取り込み能について評価したところ,Sema6Dを欠損した抑制性マクロファージにおいて低密度リポタンパク質の取り込み能が低下していた.さらに,細胞外フラックスアナライザーを用いて脂肪酸のβ酸化について評価した結果,Sema6Dを欠損した抑制性マクロファージにおいてβ酸化の低下が認められた.以上の結果より,Sema6DシグナルはPPARγを介して細胞への脂質の取り込みおよび脂質代謝を制御し,抑制性マクロファージの分化に寄与することが明らかにされた.
PPARγは脂肪組織および大腸において発現が高く,また,抗炎症作用をもつことから,Sema6D-PPARγシグナルが腸管における炎症応答および免疫応答の制御に重要であると考え,腸管での炎症応答におけるSema6Dシグナルの関与について検討した.腸管においてはインターロイキン10の産生を担う腸管に常在性のCX3CR1陽性のマクロファージにより免疫恒常性が維持されているが,この腸管に常在性のCX3CR1陽性のマクロファージはSema6Dを高く発現していた.また,腸管においてSema6Dを欠損したマクロファージはリポ多糖の刺激に対しPparg遺伝子やIl10遺伝子など抗炎症性メディエーターをコードする遺伝子の発現がいちじるしく低下する一方,Il6遺伝子,Tnf遺伝子,Il12p40遺伝子などの炎症性サイトカインをコードする遺伝子の発現が上昇していた.さらに,デキストラン硫酸ナトリウムの投与による腸炎のモデルマウスを作製したところ,Sema6Dノックアウトマウスの大腸においてPparg遺伝子の発現が顕著に低下し,体重の減少や大腸の短縮および腸管組織の破綻など重篤な腸炎が生じた.さらに,野生型のマウスおよびSema6Dノックアウトマウスを用いて骨髄キメラマウスを作製しデキストラン硫酸ナトリウムの投与により腸炎を発症させたところ,Sema6Dを欠損した骨髄細胞を移植した野生型のマウスは,野生型の骨髄細胞を移植した野生型のマウスに比べ,より重症の腸炎を呈した.以上から,ミエロイド系細胞に発現するSema6Dは免疫抑制性の応答を促進し,腸管において免疫恒常性の維持に重要であることが明らかにされた.
通常,セマフォリンはリガンドとして機能し,その受容体であるプレキシンやニューロピリンとの結合を介してさまざまな機能を発揮する7,8).クラス6のセマフォリンはセマフォリンのなかでもっとも長い細胞内領域をもつ.ニワトリの胎仔を用いた心臓の形態形成の観察において,プレキシンA1をリガンドとしたSema6D逆行性シグナルの重要性が報告されている6).一方で,免疫系におけるSema6D逆行性シグナルの機能についてはいまだ不明である.そこで,抑制性マクロファージの分化に対するSema6D逆行性シグナルの関与について検討するため,Sema6D逆行性シグナルの伝達に必須であるSrcファミリーチロシンキナーゼの一員であるc-Ablとの結合の阻害されたSema6D変異体を,Sema6Dを欠損したマクロファージに発現させたが,抑制性マクロファージのマーカーの発現は回復しなかった.つまり,抑制性マクロファージの分化にはSema6D逆行性シグナルの活性が必須であることが明らかにされた.さらに,Sema6Dのリガンドを探索したところ,プレキシンA4の存在下にて,野生型の抑制性マクロファージにおいてはPparg遺伝子の発現が上昇したのに対し,Sema6Dを欠損したマクロファージにおいて発現の変化は認められなかった.さらに,c-Ablの阻害剤およびsiRNAを用いたc-Ablのノックダウンにより抑制性マクロファージへの分化が抑制されたことから,抑制性マクロファージの分化においてc-Ablが重要な役割をはたすことが明らかにされた.これらの結果から,プレキシンA4をリガンドとするSema6D逆行性シグナルはc-Ablを介して抑制性マクロファージの分化を制御することがわかった.
この研究により,mTORシグナルをうけたSema6Dからの逆行性シグナルがPPARγを介して脂質代謝を制御し,抑制性マクロファージの分化を促進することが明らかにされた(図1).これにより,神経系と代謝系,代謝系と免疫系,免疫系と神経系が相互に連関することが分子レベルで直接的に証明された.さらに,慢性炎症における代謝制御の重要性についても示された.既存の免疫制御薬による病勢の制御が不十分な慢性炎症性の疾患において,代謝の制御という新たな観点から新規の治療薬の開発をめざすことが今後の大きな課題である.
略歴:2012年 大阪大学大学院医学研究科 修了,同年より同 助教.
研究テーマ:マクロファージの機能の制御による疾患の病態の制御.
中西 由光(Yoshimitsu Nakanishi)
大阪大学大学院医学研究科 在学中.
熊ノ郷 淳(Atsushi Kumanogoh)
大阪大学医学系研究科 教授.
研究室URL:http://www.imed3.med.osaka-u.ac.jp/
© 2018 姜 秀辰・中西由光・熊ノ郷 淳 Licensed under CC 表示 2.1 日本
(大阪大学大学院医学系研究科 呼吸器・免疫内科学)
email:熊ノ郷 淳
DOI: 10.7875/first.author.2018.063
Semaphorin 6D reverse signaling controls macrophage lipid metabolism and anti-inflammatory polarization.
Sujin Kang, Yoshimitsu Nakanishi, Yoshiyuki Kioi, Daisuke Okuzaki, Tetsuya Kimura, Hyota Takamatsu, Shohei Koyama, Satoshi Nojima, Masayuki Nishide, Yoshitomo Hayama, Yuhei Kinehara, Yasuhiro Kato, Takeshi Nakatani, Tomomi Shimogori, Junichi Takagi, Toshihiko Toyofuku, Atsushi Kumanogoh
Nature Immunology, 19, 561-570 (2018)
要 約
炎症性マクロファージあるいは抑制性マクロファージへの分化にはmTORシグナルを介した代謝系の適切な活性化が必要であるが,その詳細な機構は解明されていない.この研究において,筆者らは,mTOR-Sema6D-PPARγシグナルが抑制性マクロファージへの分化に必須であることを明らかにした.mTORの阻害あるいはSema6Dの欠損によりPPARγの発現は低下し,脂肪酸の取り込みおよびβ酸化が低下した結果,抑制性マクロファージへの分化は阻害された.また,プレキシンA4とSema6Dとの結合により抑制性マクロファージへの分化は促進され,Srcファミリーチロシンキナーゼの一員であるc-AblとSema6Dの細胞内領域との相互作用がPPARγの発現に必要であった.さらに,Sema6Dは腸管マクロファージの恒常性の維持および腸炎の発症の抑制に重要であった.以上の結果より,Sema6D逆行性シグナルはPPARγを介して免疫系と代謝系とを共役させ,抑制性マクロファージへの分化を促進することが明らかにされた.
はじめに
近年,代謝系の変化が免疫細胞の分化および活性化において重要な役割をはたすことが明らかにされつつあり,免疫代謝(immunometabolism)として注目をあつめている.一例として,リポ多糖およびインターフェロンγによる炎症性マクロファージへの分化においては好気的解糖が亢進するのに対し,インターロイキン4による抑制性マクロファージへの分化においては酸化的リン酸化が亢進する1).免疫代謝を制御する中枢として研究が進められているのがmTORである2,3).代謝のセンサーであるmTORは細胞の内外の栄養素を感知し多様な代謝経路を活性化させる.筆者らは,先行研究において,細胞内のアミノ酸によるmTORの活性化が炎症性マクロファージへの分化に必須であることを発見した4).しかし,mTORシグナルの詳細な分子機構についてはいまだ不明な点が多い.また,筆者らは,抑制性マクロファージへの分化においてmTORに依存してSema6Dの発現が誘導されることを発見したが,その機能については不明であった.
セマフォリンは軸索ガイダンスにおける反発タンパク質として同定されたが,そののち,血管の新生,腫瘍の増殖,骨代謝,免疫応答など多様な機能をもつことが明らかにされた.クラス6の膜型セマフォリンであるセマフォリン6D(Sema6D)は,プレキシンA1のリガンドとして心血管系の形態形成や免疫応答にかかわることが知られている5)(Sema6D正行性シグナル).同時に,Sema6Dはニワトリの心血管系の発生において受容体として機能することも報告されている6)(Sema6D逆行性シグナル).しかし,Sema6D逆行性シグナルの機能についてはいまだ不明な点が多い.この研究において,筆者らは,抑制性マクロファージの分化におけるSema6D逆行性シグナルの機能について,その解明をめざした.
1.mTORに依存して発現するSema6Dは抑制性マクロファージの分化に必須である
mTORの活性化による抑制性マクロファージへの分化の制御機構について明らかにするため,mTORの阻害剤であるTorin1の存在下において抑制性マクロファージへの分化を誘導し,DNAマイクロアレイ法を用いて遺伝子の発現を解析した.その結果,mTORの活性の阻害によりSema6Dの発現が低下することが明らかにされ,Sema6Dの発現はmTORシグナルにより制御されることが示された.マクロファージの分化の制御におけるSema6Dの機能について明らかにするため,Sema6Dノックアウトマウスを用いてマクロファージの分化能を評価した.野生型のマクロファージに比べ,Sema6Dを欠損したマクロファージにおいてはインターロイキン4の刺激に対する抑制性マクロファージのマーカーの発現が顕著に減弱した.一方で,Sema6Dを欠損したマクロファージにおいては,リポ多糖やインターフェロンγの刺激に対しインターロイキン6やTNFなどの炎症性サイトカインの産生が亢進し,炎症性マクロファージへの過剰な分化を示した.これらの結果から,in vitroにおいてSema6Dは抑制性マクロファージへの分化に必要であることが明らかにされた.さらに,Sema6Dによる抑制性マクロファージへの分化の制御をin vivoにおいても検討するため,キチンの腹腔内投与により抑制性マクロファージへの分化を誘導した.キチンは腹腔においてインターロイキン4を産生する細胞の分化を誘導し抑制性マクロファージの分化を促進するが,野生型のマウスと比較して,Sema6Dノックアウトマウスにおいては抑制性マクロファージのマーカーの発現が顕著に低下した.また,リポ多糖の腹腔内投与によるエンドトキシンショックモデルにおいて,Sema6Dノックアウトマウスは野生型のマウスよりも血清中の炎症性サイトカインの濃度が高く,致死率も高いことが確認された.以上の結果から,in vitroのみならずin vivoにおいても,mTORの活性に依存して発現するSema6Dが抑制性マクロファージの分化に重要であることが明らかにされた.
2.Sema6DシグナルはPPARγを介しマクロファージの脂質代謝を制御する
抑制性マクロファージへの分化におけるSema6Dシグナルの分子機構について明らかにするため,野生型のマクロファージおよびSema6Dを欠損したマクロファージにおける遺伝子の発現をRNA-seq法により解析した.その結果,Sema6Dを欠損したマクロファージにおいてはPparg遺伝子およびPPARγシグナルに関連する遺伝子の発現の低下が認められた.実際に,抑制性マクロファージが分化する条件において,Sema6Dを欠損したマクロファージにおけるPPARγの発現は顕著に低下した.さらに,Sema6Dを欠損したマクロファージにPparg遺伝子を導入すると抑制性マクロファージのマーカーの発現が上昇した.一方で,PPARγの阻害剤の存在下において,Sema6Dを欠損したマクロファージにSema6d遺伝子を導入しても抑制性マクロファージのマーカーの発現は回復しなかった.以上より,PPARγは抑制性マクロファージへの分化においてSema6Dの下流の主要なタンパク質であることが明らかにされた.
PPARγはおもに脂肪細胞の分化に関与し,脂質代謝の鍵タンパク質として知られている.免疫系においてはとくに単球やマクロファージに発現し,抗炎症作用を発揮することが報告されている.さきに述べたとおり,Sema6DシグナルによりPPARγの発現が制御されたことから,抑制性マクロファージの分化においてSema6Dが脂質代謝を制御している可能性について検討した.脂質代謝に関連する遺伝子であるCd36遺伝子およびFabp4遺伝子の発現について調べたところ,Sema6Dを欠損したマクロファージにおいて発現が顕著に低下していた.細胞への脂質の取り込み能について評価したところ,Sema6Dを欠損した抑制性マクロファージにおいて低密度リポタンパク質の取り込み能が低下していた.さらに,細胞外フラックスアナライザーを用いて脂肪酸のβ酸化について評価した結果,Sema6Dを欠損した抑制性マクロファージにおいてβ酸化の低下が認められた.以上の結果より,Sema6DシグナルはPPARγを介して細胞への脂質の取り込みおよび脂質代謝を制御し,抑制性マクロファージの分化に寄与することが明らかにされた.
3.腸管に常在性のCX3CR1陽性のマクロファージはSema6Dシグナルを介して大腸炎を抑制する
PPARγは脂肪組織および大腸において発現が高く,また,抗炎症作用をもつことから,Sema6D-PPARγシグナルが腸管における炎症応答および免疫応答の制御に重要であると考え,腸管での炎症応答におけるSema6Dシグナルの関与について検討した.腸管においてはインターロイキン10の産生を担う腸管に常在性のCX3CR1陽性のマクロファージにより免疫恒常性が維持されているが,この腸管に常在性のCX3CR1陽性のマクロファージはSema6Dを高く発現していた.また,腸管においてSema6Dを欠損したマクロファージはリポ多糖の刺激に対しPparg遺伝子やIl10遺伝子など抗炎症性メディエーターをコードする遺伝子の発現がいちじるしく低下する一方,Il6遺伝子,Tnf遺伝子,Il12p40遺伝子などの炎症性サイトカインをコードする遺伝子の発現が上昇していた.さらに,デキストラン硫酸ナトリウムの投与による腸炎のモデルマウスを作製したところ,Sema6Dノックアウトマウスの大腸においてPparg遺伝子の発現が顕著に低下し,体重の減少や大腸の短縮および腸管組織の破綻など重篤な腸炎が生じた.さらに,野生型のマウスおよびSema6Dノックアウトマウスを用いて骨髄キメラマウスを作製しデキストラン硫酸ナトリウムの投与により腸炎を発症させたところ,Sema6Dを欠損した骨髄細胞を移植した野生型のマウスは,野生型の骨髄細胞を移植した野生型のマウスに比べ,より重症の腸炎を呈した.以上から,ミエロイド系細胞に発現するSema6Dは免疫抑制性の応答を促進し,腸管において免疫恒常性の維持に重要であることが明らかにされた.
4.Sema6D逆行性シグナルはc-Ablを介して抑制性マクロファージの分化を制御する
通常,セマフォリンはリガンドとして機能し,その受容体であるプレキシンやニューロピリンとの結合を介してさまざまな機能を発揮する7,8).クラス6のセマフォリンはセマフォリンのなかでもっとも長い細胞内領域をもつ.ニワトリの胎仔を用いた心臓の形態形成の観察において,プレキシンA1をリガンドとしたSema6D逆行性シグナルの重要性が報告されている6).一方で,免疫系におけるSema6D逆行性シグナルの機能についてはいまだ不明である.そこで,抑制性マクロファージの分化に対するSema6D逆行性シグナルの関与について検討するため,Sema6D逆行性シグナルの伝達に必須であるSrcファミリーチロシンキナーゼの一員であるc-Ablとの結合の阻害されたSema6D変異体を,Sema6Dを欠損したマクロファージに発現させたが,抑制性マクロファージのマーカーの発現は回復しなかった.つまり,抑制性マクロファージの分化にはSema6D逆行性シグナルの活性が必須であることが明らかにされた.さらに,Sema6Dのリガンドを探索したところ,プレキシンA4の存在下にて,野生型の抑制性マクロファージにおいてはPparg遺伝子の発現が上昇したのに対し,Sema6Dを欠損したマクロファージにおいて発現の変化は認められなかった.さらに,c-Ablの阻害剤およびsiRNAを用いたc-Ablのノックダウンにより抑制性マクロファージへの分化が抑制されたことから,抑制性マクロファージの分化においてc-Ablが重要な役割をはたすことが明らかにされた.これらの結果から,プレキシンA4をリガンドとするSema6D逆行性シグナルはc-Ablを介して抑制性マクロファージの分化を制御することがわかった.
おわりに
この研究により,mTORシグナルをうけたSema6Dからの逆行性シグナルがPPARγを介して脂質代謝を制御し,抑制性マクロファージの分化を促進することが明らかにされた(図1).これにより,神経系と代謝系,代謝系と免疫系,免疫系と神経系が相互に連関することが分子レベルで直接的に証明された.さらに,慢性炎症における代謝制御の重要性についても示された.既存の免疫制御薬による病勢の制御が不十分な慢性炎症性の疾患において,代謝の制御という新たな観点から新規の治療薬の開発をめざすことが今後の大きな課題である.
文 献
- Covarrubias, A. J., Aksoylar, H. I., Yu, J. et al.: Akt-mTORC1 signaling regulates Acly to integrate metabolic input to control of macrophage activation. Elife, 19, 5 (2016)[PubMed]
- Murray, P. J., Allen, J. E., Biswas, S. K. et al.: Macrophage activation and polarization: nomenclature and experimental guidelines. Immunity, 41, 14-20 (2014)[PubMed]
- Weichhart, T., Hengstschlager, M. & Linke, M.: Regulation of innate immune cell function by mTOR. Nat. Rev. Immunol., 15, 599-614 (2015)[PubMed]
- Kimura, T., Nada, S., Takegahara, N. et al.: Polarization of M2 macrophages requires Lamtor1 that integrates cytokine and amino-acid signals. Nat. Commun., 12, 13130 (2016)[PubMed]
- Toyofuku, T., Zhang, H., Kumanogoh, A. et al.: Dual roles of Sema6D in cardiac morphogenesis through region-specific association of its receptor, Plexin-A1, with off-track and vascular endothelial growth factor receptor type 2. Genes Dev., 18, 435-447 (2004)[PubMed]
- Toyofuku, T., Zhang, H., Kumanogoh, A. et al.: Guidance of myocardial patterning in cardiac development by Sema6D reverse signalling. Nat. Cell Biol., 6, 1204-1211 (2004)[PubMed]
- Worzfeld, T. & Offermanns, S.: Semaphorins and plexins as therapeutic targets. Nat. Rev. Drug. Discov., 13, 603-621 (2014)[PubMed]
- Kumanogoh, A. & Kikutani, H.: Immunological functions of the neuropilins and plexins as receptors for semaphorins. Nat. Rev. Immunol., 13, 802-814 (2013)[PubMed]
著者プロフィール
略歴:2012年 大阪大学大学院医学研究科 修了,同年より同 助教.
研究テーマ:マクロファージの機能の制御による疾患の病態の制御.
中西 由光(Yoshimitsu Nakanishi)
大阪大学大学院医学研究科 在学中.
熊ノ郷 淳(Atsushi Kumanogoh)
大阪大学医学系研究科 教授.
研究室URL:http://www.imed3.med.osaka-u.ac.jp/
© 2018 姜 秀辰・中西由光・熊ノ郷 淳 Licensed under CC 表示 2.1 日本