ZNFX-1はヌアージュにおいてエピジェネティックなシグナルのバランスのとれた形成を促進する
石館 宇夫
(米国Massachusetts大学Medical School,RNA Therapeutics Institute)
email:石館宇夫
DOI: 10.7875/first.author.2018.060
ZNFX-1 functions within perinuclear nuage to balance epigenetic signals.
Takao Ishidate, Ahmet R. Ozturk, Daniel J. Durning, Rita Sharma, En-zhi Shen, Hao Chen, Meetu Seth, Masaki Shirayama, Craig C. Mello
Molecular Cell, 70, 639-649.e6 (2018)
線虫の生殖細胞においては,Argonauteタンパク質およびそれと結合した小分子RNAが世代をこえたエピジェネティックな遺伝子発現の制御にかかわることが知られている.この研究において,筆者らは,このエピジェネティックな遺伝子発現の制御機構にかかわる遺伝子をクローニングすることを目的として遺伝学的なスクリーニングを実施し,ヘリカーゼドメインおよびCysに富むジンクフィンガードメインをもつタンパク質をコードするznfx-1遺伝子を同定した.ZNFX-1はエピジェネティックな機構にかかわるほかのタンパク質と同様に,生殖細胞において核膜の周囲をとりかこむ顆粒状のオルガネラであるヌアージュに局在し,そこでArgonauteおよび小分子RNAを産生するRNA依存性RNAポリメラーゼと相互作用していた.さらに,小分子RNAのクローニング実験により,ZNFX-1はRNA依存性RNAポリメラーゼを標的となるmRNAのうえに均一に分布させ,その発現を制御する小分子RNAのシグナルを均等に増幅させることが明らかにされた.
多細胞生物における多種多様な体細胞は,分化にともない新しい遺伝子発現の状態を獲得し,その状態がエピジェネティックな機構により世代をこえて安定に維持されることにより生じる.その一方で,生殖細胞において,DNAの変異によらないエピジェネティックな変化が遺伝子発現の状態を次世代にどれだけ伝達しうるかについては,いまだに未解明な点が多い.
線虫の生殖細胞においては,導入されたトランス遺伝子の発現が活性状態あるいは非活性状態のいずれかの状態をとりうること,そして,その状態がエピジェネティックな機構により次世代へときわめて安定に伝達されることが知られており,この系はエピジェネティックな機構を研究するうえで有用なモデルになっている.これまでに,筆者らを含むいくつかの研究グループにより,線虫の生殖細胞においてはたらく3種類のArgonauteタンパク質およびそれらと結合する小分子RNAからなる精妙な遺伝子発現の制御機構が明らかにされつつある1-7).
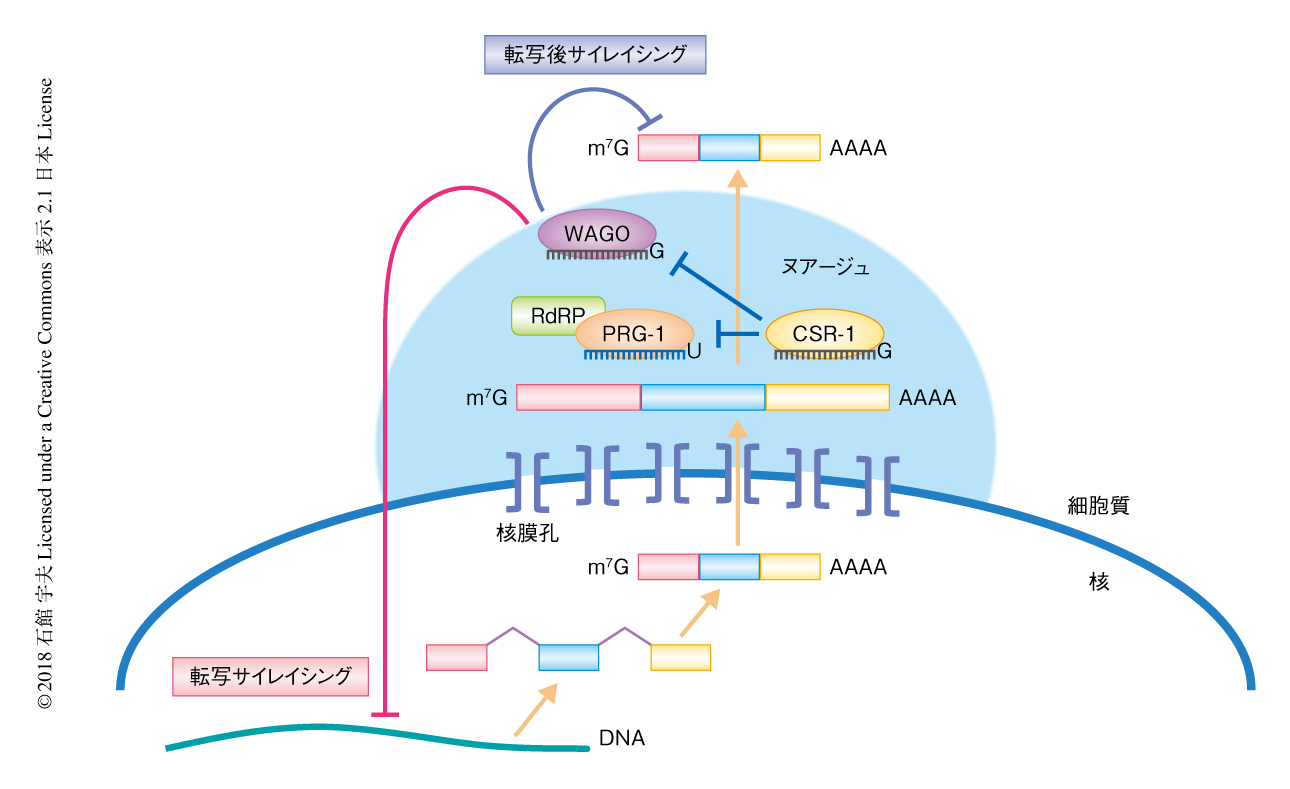
簡潔にまとめると,生殖細胞において,内在性の小分子RNAであるpiRNA(21U-RNA)はPIWI ArgonauteのPRG-1と結合しpiRISCを形成する.piRISCはあらゆる転写産物をmiRNAと類似した仕方で認識して結合し,転写産物にRNA依存性RNAポリメラーゼをリクルートして,転写産物に対しアンチセンスとなる小分子RNA(22G-RNA)を産生させる.そののち,22G-RNAはWAGOと総称される線虫に特異的な複数のArgonauteと結合し,標的となる遺伝子の転写サイレンシングおよび転写後サイレンシングをもたらす.他方,生殖細胞において発現する転写産物を標的とする22G-RNAと結合したArgonauteのひとつCSR-1は,いまだ詳細の明らかにされていない分子機構によりPRG-1およびWAGOによる遺伝子サイレンシングから“自己”の転写産物を保護する.さらに,WAGOおよびCSR-1はおのおのの標的となる転写産物にRNA依存性RNAポリメラーゼをリクルートし,それらを標的にする22G-RNAの産生をもたらす.増幅された22G-RNAはそれぞれWAGOおよびCSR-1に積み込まれたのち,卵子および精子に格納され“非自己”と“自己”のエピジェネティックな“記憶”として次世代へと受け継がれる(図1).筆者らは,このPRG-1により始動しWAGOにより維持されるエピジェネティックな遺伝子サイレンシングをRNAe(RNA epigenetic silencing),そして,CSR-1によるRNAeに対抗したエピジェネティックな遺伝子の活性化をRNAa(RNA epigenetic activation)とよんでいる4,6)(文献4) は 新着論文レビュー でも掲載,文献6) は 新着論文レビュー でも掲載).
RNAeの維持に関与する新しい遺伝子を発見することを目的として,線虫の生殖細胞においてRNAeにより非活性状態になったトランス遺伝子がふたたび活性状態になるような変異体を回収する遺伝的なスクリーニングを実施した.ねらった変異体を効率よく単離するため,以前に筆者らの研究室において単離された温度感受性の胚性致死cdk-1ts変異とともにRNAeによりその発現が抑制されたcdk-1::gfpトランス遺伝子をもつ株を用意した.変異を誘発したのち非許容温度において生育が可能になった線虫を選択すると,そのなかにはcdk-1::gfpトランス遺伝子の発現が回復することによりcdk-1ts変異による胚性致死からレスキューされる変異体が含まれることが期待された.実際,このスクリーニングにより,cdk-1::gfpトランス遺伝子の発現が回復した多数の変異体が得られ,そのなかにはWAGOをコードする遺伝子など既知の遺伝子の変異体にくわえ,RNAeの維持にかかわる複数の未知の遺伝子の変異体が含まれることが確認された.さらに解析を進めた結果,未知の変異体のなかから,機能の不明な保存されたznfx-1遺伝子について3個の対立遺伝子が同定された.
znfx-1遺伝子には中央にヘリカーゼドメインをもつタンパク質がコードされていた.ZNFX-1のヘリカーゼドメインはスーパーファミリーI型に属し,UPF1と似た5’-3’方向の巻きもどし活性をもつと考えられた.さらに,ZNFX-1のC末端側には,ヒトの転写抑制因子NF-X1に見い出されたCysに富むジンクフィンガードメインが6個存在した.znfx-1遺伝子と同様の構造をもつ遺伝子はヒトを含む多くの生物種にも保存されており,重要な遺伝子であることが示唆されたが,これまで,その機能について知られたものはなかった.しかし,分裂酵母にはZNFX-1とよく似たヘリカーゼドメインのみをもつタンパク質Hrr1が存在し,RNA依存性RNAポリメラーゼやArgonauteと相互作用しセントロメア領域のヘテロクロマチン化にかかわることが報告されていた8).
遺伝学的なスクリーニングにより同定されたznfx-1遺伝子の変異は,ヘリカーゼドメインの保存されたアミノ酸残基のミスセンス点変異,および,ヘリカーゼドメインの直後にフレームシフトにより終止コドンを挿入させる欠失変異であり,ヘリカーゼの活性がZNFX-1の機能に重要であることが強く示唆された.さらに,CRISPR-Cas9法によるゲノム編集によりヘリカーゼドメインのATP結合モチーフに点変異を導入しヘリカーゼ活性を欠失させた変異体,ジンクフィンガードメイン全体を欠損させた変異体,znfx-1遺伝子全体を完全に欠損させた変異体などを作製しその表現型を調べたところ,すべての変異体においてRNAe活性が失われており,ヘリカーゼドメインおよびジンクフィンガードメインの両者がRNAeに必要であることが示された.さらに,完全欠失変異体は4世代以内に不稔となるいわゆるmortal germlineの表現型を示すことがわかり,znfx-1遺伝子は線虫の稔性の維持に必須であることが明らかにされた.
CRISPR-Cas9法を用いてGFPとZNFX-1の融合タンパク質を発現させZNFX-1の局在について検討した.動物の生殖細胞の細胞質には核膜をとりかこむように局在する,顆粒状の膜をもたない“ヌアージュ”(nuage)と総称されるオルガネラが存在する.P顆粒とよばれる線虫のヌアージュには,mRNA,PRG-1,WAGO,CSR-1などのArgonaute,および,それらと結合する小分子RNA,さらに,RNA依存性RNAポリメラーゼなど小分子RNAの産生に必要な多くのタンパク質が凝集して存在する.多くの場合,P顆粒は核膜孔に接するかたちで局在することから,核から輸送されるmRNAが,細胞質において翻訳されるまえにArgonauteおよび小分子RNAにより発現制御をうける場であると考えられている.GFP-ZNFX-1融合タンパク質は生殖細胞においてのみ発現が確認され,そこでP顆粒様の局在パターンを示した.さらに,P顆粒に局在することの知られるPGL-1およびCSR-1との共存について調べたところ,その局在は一致した.このようなP顆粒に特異的な局在パターンは,ZNFX-1が小分子RNAを介した遺伝子発現のエピジェネティックな制御にかかわるタンパク質であることと一貫していた.なお,筆者らとは独立にZNFX-1を見い出した研究グループは,ZNFX-1がP顆粒の内部のZ顆粒とよばれるサブドメインに時期特異的に濃縮すると報告している9).
znfx-1遺伝子の機能についてさらにくわしく調べるため,以下のような実験を実施した.通常,部分的に同じ配列をもつ2つのトランス遺伝子は,相手の発現の状態に対しトランスに正あるいは負に影響をおよぼすことがわかっている.ところが,同じGFPの配列を含む2つのトランス遺伝子が,一方は活性状態,他方は不活性状態という,2つの発現状態を維持したまま安定に共存する場合もあることが知られている10).この活性状態と不活性状態がバランスをとって共存している状態は,遺伝子サイレンシングを強めたり弱めたりする遺伝的な変化に敏感に反応するため,遺伝子の変異が遺伝子サイレンシングにおよぼす影響を高感度で検出する系になる.そこで,この2つの発現状態がバランスをとって共存した株にznfx-1変異体を導入し,それがトランス遺伝子の発現状態におよぼす影響について検討した.znfx-1変異体は不活性化したトランス遺伝子が活性化するスクリーニングにより同定されたことから,当初,すべてのトランス遺伝子が活性状態を示すと予想していた.ところが予想に反し,znfx-1変異体の導入により,不活性状態にあるトランス遺伝子が活性状態に変わるだけでなく,活性状態にあるトランス遺伝子が不活性状態に変わることが観察された.このことから,znfx-1の機能はたんにRNAeに必要なだけでなく,エピジェネティックな状態を安定して次世代に伝達することにあると考えられた.
znfx-1変異体はいかにしてトランス遺伝子の活性化と不活性化という相反した表現型をひき起こすのだろうか? さきに述べたように,トランス遺伝子のRNAeによる不活性化にはWAGOが関与し,RNAaによる活性化にはCSR-1が関与する.そして,WAGOおよびCSR-1はともにRNA依存性RNAポリメラーゼを介してトランス遺伝子の活性化および不活性化にかかわる小分子RNAのシグナルの増幅を達成する.以上から,ZNFX-1の機能はWAGO経路およびCSR-1経路に共通するRNA依存性RNAポリメラーゼの機能にかかわると考えた.そこで,ZNFX-1とRNA依存性RNAポリメラーゼとの相互作用について共沈実験により検討した.さらに,分裂酵母のZNFX-1ホモログであるHrr1は,分裂酵母のRNA依存性RNAポリメラーゼであるRdp1およびArgonauteであるAgo1とも複合体を形成することから,ZNFX-1とArgonauteとの相互作用についても検討した.その結果,ZNFX-1はRNA依存性RNAポリメラーゼのひとつEGO-1と特異的に共沈しただけでなく,WAGOの一種であるWAGO-1,そして,CSR-1さらにはPRG-1とも特異的に共沈することがわかった.これらの相互作用は1本鎖RNAに特異的なRNaseに対し少なくとも部分的に耐性を示したことから,ヌアージュにおいてZNFX-1はRNA依存性RNAポリメラーゼとともにWAGO-1,CSR-1,PRG-1の3種類のArgonauteと直接的に複合体を形成することが示唆された.このため,znfx-1変異体においてはWAGO経路およびCSR-1経路の両方に異常が生じると考えられた.
分子レベルにおけるznfx-1変異体の異常とはなんなのだろうか? このZNFX-1の機能にかかわる根本的な疑問に答えるため,小分子RNAのクローニング実験を実施し,野生株および変異株における小分子RNAのプロファイルを比較した.znfx-1変異体の比較的マイルドな表現型から予想されたとおり,miRNA,piRNA,22G-RNAなど小分子RNAの種別ごとのリード数や割合については野生株とznfx-1変異株とのあいだで大きな差は認められなかった.ところが,WAGO経路の標的遺伝子をターゲットにする22G-RNAについては,標的遺伝子ごとの22G-RNAのリード数が野生株とznfx-1変異株とのあいだで大きな差があった.すなわち,ある遺伝子ではそれを標的とする22G-RNAがznfx-1変異株において野生株よりも増加しており,また,ある遺伝子では減少していた.この差は,線虫の粗抽出液からすべての小分子RNAをクローニングした場合も,免疫沈降ののちWAGO-9と結合した小分子RNAをクローニングした場合も,同じように認められた.
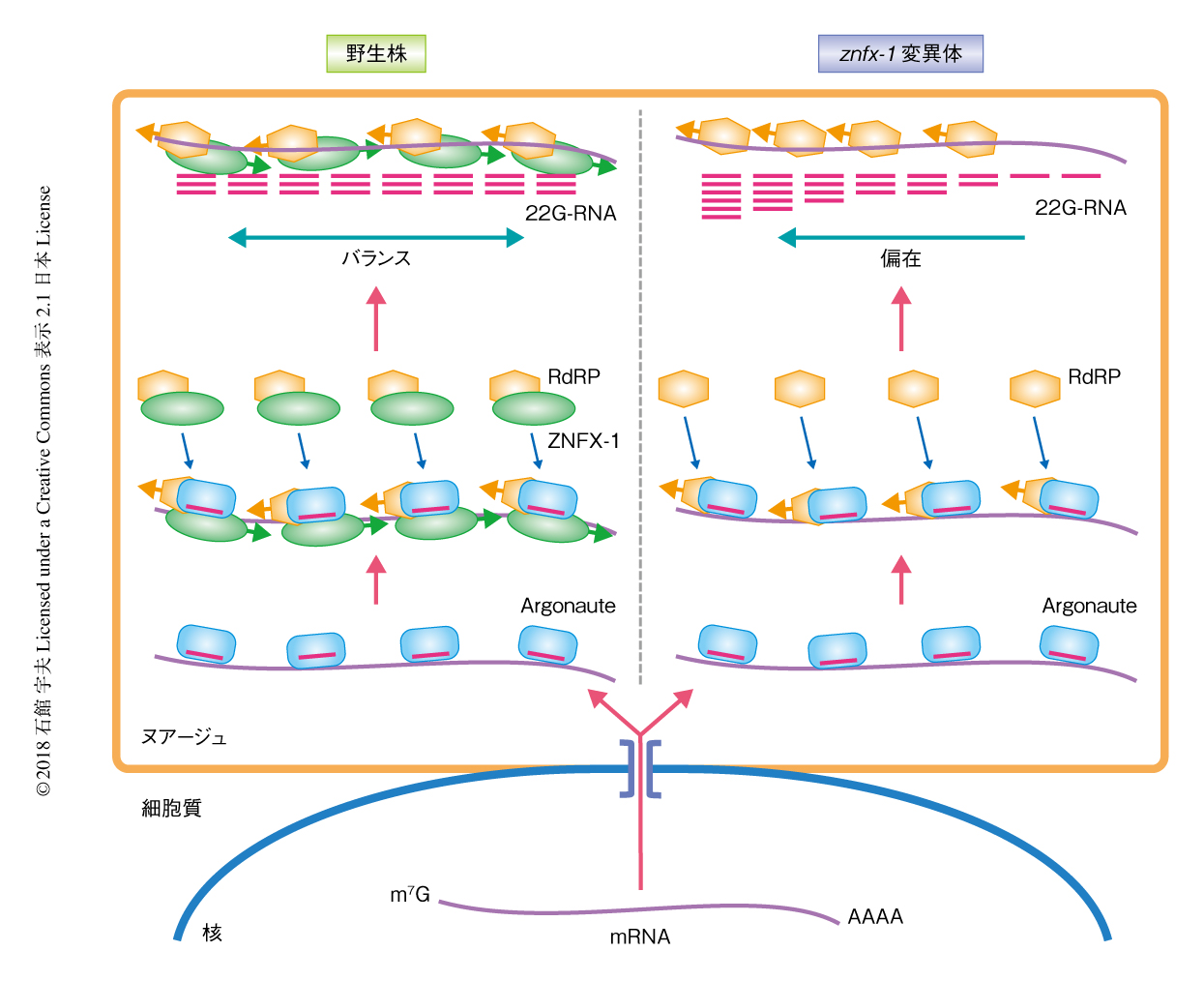
このような差はどこから生じたのだろうか? ZNFX-1はRNA依存性RNAポリメラーゼと結合することから,znfx-1変異体においては標的となるmRNAのうえに形成される22G-RNAの分布になんらかの異常が生じているのではないかと考えた.そこで,比較を容易にするため,mRNAの全長を100としてmRNAを100分割し,それぞれの位置における22G-RNAの量を,その遺伝子全体を標的とする22G-RNAのリード数により標準化したのちmRNAのうえにプロットしたところ,WAGO経路の標的となるmRNAの場合も,CSR-1経路の標的となるmRNAの場合も,野生株において22G-RNAはmRNAの全長にわたり均一に分布していたのに対し,znfx-1変異株の場合はその分布が5’側に大きく偏在していることが明らかにされた.この結果から,野生型のZNFX-1の機能は,標的となるmRNAのうえにおいて形成される22G-RNAの分布がmRNAの5’側に偏在することを抑制することであると考えられた.RNA依存性RNAポリメラーゼはmRNAを鋳型としてアンチセンスとなる22G-RNAをmRNAにおいて3’-5’方向に転写するので,22G-RNAの分布はしだいに標的となるmRNAの5’側に偏在するようになる.ZNFX-1は標的となるmRNAのうえをRNA依存性RNAポリメラーゼとともに5’側から3’側へと移動することにより,このRNA依存性RNAポリメラーゼの5’側への偏在をさまたげ,標的となるmRNAの全長にわたり22G-RNAのシグナルを均等に増幅させると考えられた(図2).また,znfx-1変異体における22G-RNAの5’側への偏在は,トランス遺伝子のmRNAのうえにて拮抗するWAGO経路とCSR-1経路のバランスをくずし,その結果,トランス遺伝子の発現状態を不安定化すると思われた.
この研究においては,遺伝学的な解析,生化学的な解析,そして,小分子RNAのクローニングにより,ZNFX-1はそのヘリカーゼ活性により22G-RNAの産生に必要なRNA依存性RNAポリメラーゼを標的となるmRNAのうえに均一に分布させることが示唆された.ZNFX-1のヘリカーゼドメインと似た構造をもつ分裂酵母のHrr1がRNA依存性RNAポリメラーゼおよびArgonauteの補因子として同定されたことからは,このタイプのヘリカーゼドメインとRNA依存性RNAポリメラーゼとの関係が進化において保存されていることが示される.ここで興味深いことは,ZNFX-1は哺乳類などRNA依存性RNAポリメラーゼをもたない生物にも保存されていることである.マウスのZNFX-1ホモログはPIWIとときを同じくしてパキテン期の精母細胞に発現する.哺乳類においてもZNFX-1ホモログは生殖細胞におけるエピジェネティックな遺伝子発現の制御にかかわるのだろうか? そして,RNA依存性RNAポリメラーゼに依存しない,保存されたZNFX-1の機能とはなんなのだろうか? それと関連し,保存されたジンクフィンガードメインはいかにZNFX-1の機能に貢献するのか? こうした疑問に対する答えを明らかにすることが今後の課題である.
略歴:1997年 大阪大学大学院医学系研究科博士課程 修了,同年 東京大学分子細胞生物学研究所 助手を経て,2002年より米国Massachusetts大学Medical School研究員.
研究テーマ:小分子RNAによるエピジェネティックな遺伝子発現の制御機構.
関心事:線虫の遺伝学を用いた新たな遺伝子サイレンシング機構の探求.
© 2018 石館 宇夫 Licensed under CC 表示 2.1 日本
(米国Massachusetts大学Medical School,RNA Therapeutics Institute)
email:石館宇夫
DOI: 10.7875/first.author.2018.060
ZNFX-1 functions within perinuclear nuage to balance epigenetic signals.
Takao Ishidate, Ahmet R. Ozturk, Daniel J. Durning, Rita Sharma, En-zhi Shen, Hao Chen, Meetu Seth, Masaki Shirayama, Craig C. Mello
Molecular Cell, 70, 639-649.e6 (2018)
要 約
線虫の生殖細胞においては,Argonauteタンパク質およびそれと結合した小分子RNAが世代をこえたエピジェネティックな遺伝子発現の制御にかかわることが知られている.この研究において,筆者らは,このエピジェネティックな遺伝子発現の制御機構にかかわる遺伝子をクローニングすることを目的として遺伝学的なスクリーニングを実施し,ヘリカーゼドメインおよびCysに富むジンクフィンガードメインをもつタンパク質をコードするznfx-1遺伝子を同定した.ZNFX-1はエピジェネティックな機構にかかわるほかのタンパク質と同様に,生殖細胞において核膜の周囲をとりかこむ顆粒状のオルガネラであるヌアージュに局在し,そこでArgonauteおよび小分子RNAを産生するRNA依存性RNAポリメラーゼと相互作用していた.さらに,小分子RNAのクローニング実験により,ZNFX-1はRNA依存性RNAポリメラーゼを標的となるmRNAのうえに均一に分布させ,その発現を制御する小分子RNAのシグナルを均等に増幅させることが明らかにされた.
はじめに
多細胞生物における多種多様な体細胞は,分化にともない新しい遺伝子発現の状態を獲得し,その状態がエピジェネティックな機構により世代をこえて安定に維持されることにより生じる.その一方で,生殖細胞において,DNAの変異によらないエピジェネティックな変化が遺伝子発現の状態を次世代にどれだけ伝達しうるかについては,いまだに未解明な点が多い.
線虫の生殖細胞においては,導入されたトランス遺伝子の発現が活性状態あるいは非活性状態のいずれかの状態をとりうること,そして,その状態がエピジェネティックな機構により次世代へときわめて安定に伝達されることが知られており,この系はエピジェネティックな機構を研究するうえで有用なモデルになっている.これまでに,筆者らを含むいくつかの研究グループにより,線虫の生殖細胞においてはたらく3種類のArgonauteタンパク質およびそれらと結合する小分子RNAからなる精妙な遺伝子発現の制御機構が明らかにされつつある1-7).
簡潔にまとめると,生殖細胞において,内在性の小分子RNAであるpiRNA(21U-RNA)はPIWI ArgonauteのPRG-1と結合しpiRISCを形成する.piRISCはあらゆる転写産物をmiRNAと類似した仕方で認識して結合し,転写産物にRNA依存性RNAポリメラーゼをリクルートして,転写産物に対しアンチセンスとなる小分子RNA(22G-RNA)を産生させる.そののち,22G-RNAはWAGOと総称される線虫に特異的な複数のArgonauteと結合し,標的となる遺伝子の転写サイレンシングおよび転写後サイレンシングをもたらす.他方,生殖細胞において発現する転写産物を標的とする22G-RNAと結合したArgonauteのひとつCSR-1は,いまだ詳細の明らかにされていない分子機構によりPRG-1およびWAGOによる遺伝子サイレンシングから“自己”の転写産物を保護する.さらに,WAGOおよびCSR-1はおのおのの標的となる転写産物にRNA依存性RNAポリメラーゼをリクルートし,それらを標的にする22G-RNAの産生をもたらす.増幅された22G-RNAはそれぞれWAGOおよびCSR-1に積み込まれたのち,卵子および精子に格納され“非自己”と“自己”のエピジェネティックな“記憶”として次世代へと受け継がれる(図1).筆者らは,このPRG-1により始動しWAGOにより維持されるエピジェネティックな遺伝子サイレンシングをRNAe(RNA epigenetic silencing),そして,CSR-1によるRNAeに対抗したエピジェネティックな遺伝子の活性化をRNAa(RNA epigenetic activation)とよんでいる4,6)(文献4) は 新着論文レビュー でも掲載,文献6) は 新着論文レビュー でも掲載).
1.遺伝学的なスクリーニングによるznfx-1遺伝子の同定
RNAeの維持に関与する新しい遺伝子を発見することを目的として,線虫の生殖細胞においてRNAeにより非活性状態になったトランス遺伝子がふたたび活性状態になるような変異体を回収する遺伝的なスクリーニングを実施した.ねらった変異体を効率よく単離するため,以前に筆者らの研究室において単離された温度感受性の胚性致死cdk-1ts変異とともにRNAeによりその発現が抑制されたcdk-1::gfpトランス遺伝子をもつ株を用意した.変異を誘発したのち非許容温度において生育が可能になった線虫を選択すると,そのなかにはcdk-1::gfpトランス遺伝子の発現が回復することによりcdk-1ts変異による胚性致死からレスキューされる変異体が含まれることが期待された.実際,このスクリーニングにより,cdk-1::gfpトランス遺伝子の発現が回復した多数の変異体が得られ,そのなかにはWAGOをコードする遺伝子など既知の遺伝子の変異体にくわえ,RNAeの維持にかかわる複数の未知の遺伝子の変異体が含まれることが確認された.さらに解析を進めた結果,未知の変異体のなかから,機能の不明な保存されたznfx-1遺伝子について3個の対立遺伝子が同定された.
2.ZNFX-1の構造と機能
znfx-1遺伝子には中央にヘリカーゼドメインをもつタンパク質がコードされていた.ZNFX-1のヘリカーゼドメインはスーパーファミリーI型に属し,UPF1と似た5’-3’方向の巻きもどし活性をもつと考えられた.さらに,ZNFX-1のC末端側には,ヒトの転写抑制因子NF-X1に見い出されたCysに富むジンクフィンガードメインが6個存在した.znfx-1遺伝子と同様の構造をもつ遺伝子はヒトを含む多くの生物種にも保存されており,重要な遺伝子であることが示唆されたが,これまで,その機能について知られたものはなかった.しかし,分裂酵母にはZNFX-1とよく似たヘリカーゼドメインのみをもつタンパク質Hrr1が存在し,RNA依存性RNAポリメラーゼやArgonauteと相互作用しセントロメア領域のヘテロクロマチン化にかかわることが報告されていた8).
遺伝学的なスクリーニングにより同定されたznfx-1遺伝子の変異は,ヘリカーゼドメインの保存されたアミノ酸残基のミスセンス点変異,および,ヘリカーゼドメインの直後にフレームシフトにより終止コドンを挿入させる欠失変異であり,ヘリカーゼの活性がZNFX-1の機能に重要であることが強く示唆された.さらに,CRISPR-Cas9法によるゲノム編集によりヘリカーゼドメインのATP結合モチーフに点変異を導入しヘリカーゼ活性を欠失させた変異体,ジンクフィンガードメイン全体を欠損させた変異体,znfx-1遺伝子全体を完全に欠損させた変異体などを作製しその表現型を調べたところ,すべての変異体においてRNAe活性が失われており,ヘリカーゼドメインおよびジンクフィンガードメインの両者がRNAeに必要であることが示された.さらに,完全欠失変異体は4世代以内に不稔となるいわゆるmortal germlineの表現型を示すことがわかり,znfx-1遺伝子は線虫の稔性の維持に必須であることが明らかにされた.
3.ZNFX-1は生殖細胞のヌアージュに局在する
CRISPR-Cas9法を用いてGFPとZNFX-1の融合タンパク質を発現させZNFX-1の局在について検討した.動物の生殖細胞の細胞質には核膜をとりかこむように局在する,顆粒状の膜をもたない“ヌアージュ”(nuage)と総称されるオルガネラが存在する.P顆粒とよばれる線虫のヌアージュには,mRNA,PRG-1,WAGO,CSR-1などのArgonaute,および,それらと結合する小分子RNA,さらに,RNA依存性RNAポリメラーゼなど小分子RNAの産生に必要な多くのタンパク質が凝集して存在する.多くの場合,P顆粒は核膜孔に接するかたちで局在することから,核から輸送されるmRNAが,細胞質において翻訳されるまえにArgonauteおよび小分子RNAにより発現制御をうける場であると考えられている.GFP-ZNFX-1融合タンパク質は生殖細胞においてのみ発現が確認され,そこでP顆粒様の局在パターンを示した.さらに,P顆粒に局在することの知られるPGL-1およびCSR-1との共存について調べたところ,その局在は一致した.このようなP顆粒に特異的な局在パターンは,ZNFX-1が小分子RNAを介した遺伝子発現のエピジェネティックな制御にかかわるタンパク質であることと一貫していた.なお,筆者らとは独立にZNFX-1を見い出した研究グループは,ZNFX-1がP顆粒の内部のZ顆粒とよばれるサブドメインに時期特異的に濃縮すると報告している9).
4.znfx-1遺伝子の変異はエピジェネティックな状態の次世代への伝達を不安定化する
znfx-1遺伝子の機能についてさらにくわしく調べるため,以下のような実験を実施した.通常,部分的に同じ配列をもつ2つのトランス遺伝子は,相手の発現の状態に対しトランスに正あるいは負に影響をおよぼすことがわかっている.ところが,同じGFPの配列を含む2つのトランス遺伝子が,一方は活性状態,他方は不活性状態という,2つの発現状態を維持したまま安定に共存する場合もあることが知られている10).この活性状態と不活性状態がバランスをとって共存している状態は,遺伝子サイレンシングを強めたり弱めたりする遺伝的な変化に敏感に反応するため,遺伝子の変異が遺伝子サイレンシングにおよぼす影響を高感度で検出する系になる.そこで,この2つの発現状態がバランスをとって共存した株にznfx-1変異体を導入し,それがトランス遺伝子の発現状態におよぼす影響について検討した.znfx-1変異体は不活性化したトランス遺伝子が活性化するスクリーニングにより同定されたことから,当初,すべてのトランス遺伝子が活性状態を示すと予想していた.ところが予想に反し,znfx-1変異体の導入により,不活性状態にあるトランス遺伝子が活性状態に変わるだけでなく,活性状態にあるトランス遺伝子が不活性状態に変わることが観察された.このことから,znfx-1の機能はたんにRNAeに必要なだけでなく,エピジェネティックな状態を安定して次世代に伝達することにあると考えられた.
5.ZNFX-1は3種類のArgonauteおよびRNA依存性RNAポリメラーゼと複合体を形成する
znfx-1変異体はいかにしてトランス遺伝子の活性化と不活性化という相反した表現型をひき起こすのだろうか? さきに述べたように,トランス遺伝子のRNAeによる不活性化にはWAGOが関与し,RNAaによる活性化にはCSR-1が関与する.そして,WAGOおよびCSR-1はともにRNA依存性RNAポリメラーゼを介してトランス遺伝子の活性化および不活性化にかかわる小分子RNAのシグナルの増幅を達成する.以上から,ZNFX-1の機能はWAGO経路およびCSR-1経路に共通するRNA依存性RNAポリメラーゼの機能にかかわると考えた.そこで,ZNFX-1とRNA依存性RNAポリメラーゼとの相互作用について共沈実験により検討した.さらに,分裂酵母のZNFX-1ホモログであるHrr1は,分裂酵母のRNA依存性RNAポリメラーゼであるRdp1およびArgonauteであるAgo1とも複合体を形成することから,ZNFX-1とArgonauteとの相互作用についても検討した.その結果,ZNFX-1はRNA依存性RNAポリメラーゼのひとつEGO-1と特異的に共沈しただけでなく,WAGOの一種であるWAGO-1,そして,CSR-1さらにはPRG-1とも特異的に共沈することがわかった.これらの相互作用は1本鎖RNAに特異的なRNaseに対し少なくとも部分的に耐性を示したことから,ヌアージュにおいてZNFX-1はRNA依存性RNAポリメラーゼとともにWAGO-1,CSR-1,PRG-1の3種類のArgonauteと直接的に複合体を形成することが示唆された.このため,znfx-1変異体においてはWAGO経路およびCSR-1経路の両方に異常が生じると考えられた.
6.ZNFX-1は標的となるmRNAに対する小分子RNAのシグナルがmRNAの5’側に偏在することを抑制する
分子レベルにおけるznfx-1変異体の異常とはなんなのだろうか? このZNFX-1の機能にかかわる根本的な疑問に答えるため,小分子RNAのクローニング実験を実施し,野生株および変異株における小分子RNAのプロファイルを比較した.znfx-1変異体の比較的マイルドな表現型から予想されたとおり,miRNA,piRNA,22G-RNAなど小分子RNAの種別ごとのリード数や割合については野生株とznfx-1変異株とのあいだで大きな差は認められなかった.ところが,WAGO経路の標的遺伝子をターゲットにする22G-RNAについては,標的遺伝子ごとの22G-RNAのリード数が野生株とznfx-1変異株とのあいだで大きな差があった.すなわち,ある遺伝子ではそれを標的とする22G-RNAがznfx-1変異株において野生株よりも増加しており,また,ある遺伝子では減少していた.この差は,線虫の粗抽出液からすべての小分子RNAをクローニングした場合も,免疫沈降ののちWAGO-9と結合した小分子RNAをクローニングした場合も,同じように認められた.
このような差はどこから生じたのだろうか? ZNFX-1はRNA依存性RNAポリメラーゼと結合することから,znfx-1変異体においては標的となるmRNAのうえに形成される22G-RNAの分布になんらかの異常が生じているのではないかと考えた.そこで,比較を容易にするため,mRNAの全長を100としてmRNAを100分割し,それぞれの位置における22G-RNAの量を,その遺伝子全体を標的とする22G-RNAのリード数により標準化したのちmRNAのうえにプロットしたところ,WAGO経路の標的となるmRNAの場合も,CSR-1経路の標的となるmRNAの場合も,野生株において22G-RNAはmRNAの全長にわたり均一に分布していたのに対し,znfx-1変異株の場合はその分布が5’側に大きく偏在していることが明らかにされた.この結果から,野生型のZNFX-1の機能は,標的となるmRNAのうえにおいて形成される22G-RNAの分布がmRNAの5’側に偏在することを抑制することであると考えられた.RNA依存性RNAポリメラーゼはmRNAを鋳型としてアンチセンスとなる22G-RNAをmRNAにおいて3’-5’方向に転写するので,22G-RNAの分布はしだいに標的となるmRNAの5’側に偏在するようになる.ZNFX-1は標的となるmRNAのうえをRNA依存性RNAポリメラーゼとともに5’側から3’側へと移動することにより,このRNA依存性RNAポリメラーゼの5’側への偏在をさまたげ,標的となるmRNAの全長にわたり22G-RNAのシグナルを均等に増幅させると考えられた(図2).また,znfx-1変異体における22G-RNAの5’側への偏在は,トランス遺伝子のmRNAのうえにて拮抗するWAGO経路とCSR-1経路のバランスをくずし,その結果,トランス遺伝子の発現状態を不安定化すると思われた.
おわりに
この研究においては,遺伝学的な解析,生化学的な解析,そして,小分子RNAのクローニングにより,ZNFX-1はそのヘリカーゼ活性により22G-RNAの産生に必要なRNA依存性RNAポリメラーゼを標的となるmRNAのうえに均一に分布させることが示唆された.ZNFX-1のヘリカーゼドメインと似た構造をもつ分裂酵母のHrr1がRNA依存性RNAポリメラーゼおよびArgonauteの補因子として同定されたことからは,このタイプのヘリカーゼドメインとRNA依存性RNAポリメラーゼとの関係が進化において保存されていることが示される.ここで興味深いことは,ZNFX-1は哺乳類などRNA依存性RNAポリメラーゼをもたない生物にも保存されていることである.マウスのZNFX-1ホモログはPIWIとときを同じくしてパキテン期の精母細胞に発現する.哺乳類においてもZNFX-1ホモログは生殖細胞におけるエピジェネティックな遺伝子発現の制御にかかわるのだろうか? そして,RNA依存性RNAポリメラーゼに依存しない,保存されたZNFX-1の機能とはなんなのだろうか? それと関連し,保存されたジンクフィンガードメインはいかにZNFX-1の機能に貢献するのか? こうした疑問に対する答えを明らかにすることが今後の課題である.
文 献
- Ashe, A., Sapetschnig, A., Weick, E. M. et al.: piRNA can trigger a multigenerational epigenetic memory in the germline of C. elegans. Cell, 150, 88-99 (2012)[PubMed]
- Buckley, B. A., Burkhart, K. B., Gu, S. G. et al.: A nuclear Argonaute promotes multigenerational epigenetic inheritance and germline immortality. Nature, 489, 447-451 (2012)[PubMed]
- Lee, H. C., Gu, W., Shirayama, M. et al.: C. elegans piRNAs mediate the genome-wide surveillance of germline transcripts. Cell, 150, 78-87 (2012)[PubMed]
- Shirayama, M., Seth, M., Lee, H. C. et al.: piRNAs initiate an epigenetic memory of nonself RNA in the C. elegans germline. Cell 150, 65-77 (2012)[PubMed] [新着論文レビュー]
- Conine, C. C., Moresco, J. J., Gu, W. et al.: Argonautes promotes male fertility and provide a paternal memory of germline gene expression in C. elegans. Cell 155, 1532-1544 (2013)[PubMed]
- Seth, M., Shirayama, M., Gu, W. et al.: The C. elegans CSR-1 Argonaute pathway counteracts epigenetic silencing to promote germline gene expression. Dev. Cell, 27, 656-663 (2013)[PubMed] [新着論文レビュー]
- Wedeles, C. J., Wu, M. Z. & Claycomb, J. M.: Protection of germline gene expression by the C. elegans Argonaute CSR-1. Dev. Cell, 27, 664-671 (2013)[PubMed]
- Motamedi, M. R., Verdel, A., Colmenares, S. U. et al.: Two RNAi complexes, RITS and RDRC, physically interact and localize to noncoding centromeric RNAs. Cell, 119, 789-802 (2004)[PubMed]
- Wan, G., Fields, B. D., Spracklin, G. et al.: Spatiotemporal regulation of liquid-like condensates in epigenetic inheritance. Nature, 557, 679-683 (2018)[PubMed]
- Seth, M., Shirayama, M., Tang, W. et al.: The coding regions of germline mRNAs confer sensitivity to Argonaute regulation in C. elegans. Cell Rep, 22, 2254-2264 (2018)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:1997年 大阪大学大学院医学系研究科博士課程 修了,同年 東京大学分子細胞生物学研究所 助手を経て,2002年より米国Massachusetts大学Medical School研究員.
研究テーマ:小分子RNAによるエピジェネティックな遺伝子発現の制御機構.
関心事:線虫の遺伝学を用いた新たな遺伝子サイレンシング機構の探求.
© 2018 石館 宇夫 Licensed under CC 表示 2.1 日本