核内輸送受容体はRNA結合タンパク質FUSの液-液相分離を抑制する
吉澤 拓也
(米国Texas大学Southwestern Medical Center,Department of Pharmacology)
email:吉澤拓也
DOI: 10.7875/first.author.2018.055
Nuclear import receptor inhibits phase separation of FUS through binding to multiple sites.
Takuya Yoshizawa, Rustam Ali, Jenny Jiou, Ho Yee Joyce Fung, Kathleen A. Burke, Seung Joong Kim, Yuan Lin, William B. Peeples, Daniel Saltzberg, Michael Soniat, Jordan M. Baumhardt, Rudolf Oldenbourg, Andrej Sali, Nicolas L. Fawzi, Michael K. Rosen, Yuh Min Chook
Cell, 173, 693-705.e22 (2018)
液-液相分離は特定の生体高分子が膜のない集合体を形成するものであるが,その形成の過程および消失については不明な点が多く残されている.RNA結合タンパク質であるFUSは,やわらかな凝集ともいえる液-液相分離をひき起こすタンパク質として,近年,さかんに研究が進められている.この研究において,筆者らは,FUSの液-液相分離が核内輸送受容体であるKapβ2により抑制されることを明らかにした.Kapβ2のこの機能は,FUSのもつKapβ2に特異的な核移行シグナル配列との結合に依存するものであった.NMR法による相互作用の解析の結果,FUSはこの核移行シグナル配列のほか幅広い領域においてKapβ2と弱く相互作用することが明らかにされ,それらの領域は液-液相分離の形成を促進する領域と一致した.以上の結果から,Kapβ2はFUSのもつKapβ2に特異的な核移行シグナル配列と強固に結合しながら,FUSのさまざまな領域と弱く相互作用することにより液-液相分離を抑制することが明らかにされた.
FUSは,転写,RNAプロセシング,DNA修復などに関与するRNA結合タンパク質である.FUSはさまざまな疾患にかかわることが知られており,とくに,重篤な神経変性疾患である筋萎縮性側索硬化症の家族性の患者において,核移行シグナル配列に多くの変異がみつかったことが注目をあつめた1).この核移行シグナル配列は核内輸送受容体Kapβ2により認識され,FUSの核への移行をつかさどる.Kapβ2による核への輸送により,FUSはおもに核に局在するが,その一方で,細胞質の膜をもたない構造体であるRNA顆粒の構成タンパク質になることも知られている.RNA顆粒におけるFUSの役割については謎が残されているが,RNA顆粒を形成するような凝集性のあるタンパク質が細胞質に過剰に蓄積することは害であり,適切に制御されることが重要であると考えられている.
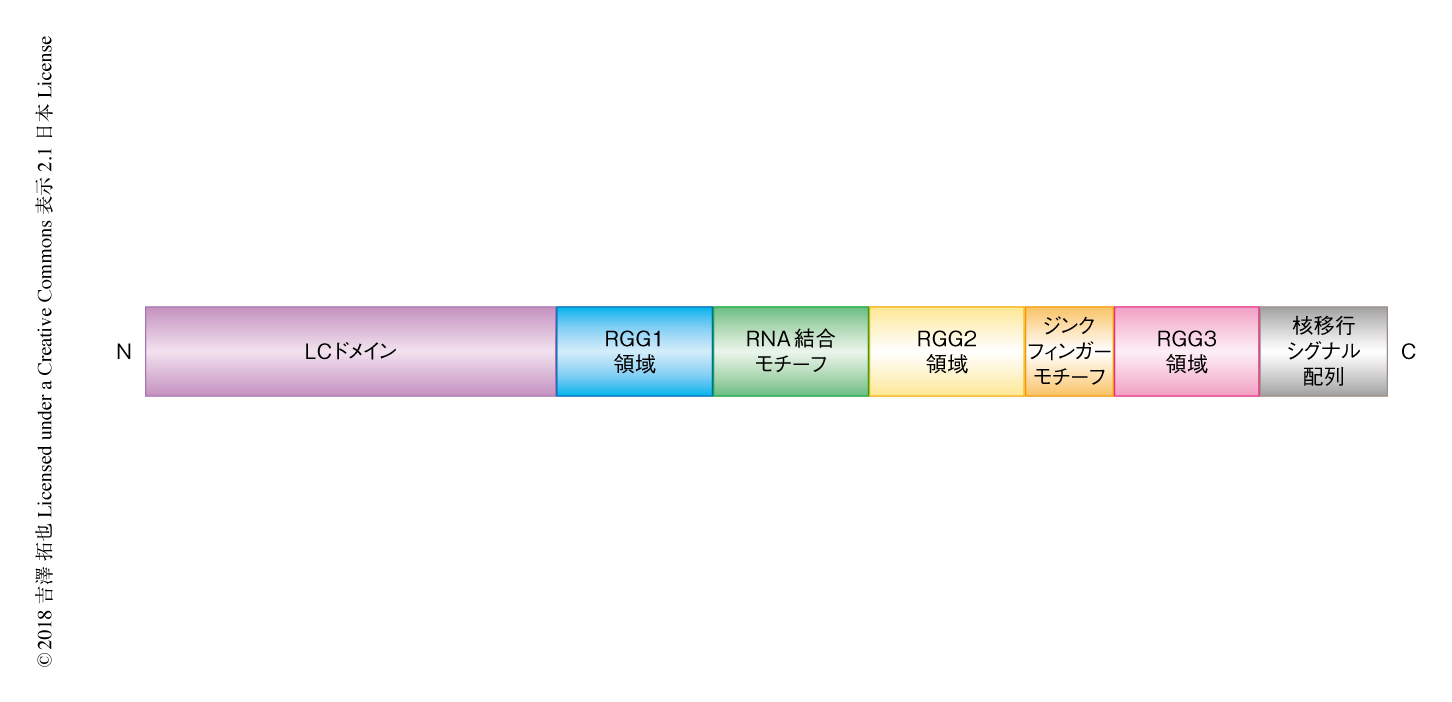
FUSは526残基からなるマルチドメインタンパク質である.N末端側にはGlu,Gly,Ser,Tyrに富むLCドメインがある.LCドメインは単独でも液-液相分離をひき起こすこと,アミロイド様のポリマーによるヒドロゲルを形成することが報告されている2,3)(文献2) は 新着論文レビュー でも掲載,文献3) は 新着論文レビュー でも掲載).LCドメインのほかにも,特定のアミノ酸残基に富む領域としてArg-Gly-Gly配列がくり返し現われるRGG領域が3つ存在する(RGG1領域~RGG3領域).それぞれのRGG領域のあいだにはRNA結合モチーフおよびジンクフィンガーモチーフが存在する.RGG領域を含むFUSのほうがより低濃度で液-液相分離を形成することから,LCドメイン以外の領域も液-液相分離に寄与すると考えられている.C末端側の26残基がKapβ2により特異的に認識される核移行シグナル配列である4)(図1).筋萎縮性側索硬化症の原因となる変異はこの核移行シグナル配列において多く報告されているが,液-液相分離との直接的なかかわりはないと考えられている.これまで,FUSの液-液相分離におけるKapβ2の影響については明らかにされていなかった.この研究において,筆者らは,FUSの液-液相分離におけるKapβ2の役割に着目した.あわせて,さまざまな手法によりKapβ2とFUSとの相互作用について解析した.
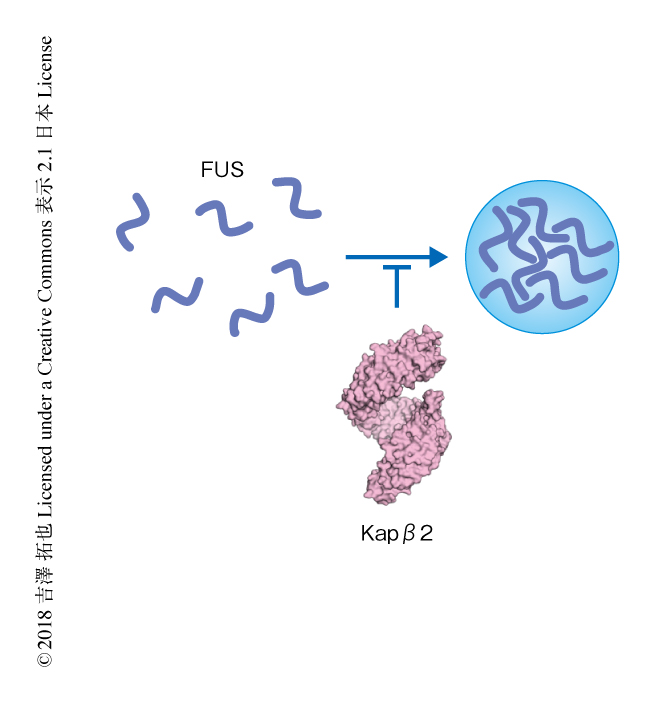
FUSは,N末端に可溶性のタグタンパク質であるMBPを付加した融合タンパク質として大腸菌により発現させ,精製したものを用いた.MBPとFUSとのあいだにはTEVプロテアーゼにより切断される配列を挿入した.TEVプロテアーゼによりFUSからMBPを切り離すと,透明であった溶液はたちまち白濁した.その溶液を共焦点顕微鏡により観察すると,液-液相分離によるFUSの粒滴が形成されていた.一方,TEVプロテアーゼをくわえるまえに等量のKapβ2をくわえておくと,TEVプロテアーゼにより処理してもFUSの液-液相分離は起こらず,Kapβ2によりFUSの液-液相分離は阻害された(図2).ゲルろ過カラムにより解析したところ,Kapβ2とFUSは1対1の複合体を形成し安定であった.Kapβ2による液-液相分離の抑制はFUSの粒滴が形成されたあとでも効果を示した.いったん液-液相分離が起こったあとでも,Kapβ2の添加により液-液相分離は消失した.
Kapβ2の存在下であっても,RanあるいはM9Mペプチドインヒビターをくわえると溶液は白濁した.すなわち,Kapβ2による液-液相分離の抑制はM9MペプチドインヒビターあるいはRanにより阻害された.M9MペプチドインヒビターおよびRanはどちらもKapβ2と結合した核移行シグナル配列を解離させる機能をもつ.したがって,Kapβ2による液-液相分離の抑制には核移行シグナル配列との結合が重要であることが明らかにされた.
Kapβ2によるFUSの液-液相分離の抑制については,同様の結果が,ほか3つの研究グループから同じ号のCell誌に発表された5-7).なかでも,ひとつの研究グループは,Kapβ2はFUSのみならず,TAF15やEWSR1といったこの特異的な核移行シグナル配列をもつほかの凝集性タンパク質についても同様の役割をはたすことを示した5).
Kapβ2は核輸送受容体Karyopherinβファミリーの一員である.ヒトにおいては,主要な核への輸送を担うImportinα-Importinβ複合体をはじめ,約20種類のファミリータンパク質が存在する.液-液相分離の抑制がKapβ2に特有の機能であるのか,ほかのKaryopherinβファミリーにはないのか解析した.その結果,Importinα-Importinβ複合体は野生型のFUSの液-液相分離に対する抑制能をもたなかったが,出芽酵母に由来するKap121はFUSの液-液相分離を部分的に抑制した.液-液相分離の抑制には核移行シグナル配列との相互作用が重要であるため,FUSの核移行シグナル配列をほかの核移行シグナル配列と置き換えたキメラタンパク質を作製し解析した.FUSの核移行シグナル配列をImportinα-Importinβ複合体により認識される古典的な核移行シグナル配列と置き換えたところ,Importinα-Importinβ複合体によりFUSの液-液相分離は抑制された.同様に,FUSの核移行シグナル配列をKap121により認識される核移行シグナルと置き換えると,Kap121によりFUSの液-液相分離は強く抑制された.いずれの液-液相分離もRanにより阻害されたことから,それぞれの核移行シグナル配列との相互作用に強く依存するものであることが明らかにされた.一方で,核外輸送受容体であるCrm1について,FUSの核移行シグナル配列をCrm1により認識される核外移行シグナル配列と置き換えても,Crm1によりFUSの液-液相分離は抑制されなかった.これらのKaryopherinβファミリーは同様にαヘリックスが積み重なったHEATリピート構造をとる.液-液相分離の抑制は核内輸送受容体に特有のものであることが示唆された.
MBP-FUS融合タンパク質およびFUS-Kapβ2複合体をX線小角散乱法により解析した結果,FUSはKapβ2との結合にともない構造がよりコンパクトになることが示された.Kapβ2は核移行シグナル配列以外の領域とどのように相互作用するのかを明らかにするため,X線結晶構造解析を試みた.FUS-Kapβ2複合体の結晶化および構造解析の結果,Kapβ2については全長にわたりモデルが構築されたものの,FUSにおいてモデルが構築されたのは核移行シグナル配列の領域のみであった.つまり,FUSの核移行シグナル配列以外の領域は結晶において特定の構造をもたないことが示唆された.Kapβ2とFUSの核移行シグナル配列以外の領域との相互作用は弱く多岐にわたるものであると推察し,NMR法により相互作用を解析した.過去にN末端側の領域が決定されていたが8).その領域に対し,Kapβ2をくわえていくとTyrを含む3つの領域においてシグナルの減衰がみられた.そのうちのひとつの配列は,近年,LCドメインによるフィラメント構造のコアになる領域であることが明らかにされている3,9).LCドメイン以外の領域についても,NMR法による相互作用を解析した結果,RGG1領域を除くすべての領域との弱い相互作用が検出された.
NMR法により決定された相互作用領域がFUSの液-液相分離におよぼす影響について調べた.FUSの液-液相分離には温度依存性があることから,溶液が白濁しはじめる温度を解析した.野生型のFUSと比べ,核移行シグナル配列のみを欠失させたFUSは白濁しはじめる温度はほとんど変わらなかったが,RGG3領域,あるいは,RGG2領域およびRGG3領域を欠失させたFUSは溶液が白濁しはじめる温度がいちじるしく低下した.LCドメインの5つのTyrをAlaに変異させたFUS,および,RGG2領域およびRGG3領域のすべてのArgをLysに変異させたFUSにおいても,溶液が白濁しはじめる温度が低下した.RGG領域のArgはメチル化をうけることが報告されている.同時に発表されたほかの2つの研究グループの論文は,Argのメチル化により液-液相分離は抑制される結果を示している6,7).また,LCドメインのTyrとRGG領域のArgの相互作用により液-液相分離が促進されることも報告している7).以上のことから,FUSの液-液相分離を促進する領域は,Kapβ2と相互作用する領域とオーバーラップすることが明らかにされた.
これまで,核内輸送受容体については核内タンパク質を核へと輸送する役割のみが知られていた.しかし,この研究において,核内輸送受容体は単なる輸送タンパク質にとどまらず,凝集性のある核内タンパク質とダイナミックに相互作用する分子シャペロンであることが示された.やわらかな凝集である液-液相分離とその制御は,近年,もっともホットなトピックのひとつである.この研究により新たな知見を得られたことをうれしく思う.
略歴:横浜市立大学大学院生命ナノシステム科学研究科にて博士号取得,米国Texas大学Southwestern Medical Center研究員を経て,立命館大学生命科学部 助教.
研究テーマ:核輸送受容体の機能および構造.
© 2018 吉澤 拓也 Licensed under CC 表示 2.1 日本
(米国Texas大学Southwestern Medical Center,Department of Pharmacology)
email:吉澤拓也
DOI: 10.7875/first.author.2018.055
Nuclear import receptor inhibits phase separation of FUS through binding to multiple sites.
Takuya Yoshizawa, Rustam Ali, Jenny Jiou, Ho Yee Joyce Fung, Kathleen A. Burke, Seung Joong Kim, Yuan Lin, William B. Peeples, Daniel Saltzberg, Michael Soniat, Jordan M. Baumhardt, Rudolf Oldenbourg, Andrej Sali, Nicolas L. Fawzi, Michael K. Rosen, Yuh Min Chook
Cell, 173, 693-705.e22 (2018)
この論文に出現する遺伝子・タンパク質のUniprot ID
核内輸送受容体, FUS(P35637), Kapβ2(Q92973), 核内輸送受容体Kapβ2(Q92973), TEVプロテアーゼ, Ran(P62826), TAF15(Q92804), EWSR1(Q01844), Karyopherinβ, Importinα, Importinβ, Kap121(P32337), Crm1(O14980)
要 約
液-液相分離は特定の生体高分子が膜のない集合体を形成するものであるが,その形成の過程および消失については不明な点が多く残されている.RNA結合タンパク質であるFUSは,やわらかな凝集ともいえる液-液相分離をひき起こすタンパク質として,近年,さかんに研究が進められている.この研究において,筆者らは,FUSの液-液相分離が核内輸送受容体であるKapβ2により抑制されることを明らかにした.Kapβ2のこの機能は,FUSのもつKapβ2に特異的な核移行シグナル配列との結合に依存するものであった.NMR法による相互作用の解析の結果,FUSはこの核移行シグナル配列のほか幅広い領域においてKapβ2と弱く相互作用することが明らかにされ,それらの領域は液-液相分離の形成を促進する領域と一致した.以上の結果から,Kapβ2はFUSのもつKapβ2に特異的な核移行シグナル配列と強固に結合しながら,FUSのさまざまな領域と弱く相互作用することにより液-液相分離を抑制することが明らかにされた.
はじめに
FUSは,転写,RNAプロセシング,DNA修復などに関与するRNA結合タンパク質である.FUSはさまざまな疾患にかかわることが知られており,とくに,重篤な神経変性疾患である筋萎縮性側索硬化症の家族性の患者において,核移行シグナル配列に多くの変異がみつかったことが注目をあつめた1).この核移行シグナル配列は核内輸送受容体Kapβ2により認識され,FUSの核への移行をつかさどる.Kapβ2による核への輸送により,FUSはおもに核に局在するが,その一方で,細胞質の膜をもたない構造体であるRNA顆粒の構成タンパク質になることも知られている.RNA顆粒におけるFUSの役割については謎が残されているが,RNA顆粒を形成するような凝集性のあるタンパク質が細胞質に過剰に蓄積することは害であり,適切に制御されることが重要であると考えられている.
FUSは526残基からなるマルチドメインタンパク質である.N末端側にはGlu,Gly,Ser,Tyrに富むLCドメインがある.LCドメインは単独でも液-液相分離をひき起こすこと,アミロイド様のポリマーによるヒドロゲルを形成することが報告されている2,3)(文献2) は 新着論文レビュー でも掲載,文献3) は 新着論文レビュー でも掲載).LCドメインのほかにも,特定のアミノ酸残基に富む領域としてArg-Gly-Gly配列がくり返し現われるRGG領域が3つ存在する(RGG1領域~RGG3領域).それぞれのRGG領域のあいだにはRNA結合モチーフおよびジンクフィンガーモチーフが存在する.RGG領域を含むFUSのほうがより低濃度で液-液相分離を形成することから,LCドメイン以外の領域も液-液相分離に寄与すると考えられている.C末端側の26残基がKapβ2により特異的に認識される核移行シグナル配列である4)(図1).筋萎縮性側索硬化症の原因となる変異はこの核移行シグナル配列において多く報告されているが,液-液相分離との直接的なかかわりはないと考えられている.これまで,FUSの液-液相分離におけるKapβ2の影響については明らかにされていなかった.この研究において,筆者らは,FUSの液-液相分離におけるKapβ2の役割に着目した.あわせて,さまざまな手法によりKapβ2とFUSとの相互作用について解析した.
1.核内輸送受容体Kapβ2によるFUSの液-液相分離の抑制
FUSは,N末端に可溶性のタグタンパク質であるMBPを付加した融合タンパク質として大腸菌により発現させ,精製したものを用いた.MBPとFUSとのあいだにはTEVプロテアーゼにより切断される配列を挿入した.TEVプロテアーゼによりFUSからMBPを切り離すと,透明であった溶液はたちまち白濁した.その溶液を共焦点顕微鏡により観察すると,液-液相分離によるFUSの粒滴が形成されていた.一方,TEVプロテアーゼをくわえるまえに等量のKapβ2をくわえておくと,TEVプロテアーゼにより処理してもFUSの液-液相分離は起こらず,Kapβ2によりFUSの液-液相分離は阻害された(図2).ゲルろ過カラムにより解析したところ,Kapβ2とFUSは1対1の複合体を形成し安定であった.Kapβ2による液-液相分離の抑制はFUSの粒滴が形成されたあとでも効果を示した.いったん液-液相分離が起こったあとでも,Kapβ2の添加により液-液相分離は消失した.
Kapβ2の存在下であっても,RanあるいはM9Mペプチドインヒビターをくわえると溶液は白濁した.すなわち,Kapβ2による液-液相分離の抑制はM9MペプチドインヒビターあるいはRanにより阻害された.M9MペプチドインヒビターおよびRanはどちらもKapβ2と結合した核移行シグナル配列を解離させる機能をもつ.したがって,Kapβ2による液-液相分離の抑制には核移行シグナル配列との結合が重要であることが明らかにされた.
Kapβ2によるFUSの液-液相分離の抑制については,同様の結果が,ほか3つの研究グループから同じ号のCell誌に発表された5-7).なかでも,ひとつの研究グループは,Kapβ2はFUSのみならず,TAF15やEWSR1といったこの特異的な核移行シグナル配列をもつほかの凝集性タンパク質についても同様の役割をはたすことを示した5).
2.FUSの液-液相分離の抑制は核内輸送受容体に共通する機能である
Kapβ2は核輸送受容体Karyopherinβファミリーの一員である.ヒトにおいては,主要な核への輸送を担うImportinα-Importinβ複合体をはじめ,約20種類のファミリータンパク質が存在する.液-液相分離の抑制がKapβ2に特有の機能であるのか,ほかのKaryopherinβファミリーにはないのか解析した.その結果,Importinα-Importinβ複合体は野生型のFUSの液-液相分離に対する抑制能をもたなかったが,出芽酵母に由来するKap121はFUSの液-液相分離を部分的に抑制した.液-液相分離の抑制には核移行シグナル配列との相互作用が重要であるため,FUSの核移行シグナル配列をほかの核移行シグナル配列と置き換えたキメラタンパク質を作製し解析した.FUSの核移行シグナル配列をImportinα-Importinβ複合体により認識される古典的な核移行シグナル配列と置き換えたところ,Importinα-Importinβ複合体によりFUSの液-液相分離は抑制された.同様に,FUSの核移行シグナル配列をKap121により認識される核移行シグナルと置き換えると,Kap121によりFUSの液-液相分離は強く抑制された.いずれの液-液相分離もRanにより阻害されたことから,それぞれの核移行シグナル配列との相互作用に強く依存するものであることが明らかにされた.一方で,核外輸送受容体であるCrm1について,FUSの核移行シグナル配列をCrm1により認識される核外移行シグナル配列と置き換えても,Crm1によりFUSの液-液相分離は抑制されなかった.これらのKaryopherinβファミリーは同様にαヘリックスが積み重なったHEATリピート構造をとる.液-液相分離の抑制は核内輸送受容体に特有のものであることが示唆された.
3.Kapβ2はFUSのさまざまな領域と相互作用する
MBP-FUS融合タンパク質およびFUS-Kapβ2複合体をX線小角散乱法により解析した結果,FUSはKapβ2との結合にともない構造がよりコンパクトになることが示された.Kapβ2は核移行シグナル配列以外の領域とどのように相互作用するのかを明らかにするため,X線結晶構造解析を試みた.FUS-Kapβ2複合体の結晶化および構造解析の結果,Kapβ2については全長にわたりモデルが構築されたものの,FUSにおいてモデルが構築されたのは核移行シグナル配列の領域のみであった.つまり,FUSの核移行シグナル配列以外の領域は結晶において特定の構造をもたないことが示唆された.Kapβ2とFUSの核移行シグナル配列以外の領域との相互作用は弱く多岐にわたるものであると推察し,NMR法により相互作用を解析した.過去にN末端側の領域が決定されていたが8).その領域に対し,Kapβ2をくわえていくとTyrを含む3つの領域においてシグナルの減衰がみられた.そのうちのひとつの配列は,近年,LCドメインによるフィラメント構造のコアになる領域であることが明らかにされている3,9).LCドメイン以外の領域についても,NMR法による相互作用を解析した結果,RGG1領域を除くすべての領域との弱い相互作用が検出された.
4.FUSの液-液相分離は特定のアミノ酸残基に富む領域により促進される
NMR法により決定された相互作用領域がFUSの液-液相分離におよぼす影響について調べた.FUSの液-液相分離には温度依存性があることから,溶液が白濁しはじめる温度を解析した.野生型のFUSと比べ,核移行シグナル配列のみを欠失させたFUSは白濁しはじめる温度はほとんど変わらなかったが,RGG3領域,あるいは,RGG2領域およびRGG3領域を欠失させたFUSは溶液が白濁しはじめる温度がいちじるしく低下した.LCドメインの5つのTyrをAlaに変異させたFUS,および,RGG2領域およびRGG3領域のすべてのArgをLysに変異させたFUSにおいても,溶液が白濁しはじめる温度が低下した.RGG領域のArgはメチル化をうけることが報告されている.同時に発表されたほかの2つの研究グループの論文は,Argのメチル化により液-液相分離は抑制される結果を示している6,7).また,LCドメインのTyrとRGG領域のArgの相互作用により液-液相分離が促進されることも報告している7).以上のことから,FUSの液-液相分離を促進する領域は,Kapβ2と相互作用する領域とオーバーラップすることが明らかにされた.
おわりに
これまで,核内輸送受容体については核内タンパク質を核へと輸送する役割のみが知られていた.しかし,この研究において,核内輸送受容体は単なる輸送タンパク質にとどまらず,凝集性のある核内タンパク質とダイナミックに相互作用する分子シャペロンであることが示された.やわらかな凝集である液-液相分離とその制御は,近年,もっともホットなトピックのひとつである.この研究により新たな知見を得られたことをうれしく思う.
文 献
- Vance, C., Rogelj, B., Hortobagyi, T. et al.: Mutations in FUS, an RNA processing protein, cause familial amyotrophic lateral sclerosis type 6. Science, 323, 1208-1211 (2009)[PubMed]
- Kato, M., Han, T. W., Xie, S. et al.: Cell-free formation of RNA granules: low complexity sequence domains form dynamic fibers within hydrogels. Cell, 149, 753-767 (2012)[PubMed] [新着論文レビュー]
- Murray, D. T., Kato, M., Lin, Y. et al.: Structure of FUS protein fibrils and its relevance to self-assembly and phase separation of low-complexity domains. Cell, 171, 615-627 (2017)[PubMed] [新着論文レビュー]
- Zhang, Z. C. & Chook, Y. M.: Structural and energetic basis of ALS-causing mutations in the atypical proline-tyrosine nuclear localization signal of the Fused in Sarcoma protein (FUS). Proc. Natl. Acad. Sci. USA, 109, 12017-12021 (2012)[PubMed]
- Guo, L., Kim, H. J., Wang, H. et al.: Nuclear-import receptors reverse aberrant phase transitions of RNA-binding proteins with prion-like domains. Cell, 173, 677-692 (2018)[PubMed]
- Hofweber, M., Hutten, S., Bourgeois, B. et al.: Phase separation of FUS is suppressed by its nuclear import receptor and arginine methylation. Cell, 173, 706-719 (2018)[PubMed]
- Qamar, S., Wang, G., Randle, S. J. et al.: FUS phase separation is modulated by a molecular chaperone and methylation of arginine cation-π interactions. Cell, 173, 720-734 (2018)[PubMed]
- Bruke, K. A., Janke, A. M., Rhine, C. L. et al.: Residue-by-residue view of in vitro FUS granules that bind the C-terminal domain of RNA polymerase II. Mol. Cell, 60, 231-241 (2015)[PubMed]
- Luo, F., Gui, X., Zhou, H. et al.: Atomic structures of FUS LC domain segments reveal bases for reversible amyloid fibril formation. Nat. Struct. Mol. Biol., 25, 341-346 (2018)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:横浜市立大学大学院生命ナノシステム科学研究科にて博士号取得,米国Texas大学Southwestern Medical Center研究員を経て,立命館大学生命科学部 助教.
研究テーマ:核輸送受容体の機能および構造.
© 2018 吉澤 拓也 Licensed under CC 表示 2.1 日本