アンチセンスオリゴヌクレオチドの全身への投与によるDuchenne型筋ジストロフィーの患者のエキソンスキップによる治療
永田哲也・武田伸一
(国立精神・神経医療研究センター神経研究所 遺伝子疾患治療研究部)
email:永田哲也
DOI: 10.7875/first.author.2018.052
Systemic administration of the antisense oligonucleotide NS-065/NCNP-01 for skipping of exon 53 in patients with Duchenne muscular dystrophy.
Hirofumi Komaki, Tetsuya Nagata, Takashi Saito, Satoru Masuda, Eri Takeshita, Masayuki Sasaki, Hisateru Tachimori, Harumasa Nakamura, Yoshitsugu Aoki, Shin’ichi Takeda
Science Translational Medicine, 10, eaan0713 (2018)
Duchenne型筋ジストロフィーは最終的に死にいたる重篤な遺伝性の筋疾患である.ジストロフィンタンパク質は筋細胞の機能に必要不可欠な構造タンパク質であり,その欠損は筋線維の変性および壊死をひき起こす.Duchenne型筋ジストロフィーにおけるジストロフィンタンパク質の欠損は,ジストロフィンをコードする遺伝子の変異に起因する.この研究において,筆者らは,ジストロフィン遺伝子のエキソン53をスキップさせることによりジストロフィンタンパク質の発現および機能を回復させるアンチセンスオリゴヌクレオチドNS-065/NCNP-01を開発した.Duchenne型筋ジストロフィーの患者10人を対象に実施した第1相試験の結果,すぐれた安全性プロファイルおよび薬物動態が確認され,さらに,ジストロフィンmRNAにおけるエキソン53のスキップおよびジストロフィンタンパク質の発現および機能の回復が確認された.
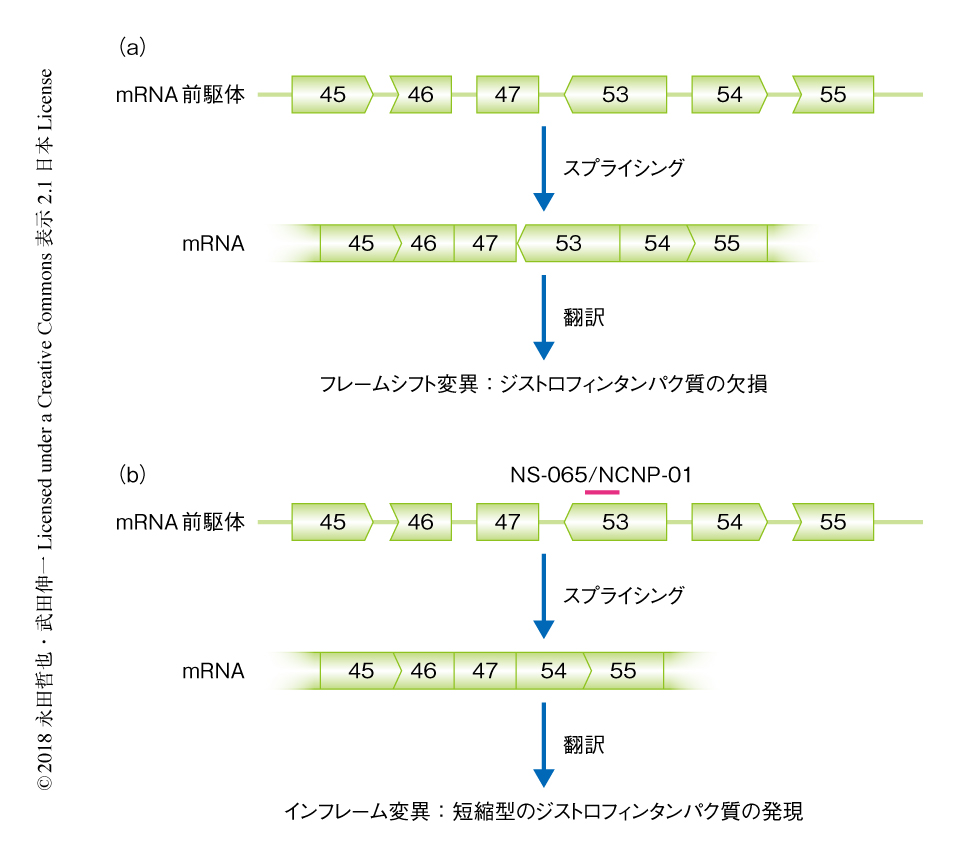
Duchenne型筋ジストロフィーはジストロフィン遺伝子の異常によりジストロフィンタンパク質が欠損する遺伝性の筋疾患で,わが国における指定難病のひとつである.男児にのみ発症し,米国および英国における新生児のスクリーニングでは5000例に1例の割合で発症したことが報告されている1,2).ジストロフィンタンパク質は筋細胞膜の安定化に関与し,その欠損は筋線維の変性および壊死をきたす.そのため,Duchenne型筋ジストロフィーの患者は進行性に筋力の低下が進み成人期に呼吸不全あるいは心不全により死亡する.ジストロフィン遺伝子は79のエキソンから構成されるが,変異の形式はエキソンの欠失が60~70%をしめ,フレームシフト変異においてはジストロフィンタンパク質が欠損するのに対し,インフレーム変異においては構造の一部が欠損するが機能をもつ短縮型のジストロフィンタンパク質が発現する.これは,ジストロフィンタンパク質は中央の領域にくり返し構造をもち,その一部を欠損した短縮型のジストロフィンタンパク質は正常に機能する場合が多いためである.患者の表現型については一般に,フレームシフト変異は重症でインフレーム変異は軽症である.例として,エキソン48~エキソン52が欠失したジストロフィンmRNAではエキソン47とエキソン53とが接続してフレームシフト変異になるが,エキソン53も欠失した場合にはエキソン47とエキソン54とが接続してインフレーム変異になる(図1).そのため,エキソン53を標的とするアンチセンスオリゴヌクレオチドによりスプライシングを阻害してジストロフィンmRNAからエキソン53を取り除き,インフレーム変異のmRNAを産生させることがDuchenne型筋ジストロフィーの治療の戦略になりうる.
これまで,筆者らは,マウスおよびイヌのDuchenne型筋ジストロフィーのモデルにおいてこの手法の概念を実証してきた.具体的には,モルフォリノアンチセンスオリゴヌクレオチドをモデル動物に投与し,標的とするエキソンをスキップさせてフレームシフト変異をもつジストロフィンmRNAをインフレーム変異とすることにより,ジストロフィンタンパク質の発現が回復し骨格筋の障害の進行が抑制された.また,これらのモデル動物において,モルフォリノアンチセンスオリゴヌクレオチドには毒性は認められなかった3,4).これらの研究にもとづき,モデル動物における研究の成果をヒトへと応用すべく,ジストロフィン遺伝子のエキソン53のスキップをひき起こすモルフォリノアンチセンスオリゴヌクレオチドNS-065/NCNP-01を創製し,ヒトにおける最初の試験として,Duchenne型筋ジストロフィーの患者10名に対し第1相試験を実施した.
6歳から16歳の10名のDuchenne型筋ジストロフィーの患者を対象とし,週1回12週間にわたり,ジストロフィン遺伝子のエキソン53のスキップをひき起こすモルフォリノアンチセンスオリゴヌクレオチドNS-065/NCNP-01を投与した.生理食塩水により合計100 mlとなるように希釈し,1時間かけて点滴により静脈に注入することにより全身に投与した.ジストロフィンmRNAおよびジストロフィンタンパク質の発現の評価については,投与の前後に筋生検を実施し,これを比較した.また,被験者の組み入れに際しては,国立精神・神経医療研究センターの運営する神経筋疾患の患者の登録サイトRemudy(URL:http://www.remudy.jp/)が活用された.
投与は低用量から開始し,被験者に安全性の問題が認められないことが確認されたのち,つぎの用量に移行した.最終的に,全体において重篤あるいは投与の中止にいたった有害事象は認められず,全例が12回の投与を終了した.おもな有害事象として腎機能への影響や貧血が認められた.このうち,貧血については,頻回の採血を施行したことが影響した可能性があった.いずれの有害事象も軽度または中等度であり,特段の治療を必要とせず自然に回復した.以上より,この試験において検討した用量および投与期間では,このアンチセンスオリゴヌクレオチドの忍容性が確認された.
薬物動態について,このアンチセンスオリゴヌクレオチドは短い半減期をもち,用量依存性に最高血中濃度および血中濃度曲線下面積が増加した.これらの結果は,これまでに報告されているモルフォリノアンチセンスオリゴヌクレオチドの特性と一致した.また,体重あたりの投与量および体表面積あたりの投与量と血中濃度との相関について探索的に解析したところ,ともに用量依存性が認められたが,体表面積あたりの投与量と血中濃度との相関のほうが強い傾向が認められた.
ジストロフィンmRNAについては,生検した筋組織からRNAを抽出しRT-PCR法により評価した.その結果,エキソンスキップの効率は用量を増量すると有意に増加する傾向が認められ,被験者NS-07においては投与前の0.3%から47.8%へと増加した.ジストロフィンタンパク質については,生検した筋組織の免疫蛍光染色およびウェスタンブロット法により評価した.いずれの測定においても,定量における対照タンパク質としてスペクトリンを用いた5).免疫蛍光染色においては,10例中7例の被験者において投与前のジストロフィンとスペクトリンとの比率が有意に上昇し,被験者NS-07においては投与前の0.8%から17.6%へと増加した.ジストロフィンに陽性を示す筋線維の割合は,被験者NS-07において投与前の0%から6.3%へと上昇した.また,ウェスタンブロット法においては被験者NS-07以外にジストロフィンのバンドは検出されなかったが,ジストロフィンおよびスペクトリンのバンド強度の比率にもとづく定量において,ジストロフィンは正常な対照(100%)に対し投与後には8.1%まで上昇した.
アンチセンスオリゴヌクレオチドNS-065/NCNP-01の開発に際しては,ヒトの横紋筋肉腫細胞および転写因子MyoDにより筋分化を誘導したDuchenne型筋ジストロフィー患者の細胞を用いて塩基配列の探索および最適化が実施されたが,この試験において,はじめてヒトにおける忍容性,薬物動態,有効性について一定の結果が得られた.試験のデザインを検討する過程においては,エキソン51のスキップによる治療薬として開発されてきたdrisapersenおよびeteplirsenに関する報告を参考にした.これらのヒトにおける最初の試験においては,はじめに骨格筋への局所の投与によりジストロフィンの発現を評価していたが6,7),この試験においては,臨床において想定される投与の経路および全身での安全性の評価の必要性を考慮し,静脈への注入による反復投与を選択した.複数の被験者における安全性を評価する必要性,また,単一の施設における試験として参加の可能な被験者の数は最大で10例という制約から,3用量のコホート,公比4で漸増して最大用量を設定した.ただし,eteplirsenにおいて得られた結果より推定して8),この最大用量での12週間にわたる治療ではジストロフィンの発現は10例のうち1例程度しか期待できないと予想した.そのため,主要な評価項目は安全性のみとした.また,運動機能などの評価は困難と考え評価項目から除外し,原則として症状が進行した歩行の不能な患者を組み入れる計画としたが,症例の確保の必要性から最終的に3例の歩行の可能な患者も組み入れた.
安全性に関して,この試験では大きな懸念は認められず,核酸医薬において懸念される炎症性の反応,血液の凝固による障害,肝毒性なども認められなかった.しかしながら,腎機能への影響および貧血についてはこのアンチセンスオリゴヌクレオチドとの因果関係が否定されていないことから,今後の臨床試験においてはさらに検証が必要と考えられた.一方で,薬物動態に関して,このアンチセンスオリゴヌクレオチドの血中濃度は用量依存性かつ線形性を示し,ほとんどが24時間以内に尿から排泄された.なかでも,著明なエキソンスキップの効率およびジストロフィンの発現の認められた被験者NS-07は,すべての被験者のなかでもっとも高い最高血中濃度および血中濃度曲線下面積を呈しており,血中濃度およびエキソンスキップの効率において用量依存性が認められたこともふまえると,被験者NS-07において著明な効果が認められたことは血中濃度により説明可能と考えられた.
なお,ジストロフィンmRNAの定量により被験者NS-07において47.5%というエキソンスキップの効率が認められたが,通常のRT-PCR法ではエキソンがスキップされたmRNAからのPCR産物が過剰に増幅される現象も報告されているため9),その解釈には注意が必要である.また,ジストロフィンタンパク質の定量に関しては予備的な検討により一定の定量性が確認されたが,この試験においてはC末端側の領域と結合する1種類の抗ジストロフィン抗体しか用いておらず,正常な対照は1種類のみであることなど,完全なバリデーションは実施されておらず,今後の課題である.
この試験において明瞭なジストロフィンの発現が認められたのは1例のみであったが,同時に認められた忍容性および効果の用量依存性をふまえると,次相の試験においてより高用量あるいは長期間の投与により治療の効果が見い出される可能性が考えられた.
エキソンスキップによるDuchenne型筋ジストロフィーの治療薬としては,米国において2016年にeteplirsenが承認されている.しかしながら,eteplirsenによる臨床的な改善そのものは確認されておらず,ジストロフィンの発現量を代替エンドポイントとした迅速承認制度のもとでの承認であり,その値は正常な対照(100%)に対し治療前の0.16%から治療後に0.44%まで増加したというものあった.どの程度のジストロフィンの発現により患者において臨床的な改善を期待できるかについてはいまだコンセンサスは得られていないが,米国食品医薬品局は10%程度の発現が必要であろうと考察している.代替エンドポイントにより承認されたeteplirsenの有効性については今後の検証が待たれている.アンチセンスオリゴヌクレオチドNS-065/NCNP-01についても,ジストロフィンの発現のみではなく,最終的には臨床的な有効性がもとめられることは同様であり,その点は今後の臨床試験において検証される.ジストロフィンの発現量にもとづいてアンチセンスオリゴヌクレオチドNS-065/NCNP-01の至適な用法および用量を探索する第II相試験は2016年からわが国および米国で開始されており,その結果が期待される.
略歴:1999年 東北大学大学院医学研究科 修了,2003年 岡山大学医学部 助手,2005年 米国Columbia大学 研究員,2008年 岡山大学医学部 助教,2009年 国立精神・神経センター神経研究所 室長,2014年 東京医科歯科大学大学院医歯学総合研究科 特任講師を経て,2018年より同 プロジェクト准教授.
研究テーマ:核酸医薬の開発.神経変性疾患,筋変性疾患.
武田 伸一(Shin’ichi Takeda)
国立精神・神経医療研究センター神経研究所 部長.
研究室URL:https://www.ncnp.go.jp/nin/guide/r_dna2/
© 2018 永田哲也・武田伸一 Licensed under CC 表示 2.1 日本
(国立精神・神経医療研究センター神経研究所 遺伝子疾患治療研究部)
email:永田哲也
DOI: 10.7875/first.author.2018.052
Systemic administration of the antisense oligonucleotide NS-065/NCNP-01 for skipping of exon 53 in patients with Duchenne muscular dystrophy.
Hirofumi Komaki, Tetsuya Nagata, Takashi Saito, Satoru Masuda, Eri Takeshita, Masayuki Sasaki, Hisateru Tachimori, Harumasa Nakamura, Yoshitsugu Aoki, Shin’ichi Takeda
Science Translational Medicine, 10, eaan0713 (2018)
この論文に出現する遺伝子・タンパク質のUniprot ID
要 約
Duchenne型筋ジストロフィーは最終的に死にいたる重篤な遺伝性の筋疾患である.ジストロフィンタンパク質は筋細胞の機能に必要不可欠な構造タンパク質であり,その欠損は筋線維の変性および壊死をひき起こす.Duchenne型筋ジストロフィーにおけるジストロフィンタンパク質の欠損は,ジストロフィンをコードする遺伝子の変異に起因する.この研究において,筆者らは,ジストロフィン遺伝子のエキソン53をスキップさせることによりジストロフィンタンパク質の発現および機能を回復させるアンチセンスオリゴヌクレオチドNS-065/NCNP-01を開発した.Duchenne型筋ジストロフィーの患者10人を対象に実施した第1相試験の結果,すぐれた安全性プロファイルおよび薬物動態が確認され,さらに,ジストロフィンmRNAにおけるエキソン53のスキップおよびジストロフィンタンパク質の発現および機能の回復が確認された.
はじめに
Duchenne型筋ジストロフィーはジストロフィン遺伝子の異常によりジストロフィンタンパク質が欠損する遺伝性の筋疾患で,わが国における指定難病のひとつである.男児にのみ発症し,米国および英国における新生児のスクリーニングでは5000例に1例の割合で発症したことが報告されている1,2).ジストロフィンタンパク質は筋細胞膜の安定化に関与し,その欠損は筋線維の変性および壊死をきたす.そのため,Duchenne型筋ジストロフィーの患者は進行性に筋力の低下が進み成人期に呼吸不全あるいは心不全により死亡する.ジストロフィン遺伝子は79のエキソンから構成されるが,変異の形式はエキソンの欠失が60~70%をしめ,フレームシフト変異においてはジストロフィンタンパク質が欠損するのに対し,インフレーム変異においては構造の一部が欠損するが機能をもつ短縮型のジストロフィンタンパク質が発現する.これは,ジストロフィンタンパク質は中央の領域にくり返し構造をもち,その一部を欠損した短縮型のジストロフィンタンパク質は正常に機能する場合が多いためである.患者の表現型については一般に,フレームシフト変異は重症でインフレーム変異は軽症である.例として,エキソン48~エキソン52が欠失したジストロフィンmRNAではエキソン47とエキソン53とが接続してフレームシフト変異になるが,エキソン53も欠失した場合にはエキソン47とエキソン54とが接続してインフレーム変異になる(図1).そのため,エキソン53を標的とするアンチセンスオリゴヌクレオチドによりスプライシングを阻害してジストロフィンmRNAからエキソン53を取り除き,インフレーム変異のmRNAを産生させることがDuchenne型筋ジストロフィーの治療の戦略になりうる.
これまで,筆者らは,マウスおよびイヌのDuchenne型筋ジストロフィーのモデルにおいてこの手法の概念を実証してきた.具体的には,モルフォリノアンチセンスオリゴヌクレオチドをモデル動物に投与し,標的とするエキソンをスキップさせてフレームシフト変異をもつジストロフィンmRNAをインフレーム変異とすることにより,ジストロフィンタンパク質の発現が回復し骨格筋の障害の進行が抑制された.また,これらのモデル動物において,モルフォリノアンチセンスオリゴヌクレオチドには毒性は認められなかった3,4).これらの研究にもとづき,モデル動物における研究の成果をヒトへと応用すべく,ジストロフィン遺伝子のエキソン53のスキップをひき起こすモルフォリノアンチセンスオリゴヌクレオチドNS-065/NCNP-01を創製し,ヒトにおける最初の試験として,Duchenne型筋ジストロフィーの患者10名に対し第1相試験を実施した.
1.方法
6歳から16歳の10名のDuchenne型筋ジストロフィーの患者を対象とし,週1回12週間にわたり,ジストロフィン遺伝子のエキソン53のスキップをひき起こすモルフォリノアンチセンスオリゴヌクレオチドNS-065/NCNP-01を投与した.生理食塩水により合計100 mlとなるように希釈し,1時間かけて点滴により静脈に注入することにより全身に投与した.ジストロフィンmRNAおよびジストロフィンタンパク質の発現の評価については,投与の前後に筋生検を実施し,これを比較した.また,被験者の組み入れに際しては,国立精神・神経医療研究センターの運営する神経筋疾患の患者の登録サイトRemudy(URL:http://www.remudy.jp/)が活用された.
2.結果
投与は低用量から開始し,被験者に安全性の問題が認められないことが確認されたのち,つぎの用量に移行した.最終的に,全体において重篤あるいは投与の中止にいたった有害事象は認められず,全例が12回の投与を終了した.おもな有害事象として腎機能への影響や貧血が認められた.このうち,貧血については,頻回の採血を施行したことが影響した可能性があった.いずれの有害事象も軽度または中等度であり,特段の治療を必要とせず自然に回復した.以上より,この試験において検討した用量および投与期間では,このアンチセンスオリゴヌクレオチドの忍容性が確認された.
薬物動態について,このアンチセンスオリゴヌクレオチドは短い半減期をもち,用量依存性に最高血中濃度および血中濃度曲線下面積が増加した.これらの結果は,これまでに報告されているモルフォリノアンチセンスオリゴヌクレオチドの特性と一致した.また,体重あたりの投与量および体表面積あたりの投与量と血中濃度との相関について探索的に解析したところ,ともに用量依存性が認められたが,体表面積あたりの投与量と血中濃度との相関のほうが強い傾向が認められた.
ジストロフィンmRNAについては,生検した筋組織からRNAを抽出しRT-PCR法により評価した.その結果,エキソンスキップの効率は用量を増量すると有意に増加する傾向が認められ,被験者NS-07においては投与前の0.3%から47.8%へと増加した.ジストロフィンタンパク質については,生検した筋組織の免疫蛍光染色およびウェスタンブロット法により評価した.いずれの測定においても,定量における対照タンパク質としてスペクトリンを用いた5).免疫蛍光染色においては,10例中7例の被験者において投与前のジストロフィンとスペクトリンとの比率が有意に上昇し,被験者NS-07においては投与前の0.8%から17.6%へと増加した.ジストロフィンに陽性を示す筋線維の割合は,被験者NS-07において投与前の0%から6.3%へと上昇した.また,ウェスタンブロット法においては被験者NS-07以外にジストロフィンのバンドは検出されなかったが,ジストロフィンおよびスペクトリンのバンド強度の比率にもとづく定量において,ジストロフィンは正常な対照(100%)に対し投与後には8.1%まで上昇した.
3.考察
アンチセンスオリゴヌクレオチドNS-065/NCNP-01の開発に際しては,ヒトの横紋筋肉腫細胞および転写因子MyoDにより筋分化を誘導したDuchenne型筋ジストロフィー患者の細胞を用いて塩基配列の探索および最適化が実施されたが,この試験において,はじめてヒトにおける忍容性,薬物動態,有効性について一定の結果が得られた.試験のデザインを検討する過程においては,エキソン51のスキップによる治療薬として開発されてきたdrisapersenおよびeteplirsenに関する報告を参考にした.これらのヒトにおける最初の試験においては,はじめに骨格筋への局所の投与によりジストロフィンの発現を評価していたが6,7),この試験においては,臨床において想定される投与の経路および全身での安全性の評価の必要性を考慮し,静脈への注入による反復投与を選択した.複数の被験者における安全性を評価する必要性,また,単一の施設における試験として参加の可能な被験者の数は最大で10例という制約から,3用量のコホート,公比4で漸増して最大用量を設定した.ただし,eteplirsenにおいて得られた結果より推定して8),この最大用量での12週間にわたる治療ではジストロフィンの発現は10例のうち1例程度しか期待できないと予想した.そのため,主要な評価項目は安全性のみとした.また,運動機能などの評価は困難と考え評価項目から除外し,原則として症状が進行した歩行の不能な患者を組み入れる計画としたが,症例の確保の必要性から最終的に3例の歩行の可能な患者も組み入れた.
安全性に関して,この試験では大きな懸念は認められず,核酸医薬において懸念される炎症性の反応,血液の凝固による障害,肝毒性なども認められなかった.しかしながら,腎機能への影響および貧血についてはこのアンチセンスオリゴヌクレオチドとの因果関係が否定されていないことから,今後の臨床試験においてはさらに検証が必要と考えられた.一方で,薬物動態に関して,このアンチセンスオリゴヌクレオチドの血中濃度は用量依存性かつ線形性を示し,ほとんどが24時間以内に尿から排泄された.なかでも,著明なエキソンスキップの効率およびジストロフィンの発現の認められた被験者NS-07は,すべての被験者のなかでもっとも高い最高血中濃度および血中濃度曲線下面積を呈しており,血中濃度およびエキソンスキップの効率において用量依存性が認められたこともふまえると,被験者NS-07において著明な効果が認められたことは血中濃度により説明可能と考えられた.
なお,ジストロフィンmRNAの定量により被験者NS-07において47.5%というエキソンスキップの効率が認められたが,通常のRT-PCR法ではエキソンがスキップされたmRNAからのPCR産物が過剰に増幅される現象も報告されているため9),その解釈には注意が必要である.また,ジストロフィンタンパク質の定量に関しては予備的な検討により一定の定量性が確認されたが,この試験においてはC末端側の領域と結合する1種類の抗ジストロフィン抗体しか用いておらず,正常な対照は1種類のみであることなど,完全なバリデーションは実施されておらず,今後の課題である.
この試験において明瞭なジストロフィンの発現が認められたのは1例のみであったが,同時に認められた忍容性および効果の用量依存性をふまえると,次相の試験においてより高用量あるいは長期間の投与により治療の効果が見い出される可能性が考えられた.
おわりに
エキソンスキップによるDuchenne型筋ジストロフィーの治療薬としては,米国において2016年にeteplirsenが承認されている.しかしながら,eteplirsenによる臨床的な改善そのものは確認されておらず,ジストロフィンの発現量を代替エンドポイントとした迅速承認制度のもとでの承認であり,その値は正常な対照(100%)に対し治療前の0.16%から治療後に0.44%まで増加したというものあった.どの程度のジストロフィンの発現により患者において臨床的な改善を期待できるかについてはいまだコンセンサスは得られていないが,米国食品医薬品局は10%程度の発現が必要であろうと考察している.代替エンドポイントにより承認されたeteplirsenの有効性については今後の検証が待たれている.アンチセンスオリゴヌクレオチドNS-065/NCNP-01についても,ジストロフィンの発現のみではなく,最終的には臨床的な有効性がもとめられることは同様であり,その点は今後の臨床試験において検証される.ジストロフィンの発現量にもとづいてアンチセンスオリゴヌクレオチドNS-065/NCNP-01の至適な用法および用量を探索する第II相試験は2016年からわが国および米国で開始されており,その結果が期待される.
文 献
- Mendell, J. R.: Evidence-based path to newborn screening for Duchenne muscular dystrophy. Ann. Neurol., 71, 304-313 (2012)[PubMed]
- Moat, S. J.: Newborn bloodspot screening for Duchenne muscular dystrophy: 21 years experience in Wales (UK). Eur. J. Hum. Genet., 21, 1049-1053 (2013)[PubMed]
- Yokota, T., Lu, Q. L., Partridge, T. et al.: Efficacy of systemic morpholino exon-skipping in Duchenne dystrophy dogs. Ann. Neurol., 65, 667-676 (2009)[PubMed]
- Aoki, Y., Nakamura, A., Yokota, T. et al.: In-frame dystrophin following exon 51-skipping improves muscle pathology and function in the exon 52-deficient mdx mouse. Mol. Ther., 18, 1995-2005 (2010)[PubMed]
- Taylor, L. E., Kaminoh, Y. J., Rodesch, C. K. et al.: Quantification of dystrophin immunofluorescence in dystrophinopathy muscle specimens. Neuropathol. Appl. Neurobiol., 38, 591-601 (2012)[PubMed]
- van Deutekom, J. C., Janson, A. A., Ginjaar, I. B. et al.: Local dystrophin restoration with antisense oligonucleotide PRO051. N. Engl. J. Med., 357, 2677-2686 (2007)[PubMed]
- Kinali, M., Arechavala-Gomeza, V., Feng, L. et al.: Local restoration of dystrophin expression with the morpholino oligomer AVI-4658 in Duchenne muscular dystrophy: a single-blind, placebo-controlled, dose-escalation, proof-of-concept study. Lancet Neurol., 8, 918-928 (2009)[PubMed]
- Mendell, J. R., Rodino-Klapac, L. R., Sahenk, Z. et al.: Eteplirsen for the treatment of Duchenne muscular dystrophy. Ann. Neurol., 74, 637-647 (2013)[PubMed]
- Verheul, R. C., van Deutekom, J. C. & Datson, N. A.: Digital droplet PCR for the absolute quantification of exon skipping induced by antisense oligonucleotides in (pre-)clinical development for Duchenne muscular dystrophy. PLoS One, 11, e0162467 (2016)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:1999年 東北大学大学院医学研究科 修了,2003年 岡山大学医学部 助手,2005年 米国Columbia大学 研究員,2008年 岡山大学医学部 助教,2009年 国立精神・神経センター神経研究所 室長,2014年 東京医科歯科大学大学院医歯学総合研究科 特任講師を経て,2018年より同 プロジェクト准教授.
研究テーマ:核酸医薬の開発.神経変性疾患,筋変性疾患.
武田 伸一(Shin’ichi Takeda)
国立精神・神経医療研究センター神経研究所 部長.
研究室URL:https://www.ncnp.go.jp/nin/guide/r_dna2/
© 2018 永田哲也・武田伸一 Licensed under CC 表示 2.1 日本