胚中心B細胞のプラズマ細胞への分化は濾胞性ヘルパーT細胞との相互作用により制御される
伊勢 渉・黒崎知博
(大阪大学免疫学フロンティア研究センター 分化制御)
email:伊勢 渉
DOI: 10.7875/first.author.2018.051
T follicular helper cell-germinal center B cell interaction strength regulates entry into plasma cell or recycling germinal center cell fate.
Wataru Ise, Kentaro Fujii, Katsuyuki Shiroguchi, Ayako Ito, Kohei Kometani, Kiyoshi Takeda, Eiryo Kawakami, Kazuo Yamashita, Kazuhiro Suzuki, Takaharu Okada, Tomohiro Kurosaki
Immunity, 48, 702-715.e4 (2018)
胚中心は免疫応答の際に脾臓やリンパ節などの免疫組織に形成される微小な構造であり,高親和性の抗体を産生するB細胞が分化する場である.胚中心における免疫応答は胚中心B細胞と濾胞性ヘルパーT細胞との相互作用により担われ,抗原受容体との親和性にもとづき選択される.高親和性の抗体を産生する胚中心B細胞がプラズマ細胞へと分化することはよく知られていたが,その分子機構は長いあいだ不明であった.この研究において,筆者らは,胚中心の明領域に存在するプラズマ細胞の前駆細胞となるB細胞を同定した.このB細胞の分化は濾胞性ヘルパーT細胞を介した強いCD40シグナルを必要とした.このB細胞はほかの胚中心B細胞と比較して細胞接着分子であるICAM-1やSLAMを高く発現しており,濾胞性ヘルパーT細胞とより安定に結合すること,濾胞性ヘルパーT細胞との結合を阻害すると数が減少することが判明した.以上の結果から,濾胞性ヘルパーT細胞と胚中心B細胞との安定な相互作用は胚中心B細胞のプラズマ細胞の前駆細胞への分化にとり重要であることが示された.
生体に侵入するウイルスなどの外来性の異物の排除には抗体が必要不可欠である.感染の初期には低親和性の抗体が産生されるが,時間の経過とともに産生される抗体の親和性は上昇する.これは,胚中心において高親和性の抗体を産生するB細胞が分化するからである.感染の初期には抗原に特異的なB細胞がプラズマ細胞へとすみやかに分化し低親和性の抗体を産生するが,一部のB細胞は転写因子Bcl6を発現し胚中心を形成する.胚中心はその構造から明領域と暗領域とに分けられるが,明領域と暗領域では異なるイベントが起こる1).暗領域においてはB細胞がさかんに増殖し,AIDのはたらきにより抗体遺伝子の可変領域に体細胞変異がひき起こされ,その親和性が変化する.暗領域B細胞は明領域へと移動し,濾胞樹状細胞や濾胞性ヘルパーT細胞と接触する.そして,適切な親和性をもつ明領域B細胞はプラズマ細胞やメモリーB細胞として胚中心をはなれる,あるいは,ふたたび暗領域へともどりさらなる体細胞変異の導入をうける.このような明領域におけるB細胞の運命決定はB細胞が発現する抗体の親和性にもとづくことが明らかにされており,高親和性のB細胞はプラズマ細胞として2),低親和性のB細胞はメモリーB細胞として3),選択されることが報告されている.これらのデータから,胚中心にはすでにプラズマ細胞やメモリーB細胞へと分化することが決定づけられた“前駆細胞”の存在することが予想される.実際,胚中心にプラズマ細胞と似た表現型を示すB細胞の存在が報告されており4),プラズマ細胞へ分化するひとつまえの段階のB細胞である可能性が示唆されていた.しかし,これが本当にプラズマ細胞の前駆細胞であるのかどうか,その検証はまったくなされていなかった.また,もし前駆細胞であるなら,どのようなシグナルがその分化に必要なのかを明らかにすることも課題として残されていた.この研究において,筆者らは,胚中心B細胞からプラズマ細胞への分化に焦点をあて,これらの課題を明らかにしようと試みた.
プラズマ細胞の前駆細胞は胚中心B細胞のアイデンティティを失いつつあるのではないかと考え,胚中心B細胞が高く発現する転写因子Bcl6のレポーターマウスを用いた5).このマウスを免疫し抗原に特異的な胚中心B細胞を詳細に解析した結果,明領域B細胞の一部はBcl6の発現が低く,プラズマ細胞が高く発現する転写因子IRF4 6) を発現することが判明した.細胞表面タンパク質を解析したところ,このBcl6低発現IRF4陽性B細胞はCD69を高く発現していた.そこで,以降の解析では,Bcl6低発現CD69高発現B細胞をBcl6低発現IRF4陽性B細胞として扱った.
胚中心の明領域に存在するBcl6低発現CD69高発現B細胞がプラズマ細胞の前駆細胞である可能性を検証するため,胚中心に由来する抗原に特異的なプラズマ細胞と胚中心B細胞の免疫グロブリン重鎖の可変領域の遺伝子の塩基配列を比較した.その結果,Bcl6低発現CD69高発現B細胞の抗体遺伝子はプラズマ細胞の抗体遺伝子ともっとも似ていた.また,同じく明領域に存在するBcl6高発現CD69高発現B細胞の抗体遺伝子は暗領域B細胞の抗体遺伝子と似ていた.遺伝子の発現パターンを比較したところ,Bcl6低発現CD69高発現B細胞においては胚中心B細胞に特徴的な遺伝子の発現が顕著に低下していること,逆に,プラズマ細胞に特有の遺伝子の発現パターンが認められることが判明した.Bcl6低発現CD69高発現B細胞はプラズマ細胞のマスター遺伝子であるBlimp-1遺伝子は発現していなかったが,in vitroにおいてインターロイキン21の存在下にて培養するとBlimp-1遺伝子の発現がすみやかに誘導された.プラズマ細胞の分化が障害されている系においても検討した.胚中心B細胞においてIRF4を欠失させたところ,胚中心B細胞は正常に生存したが,胚中心B細胞からのプラズマ細胞の分化は完全に消失した.このIRF4を欠損した明領域B細胞を解析したところ,Bcl6低発現CD69高発現B細胞はほとんど検出されなかった.以上の結果から,胚中心の明領域に存在するBcl6低発現CD69高発現B細胞はプラズマ細胞の前駆細胞であると考えられた.
さきに述べた遺伝子の発現パターンの解析により,胚中心の明領域に存在するBcl6低発現CD69高発現B細胞はほかの明領域B細胞と比較して,CD40シグナルにより発現が誘導される遺伝子が強く発現することが明らかにされた.このことから,Bcl6低発現CD69高発現B細胞は濾胞性ヘルパーT細胞から強いシグナルをうけている可能性が示唆された.濾胞性ヘルパーT細胞からのCD40シグナルの強さがプラズマ細胞の前駆細胞への分化を制御するのではないかと考え,胚中心において野生型のB細胞とCD40ヘテロ接合B細胞とが共存する状況を構築し,胚中心B細胞の数やそこから分化したプラズマ細胞の数を解析した.その結果,CD40ヘテロ接合B細胞は野生型のB細胞とほぼ1対1の割合で胚中心B細胞として存在したが,分化したプラズマ細胞の数は約半分に減少し,このとき,CD40ヘテロ接合B細胞に由来するBcl6低発現CD69高発現B細胞の数も約半分に減少した.このことから,胚中心の明領域に存在するBcl6低発現CD69高発現B細胞の分化は,濾胞性ヘルパーT細胞を介したCD40シグナルの強さにより制御されることが明らかにされた.
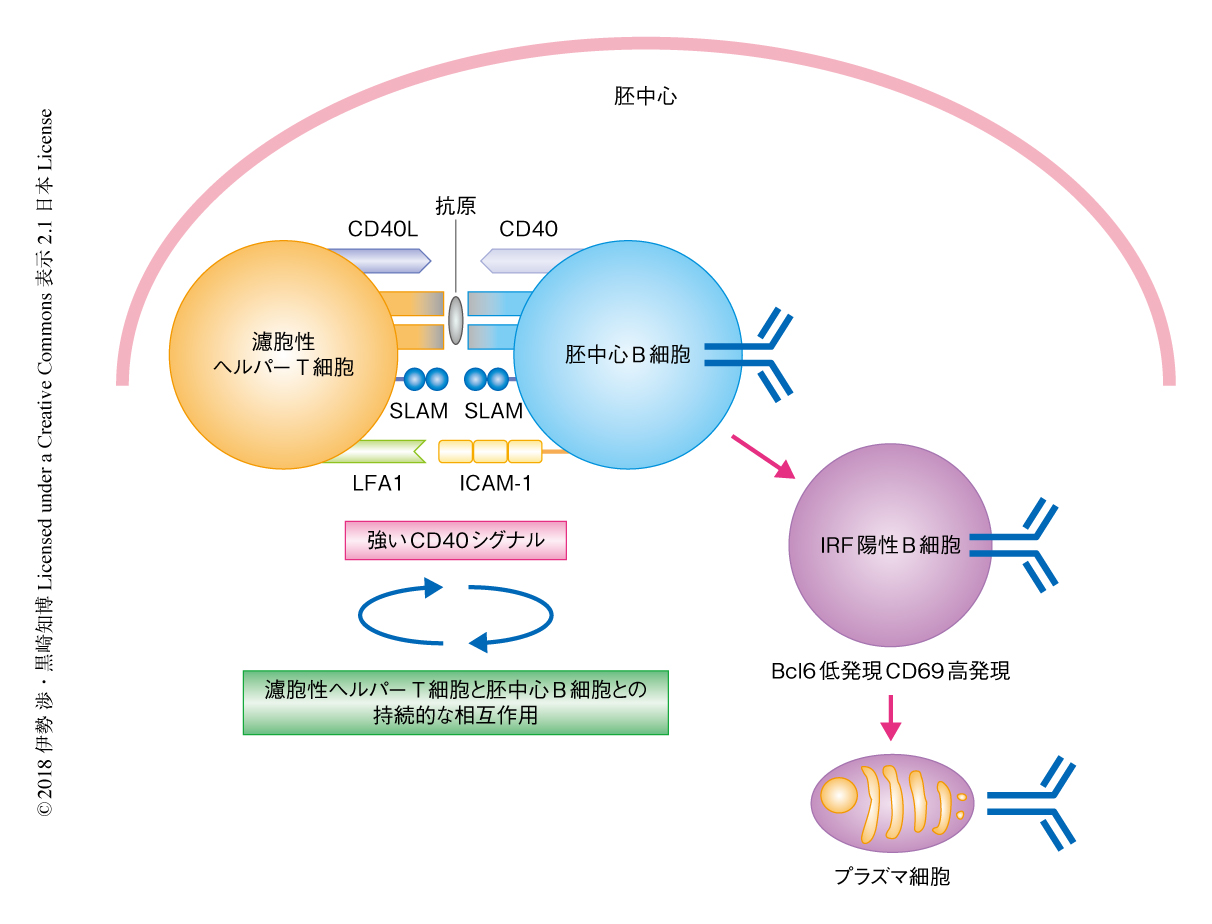
なぜ,胚中心の明領域に存在するBcl6低発現CD69高発現B細胞は濾胞性ヘルパーT細胞から強いCD40シグナルをうけることができるのだろうか? 遺伝子の発現パターンの解析や細胞表面タンパク質の解析から,胚中心のBcl6低発現CD69高発現B細胞はほかの胚中心B細胞よりも,細胞接着分子であるICAM-1やSLAMを高く発現することが明らかにされた.また,in vitroにおいて濾胞性ヘルパーT細胞と抗原の存在下にて共培養すると,ほかの胚中心B細胞と比較してより多くの濾胞性ヘルパーT細胞と持続的に結合した.胚中心のBcl6低発現CD69高発現B細胞はin vivoにおいてもより多くの濾胞性ヘルパーT細胞と結合した.また,抗ICAM-1抗体を投与するとこの濾胞性ヘルパーT細胞との結合が阻害され,明領域B細胞においてIRF4の発現が低下し,さらに,Bcl6低発現CD69高発現B細胞の数が減少した.以上の結果から,胚中心の明領域に存在するBcl6低発現CD69高発現B細胞がプラズマ細胞の前駆細胞へと分化するのには,濾胞性ヘルパーT細胞との強い相互作用が重要であることが示された(図1).
この研究において,筆者らは,胚中心に存在するプラズマ細胞の前駆細胞を同定し,それが分化するために重要なシグナルを明らかにした.最近,この研究結果を支持する論文がいくつか報告され7,8),これまで不明であった胚中心B細胞からのプラズマ細胞の選択および分化の機構がかなり明確になってきた.胚中心において選択されたプラズマ細胞は骨髄へと移動し長寿命プラズマ細胞として生存するとされている9).良質なワクチンの開発を考えるうえで,プラズマ細胞の生存をささえる分子基盤を明らかにすることは重要な課題である.今後は,胚中心から骨髄へと移動したプラズマ細胞の不均一性や遺伝子発現の解析をつうじて長寿命プラズマ細胞の実質を明らかにしたいと考えている.
略歴:2000年 東京大学大学院農学生命科学研究科研究科博士課程 修了,同年 同 助手,2004年 米国Washington大学School of Medicine博士研究員を経て,2011年より大阪大学免疫学フロンティア研究センター 特任准教授.
研究テーマ:プラズマ細胞の分化および維持の機構.
黒崎 知博(Tomohiro Kurosaki)
大阪大学免疫学フロンティア研究センター 特任教授.
研究室URL:http://lymph.ifrec.osaka-u.ac.jp/index_j
© 2018 伊勢 渉・黒崎知博 Licensed under CC 表示 2.1 日本
(大阪大学免疫学フロンティア研究センター 分化制御)
email:伊勢 渉
DOI: 10.7875/first.author.2018.051
T follicular helper cell-germinal center B cell interaction strength regulates entry into plasma cell or recycling germinal center cell fate.
Wataru Ise, Kentaro Fujii, Katsuyuki Shiroguchi, Ayako Ito, Kohei Kometani, Kiyoshi Takeda, Eiryo Kawakami, Kazuo Yamashita, Kazuhiro Suzuki, Takaharu Okada, Tomohiro Kurosaki
Immunity, 48, 702-715.e4 (2018)
この論文に出現する遺伝子・タンパク質のUniprot ID
CD40(P27512), ICAM-1(P13597), SLAM, Bcl6(P41182), AID(Q9WVE0), IRF4(Q64287), CD69(P37217), Blimp-1(Q60636), インターロイキン21(Q9ES17)
要 約
胚中心は免疫応答の際に脾臓やリンパ節などの免疫組織に形成される微小な構造であり,高親和性の抗体を産生するB細胞が分化する場である.胚中心における免疫応答は胚中心B細胞と濾胞性ヘルパーT細胞との相互作用により担われ,抗原受容体との親和性にもとづき選択される.高親和性の抗体を産生する胚中心B細胞がプラズマ細胞へと分化することはよく知られていたが,その分子機構は長いあいだ不明であった.この研究において,筆者らは,胚中心の明領域に存在するプラズマ細胞の前駆細胞となるB細胞を同定した.このB細胞の分化は濾胞性ヘルパーT細胞を介した強いCD40シグナルを必要とした.このB細胞はほかの胚中心B細胞と比較して細胞接着分子であるICAM-1やSLAMを高く発現しており,濾胞性ヘルパーT細胞とより安定に結合すること,濾胞性ヘルパーT細胞との結合を阻害すると数が減少することが判明した.以上の結果から,濾胞性ヘルパーT細胞と胚中心B細胞との安定な相互作用は胚中心B細胞のプラズマ細胞の前駆細胞への分化にとり重要であることが示された.
はじめに
生体に侵入するウイルスなどの外来性の異物の排除には抗体が必要不可欠である.感染の初期には低親和性の抗体が産生されるが,時間の経過とともに産生される抗体の親和性は上昇する.これは,胚中心において高親和性の抗体を産生するB細胞が分化するからである.感染の初期には抗原に特異的なB細胞がプラズマ細胞へとすみやかに分化し低親和性の抗体を産生するが,一部のB細胞は転写因子Bcl6を発現し胚中心を形成する.胚中心はその構造から明領域と暗領域とに分けられるが,明領域と暗領域では異なるイベントが起こる1).暗領域においてはB細胞がさかんに増殖し,AIDのはたらきにより抗体遺伝子の可変領域に体細胞変異がひき起こされ,その親和性が変化する.暗領域B細胞は明領域へと移動し,濾胞樹状細胞や濾胞性ヘルパーT細胞と接触する.そして,適切な親和性をもつ明領域B細胞はプラズマ細胞やメモリーB細胞として胚中心をはなれる,あるいは,ふたたび暗領域へともどりさらなる体細胞変異の導入をうける.このような明領域におけるB細胞の運命決定はB細胞が発現する抗体の親和性にもとづくことが明らかにされており,高親和性のB細胞はプラズマ細胞として2),低親和性のB細胞はメモリーB細胞として3),選択されることが報告されている.これらのデータから,胚中心にはすでにプラズマ細胞やメモリーB細胞へと分化することが決定づけられた“前駆細胞”の存在することが予想される.実際,胚中心にプラズマ細胞と似た表現型を示すB細胞の存在が報告されており4),プラズマ細胞へ分化するひとつまえの段階のB細胞である可能性が示唆されていた.しかし,これが本当にプラズマ細胞の前駆細胞であるのかどうか,その検証はまったくなされていなかった.また,もし前駆細胞であるなら,どのようなシグナルがその分化に必要なのかを明らかにすることも課題として残されていた.この研究において,筆者らは,胚中心B細胞からプラズマ細胞への分化に焦点をあて,これらの課題を明らかにしようと試みた.
1.胚中心の明領域にはBcl6低発現IRF4陽性CD69高発現B細胞が存在する
プラズマ細胞の前駆細胞は胚中心B細胞のアイデンティティを失いつつあるのではないかと考え,胚中心B細胞が高く発現する転写因子Bcl6のレポーターマウスを用いた5).このマウスを免疫し抗原に特異的な胚中心B細胞を詳細に解析した結果,明領域B細胞の一部はBcl6の発現が低く,プラズマ細胞が高く発現する転写因子IRF4 6) を発現することが判明した.細胞表面タンパク質を解析したところ,このBcl6低発現IRF4陽性B細胞はCD69を高く発現していた.そこで,以降の解析では,Bcl6低発現CD69高発現B細胞をBcl6低発現IRF4陽性B細胞として扱った.
2.胚中心のBcl6低発現CD69高発現B細胞はプラズマ細胞の前駆細胞である
胚中心の明領域に存在するBcl6低発現CD69高発現B細胞がプラズマ細胞の前駆細胞である可能性を検証するため,胚中心に由来する抗原に特異的なプラズマ細胞と胚中心B細胞の免疫グロブリン重鎖の可変領域の遺伝子の塩基配列を比較した.その結果,Bcl6低発現CD69高発現B細胞の抗体遺伝子はプラズマ細胞の抗体遺伝子ともっとも似ていた.また,同じく明領域に存在するBcl6高発現CD69高発現B細胞の抗体遺伝子は暗領域B細胞の抗体遺伝子と似ていた.遺伝子の発現パターンを比較したところ,Bcl6低発現CD69高発現B細胞においては胚中心B細胞に特徴的な遺伝子の発現が顕著に低下していること,逆に,プラズマ細胞に特有の遺伝子の発現パターンが認められることが判明した.Bcl6低発現CD69高発現B細胞はプラズマ細胞のマスター遺伝子であるBlimp-1遺伝子は発現していなかったが,in vitroにおいてインターロイキン21の存在下にて培養するとBlimp-1遺伝子の発現がすみやかに誘導された.プラズマ細胞の分化が障害されている系においても検討した.胚中心B細胞においてIRF4を欠失させたところ,胚中心B細胞は正常に生存したが,胚中心B細胞からのプラズマ細胞の分化は完全に消失した.このIRF4を欠損した明領域B細胞を解析したところ,Bcl6低発現CD69高発現B細胞はほとんど検出されなかった.以上の結果から,胚中心の明領域に存在するBcl6低発現CD69高発現B細胞はプラズマ細胞の前駆細胞であると考えられた.
3.胚中心のBcl6低発現CD69高発現B細胞の分化はCD40シグナルにより制御される
さきに述べた遺伝子の発現パターンの解析により,胚中心の明領域に存在するBcl6低発現CD69高発現B細胞はほかの明領域B細胞と比較して,CD40シグナルにより発現が誘導される遺伝子が強く発現することが明らかにされた.このことから,Bcl6低発現CD69高発現B細胞は濾胞性ヘルパーT細胞から強いシグナルをうけている可能性が示唆された.濾胞性ヘルパーT細胞からのCD40シグナルの強さがプラズマ細胞の前駆細胞への分化を制御するのではないかと考え,胚中心において野生型のB細胞とCD40ヘテロ接合B細胞とが共存する状況を構築し,胚中心B細胞の数やそこから分化したプラズマ細胞の数を解析した.その結果,CD40ヘテロ接合B細胞は野生型のB細胞とほぼ1対1の割合で胚中心B細胞として存在したが,分化したプラズマ細胞の数は約半分に減少し,このとき,CD40ヘテロ接合B細胞に由来するBcl6低発現CD69高発現B細胞の数も約半分に減少した.このことから,胚中心の明領域に存在するBcl6低発現CD69高発現B細胞の分化は,濾胞性ヘルパーT細胞を介したCD40シグナルの強さにより制御されることが明らかにされた.
4.胚中心のBcl6低発現CD69高発現B細胞は濾胞性ヘルパーT細胞と安定に結合する
なぜ,胚中心の明領域に存在するBcl6低発現CD69高発現B細胞は濾胞性ヘルパーT細胞から強いCD40シグナルをうけることができるのだろうか? 遺伝子の発現パターンの解析や細胞表面タンパク質の解析から,胚中心のBcl6低発現CD69高発現B細胞はほかの胚中心B細胞よりも,細胞接着分子であるICAM-1やSLAMを高く発現することが明らかにされた.また,in vitroにおいて濾胞性ヘルパーT細胞と抗原の存在下にて共培養すると,ほかの胚中心B細胞と比較してより多くの濾胞性ヘルパーT細胞と持続的に結合した.胚中心のBcl6低発現CD69高発現B細胞はin vivoにおいてもより多くの濾胞性ヘルパーT細胞と結合した.また,抗ICAM-1抗体を投与するとこの濾胞性ヘルパーT細胞との結合が阻害され,明領域B細胞においてIRF4の発現が低下し,さらに,Bcl6低発現CD69高発現B細胞の数が減少した.以上の結果から,胚中心の明領域に存在するBcl6低発現CD69高発現B細胞がプラズマ細胞の前駆細胞へと分化するのには,濾胞性ヘルパーT細胞との強い相互作用が重要であることが示された(図1).
おわりに
この研究において,筆者らは,胚中心に存在するプラズマ細胞の前駆細胞を同定し,それが分化するために重要なシグナルを明らかにした.最近,この研究結果を支持する論文がいくつか報告され7,8),これまで不明であった胚中心B細胞からのプラズマ細胞の選択および分化の機構がかなり明確になってきた.胚中心において選択されたプラズマ細胞は骨髄へと移動し長寿命プラズマ細胞として生存するとされている9).良質なワクチンの開発を考えるうえで,プラズマ細胞の生存をささえる分子基盤を明らかにすることは重要な課題である.今後は,胚中心から骨髄へと移動したプラズマ細胞の不均一性や遺伝子発現の解析をつうじて長寿命プラズマ細胞の実質を明らかにしたいと考えている.
文 献
- Victora, G. D. & Nussenzweig, M. C.: Germinal centers. Annu. Rev. Immunol., 30, 429-457 (2012)[PubMed]
- Phan, T. G., Paus, D., Chan, T. D. et al.: High affinity germinal center B cells are actively selected into the plasma cell compartment. J. Exp. Med., 203, 2419-2424 (2006)[PubMed]
- Shinnakasu, R., Inoue, T., Kometani, K. et al.: Regulated selection of germinal-center cells into the memory B cell compartment. Nat. Immunol., 17, 861-869 (2016)[PubMed]
- De Silva, N. S., Anderson, M. M., Carette, A. et al.: Transcription factors of the alternative NF-κB pathway are required for germinal center B-cell development. Proc. Natl. Acad. Sci. USA, 113, 9063-9068 (2016)[PubMed]
- Kitano, M., Moriyama, S., Ando, Y. et al.: Bcl6 protein expression shapes pre-germinal center B cell dynamics and follicular helper T cell heterogeneity. Immunity, 34, 961-972 (2011)[PubMed] [新着論文レビュー]
- De Silva, N. S., Simonetti, G., Heise, N. et al.: The diverse roles of IRF4 in late germinal center B-cell differentiation. Immunol. Rev., 247, 73-92 (2012)[PubMed]
- Yan, H., Wu, L., Shih, C. et al.: Plexin B2 and semaphorin 4C guide T cell recruitment and function in the germinal center. Cell Rep., 19, 995-1007 (2017)[PubMed]
- Li, X., Gadzinsky, A., Gong, L. et al.: Cbl ubiquitin ligases control B cell exit from the germinal-center reaction. Immunity, 48, 530-541 (2018)[PubMed]
- Nutt, S. L., Hodgkin, P. D., Tarlinton, D. M. et al.: The generation of antibody-secreting plasma cells. Nat. Rev. Immunol., 15, 160-171 (2015)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2000年 東京大学大学院農学生命科学研究科研究科博士課程 修了,同年 同 助手,2004年 米国Washington大学School of Medicine博士研究員を経て,2011年より大阪大学免疫学フロンティア研究センター 特任准教授.
研究テーマ:プラズマ細胞の分化および維持の機構.
黒崎 知博(Tomohiro Kurosaki)
大阪大学免疫学フロンティア研究センター 特任教授.
研究室URL:http://lymph.ifrec.osaka-u.ac.jp/index_j
© 2018 伊勢 渉・黒崎知博 Licensed under CC 表示 2.1 日本