光化学系Iとフェレドキシンとの複合体の結晶構造
河合 (久保田) 寿子・栗栖源嗣
(大阪大学蛋白質研究所 蛋白質結晶学研究室)
email:河合 (久保田) 寿子,栗栖源嗣
DOI: 10.7875/first.author.2018.046
X-ray structure of an asymmetrical trimeric ferredoxin-photosystem I complex.
Hisako Kubota-Kawai, Risa Mutoh, Kanako Shinmura, Pierre Sétif, Marc M. Nowaczyk, Matthias Rögner, Takahisa Ikegami, Hideaki Tanaka, Genji Kurisu
Nature Plants, 4, 218-224 (2018)
ヒトを含む地球上のほとんどすべての生物は,光合成によりつくられた有機物を利用して生命活動している.光合成において無機酸化物を還元する還元力を生じているのは光化学系Iである.光化学系Iにより生じた還元力は電子伝達タンパク質であるフェレドキシンを介し生体のさまざまな還元同化酵素に分配される.光化学系Iは光エネルギーを利用して有機物を合成するための還元力を供給しており,光化学系Iからフェレドキシンへ効率のよく電子を伝達することが要求される.光化学系Iおよびフェレドキシンの構造生物学的な研究の歴史は古く,フェレドキシンの最初の高分解能での構造は1980年,光化学系Iの立体構造は2001年に報告された.しかし,どのようなしくみにより光化学系Iからフェレドキシンへと効率よく電子がうけわたされるのか,という問いに対する答えはでていなかった.この研究において,筆者らは,光化学系Iおよびフェレドキシンが機能する複合体の状態における立体構造を解き明かすことにより,タンパク質のあいだの分子認識の機構および複合体の形成により誘起される構造の変化をとらえることをめざした.最終的に,光化学系Iとフェレドキシンとの複合体の結晶構造を4.2Å分解能で決定し,これまで確定されていなかった光化学系Iにおけるフェレドキシンの結合部位が特定され,光化学系Iおよびフェレドキシンの酸化還元中心は電子の伝達に適した距離に配置されていること,また,その周辺は疎水的な環境になっていることが明らかにされた.さらに,複合体の形成により誘起される光化学系Iの構造の変化をとらえることにより,光化学系Iおよびフェレドキシンの単独の構造からは導き出せない,PsaFを介した細胞質側とルーメン側とのクロストークの可能性を示唆する構造や,光化学系I三量体のおのおののプロトマーが協調して集光するという植物生理学的な報告を支持する構造の情報が得られた.この研究において明らかにされた光化学系Iとフェレドキシンとの複合体の構造により,フェレドキシンは光化学系Iを酸化するだけでなく,光化学系Iの全体の構造に変化をひき起こすことにより光化学系Iの機能を微調整する可能性が見い出された.
光合成生物のもつ無機酸化物から有機化合物をつくりだす能力はきわめて重要である.生命を特徴づける炭素,窒素,硫黄などの元素は大気や土壌に二酸化炭素や硝酸などの無機酸化物として存在する.生物がこれら無機物を糖やアミノ酸のような有機物として利用するには,それらを還元し同化する必要がある.そのための強力な還元力を生じているのは,植物,藻類,シアノバクテリアのチラコイド膜に存在する光化学系Iである.生体における多種多様な還元同化酵素,たとえば,フェレドキシン-NADP+還元酵素,亜硝酸還元酵素,亜硫酸還元酵素,フェレドキシン-チオレドキシン還元酵素,グルタミン酸合成酵素,ヒドロゲナーゼなどは,光化学系Iから生じた還元力を必要とするが,光化学系Iから直接には電子をうけとることができない.光化学系Iに結合して電子をうけとることができるのは電子伝達タンパク質であるフェレドキシンだけである.つまり,光化学系Iを基点とした生体における還元力の分配はフェレドキシンに依存しており,フェレドキシンには光化学系Iから高い効率で電子をうけとるしくみが必要とされる.
これまで,光化学系Iや還元同化酵素などフェレドキシンに依存性の多くの酵素について,単体での立体構造の情報が蓄積されてきた.そして,これらの構造の情報をもとに変異体が作製され,複合体の形成に対する理解が深められてきた.しかし,これらのタンパク質は生体において電子伝達複合体を形成して生理的な機能を発揮する.そこで,実際にはたらいている複合体の状態で構造を解析し,タンパク質のあいだの相互作用を直接的にみる試みがなされてきた.たとえば,これまでにNMR法やX線結晶構造解析法を駆使して,フェレドキシンとフェレドキシン-NADP+還元酵素1),フェレドキシンと亜硝酸還元酵素2),フェレドキシンと亜硫酸還元酵素3),フェレドキシンとフェレドキシン-チオレドキシン還元酵素4),などの複合体の構造が解析されてきた.これらの構造の情報を相互に比較したところ,フェレドキシンはそれぞれ個別に複合体を形成しており,統一的な構造の基盤は存在しないことがわかってきた.さらに,複合体の構造解析からは,複合体の形成により誘起される構造の変化,ドメインのあいだの相対配置の調整,配位様式の変化など,単体の構造からは得られない新規の知見が得られた.しかし,フェレドキシンが電子を分配する下流の構造の情報は蓄積してきたものの,上流にあたる光化学系Iからフェレドキシンへの電子の伝達の詳細は解明されていなかった.可溶性タンパク質どうしの構造解析とは異なり,光化学系Iが光に弱い巨大膜タンパク質であることも,複合体の構造解析の難易度をあげていたと考えられる.この研究において,筆者らは,光化学系Iとフェレドキシンとの電子伝達複合体の形成を直接とらえることをめざし,光化学系Iとフェレドキシンとの複合体の結晶構造を解析した.
好熱性シアノバクテリアThermosynechococcus elongatusの光化学系Iおよびフェレドキシンを用い,4℃,波長525 nmの弱緑光下にて精製した光化学系I三量体と組換えフェレドキシンとを混合し,蒸気拡散法にて結晶化のスクリーニングを実施した.その結果,緑色の結晶にフェレドキシンが含まれる結晶化の条件が得られた.フェレドキシンの存在はSDS-ポリアクリルアミドゲル電気泳動法により確認された.そののち,バッチ法により結晶化の条件を最適化することにより,良質な単結晶が得られた.この結晶を用いて大型放射光施設SPring-8のビームラインBL44XUにてX線回折強度データを収集し,T. elongatusの光化学系Iの構造5)(PDB ID:1JB0)をモデルとした分子置換法により初期位相を決定し,4.3Å分解能で結晶構造を決定した.しかしながら,フェレドキシンの酸化還元中心にある鉄の異常散乱シグナルは確認されたものの,フェレドキシンのタンパク質の部分の電子密度は主鎖の構造を明らかにできるレベルにはなかった.これは,光化学系Iとフェレドキシンとの複合体は弱い相互作用で過渡的に形成され,電子がうけわたされるとただちに解離する不安定な複合体であることに起因すると考えた.
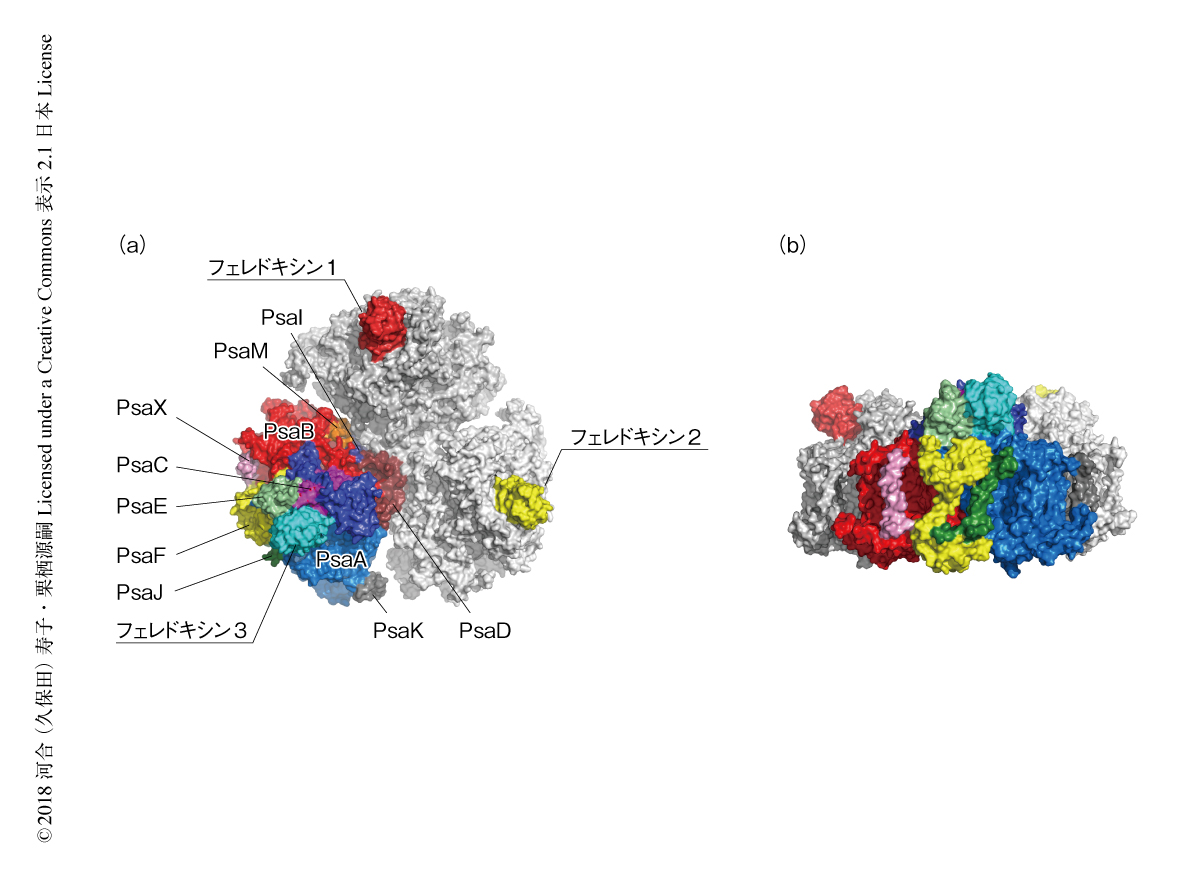
この問題を解決するため,フェレドキシンの鉄をガリウムに置換した.ガリウム置換フェレドキシンは酸化型の野生型フェレドキシンとほぼ同じ構造をとり,フェレドキシンに依存性の酵素を認識して結合する能力はもつが電子伝達の活性はもたないこと6),また,解離定数が野生型フェレドキシンよりも小さいことが報告されている7).このガリウム置換フェレドキシンを利用したことがブレークスルーとなり,フェレドキシンのタンパク質の部分の主鎖の構造までが明らかにされた光化学系Iとフェレドキシンとの複合体の全体構造が4.2Å分解能で決定された(PDB ID:5ZF0,図1).結晶の非対称単位には,生物学的な単位である光化学系I三量体が2分子およびフェレドキシンが6分子,あわせて2.2 MDa,78個のタンパク質サブユニットが含まれていた.2分子の光化学系I三量体はルーメン側どうしがむかいあうようにパッキングされており,上側の光化学系I三量体に含まれるフェレドキシンをフェレドキシン1~フェレドキシン3,下側の光化学系I三量体に含まれるフェレドキシンをフェレドキシン4~フェレドキシン6とした.上下の複合体はほぼ変わらない構造をしていたため,以下は,上側の光化学系I-フェレドキシン複合体の構造について記述する.
これまでの部位特異的な変異体を用いた研究により,フェレドキシンは光化学系Iの表在性タンパク質PsaC,PsaD,PsaEと相互作用して結合するとされてきた8,9).しかしながら,光化学系Iとフェレドキシンとの複合体の結晶構造において,フェレドキシン1~フェレドキシン3はすべてPsaC,PsaE,また,反応中心膜タンパク質であるPsaAが形成するポケットと結合しており,PsaDはフェレドキシンとの直接の接点をもたなかった.これは,PsaDの酸性残基に変異を導入すると結合に大きな影響がでるとする報告10) とは相反する一方,塩基性残基に変異を導入した際に影響が小さいこととは矛盾しない結果となった.また,近年,細胞質側に存在する集光タンパク質であるフィコビリソームはPsaAの一部およびPsaDと結合すると報告されており,フェレドキシンとフィコビリソームの結合は競合しないと理解することもでき,このモデルを支持する結果と考えられた.
光化学系Iとフェレドキシンとが相互作用する表面は,どの光化学系Iプロトマーにおいても金属中心の近傍の疎水的な領域とそれを半月状にとりまく静電的な相互作用および水素結合により複合体を安定化する領域とに分けられた.中心金属であるフェレドキシンの[2Ga-2S]クラスターは,PsaCのFB([4Fe-4S]クラスター)とむかいあって位置していた.おのおのの光化学系Iプロトマーの金属クラスターとフェレドキシンの[2Ga-2S]クラスターとのあいだの距離には8.3Åから9.6Åの開きがあり,フェレドキシン3の[2Ga-2S]クラスターがFBともっとも近い位置に存在していた.また,フェレドキシンの異常分散差フーリエマップのピークの高さにも違いがあり,フェレドキシン3の値がもっとも高かった.これらのことから,フェレドキシン3はフェレドキシン1あるいはフェレドキシン2と比べ光化学系Iと強固に結合することが示唆された.これら金属中心の周辺は,フェレドキシンとPsaCのFBとのあいだで直接的に電子が伝達されるのに適した疎水的な環境になっていた.フェレドキシン3の場合は,相互作用するアミノ酸残基の数がフェレドキシン1あるいはフェレドキシン2よりも多く,フェレドキシンの5残基およびPsaCの6残基が関与していた.この金属中心をとりまく疎水的な領域は,フェレドキシンとPsaAおよびPsaEとの静電的な相互作用および水素結合にとりかこまれていた.この極性残基による相互作用については,フェレドキシン1~フェレドキシン3とPsaAおよびPsaEとのあいだで相互作用するアミノ酸残基の数に大きな違いはなく,複合体の構造の安定化に寄与していた.このような階層的な相互作用の様式をとることにより,光化学系Iからフェレドキシンへの効率のよい電子伝達が達成されると考えられた.
さらに,NMRによる転移交差飽和法により,溶液における光化学系Iとフェレドキシンとの相互作用を検証した.この方法では,2Hにより標識したフェレドキシンを利用することで,光化学系Iと相互作用するフェレドキシンの残基が特定される.酸化型のフェレドキシンでは鉄の常磁性効果により[2Fe-2S]クラスターの周辺のシグナルが検出されないため,同じように光化学系Iと相互作用するガリウム置換フェレドキシンを使用した.その結果,結晶において光化学系Iと相互作用するフェレドキシンのアミノ酸残基は,溶液においてもほとんど同じように相互作用することが示された.このように,X線結晶構造解析にくわえ,溶液における相互作用を検証できるNMR法を相補的に併用することにより,信頼性の高い情報が得られた.
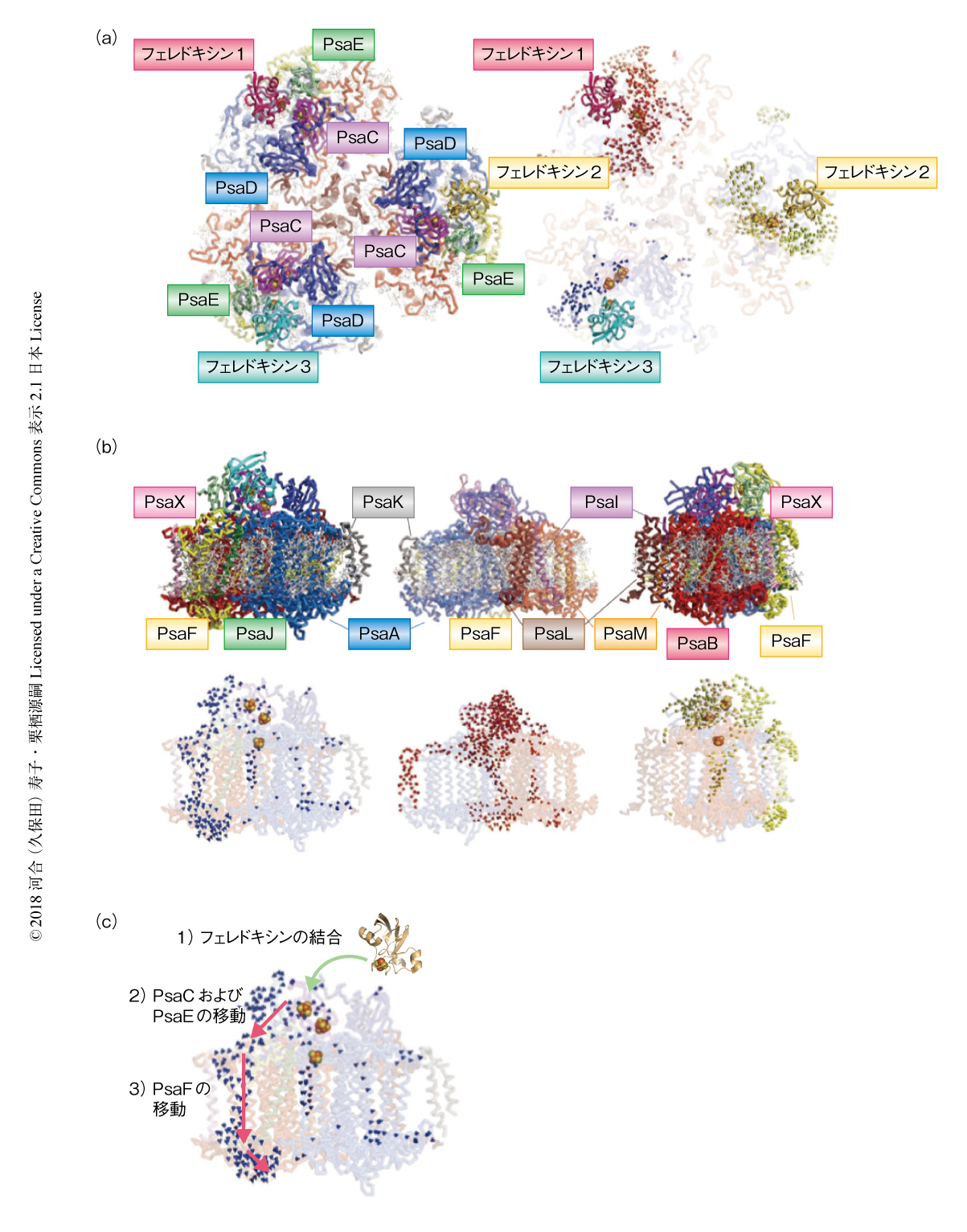
フェレドキシンが結合していない光化学系I三量体の構造は,結晶学的な3回軸にのるため三量体は完全に等価である.一方,光化学系Iとフェレドキシンとの複合体の構造においては,非結晶学的な単位に2組の三量体が入るため,構成するおのおのの分子にはある程度の非等価性が許容される.実際,3回対称からずれた角度を算出すると,反応中心タンパク質であるPsaAはおのおののプロトマーにおいてほとんど3回回転対称の位置にあったのに対し,フェレドキシン1~フェレドキシン3は明らかに3回回転対称からはずれていた.さらに,おのおののプロトマーの境目に存在するPsaIも同様に3回回転対称からはずれていた.このことから,光化学系I三量体はフェレドキシンとの結合の情報を共有し全体の構造を順番に微調整して,協調して機能する可能性が想定された.実際に,フェレドキシンの結合により光化学系I三量体の3つあるプロトマーの間隔が縮まったり広がったりする構造の変化がひき起こされた(図2 a, b).これは,おのおののプロトマーのあいだで光エネルギーを共有し,三量体が全体として効率よく電荷を分離するための構造の変化とも考えられた11).さらに,フェレドキシンが結合することにより,チラコイド膜を隔てた細胞質側とルーメン側をつなぐ,垂直方向の構造の変化もひき起こされていた.フェレドキシンが光化学系Iの表在性タンパク質PsaCおよびPsaEと結合することにより,それらのタンパク質が光化学系I三量体の外側にむかい移動する.さらに,PsaCおよびPsaEの動きはフェレドキシンとは直接に相互作用していない膜貫通サブユニットPsaFにも伝達され,光化学系I三量体の外側にそってチラコイド膜を縦断し,構造の変化は最終的にルーメン側まで到達していた.PsaFのN末端の近傍は光化学系Iを還元するシトクロムc6と結合する部位であることから,光化学系IはPsaFを介して膜の内外の酸化還元タンパク質との結合の情報を共有する可能性が示唆され,これをPsaFピストンモデルとして提唱した(図2c).
この研究により明らかにされた光化学系Iとフェレドキシンとの複合体の構造により,光化学系Iからフェレドキシンへと電子を効率よくうけわたすための構造の基盤が解き明かされた.さらに,フェレドキシンの結合は単純に電子を受容するだけでなく,光化学系Iの全体に構造の変化をひき起こし,効率のよい酸化還元反応および集光反応のため微調整をしている可能性が見い出された.光化学系Iと相互作用するタンパク質としては,ほかに光化学系Iを還元するシトクロムc6およびプラストシアニンとよばれる小型の電子伝達タンパク質がある.しかし,それらが光化学系Iと結合する際に光化学系Iの構造に変化をひき起こすかどうかについては調べられていない.たとえば,PsaFを介したルーメン側から細胞質側への結合の情報の伝達などにも興味がもたれる.今後,光化学系Iと光化学系Iを還元するタンパク質との複合体の構造解析が進むことにより,光化学系Iの酸化還元反応の包括的な理解につながることを期待している.
略歴:2010年 東京大学大学院総合文化研究科博士課程 修了,同年 大阪大学蛋白質研究所 研究員を経て,2015年より基礎生物学研究所 研究員.
研究テーマ:光合成関連タンパク質の構造および機能.
抱負:“お母さん”であることも“研究者”であることも精一杯楽しみたい
栗栖 源嗣(Genji Kurisu)
大阪大学蛋白質研究所 教授.
研究室URL:http://www.protein.osaka-u.ac.jp/crystallography/
© 2018 河合 (久保田) 寿子・栗栖源嗣 Licensed under CC 表示 2.1 日本
(大阪大学蛋白質研究所 蛋白質結晶学研究室)
email:河合 (久保田) 寿子,栗栖源嗣
DOI: 10.7875/first.author.2018.046
X-ray structure of an asymmetrical trimeric ferredoxin-photosystem I complex.
Hisako Kubota-Kawai, Risa Mutoh, Kanako Shinmura, Pierre Sétif, Marc M. Nowaczyk, Matthias Rögner, Takahisa Ikegami, Hideaki Tanaka, Genji Kurisu
Nature Plants, 4, 218-224 (2018)
要 約
ヒトを含む地球上のほとんどすべての生物は,光合成によりつくられた有機物を利用して生命活動している.光合成において無機酸化物を還元する還元力を生じているのは光化学系Iである.光化学系Iにより生じた還元力は電子伝達タンパク質であるフェレドキシンを介し生体のさまざまな還元同化酵素に分配される.光化学系Iは光エネルギーを利用して有機物を合成するための還元力を供給しており,光化学系Iからフェレドキシンへ効率のよく電子を伝達することが要求される.光化学系Iおよびフェレドキシンの構造生物学的な研究の歴史は古く,フェレドキシンの最初の高分解能での構造は1980年,光化学系Iの立体構造は2001年に報告された.しかし,どのようなしくみにより光化学系Iからフェレドキシンへと効率よく電子がうけわたされるのか,という問いに対する答えはでていなかった.この研究において,筆者らは,光化学系Iおよびフェレドキシンが機能する複合体の状態における立体構造を解き明かすことにより,タンパク質のあいだの分子認識の機構および複合体の形成により誘起される構造の変化をとらえることをめざした.最終的に,光化学系Iとフェレドキシンとの複合体の結晶構造を4.2Å分解能で決定し,これまで確定されていなかった光化学系Iにおけるフェレドキシンの結合部位が特定され,光化学系Iおよびフェレドキシンの酸化還元中心は電子の伝達に適した距離に配置されていること,また,その周辺は疎水的な環境になっていることが明らかにされた.さらに,複合体の形成により誘起される光化学系Iの構造の変化をとらえることにより,光化学系Iおよびフェレドキシンの単独の構造からは導き出せない,PsaFを介した細胞質側とルーメン側とのクロストークの可能性を示唆する構造や,光化学系I三量体のおのおののプロトマーが協調して集光するという植物生理学的な報告を支持する構造の情報が得られた.この研究において明らかにされた光化学系Iとフェレドキシンとの複合体の構造により,フェレドキシンは光化学系Iを酸化するだけでなく,光化学系Iの全体の構造に変化をひき起こすことにより光化学系Iの機能を微調整する可能性が見い出された.
はじめに
光合成生物のもつ無機酸化物から有機化合物をつくりだす能力はきわめて重要である.生命を特徴づける炭素,窒素,硫黄などの元素は大気や土壌に二酸化炭素や硝酸などの無機酸化物として存在する.生物がこれら無機物を糖やアミノ酸のような有機物として利用するには,それらを還元し同化する必要がある.そのための強力な還元力を生じているのは,植物,藻類,シアノバクテリアのチラコイド膜に存在する光化学系Iである.生体における多種多様な還元同化酵素,たとえば,フェレドキシン-NADP+還元酵素,亜硝酸還元酵素,亜硫酸還元酵素,フェレドキシン-チオレドキシン還元酵素,グルタミン酸合成酵素,ヒドロゲナーゼなどは,光化学系Iから生じた還元力を必要とするが,光化学系Iから直接には電子をうけとることができない.光化学系Iに結合して電子をうけとることができるのは電子伝達タンパク質であるフェレドキシンだけである.つまり,光化学系Iを基点とした生体における還元力の分配はフェレドキシンに依存しており,フェレドキシンには光化学系Iから高い効率で電子をうけとるしくみが必要とされる.
これまで,光化学系Iや還元同化酵素などフェレドキシンに依存性の多くの酵素について,単体での立体構造の情報が蓄積されてきた.そして,これらの構造の情報をもとに変異体が作製され,複合体の形成に対する理解が深められてきた.しかし,これらのタンパク質は生体において電子伝達複合体を形成して生理的な機能を発揮する.そこで,実際にはたらいている複合体の状態で構造を解析し,タンパク質のあいだの相互作用を直接的にみる試みがなされてきた.たとえば,これまでにNMR法やX線結晶構造解析法を駆使して,フェレドキシンとフェレドキシン-NADP+還元酵素1),フェレドキシンと亜硝酸還元酵素2),フェレドキシンと亜硫酸還元酵素3),フェレドキシンとフェレドキシン-チオレドキシン還元酵素4),などの複合体の構造が解析されてきた.これらの構造の情報を相互に比較したところ,フェレドキシンはそれぞれ個別に複合体を形成しており,統一的な構造の基盤は存在しないことがわかってきた.さらに,複合体の構造解析からは,複合体の形成により誘起される構造の変化,ドメインのあいだの相対配置の調整,配位様式の変化など,単体の構造からは得られない新規の知見が得られた.しかし,フェレドキシンが電子を分配する下流の構造の情報は蓄積してきたものの,上流にあたる光化学系Iからフェレドキシンへの電子の伝達の詳細は解明されていなかった.可溶性タンパク質どうしの構造解析とは異なり,光化学系Iが光に弱い巨大膜タンパク質であることも,複合体の構造解析の難易度をあげていたと考えられる.この研究において,筆者らは,光化学系Iとフェレドキシンとの電子伝達複合体の形成を直接とらえることをめざし,光化学系Iとフェレドキシンとの複合体の結晶構造を解析した.
1.光化学系Iとフェレドキシンとの複合体の結晶化および構造の決定
好熱性シアノバクテリアThermosynechococcus elongatusの光化学系Iおよびフェレドキシンを用い,4℃,波長525 nmの弱緑光下にて精製した光化学系I三量体と組換えフェレドキシンとを混合し,蒸気拡散法にて結晶化のスクリーニングを実施した.その結果,緑色の結晶にフェレドキシンが含まれる結晶化の条件が得られた.フェレドキシンの存在はSDS-ポリアクリルアミドゲル電気泳動法により確認された.そののち,バッチ法により結晶化の条件を最適化することにより,良質な単結晶が得られた.この結晶を用いて大型放射光施設SPring-8のビームラインBL44XUにてX線回折強度データを収集し,T. elongatusの光化学系Iの構造5)(PDB ID:1JB0)をモデルとした分子置換法により初期位相を決定し,4.3Å分解能で結晶構造を決定した.しかしながら,フェレドキシンの酸化還元中心にある鉄の異常散乱シグナルは確認されたものの,フェレドキシンのタンパク質の部分の電子密度は主鎖の構造を明らかにできるレベルにはなかった.これは,光化学系Iとフェレドキシンとの複合体は弱い相互作用で過渡的に形成され,電子がうけわたされるとただちに解離する不安定な複合体であることに起因すると考えた.
この問題を解決するため,フェレドキシンの鉄をガリウムに置換した.ガリウム置換フェレドキシンは酸化型の野生型フェレドキシンとほぼ同じ構造をとり,フェレドキシンに依存性の酵素を認識して結合する能力はもつが電子伝達の活性はもたないこと6),また,解離定数が野生型フェレドキシンよりも小さいことが報告されている7).このガリウム置換フェレドキシンを利用したことがブレークスルーとなり,フェレドキシンのタンパク質の部分の主鎖の構造までが明らかにされた光化学系Iとフェレドキシンとの複合体の全体構造が4.2Å分解能で決定された(PDB ID:5ZF0,図1).結晶の非対称単位には,生物学的な単位である光化学系I三量体が2分子およびフェレドキシンが6分子,あわせて2.2 MDa,78個のタンパク質サブユニットが含まれていた.2分子の光化学系I三量体はルーメン側どうしがむかいあうようにパッキングされており,上側の光化学系I三量体に含まれるフェレドキシンをフェレドキシン1~フェレドキシン3,下側の光化学系I三量体に含まれるフェレドキシンをフェレドキシン4~フェレドキシン6とした.上下の複合体はほぼ変わらない構造をしていたため,以下は,上側の光化学系I-フェレドキシン複合体の構造について記述する.
2.光化学系Iとフェレドキシンとの複合体の構造
これまでの部位特異的な変異体を用いた研究により,フェレドキシンは光化学系Iの表在性タンパク質PsaC,PsaD,PsaEと相互作用して結合するとされてきた8,9).しかしながら,光化学系Iとフェレドキシンとの複合体の結晶構造において,フェレドキシン1~フェレドキシン3はすべてPsaC,PsaE,また,反応中心膜タンパク質であるPsaAが形成するポケットと結合しており,PsaDはフェレドキシンとの直接の接点をもたなかった.これは,PsaDの酸性残基に変異を導入すると結合に大きな影響がでるとする報告10) とは相反する一方,塩基性残基に変異を導入した際に影響が小さいこととは矛盾しない結果となった.また,近年,細胞質側に存在する集光タンパク質であるフィコビリソームはPsaAの一部およびPsaDと結合すると報告されており,フェレドキシンとフィコビリソームの結合は競合しないと理解することもでき,このモデルを支持する結果と考えられた.
光化学系Iとフェレドキシンとが相互作用する表面は,どの光化学系Iプロトマーにおいても金属中心の近傍の疎水的な領域とそれを半月状にとりまく静電的な相互作用および水素結合により複合体を安定化する領域とに分けられた.中心金属であるフェレドキシンの[2Ga-2S]クラスターは,PsaCのFB([4Fe-4S]クラスター)とむかいあって位置していた.おのおのの光化学系Iプロトマーの金属クラスターとフェレドキシンの[2Ga-2S]クラスターとのあいだの距離には8.3Åから9.6Åの開きがあり,フェレドキシン3の[2Ga-2S]クラスターがFBともっとも近い位置に存在していた.また,フェレドキシンの異常分散差フーリエマップのピークの高さにも違いがあり,フェレドキシン3の値がもっとも高かった.これらのことから,フェレドキシン3はフェレドキシン1あるいはフェレドキシン2と比べ光化学系Iと強固に結合することが示唆された.これら金属中心の周辺は,フェレドキシンとPsaCのFBとのあいだで直接的に電子が伝達されるのに適した疎水的な環境になっていた.フェレドキシン3の場合は,相互作用するアミノ酸残基の数がフェレドキシン1あるいはフェレドキシン2よりも多く,フェレドキシンの5残基およびPsaCの6残基が関与していた.この金属中心をとりまく疎水的な領域は,フェレドキシンとPsaAおよびPsaEとの静電的な相互作用および水素結合にとりかこまれていた.この極性残基による相互作用については,フェレドキシン1~フェレドキシン3とPsaAおよびPsaEとのあいだで相互作用するアミノ酸残基の数に大きな違いはなく,複合体の構造の安定化に寄与していた.このような階層的な相互作用の様式をとることにより,光化学系Iからフェレドキシンへの効率のよい電子伝達が達成されると考えられた.
さらに,NMRによる転移交差飽和法により,溶液における光化学系Iとフェレドキシンとの相互作用を検証した.この方法では,2Hにより標識したフェレドキシンを利用することで,光化学系Iと相互作用するフェレドキシンの残基が特定される.酸化型のフェレドキシンでは鉄の常磁性効果により[2Fe-2S]クラスターの周辺のシグナルが検出されないため,同じように光化学系Iと相互作用するガリウム置換フェレドキシンを使用した.その結果,結晶において光化学系Iと相互作用するフェレドキシンのアミノ酸残基は,溶液においてもほとんど同じように相互作用することが示された.このように,X線結晶構造解析にくわえ,溶液における相互作用を検証できるNMR法を相補的に併用することにより,信頼性の高い情報が得られた.
3.フェレドキシンの結合に由来する光化学系Iの構造の変化
フェレドキシンが結合していない光化学系I三量体の構造は,結晶学的な3回軸にのるため三量体は完全に等価である.一方,光化学系Iとフェレドキシンとの複合体の構造においては,非結晶学的な単位に2組の三量体が入るため,構成するおのおのの分子にはある程度の非等価性が許容される.実際,3回対称からずれた角度を算出すると,反応中心タンパク質であるPsaAはおのおののプロトマーにおいてほとんど3回回転対称の位置にあったのに対し,フェレドキシン1~フェレドキシン3は明らかに3回回転対称からはずれていた.さらに,おのおののプロトマーの境目に存在するPsaIも同様に3回回転対称からはずれていた.このことから,光化学系I三量体はフェレドキシンとの結合の情報を共有し全体の構造を順番に微調整して,協調して機能する可能性が想定された.実際に,フェレドキシンの結合により光化学系I三量体の3つあるプロトマーの間隔が縮まったり広がったりする構造の変化がひき起こされた(図2 a, b).これは,おのおののプロトマーのあいだで光エネルギーを共有し,三量体が全体として効率よく電荷を分離するための構造の変化とも考えられた11).さらに,フェレドキシンが結合することにより,チラコイド膜を隔てた細胞質側とルーメン側をつなぐ,垂直方向の構造の変化もひき起こされていた.フェレドキシンが光化学系Iの表在性タンパク質PsaCおよびPsaEと結合することにより,それらのタンパク質が光化学系I三量体の外側にむかい移動する.さらに,PsaCおよびPsaEの動きはフェレドキシンとは直接に相互作用していない膜貫通サブユニットPsaFにも伝達され,光化学系I三量体の外側にそってチラコイド膜を縦断し,構造の変化は最終的にルーメン側まで到達していた.PsaFのN末端の近傍は光化学系Iを還元するシトクロムc6と結合する部位であることから,光化学系IはPsaFを介して膜の内外の酸化還元タンパク質との結合の情報を共有する可能性が示唆され,これをPsaFピストンモデルとして提唱した(図2c).
おわりに
この研究により明らかにされた光化学系Iとフェレドキシンとの複合体の構造により,光化学系Iからフェレドキシンへと電子を効率よくうけわたすための構造の基盤が解き明かされた.さらに,フェレドキシンの結合は単純に電子を受容するだけでなく,光化学系Iの全体に構造の変化をひき起こし,効率のよい酸化還元反応および集光反応のため微調整をしている可能性が見い出された.光化学系Iと相互作用するタンパク質としては,ほかに光化学系Iを還元するシトクロムc6およびプラストシアニンとよばれる小型の電子伝達タンパク質がある.しかし,それらが光化学系Iと結合する際に光化学系Iの構造に変化をひき起こすかどうかについては調べられていない.たとえば,PsaFを介したルーメン側から細胞質側への結合の情報の伝達などにも興味がもたれる.今後,光化学系Iと光化学系Iを還元するタンパク質との複合体の構造解析が進むことにより,光化学系Iの酸化還元反応の包括的な理解につながることを期待している.
文 献
- Kurisu, G., Kusunoki, M., Katoh, E. et al.: Structure of the electron transfer complex between ferredoxin and ferredoxin-NADP+ reductase. Nat. Struct. Biol., 8, 117-121 (2001)[PubMed]
- Sakakibara, Y., Kimura, H., Iwamura, A. et al.: A new structural insight into differential interaction of cyanobacterial and plant ferredoxins with nitrite reductase as revealed by NMR and X-ray crystallographic studies. J. Biochem., 151, 483-492 (2012)[PubMed]
- Kim, J. Y., Nakayama, M., Toyota, H. et al.: Structural and mutational studies of an electron transfer complex of maize sulfite reductase and ferredoxin. J. Biochem., 160, 101-109 (2016)[PubMed]
- Dai, S., Friemann, R., Glauser, D. A. et al.: Structural snapshots along the reaction pathway of ferredoxin-thioredoxin reductase. Nature, 448, 92-96 (2007)[PubMed]
- Jordan, P., Fromme, P., Witt, H. T. et al.: Three-dimensional structure of cyanobacterial photosystem I at 2.5Å resolution. Nature, 411, 909-917 (2001)[PubMed]
- Mutoh, R., Muraki, N., Shinmura, K. et al.: X-ray structure and nuclear magnetic resonance analysis of the interaction sites of the Ga-substituted cyanobacterial ferredoxin. Biochemistry, 54, 6052-6061 (2015)[PubMed]
- Mignee, C., Mutoh, R., Krieger-Liszkay, A. et al.: Gallium ferredoxin as a tool to study the effects of ferredoxin binding to photosystem I without ferredoxin reduction. Photosynth. Res., 134, 251-263 (2017)[PubMed]
- Fischer, N., Setif, P. & Rochaix, J. D.: Site-directed mutagenesis of the PsaC subunit of photosystem I. FB is the cluster interacting with soluble ferredoxin. J. Biol. Chem., 274, 23333-23340 (1999)[PubMed]
- Barth, P., Guillouard, I., Setif, P. et al.: Essential role of a single arginine of photosystem I in stabilizing the electron transfer complex with ferredoxin. J. Biol. Chem., 275, 7030-7036 (2000)[PubMed]
- Bottin, H., Hanley, J. & Lagoutte, B.: Role of acidic amino acid residues of PsaD subunit on limiting the affinity of photosystem I for ferredoxin. Biochem. Biophys. Res. Commun.. 287, 833-836 (2001)[PubMed]
- Baker, D. R., Manocchi, A. K., Lamicq, M. L. et al.: Comparative photoactivity and stability of isolated cyanobacterial monomeric and trimeric Photosystem I. J. Phys. Chem. B., 118, 2703-2711 (2014)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2010年 東京大学大学院総合文化研究科博士課程 修了,同年 大阪大学蛋白質研究所 研究員を経て,2015年より基礎生物学研究所 研究員.
研究テーマ:光合成関連タンパク質の構造および機能.
抱負:“お母さん”であることも“研究者”であることも精一杯楽しみたい
栗栖 源嗣(Genji Kurisu)
大阪大学蛋白質研究所 教授.
研究室URL:http://www.protein.osaka-u.ac.jp/crystallography/
© 2018 河合 (久保田) 寿子・栗栖源嗣 Licensed under CC 表示 2.1 日本