ヒトの中枢神経系およびニューロンにおけるTauの代謝の機構
佐藤 千尋
(米国Washington大学School of Medicine,Department of Neurology)
email:佐藤千尋
DOI: 10.7875/first.author.2018.045
Tau kinetics in neurons and the human central nervous system.
Chihiro Sato, Nicolas R. Barthélemy, Kwasi G. Mawuenyega, Bruce W. Patterson, Brian A. Gordon, Jennifer Jockel-Balsarotti, Melissa Sullivan, Matthew J. Crisp, Tom Kasten, Kristopher M. Kirmess, Nicholas M. Kanaan, Kevin E. Yarasheski, Alaina Baker-Nigh, Tammie L.S. Benzinger, Timothy M. Miller, Celeste M. Karch, Randall J. Bateman
Neuron, 97, 1284-1298.e7 (2018)
Tauは微小管と結合する細胞内タンパク質であるが,近年,細胞の外にも恒常的に微量が分泌されることが明らかにされた.また,脳骨髄液におけるTauの濃度は認知機能の低下にともない微量ではあるが変動し,タウオパチーと総称されるアルツハイマー病やそのほかTauの異常な蓄積を原因とする神経変性疾患におけるバイオマーカーとして注目されている.しかし,なぜアルツハイマー病においてTauおよびリン酸化Tauが増加するのか,その代謝の機構は明らかにされていない.また,Tauには異なる6種類のアイソフォームが存在し,微小管結合領域に存在するリピートの数により3リピートTauと4リピートTauに大別され,タウオパチーも脳に蓄積するアイソフォームにより分類されるが,これらアイソフォームの細胞における代謝の機構も不明であった.この研究において,筆者らは,ヒトのiPS細胞から分化させたニューロンにおいてTauの代謝回転率を測定し,リン酸化Tauおよび4リピートTauは,非リン酸化Tauおよび3リピートTauに比べ,迅速に代謝されることを明らかにした.さらに,ヒトの中枢神経系におけるTauの半減期は約23日と計算された.そして,アルツハイマー病の患者においてTauの合成率が促進されていることが明らかにされた.
アルツハイマー病は老年期認知症の原因としてもっとも頻度の高い神経変性疾患であり,病因の解明また早期の治療法および予防法の確立は社会的な急務である.アルツハイマー病は老化した脳に異常に蓄積するアミロイド斑および神経原繊維変化を病理学的な特徴とし,その構成タンパク質はアミロイドβタンパク質およびTauである.アミロイドβタンパク質はニューロンなどから細胞の外に分泌されシナプスの障害や細胞毒性を発揮することが示されており,クリアランスの低下による脳におけるアミロイドβタンパク質の濃度の上昇(および,それにともなう脳骨髄液における濃度の低下)と病態との相関が示唆されている.一方,Tauは神経軸索に存在する微小管結合タンパク質でありおもに細胞に蓄積するが,近年,細胞の外にも恒常的に微量が分泌されることが明らかにされた1-3).また,脳骨髄液におけるTauの濃度は認知機能の低下にともない微量ではあるが上昇し,アミロイドβタンパク質よりも認知機能の低下との強い相関がみられることから,タウオパチーと総称されるアルツハイマー病やそのほかTauの異常な蓄積を原因とする神経変性疾患におけるバイオマーカーとして注目されている.しかし,Tauのクリアランスおよび代謝の機構については明らかにされておらず,その解明が待ち望まれていた.Tauのヒトにおける半減期や代謝の機構の情報は,近年,とくに注目をあつめているTauを標的とした治療法の開発や臨床試験の有効性の評価において重要な知見をもたらすものと考えられる.
この研究において,筆者らは,アルツハイマー病を含むタウオパチーの患者においてTauのクリアランスおよび代謝に異常が起こっているという仮説をたて,これを検証するため,Tauの代謝回転率の測定法としてSILK法を適用した.そして,ヒトのiPS細胞から分化させたニューロンおよびヒト被験者においてTauの代謝の機構を解析した.
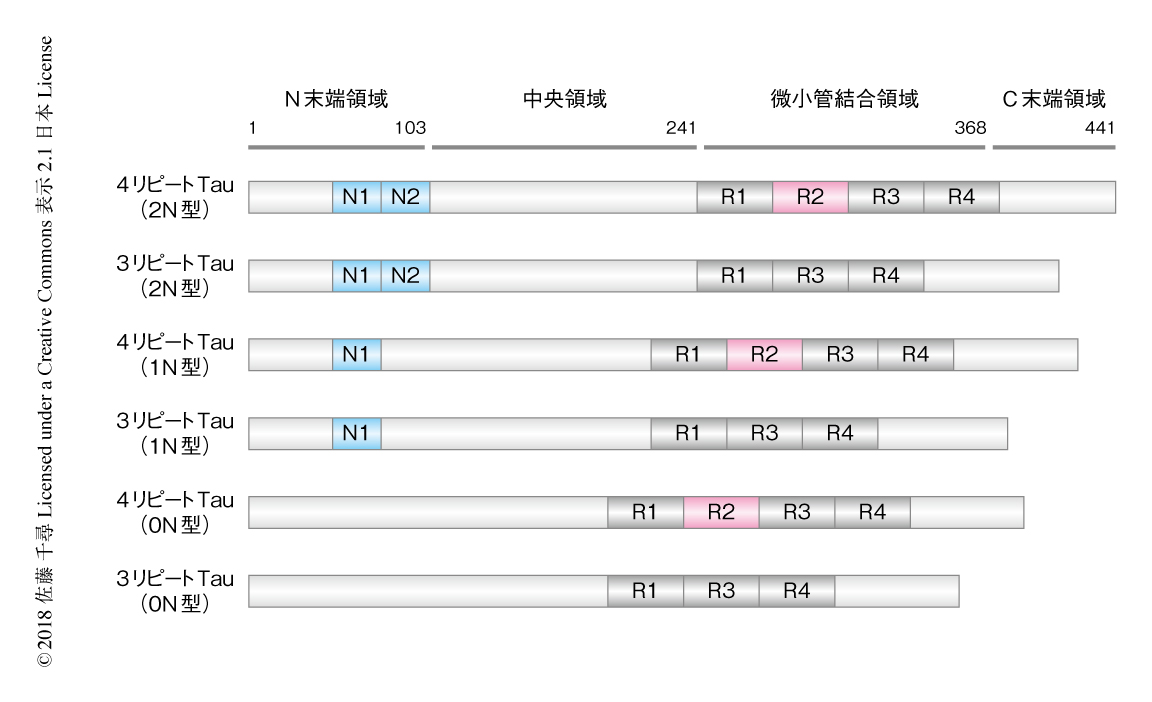
筆者らの研究室においては,非放射性同位体を用いてヒトの中枢神経系においてアミロイドβタンパク質の代謝回転率を測定するSILK(stable isotope labeling kinetics)法を開発し,過去10年間にわたり300人以上のアルツハイマー病の患者およびその家族の協力を得てアミロイドβタンパク質の代謝の機構を解析してきた4-6).この研究において,SILK法をはじめてTauに適用したが,その際,アミロイドβタンパク質と異なりTauは巨大なタンパク質であること,アミロイドβタンパク質よりさらに微量しか脳骨髄液に存在しないこと,3リピートTauと4リピートTauに分類されるほか合計6種類のアイソフォームが存在し(図1),また,翻訳後修飾をうけることなどにより,非常にチャレンジングなプロジェクトであった.しかし,さまざまな抗Tau抗体を用いた免疫沈降法と最新の計器を用いた質量分析法との組合せ,および,大幅な改良により,非放射性同位体13C6-ロイシンにより約0.1%まで標識されたTauの検出に成功した.これは,従来の類似した質量分析法による解析と比べ約20倍の改善に値した7-9).
SILK法により標識されたヒトの脳および脳骨髄液のTauを解析するまえに,免疫沈降法および最新の質量分析法を用いて,ヒトの脳および脳骨髄液におけるTauのアイソフォームおよび欠損などを定量的に解析した.これまで,多数の研究グループにより,ヒトやマウスの脳あるいは脳骨髄液におけるTauの解析が報告されてきたが,この研究においては,格段に改善された解像度および定量性をもって脳および脳骨髄液を並行して解析した.また,ヒトiPS細胞から分化させたニューロンはトランスレーショナルなモデルとして注目されてきたが,このiPS細胞に由来するニューロンの内部および外部におけるTauの定量的な解析も実施した.その結果,脳(および,ニューロンの内部)に存在するTauはおもに全長型であったのに対し,脳骨髄液(および,ニューロンの外部)に存在するTauは中央領域と微小管結合領域とのあいだで切断が起こっておりN末端側のみが検出された.この結果から,iPS細胞から分化させたニューロンのトランスレーショナルなモデルとしての有効性が支持された.ただし,すでに複数の研究グループにより報告されているとおり,iPS細胞から分化させたニューロンにおいては成熟型のニューロンにおいて多く発現するとされる4リピートTauが顕著に減少していた.
ヒトのiPS細胞から分化させたニューロンにおいて,SILK法を用いてTauの代謝回転率を測定した.Tauの変異をもたない健常者から得たiPS細胞を神経幹細胞をへてニューロンに分化させ,13C6-ロイシンにより2週間にわたり標識し(パルス),そののちの21日間,3日ごとに細胞および培養液を回収した(チェイス).標識されたTauと標識されていないTauの比率から半減期を計算した結果,細胞内のTauおよび細胞外のTauの半減期はともに約6日間で,細胞外のTauは細胞内のTauから3日おくれたかたちで代謝曲線をかくことが明らかにされた.この結果から,Tauは約3日間かけて細胞外へと分泌され,代謝回転率は細胞の内外で変わらないことが示唆された.この3日の分泌の遅延は切断型のTauのみにみられ,全長型のTauは合成ののちすぐに分泌されることが示唆された.さらに,リン酸化Tauおよび4リピートTauは,非リン酸化Tauおよび3リピートTauに比べ,迅速に代謝された.リン酸化Tauおよび4リピートTauはアルツハイマー病および4リピートタウオパチーに関与することから,今後,これらの疾患との関連性を検討する必要があろう.
ヒト被験者においてTauの代謝回転率を測定した.これまでのマウスにおける実験などから,Tauはアミロイドβタンパク質(半減期は約9時間)とは異なり,2週間ほどの半減期が予測された10,11).よって,被験者には13C6-ロイシンを10日間にわたり経口投与あるいは16時間にわたり静脈投与したのち,約4カ月のあいだ計5回,腰椎穿刺により脳骨髄液および血液を採取した.その結果,計10人の健康なヒト(平均年齢は50歳代)においてTauの半減期は約23日であることが示された.
定期的に認知機能の評価,および,アミロイドβタンパク質およびTauのPETイメージングを実施している,計24人のアルツハイマー病の患者および対照(平均年齢は70歳代)においてTauの代謝回転率を測定した.その結果,アミロイドβタンパク質のPETイメージングが陽性のグループと陰性のグループとでTauのクリアランスに差はみられなかったが,Tauの合成率とアミロイドβタンパク質のPETメージングのあいだに正の相関関係がみられた.
Tauを標的としたアルツハイマー病およびほかのタウオパチーの治療法の開発,臨床試験のデザイン,結果の評価をするにあたり,この研究において明らかにされたヒトにおけるTauの半減期,また,標的とするTauの種類による代謝率の違いは重要な知見となるだろう.現在,筆者ら研究室において,100人の被験者に対するSILK法によるTauの解析を進めており,結果は数年後に報告する予定である.
略歴:2008年 東京大学大学院薬学系研究科博士課程 修了,同年 米国Washington大学School of Medicine博士研究員を経て,2014年より同Research Instructor.
研究テーマ:Tauの代謝の機構,アルツハイマー病,タウオパチー.
© 2018 佐藤 千尋 Licensed under CC 表示 2.1 日本
(米国Washington大学School of Medicine,Department of Neurology)
email:佐藤千尋
DOI: 10.7875/first.author.2018.045
Tau kinetics in neurons and the human central nervous system.
Chihiro Sato, Nicolas R. Barthélemy, Kwasi G. Mawuenyega, Bruce W. Patterson, Brian A. Gordon, Jennifer Jockel-Balsarotti, Melissa Sullivan, Matthew J. Crisp, Tom Kasten, Kristopher M. Kirmess, Nicholas M. Kanaan, Kevin E. Yarasheski, Alaina Baker-Nigh, Tammie L.S. Benzinger, Timothy M. Miller, Celeste M. Karch, Randall J. Bateman
Neuron, 97, 1284-1298.e7 (2018)
要 約
Tauは微小管と結合する細胞内タンパク質であるが,近年,細胞の外にも恒常的に微量が分泌されることが明らかにされた.また,脳骨髄液におけるTauの濃度は認知機能の低下にともない微量ではあるが変動し,タウオパチーと総称されるアルツハイマー病やそのほかTauの異常な蓄積を原因とする神経変性疾患におけるバイオマーカーとして注目されている.しかし,なぜアルツハイマー病においてTauおよびリン酸化Tauが増加するのか,その代謝の機構は明らかにされていない.また,Tauには異なる6種類のアイソフォームが存在し,微小管結合領域に存在するリピートの数により3リピートTauと4リピートTauに大別され,タウオパチーも脳に蓄積するアイソフォームにより分類されるが,これらアイソフォームの細胞における代謝の機構も不明であった.この研究において,筆者らは,ヒトのiPS細胞から分化させたニューロンにおいてTauの代謝回転率を測定し,リン酸化Tauおよび4リピートTauは,非リン酸化Tauおよび3リピートTauに比べ,迅速に代謝されることを明らかにした.さらに,ヒトの中枢神経系におけるTauの半減期は約23日と計算された.そして,アルツハイマー病の患者においてTauの合成率が促進されていることが明らかにされた.
はじめに
アルツハイマー病は老年期認知症の原因としてもっとも頻度の高い神経変性疾患であり,病因の解明また早期の治療法および予防法の確立は社会的な急務である.アルツハイマー病は老化した脳に異常に蓄積するアミロイド斑および神経原繊維変化を病理学的な特徴とし,その構成タンパク質はアミロイドβタンパク質およびTauである.アミロイドβタンパク質はニューロンなどから細胞の外に分泌されシナプスの障害や細胞毒性を発揮することが示されており,クリアランスの低下による脳におけるアミロイドβタンパク質の濃度の上昇(および,それにともなう脳骨髄液における濃度の低下)と病態との相関が示唆されている.一方,Tauは神経軸索に存在する微小管結合タンパク質でありおもに細胞に蓄積するが,近年,細胞の外にも恒常的に微量が分泌されることが明らかにされた1-3).また,脳骨髄液におけるTauの濃度は認知機能の低下にともない微量ではあるが上昇し,アミロイドβタンパク質よりも認知機能の低下との強い相関がみられることから,タウオパチーと総称されるアルツハイマー病やそのほかTauの異常な蓄積を原因とする神経変性疾患におけるバイオマーカーとして注目されている.しかし,Tauのクリアランスおよび代謝の機構については明らかにされておらず,その解明が待ち望まれていた.Tauのヒトにおける半減期や代謝の機構の情報は,近年,とくに注目をあつめているTauを標的とした治療法の開発や臨床試験の有効性の評価において重要な知見をもたらすものと考えられる.
この研究において,筆者らは,アルツハイマー病を含むタウオパチーの患者においてTauのクリアランスおよび代謝に異常が起こっているという仮説をたて,これを検証するため,Tauの代謝回転率の測定法としてSILK法を適用した.そして,ヒトのiPS細胞から分化させたニューロンおよびヒト被験者においてTauの代謝の機構を解析した.
1.Tauに対するSILK法の確立
筆者らの研究室においては,非放射性同位体を用いてヒトの中枢神経系においてアミロイドβタンパク質の代謝回転率を測定するSILK(stable isotope labeling kinetics)法を開発し,過去10年間にわたり300人以上のアルツハイマー病の患者およびその家族の協力を得てアミロイドβタンパク質の代謝の機構を解析してきた4-6).この研究において,SILK法をはじめてTauに適用したが,その際,アミロイドβタンパク質と異なりTauは巨大なタンパク質であること,アミロイドβタンパク質よりさらに微量しか脳骨髄液に存在しないこと,3リピートTauと4リピートTauに分類されるほか合計6種類のアイソフォームが存在し(図1),また,翻訳後修飾をうけることなどにより,非常にチャレンジングなプロジェクトであった.しかし,さまざまな抗Tau抗体を用いた免疫沈降法と最新の計器を用いた質量分析法との組合せ,および,大幅な改良により,非放射性同位体13C6-ロイシンにより約0.1%まで標識されたTauの検出に成功した.これは,従来の類似した質量分析法による解析と比べ約20倍の改善に値した7-9).
2.ヒトの脳,脳骨髄液,iPS細胞から分化させたニューロンにおけるTauの解析
SILK法により標識されたヒトの脳および脳骨髄液のTauを解析するまえに,免疫沈降法および最新の質量分析法を用いて,ヒトの脳および脳骨髄液におけるTauのアイソフォームおよび欠損などを定量的に解析した.これまで,多数の研究グループにより,ヒトやマウスの脳あるいは脳骨髄液におけるTauの解析が報告されてきたが,この研究においては,格段に改善された解像度および定量性をもって脳および脳骨髄液を並行して解析した.また,ヒトiPS細胞から分化させたニューロンはトランスレーショナルなモデルとして注目されてきたが,このiPS細胞に由来するニューロンの内部および外部におけるTauの定量的な解析も実施した.その結果,脳(および,ニューロンの内部)に存在するTauはおもに全長型であったのに対し,脳骨髄液(および,ニューロンの外部)に存在するTauは中央領域と微小管結合領域とのあいだで切断が起こっておりN末端側のみが検出された.この結果から,iPS細胞から分化させたニューロンのトランスレーショナルなモデルとしての有効性が支持された.ただし,すでに複数の研究グループにより報告されているとおり,iPS細胞から分化させたニューロンにおいては成熟型のニューロンにおいて多く発現するとされる4リピートTauが顕著に減少していた.
3.ヒトのiPS細胞から分化させたニューロンにおけるTauの代謝の機構
ヒトのiPS細胞から分化させたニューロンにおいて,SILK法を用いてTauの代謝回転率を測定した.Tauの変異をもたない健常者から得たiPS細胞を神経幹細胞をへてニューロンに分化させ,13C6-ロイシンにより2週間にわたり標識し(パルス),そののちの21日間,3日ごとに細胞および培養液を回収した(チェイス).標識されたTauと標識されていないTauの比率から半減期を計算した結果,細胞内のTauおよび細胞外のTauの半減期はともに約6日間で,細胞外のTauは細胞内のTauから3日おくれたかたちで代謝曲線をかくことが明らかにされた.この結果から,Tauは約3日間かけて細胞外へと分泌され,代謝回転率は細胞の内外で変わらないことが示唆された.この3日の分泌の遅延は切断型のTauのみにみられ,全長型のTauは合成ののちすぐに分泌されることが示唆された.さらに,リン酸化Tauおよび4リピートTauは,非リン酸化Tauおよび3リピートTauに比べ,迅速に代謝された.リン酸化Tauおよび4リピートTauはアルツハイマー病および4リピートタウオパチーに関与することから,今後,これらの疾患との関連性を検討する必要があろう.
4.ヒトの中枢神経系におけるTauの代謝の機構
ヒト被験者においてTauの代謝回転率を測定した.これまでのマウスにおける実験などから,Tauはアミロイドβタンパク質(半減期は約9時間)とは異なり,2週間ほどの半減期が予測された10,11).よって,被験者には13C6-ロイシンを10日間にわたり経口投与あるいは16時間にわたり静脈投与したのち,約4カ月のあいだ計5回,腰椎穿刺により脳骨髄液および血液を採取した.その結果,計10人の健康なヒト(平均年齢は50歳代)においてTauの半減期は約23日であることが示された.
定期的に認知機能の評価,および,アミロイドβタンパク質およびTauのPETイメージングを実施している,計24人のアルツハイマー病の患者および対照(平均年齢は70歳代)においてTauの代謝回転率を測定した.その結果,アミロイドβタンパク質のPETイメージングが陽性のグループと陰性のグループとでTauのクリアランスに差はみられなかったが,Tauの合成率とアミロイドβタンパク質のPETメージングのあいだに正の相関関係がみられた.
おわりに
Tauを標的としたアルツハイマー病およびほかのタウオパチーの治療法の開発,臨床試験のデザイン,結果の評価をするにあたり,この研究において明らかにされたヒトにおけるTauの半減期,また,標的とするTauの種類による代謝率の違いは重要な知見となるだろう.現在,筆者ら研究室において,100人の被験者に対するSILK法によるTauの解析を進めており,結果は数年後に報告する予定である.
文 献
- Pooler, A. M., Phillips, E. C., Lau, D. H. W. et al.: Physiological release of endogenous tau is stimulated by neuronal activity. EMBO Rep., 14, 389-394 (2013)[PubMed]
- Karch, C. M., Jeng, A. T. & Goate, A. M.: Extracellular Tau levels are influenced by variability in Tau that is associated with tauopathies. J. Biol. Chem., 287, 42751-42762 (2012)[PubMed]
- Yamada, K., Cirrito, J. R., Stewart, F. R. et al.: In vivo microdialysis reveals age-dependent decrease of brain interstitial fluid tau levels in P301S human tau transgenic mice. J. Neurosci.,31, 13110-13117 (2011)[PubMed]
- Bateman, R. J., Munsell, L. Y., Morris, J. C. et al.: Human amyloid-β synthesis and clearance rates as measured in cerebrospinal fluid in vivo. Nat. Med., 12, 856-861 (2006)[PubMed]
- Mawuenyega, K. G., Sigurdson, W., Ovod, V. et al.: Decreased clearance of CNS β-amyloid in Alzheimer’s disease. Science, 330, 1774 (2010)[PubMed]
- Patterson, B. W., Elbert, D. L., Mawuenyega, K. G. et al.: Age and amyloid effects on human CNS amyloid-beta kinetics. Ann. Neurol., 78, 439-453 (2015)[PubMed]
- Barthelemy, N. R., Fenaille, F., Hirtz, C. et al.: Tau protein quantification in human cerebrospinal fluid by targeted mass spectrometry at high sequence coverage provides insights into its primary structure heterogeneity. J. Proteome Res., 15, 667-676 (2016)[PubMed]
- McAvoy, T., Lassman, M. E., Spellman, D. S. et al.: Quantification of tau in cerebrospinal fluid by immunoaffinity enrichment and tandem mass spectrometry. Clin. Chem., 60, 683-689 (2014)[PubMed]
- Portelius, E., Hansson, S. F., Tran, A. J. et al.: Characterization of tau in cerebrospinal fluid using mass spectrometry. J. Proteome Res., 7, 2114-2120 (2008)[PubMed]
- Price, J. C., Guan, S., Burlingame, A. et al.: Analysis of proteome dynamics in the mouse brain. Proc. Natl. Acad. Sci. USA, 107, 14508-14513 (2010)[PubMed]
- Yamada, K., Holth, J. K., Liao, F. et al.: Neuronal activity regulates extracellular tau in vivo. J. Exp. Med., 211, 387-393 (2014)[PubMed]
著者プロフィール
略歴:2008年 東京大学大学院薬学系研究科博士課程 修了,同年 米国Washington大学School of Medicine博士研究員を経て,2014年より同Research Instructor.
研究テーマ:Tauの代謝の機構,アルツハイマー病,タウオパチー.
© 2018 佐藤 千尋 Licensed under CC 表示 2.1 日本