Paneth細胞は腸管上皮幹細胞のニッチを構成していた
佐藤 俊朗
(オランダHubrecht Institute)
email:佐藤俊朗
DOI: 10.7875/first.author.2011.008
Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts.
Toshiro Sato, Johan H. van Es, Hugo J. Snippert, Daniel E. Stange, Robert G. Vries, Maaike van den Born, Nick Barker, Noah F. Shroyer, Marc van de Wetering, Hans Clevers
Nature, 469, 415-418 (2011)
Lgr5幹細胞は陰窩の底部でつねに自己複製している.最近,単一のLgr5幹細胞がin vitroで幹細胞の機能をあわせもつ細胞組織体を形成することから,腸管上皮の下に存在する線維芽細胞が幹細胞ニッチではないことが明らかになった.今回,小腸のLgr5幹細胞に密接に接着しているPaneth細胞を純化したところ,EGF,Dll4,Wnt3などの幹細胞増殖因子を発現していることを見い出した.さらに,Paneth細胞はおもにWntの産生を介してLgr5幹細胞の幹細胞機能の維持を強力にサポートしていることがわかった.また,Paneth細胞を遺伝子操作により減少または欠損させたマウスでは相関してLgr5幹細胞が減少または消失することから,Paneth細胞が腸管上皮幹細胞のニッチとして機能していることがわかった.
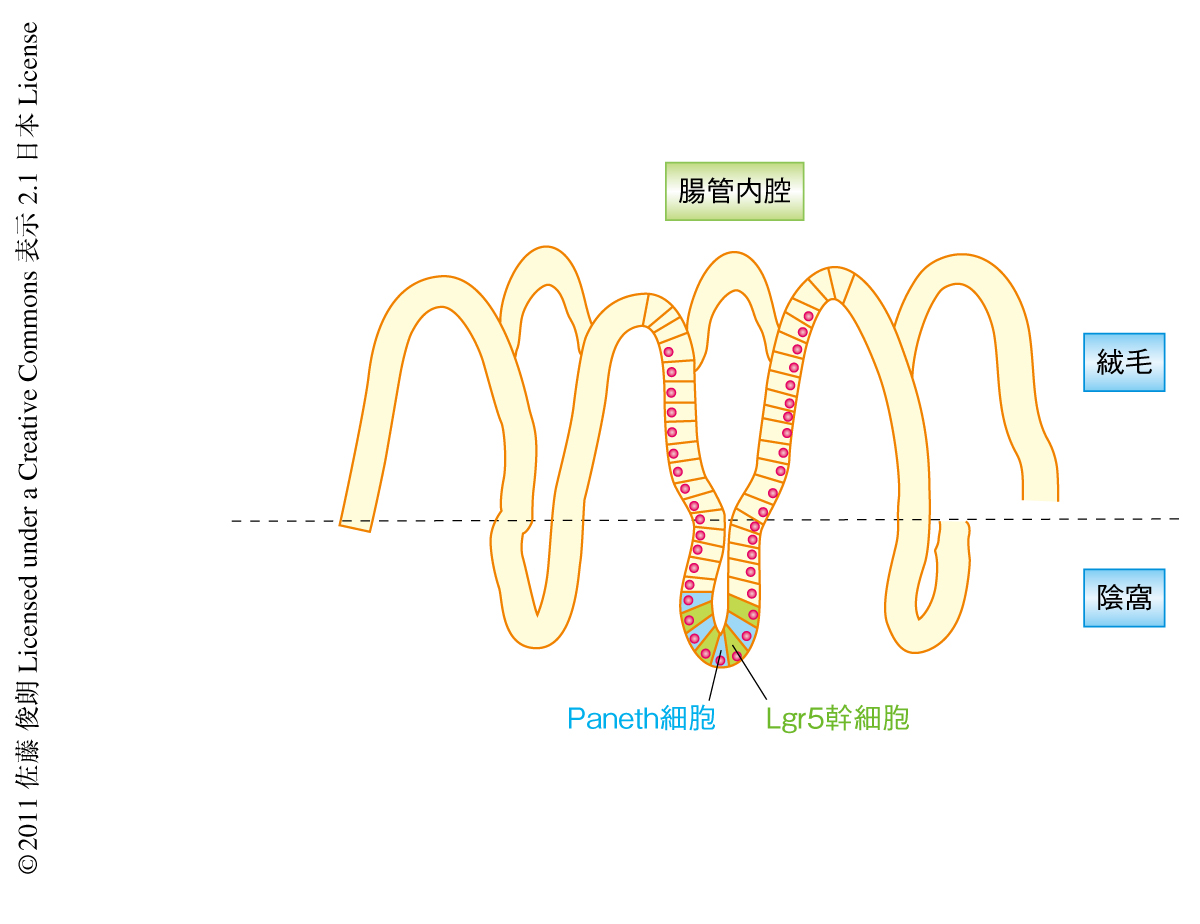
小腸の腸管上皮は腸管の内腔を単層でおおっており,その組織学的な構造は幹細胞のヒエラルキーを反映している.腸管上皮は絨毛と陰窩の2つのコンパートメントから構成されており,陰窩は未分化な増殖細胞からなり分化とともに絨毛へと移動していく.絨毛の細胞は2~3日でその先端からはがれおちていく(図1).腸管上皮には吸収上皮細胞,杯細胞,腸管上皮内分泌細胞,Paneth細胞の4種類の分化細胞がある.なかでも,Paneth細胞は陰窩の底部に存在し抗菌物質の産生により腸管内腔を細菌から守っているものと考えられている.
近年,Paneth細胞にはさまれたかたちで存在する陰窩底部円柱細胞(crypt base columnar cell,CBC細胞)について,この細胞に特異的に発現するLgr5遺伝子を利用した遺伝学的な細胞系譜の追跡により,CBC細胞は永続的に自己複製とすべての分化細胞の産生とを行っていることがわかった1).この結果から,CBC細胞は腸管上皮幹細胞であることが実証された.ここでは,CBC細胞をLgr5幹細胞と呼称することにする.従来,腸管上皮幹細胞は非対称性の幹細胞分裂(ひとつの幹細胞が分裂ののち,幹細胞と分化細胞となる)を行い幹細胞の数を一定に保っていると考えられてきた.最近,遺伝学的な細胞系譜の追跡と生物物理学的な解析により,Lgr5幹細胞は陰窩の底部で頻繁に対称性の幹細胞分裂(ひとつの幹細胞が分裂ののち,2つの幹細胞となる)を行っていて,陰窩の底部に残った細胞のみが幹細胞能を保ち,この領域から排出された細胞は分化してしまっていることがわかった2).つまり,陰窩の底部に幹細胞の維持のための微小環境(ニッチ)が存在し,このニッチが幹細胞の数を一定に保っていることがわかったのである.しかしながら,どのようにして,また,どの細胞が幹細胞ニッチを構成しているかについてはわかっていなかった.
筆者らは,単離した陰窩をin vitroにおいて永続的に増殖させる3次元培養法(細胞組織体培養)を確立した3).細胞組織体培養において,Lgr5幹細胞は自己複製とともにすべての分化細胞を産生し,体内の腸管上皮の構造を擬似していた.単一のLgr5幹細胞から細胞組織体の形成が可能であることから,非上皮細胞は幹細胞ニッチとして必須ではないことがわかった.今回,筆者らは,上皮細胞自体がLgr5幹細胞のニッチとなっていることを見い出した.
幹細胞ニッチは幹細胞との細胞接着を介して自己複製や分化の制御を行っていることが多いことから,Lgr5幹細胞と接着している細胞に注目した.Lgr5幹細胞と接着する細胞を解析したところ,細胞の表面の90%程度はPaneth細胞と接着していることがわかった.Lgr5幹細胞は1日に1回くらい分裂するため,分裂ののちすみやかにPaneth細胞のあいだに混ざり合うことになる.さらに,この傾向は細胞組織体培養でも再現できることから,Paneth細胞はLgr5幹細胞にとって必須の細胞,つまり,ニッチとなっているという仮説をたてた.
Paneth細胞の解析を行うためその純化を試みた.Paneth細胞はCD24を高発現していたことからフローサイトメトリーによる純化に成功した.純化されたPaneth細胞のマイクロアレイ解析により,幹細胞の維持に必須な増殖因子であるEGF,TGFα,Dll4,Wnt3の発現していることがわかった.一方,これらの増殖因子の受容体であるEGF受容体,Notch1,Frizzled7などはLgr5幹細胞に発現していた.
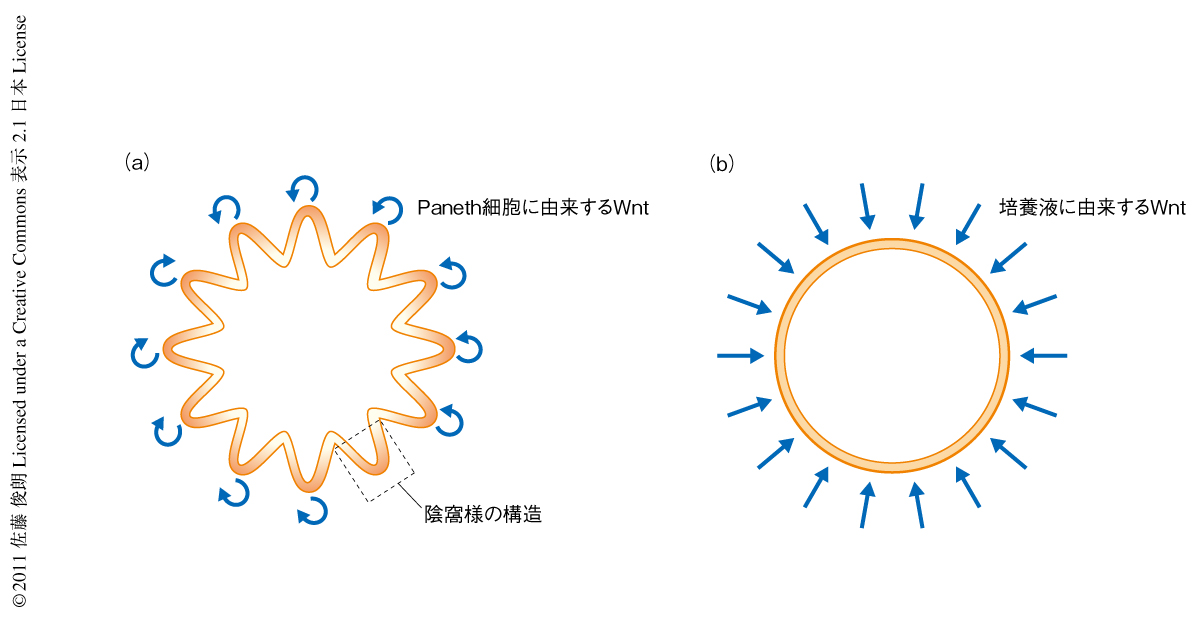
Wnt3の発現をin situハイブリダイゼーションにより解析したところ,Paneth細胞に特異的に発現していることが確認された.陰窩の細胞組織体培養ではR-spondinというWntの活性化作用をもつ増殖因子が必須である.近年,R-spondinはWnt受容体の発現を制御しており,Wntの非存在下ではその活性の認められないことが報告された4).この報告と合致して,細胞組織体では陰窩の底部,Paneth細胞の近傍の細胞だけでWntの活性化がみられた.さらに,細胞組織体に活性化Wnt阻害剤であるIWP1 5) を投与したところWntの不活性化とともに細胞は死滅した.この過程は阻害剤とともに活性化Wntを投与することで防ぐことができることから,IWP1の毒性ではなくWnt合成阻害による効果であることが確認できた.興味深いことに,Wntを培養液にくわえた場合,Wntの活性化はPaneth細胞の近傍にかぎらず,びまん性にみられた.さらに,陰窩様の構造は消失し嚢胞状の構造に変化した(図2).このことから,細胞組織体にみられる陰窩様の構造はPaneth細胞からWntを介して産生される上皮細胞に自律的に形成されることがわかった.
Paneth細胞のLgr5幹細胞への作用を調べるため,遺伝子操作により作製したRFPを発現するLgr5幹細胞とYFPを発現するPaneth細胞とを純化し,それぞれ単独あるいはいっしょに培養した.Lgr5幹細胞単独の培養では非常に低い培養効率であったが,Paneth細胞との共培養により培養効率は飛躍的に向上した.また,Lgr5幹細胞の単独培養においても同時にWntを投与することにより同様に培養効率は向上した.これらのことから,Paneth細胞はWntの産生を介してLgr5幹細胞にニッチを提供しているものと結論づけた.
これまで明らかになったPaneth細胞に依存性の幹細胞の制御機構が実際にin vivoでも存在することを確認するため,Paneth細胞の減少したマウスの腸管を解析した.Paneth細胞に特異的に毒素を発現させたCr2-Toxマウス6) や,Paneth細胞の分化タンパク質であるGfi1のノックアウトマウス7) では,Paneth細胞の数が著しく減少していることが報告されている.これらのマウスにおいてLgr5幹細胞のマーカーであるOlfm4 8) の発現を解析したところ,Paneth細胞の減少と著しく相関してLgr5幹細胞の減少していることがわかった.さらに,Paneth細胞の分化に必須の転写因子であるSox9 9) を成体マウスの腸管上皮において特異的にノックアウトした場合,Paneth細胞は経時的に欠損していくことが観察された.この実験では,薬剤による誘導により95%以上のLgr5幹細胞にCreを発現させるp450-Creマウスと,Cre依存的にSox9を欠損するコンディショナルノックアウトマウスを交配させたマウスを用いた.幹細胞は新しいPaneth細胞を生み出すことができず,Paneth細胞の寿命である2ヶ月をすぎるとほぼすべての陰窩においてPaneth細胞は消失した.興味深いことに,このようなPaneth細胞を完全に欠損した陰窩ではLgr5幹細胞も同時に消失していた.ただし,Sox9を欠損しなかった野生型の陰窩はPaneth細胞をもっており,これらの陰窩は非常に速く増殖していた.
驚くべきことに,これらの野生型の陰窩はSox9を欠損しPaneth細胞を欠失した陰窩を置き換えていき,最終的には小腸の全域が野生型の陰窩に置き換わった.この置換現象はLgr5幹細胞に特異的に発現するAscl2をノックアウトしたときと非常に近似していた.この場合,Ascl2のノックアウトにより死滅したLgr5幹細胞は,ノックアウトをまぬがれた野生型のLgr5幹細胞に置き換わった8).筆者らは最近,Lgr5幹細胞を遺伝子組換えによる蛍光タンパク質の発現により5通りの色(青色,緑色,黄色,赤色,無色)で識別できるようなトランスジェニックマウスを作製した2).この場合,Lgr5幹細胞は確率論的に競合しあい,2ヶ月以内に陰窩あたり14~16細胞ある幹細胞は1つの色に収束すること(neutral drift)を報告している2).Ascl2ノックアウトマウスのような幹細胞自体の機能を欠損させた場合,このような収束はくずれ野生型の幹細胞は選択的にPaneth細胞に接着し,自己複製とともにすみやかに腸管全体が野生型の幹細胞に置き換わったものと考えられる.Sox9コンディショナルノックアウトマウスではLgr5幹細胞およびPaneth細胞の欠損により残された野生型の陰窩が,陰窩の分裂によって異なった機構で置き換えを起こしたものと考えられた.
幹細胞ニッチはショウジョウバエの生殖腺において細胞レベルでその機能が解明されてきた.哺乳類では,造血幹細胞における骨芽細胞,血管内皮細胞,精巣幹細胞におけるセルトリ細胞などが報告されてきたが,この研究のような,細胞レベルでの幹細胞ニッチの実証は哺乳類でははじめてといえる.これまで,腸管上皮幹細胞のニッチは上皮の下に存在する線維芽細胞だと考えられてきたが,この研究により,Paneth細胞であることが結論づけられた.
略歴:2004年 医学博士(慶應義塾大学医学部),同年 慶應義塾大学医学部 COE特別研究員,2006年 米国Stowers Institute for Medical Research研究員を経て,2007年よりオランダHubrecht Institute 研究員.
研究テーマ:腸管上皮幹細胞,炎症性腸疾患,大腸がん.
抱負:2011年4月より慶應義塾大学医学部消化器内科で,これまでの研究を臨床に還元できるような研究を行いたいと思っています.共同研究やいっしょに研究したいという希望がありましたらご連絡ください.
© 2011 佐藤 俊朗 Licensed under CC 表示 2.1 日本
(オランダHubrecht Institute)
email:佐藤俊朗
DOI: 10.7875/first.author.2011.008
Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts.
Toshiro Sato, Johan H. van Es, Hugo J. Snippert, Daniel E. Stange, Robert G. Vries, Maaike van den Born, Nick Barker, Noah F. Shroyer, Marc van de Wetering, Hans Clevers
Nature, 469, 415-418 (2011)
この論文に出現する遺伝子・タンパク質のUniprot ID
Lgr5(Q9Z1P4), EGF(P01132), Dll4(Q9JI71), Wnt3(P17553), Wnt, CD24(P24807), TGFα(P48030), EGF受容体(Q01279), Notch1(Q01705), Frizzled7(Q61090), R-spondin, Cr2(P19070), Tox, Gfi1(P70338), Olfm4(Q3UZZ4), Sox9(Q04887), p450, Ascl2(O35885)
要 約
Lgr5幹細胞は陰窩の底部でつねに自己複製している.最近,単一のLgr5幹細胞がin vitroで幹細胞の機能をあわせもつ細胞組織体を形成することから,腸管上皮の下に存在する線維芽細胞が幹細胞ニッチではないことが明らかになった.今回,小腸のLgr5幹細胞に密接に接着しているPaneth細胞を純化したところ,EGF,Dll4,Wnt3などの幹細胞増殖因子を発現していることを見い出した.さらに,Paneth細胞はおもにWntの産生を介してLgr5幹細胞の幹細胞機能の維持を強力にサポートしていることがわかった.また,Paneth細胞を遺伝子操作により減少または欠損させたマウスでは相関してLgr5幹細胞が減少または消失することから,Paneth細胞が腸管上皮幹細胞のニッチとして機能していることがわかった.
はじめに
小腸の腸管上皮は腸管の内腔を単層でおおっており,その組織学的な構造は幹細胞のヒエラルキーを反映している.腸管上皮は絨毛と陰窩の2つのコンパートメントから構成されており,陰窩は未分化な増殖細胞からなり分化とともに絨毛へと移動していく.絨毛の細胞は2~3日でその先端からはがれおちていく(図1).腸管上皮には吸収上皮細胞,杯細胞,腸管上皮内分泌細胞,Paneth細胞の4種類の分化細胞がある.なかでも,Paneth細胞は陰窩の底部に存在し抗菌物質の産生により腸管内腔を細菌から守っているものと考えられている.
近年,Paneth細胞にはさまれたかたちで存在する陰窩底部円柱細胞(crypt base columnar cell,CBC細胞)について,この細胞に特異的に発現するLgr5遺伝子を利用した遺伝学的な細胞系譜の追跡により,CBC細胞は永続的に自己複製とすべての分化細胞の産生とを行っていることがわかった1).この結果から,CBC細胞は腸管上皮幹細胞であることが実証された.ここでは,CBC細胞をLgr5幹細胞と呼称することにする.従来,腸管上皮幹細胞は非対称性の幹細胞分裂(ひとつの幹細胞が分裂ののち,幹細胞と分化細胞となる)を行い幹細胞の数を一定に保っていると考えられてきた.最近,遺伝学的な細胞系譜の追跡と生物物理学的な解析により,Lgr5幹細胞は陰窩の底部で頻繁に対称性の幹細胞分裂(ひとつの幹細胞が分裂ののち,2つの幹細胞となる)を行っていて,陰窩の底部に残った細胞のみが幹細胞能を保ち,この領域から排出された細胞は分化してしまっていることがわかった2).つまり,陰窩の底部に幹細胞の維持のための微小環境(ニッチ)が存在し,このニッチが幹細胞の数を一定に保っていることがわかったのである.しかしながら,どのようにして,また,どの細胞が幹細胞ニッチを構成しているかについてはわかっていなかった.
筆者らは,単離した陰窩をin vitroにおいて永続的に増殖させる3次元培養法(細胞組織体培養)を確立した3).細胞組織体培養において,Lgr5幹細胞は自己複製とともにすべての分化細胞を産生し,体内の腸管上皮の構造を擬似していた.単一のLgr5幹細胞から細胞組織体の形成が可能であることから,非上皮細胞は幹細胞ニッチとして必須ではないことがわかった.今回,筆者らは,上皮細胞自体がLgr5幹細胞のニッチとなっていることを見い出した.
1.Paneth細胞はLgr5幹細胞と密接に接着している
幹細胞ニッチは幹細胞との細胞接着を介して自己複製や分化の制御を行っていることが多いことから,Lgr5幹細胞と接着している細胞に注目した.Lgr5幹細胞と接着する細胞を解析したところ,細胞の表面の90%程度はPaneth細胞と接着していることがわかった.Lgr5幹細胞は1日に1回くらい分裂するため,分裂ののちすみやかにPaneth細胞のあいだに混ざり合うことになる.さらに,この傾向は細胞組織体培養でも再現できることから,Paneth細胞はLgr5幹細胞にとって必須の細胞,つまり,ニッチとなっているという仮説をたてた.
2.Paneth細胞の純化
Paneth細胞の解析を行うためその純化を試みた.Paneth細胞はCD24を高発現していたことからフローサイトメトリーによる純化に成功した.純化されたPaneth細胞のマイクロアレイ解析により,幹細胞の維持に必須な増殖因子であるEGF,TGFα,Dll4,Wnt3の発現していることがわかった.一方,これらの増殖因子の受容体であるEGF受容体,Notch1,Frizzled7などはLgr5幹細胞に発現していた.
3.Paneth細胞はWntの産生を介してLgr5幹細胞の維持にかかわっていた
Wnt3の発現をin situハイブリダイゼーションにより解析したところ,Paneth細胞に特異的に発現していることが確認された.陰窩の細胞組織体培養ではR-spondinというWntの活性化作用をもつ増殖因子が必須である.近年,R-spondinはWnt受容体の発現を制御しており,Wntの非存在下ではその活性の認められないことが報告された4).この報告と合致して,細胞組織体では陰窩の底部,Paneth細胞の近傍の細胞だけでWntの活性化がみられた.さらに,細胞組織体に活性化Wnt阻害剤であるIWP1 5) を投与したところWntの不活性化とともに細胞は死滅した.この過程は阻害剤とともに活性化Wntを投与することで防ぐことができることから,IWP1の毒性ではなくWnt合成阻害による効果であることが確認できた.興味深いことに,Wntを培養液にくわえた場合,Wntの活性化はPaneth細胞の近傍にかぎらず,びまん性にみられた.さらに,陰窩様の構造は消失し嚢胞状の構造に変化した(図2).このことから,細胞組織体にみられる陰窩様の構造はPaneth細胞からWntを介して産生される上皮細胞に自律的に形成されることがわかった.
Paneth細胞のLgr5幹細胞への作用を調べるため,遺伝子操作により作製したRFPを発現するLgr5幹細胞とYFPを発現するPaneth細胞とを純化し,それぞれ単独あるいはいっしょに培養した.Lgr5幹細胞単独の培養では非常に低い培養効率であったが,Paneth細胞との共培養により培養効率は飛躍的に向上した.また,Lgr5幹細胞の単独培養においても同時にWntを投与することにより同様に培養効率は向上した.これらのことから,Paneth細胞はWntの産生を介してLgr5幹細胞にニッチを提供しているものと結論づけた.
4.Paneth細胞とLgr5幹細胞の数にはin vivoにおいて相関関係が認められた
これまで明らかになったPaneth細胞に依存性の幹細胞の制御機構が実際にin vivoでも存在することを確認するため,Paneth細胞の減少したマウスの腸管を解析した.Paneth細胞に特異的に毒素を発現させたCr2-Toxマウス6) や,Paneth細胞の分化タンパク質であるGfi1のノックアウトマウス7) では,Paneth細胞の数が著しく減少していることが報告されている.これらのマウスにおいてLgr5幹細胞のマーカーであるOlfm4 8) の発現を解析したところ,Paneth細胞の減少と著しく相関してLgr5幹細胞の減少していることがわかった.さらに,Paneth細胞の分化に必須の転写因子であるSox9 9) を成体マウスの腸管上皮において特異的にノックアウトした場合,Paneth細胞は経時的に欠損していくことが観察された.この実験では,薬剤による誘導により95%以上のLgr5幹細胞にCreを発現させるp450-Creマウスと,Cre依存的にSox9を欠損するコンディショナルノックアウトマウスを交配させたマウスを用いた.幹細胞は新しいPaneth細胞を生み出すことができず,Paneth細胞の寿命である2ヶ月をすぎるとほぼすべての陰窩においてPaneth細胞は消失した.興味深いことに,このようなPaneth細胞を完全に欠損した陰窩ではLgr5幹細胞も同時に消失していた.ただし,Sox9を欠損しなかった野生型の陰窩はPaneth細胞をもっており,これらの陰窩は非常に速く増殖していた.
驚くべきことに,これらの野生型の陰窩はSox9を欠損しPaneth細胞を欠失した陰窩を置き換えていき,最終的には小腸の全域が野生型の陰窩に置き換わった.この置換現象はLgr5幹細胞に特異的に発現するAscl2をノックアウトしたときと非常に近似していた.この場合,Ascl2のノックアウトにより死滅したLgr5幹細胞は,ノックアウトをまぬがれた野生型のLgr5幹細胞に置き換わった8).筆者らは最近,Lgr5幹細胞を遺伝子組換えによる蛍光タンパク質の発現により5通りの色(青色,緑色,黄色,赤色,無色)で識別できるようなトランスジェニックマウスを作製した2).この場合,Lgr5幹細胞は確率論的に競合しあい,2ヶ月以内に陰窩あたり14~16細胞ある幹細胞は1つの色に収束すること(neutral drift)を報告している2).Ascl2ノックアウトマウスのような幹細胞自体の機能を欠損させた場合,このような収束はくずれ野生型の幹細胞は選択的にPaneth細胞に接着し,自己複製とともにすみやかに腸管全体が野生型の幹細胞に置き換わったものと考えられる.Sox9コンディショナルノックアウトマウスではLgr5幹細胞およびPaneth細胞の欠損により残された野生型の陰窩が,陰窩の分裂によって異なった機構で置き換えを起こしたものと考えられた.
おわりに
幹細胞ニッチはショウジョウバエの生殖腺において細胞レベルでその機能が解明されてきた.哺乳類では,造血幹細胞における骨芽細胞,血管内皮細胞,精巣幹細胞におけるセルトリ細胞などが報告されてきたが,この研究のような,細胞レベルでの幹細胞ニッチの実証は哺乳類でははじめてといえる.これまで,腸管上皮幹細胞のニッチは上皮の下に存在する線維芽細胞だと考えられてきたが,この研究により,Paneth細胞であることが結論づけられた.
文 献
- Barker, N., van Es, J. H., Kuipers, J. et al.: Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature, 449, 1003-1007 (2007)[PubMed]
- Snippert, H. J., van der Flier, L. G., Sato, T. et al.: Intestinal crypt homeostasis results from neutral competition between symmetrically dividing Lgr5 stem cells. Cell, 143, 134-144 (2010)[PubMed]
- Sato, T., Vries, R. G., Snippert, H. J. et al.: Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature, 459, 263-265 (2009)[PubMed]
- Binnerts, M. E., Kim, K. A., Bright, J. M. et al.: R-Spondin1 regulates Wnt signaling by inhibiting internalization of LRP6. Proc. Natl. Acad. Sci. USA, 104, 14700-14705 (2007)[PubMed]
- Chen, B., Dodge, M. E., Tang, W/ et al.: Small molecule-mediated disruption of Wnt-dependent signaling in tissue regeneration and cancer. Nat. Chem. Biol., 5, 100-107 (2009)[PubMed]
- Garabedian, E. M., Roberts, L. J., McNevin, M. S. et al.: Examining the role of Paneth cells in the small intestine by lineage ablation in transgenic mice. J. Biol. Chem., 272, 23729-23740 (1997)[PubMed]
- Shroyer, N. F., Wallis, D., Venken, K. J. et al.: Gfi1 functions downstream of Math1 to control intestinal secretory cell subtype allocation and differentiation. Genes Dev., 19, 2412-2417 (2005)[PubMed]
- van der Flier, L. G., van Gijn, M. E., Hatzis, P. et al.: Transcription factor achaete scute-like 2 controls intestinal stem cell fate. Cell, 136, 903-912 (2009)[PubMed]
- Mori-Akiyama, Y., van den Born, M., van Es, J. H. et al.: SOX9 is required for the differentiation of paneth cells in the intestinal epithelium. Gastroenterology, 133, 539-546 (2007)[PubMed]
著者プロフィール
略歴:2004年 医学博士(慶應義塾大学医学部),同年 慶應義塾大学医学部 COE特別研究員,2006年 米国Stowers Institute for Medical Research研究員を経て,2007年よりオランダHubrecht Institute 研究員.
研究テーマ:腸管上皮幹細胞,炎症性腸疾患,大腸がん.
抱負:2011年4月より慶應義塾大学医学部消化器内科で,これまでの研究を臨床に還元できるような研究を行いたいと思っています.共同研究やいっしょに研究したいという希望がありましたらご連絡ください.
© 2011 佐藤 俊朗 Licensed under CC 表示 2.1 日本