哺乳動物において新生タンパク質を小胞体へと輸送する複合体の構造
小林 幹
(スイスFederal Institute of Technology Zurich,Department of Biology,Institute of Molecular Biology and Biophysics)
email:小林 幹
DOI: 10.7875/first.author.2018.041
Structure of a prehandover mammalian ribosomal SRP•SRP receptor targeting complex.
Kan Kobayashi, Ahmad Jomaa, Jae Ho Lee, Sowmya Chandrasekar, Daniel Boehringer, Shu-ou Shan, Nenad Ban
Science, 360, 323-327 (2018)
真核生物における膜タンパク質や分泌タンパク質の合成にはシグナル認識粒子およびシグナル認識粒子受容体が深く関与する.シグナル認識粒子は,これらのタンパク質のシグナル配列を合成しているリボソームと結合し,さらに,小胞体膜に存在するシグナル認識粒子受容体と結合することにより,これらのタンパク質を小胞体膜へと導く.この研究において,筆者らは,哺乳動物に由来するシグナル認識粒子,シグナル認識粒子受容体,シグナル配列を含むリボソームからなる複合体の構造を決定した.この構造において,シグナル認識粒子とシグナル認識粒子受容体との相互作用により,リボソームは小胞体膜に存在するタンパク質透過装置であるSecトランスロコンとの結合部位を露出させていた.さらに,生化学的な実験により,この構造においてシグナル認識粒子およびシグナル認識粒子受容体のGTPaseドメインと相互作用する部位はGTPの加水分解を抑制することがわかった.これは,GTPの加水分解にともなう複合体の解離を抑制することにより,Secトランスロコンへのうけわたしが完了するまでリボソームを小胞体膜にとどめておくためと考えられた.よって,この構造はリボソームおよびシグナル配列をSecトランスロコンへとうけわたす直前の状態であると考えられた.
真核生物において,約30%のタンパク質は小胞体へと輸送され,この過程にはシグナル認識粒子(signal recognition particle:SRP)およびシグナル認識粒子受容体(SRP receptor:SR)が深くかかわる1,2).シグナル認識粒子はそれらのタンパク質のシグナル配列を合成しているリボソームを認識し3),さらに,小胞体膜に存在するシグナル認識粒子受容体とGTPに依存的に結合する4,5).そして,小胞体膜においてシグナル認識粒子およびシグナル認識粒子受容体は,リボソームおよびシグナル配列を小胞体膜に存在するタンパク質透過装置であるSecトランスロコンへとうけわたしたのち,GTPの加水分解によりリボソームから解離し4),小胞体へとうけわたされた新生タンパク質は細胞膜あるいは細胞の外へと輸送される.シグナル認識粒子は1つのRNA(SRP RNA)および6つのタンパク質(SRP9,SRP14,SRP19,SRP54,SRP68,SRP72)から構成される複合体であり1,6),これらのうち,SRP54がとくに重要な役割をはたす1).SRP54はリボソームと結合するN末端側のNGドメインおよびシグナル配列を認識するC末端側のMドメインからなる1,7).シグナル認識粒子受容体は2つのタンパク質SRαおよびSRβから構成され,SRβが小胞体膜と結合する1,8).SRαはSRβと結合するN末端側のSRXドメインおよびC末端側のNGドメインからなる1,9).SRαのNGドメインはSRP54のNGドメインとGTPに依存的にNGヘテロ二量体を形成することによりシグナル認識粒子と結合する5).しかし,ほかの構成タンパク質やドメイン(とくに,SRP68,SRP72,SRXドメイン,SRβ)の詳細な機能についてはわかっていなかった.そこで,この研究において,筆者らは,哺乳動物に由来するシグナル認識粒子,シグナル認識粒子受容体,シグナル配列を含むリボソームからなる複合体の構造を,クライオ電子顕微鏡を用いた単粒子解析により決定し,哺乳動物における新生タンパク質の小胞体への輸送機構を解明することを試みた.
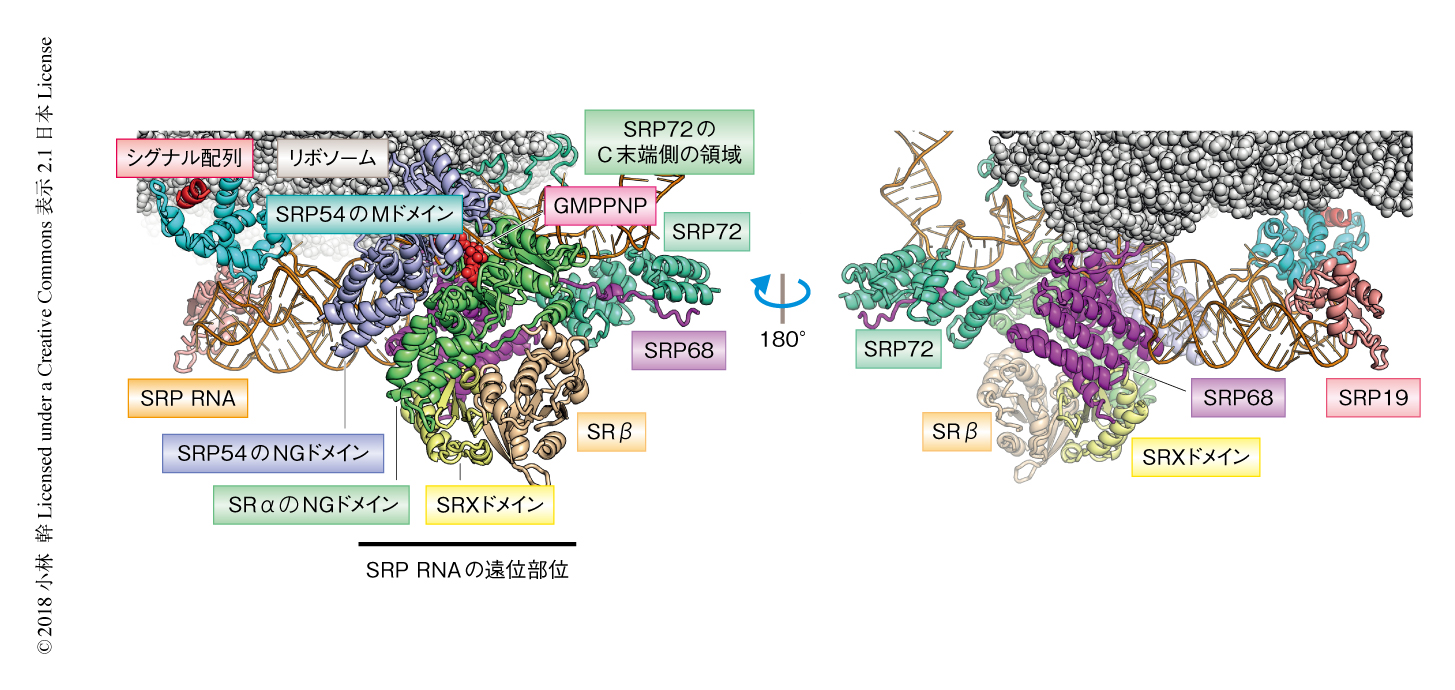
シグナル配列を含むリボソームはin vitro翻訳系により調製し,GTPの非加水分解アナログであるGMPPNPの存在のもとシグナル認識粒子およびシグナル認識粒子受容体を混合することにより複合体を調製した.そして,非晶質の氷に包埋した複合体をクライオ電子顕微鏡により観察し,収集したデータを単粒子解析することにより複合体のマップを計算した.試料にSecトランスロコンをくわえることによりシグナル認識粒子およびシグナル認識粒子受容体のマップが改善したが,マップにおいてSecトランスロコンと断定できる密度は確認されなかった.そして,最終的に得られた平均分解能3.7Åのマップに対し,すでにProtein Data Bankに登録されていたシグナル認識粒子およびシグナル認識粒子受容体の部分構造をあてはめることにより,シグナル認識粒子,シグナル認識粒子受容体,シグナル配列を含むリボソームからなる複合体の全体構造を決定した(図1,PDB ID:6FRK).先行研究において指摘されていたとおり,シグナル認識粒子受容体の存在のもとではSRP54のNGドメインはリボソームから解離しており,その結果,シグナル配列を認識したSRP54のMドメインに近接するリボソームのSecトランスロコン結合部位は露出していた10).一方,SRP RNAの遠位部位とよばれる領域には,GMPPNPを結合したNGヘテロ二量体,SRP68,SRP72,SRXドメイン,SRβからなる大きなタンパク質複合体が観察された.
SRP RNAの遠位部位においては,GMPPNPと結合したNGヘテロ二量体がSRXドメイン,SRβ,SRP68との広範な相互作用により固定されていた(図1).リボソームのSecトランスロコン結合部位をふさいでいたSRP54のNGドメインがSRαとNGヘテロ二量体を形成することによりそこから解離することを考慮すると5,10),これらのタンパク質(ドメイン)はリボソームから解離したNGヘテロ二量体がSRP RNAの遠位部位と結合するための足場としてはたらくと考えられた.また,SRP72も遠位部位においてSRP68と相互作用しており,このコンホメーションの安定化に寄与する可能性があった.
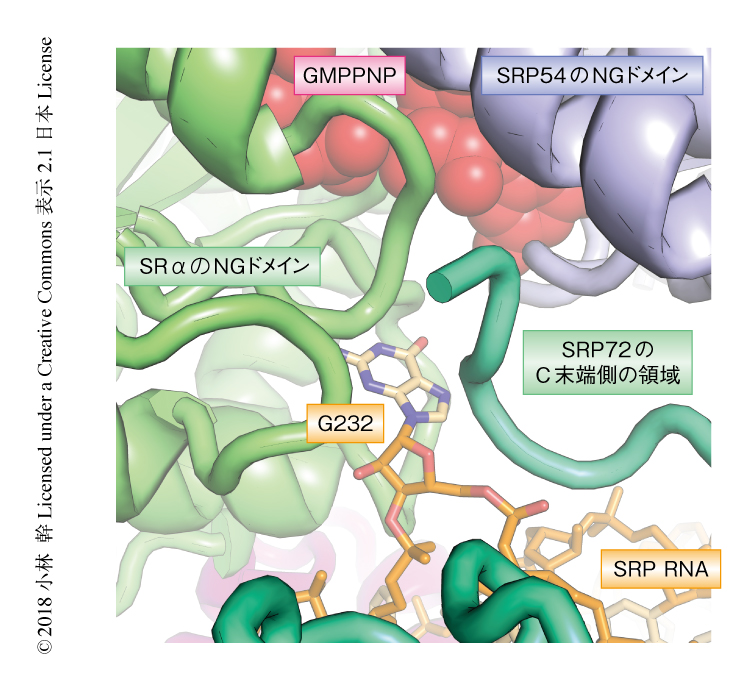
NGヘテロ二量体のGTPase活性化部位にはSRP RNAのG232が接近しており,さらに,SRP72のC末端側の領域と相互作用していた(図2).そこで,SRP RNAのG232を改変したりSRP72のC末端側の領域の一部を欠損させたりした変異型のシグナル認識粒子を作製し,リボソーム,シグナル認識粒子受容体,シグナル配列の存在のもとGTPaseの活性を測定したところ,変異型のシグナル認識粒子においてはGTPase活性が上昇することがわかった.また,野生型のシグナル認識粒子に対しSRXドメインおよびSRβを欠損させたシグナル認識粒子受容体を用いた場合にも同様にGTPase活性の上昇が確認され,SRP RNAの遠位部位におけるNGヘテロ二量体との相互作用はNGヘテロ二量体のGTPase活性を抑制することが示唆された.NGヘテロ二量体によるGTPの加水分解によりシグナル認識粒子およびシグナル認識粒子受容体がリボソームから解離することを考えると4),このGTPase活性の抑制はリボソームおよびシグナル配列のSecトランスロコンへのうけわたしが完了するまでリボソームを小胞体膜にとどめるためと考えられた.よって,この構造はリボソームおよびシグナル配列をSecトランスロコンへとうけわたす直前の状態であると考えられた.
以上の考察より,哺乳動物におけるシグナル認識粒子およびシグナル認識粒子受容体による新生タンパク質の小胞体への輸送について,以下のような機構が考えられた.まず,シグナル認識粒子はシグナル配列を合成しているリボソームを認識し,SRP54がMドメインによりシグナル配列と結合するとともに,NGドメインによりリボソームのSecトランスロコン結合部位と相互作用する7).つづいて,SRP54のNGドメインは小胞体膜においてSRαのNGドメインとGTPに依存的にNGヘテロ二量体を形成する.そして,GTPと結合したNGヘテロ二量体はリボソームから解離し,SRP68,SRXドメイン,SRβとの相互作用によりSRP RNAの遠位部位に固定される.この状態ではNGヘテロ二量体のGTPase活性はSRP72,SRP RNA,シグナル認識粒子受容体により抑制されており,リボソームは露出した結合部位を介してSecトランスロコンと結合し,シグナル配列はSecトランスロコンへとうけわたされる.最後に,NGヘテロ二量体はGTPを加水分解し,シグナル認識粒子およびシグナル認識粒子受容体はリボソームから解離する.
これまで,シグナル認識粒子およびシグナル認識粒子受容体による新生タンパク質の膜への輸送機構に関する構造生物学的な研究は,おもに哺乳動物に比べはるかに小さく単純な構造をもつ細菌のオルソログを用いて進められてきた.この研究により解明された,哺乳動物に由来するシグナル認識粒子,シグナル認識粒子受容体,リボソームからなるより複雑な複合体の構造は,細菌とは異なる高等真核生物における新生タンパク質の膜への輸送機構の全容を解明するうえで大きな助けとなることはまちがいないだろう.
哺乳動物における構造が決定されたとき,SRP RNAのG232がNGヘテロ二量体のGTPase活性化部位に接近しているようすが細菌におけるGTPaseの活性化機構と酷似していたため11),これで哺乳動物のシグナル認識粒子およびシグナル認識粒子受容体によるGTPaseの活性化機構が解明されたものと考え,その流れで論文を書きはじめた.のちの実験において得られた,変異型のシグナル認識粒子においてGTPase活性が逆に上昇するという結果は衝撃的であり,論文の内容は大幅な変更を余儀なくされた.しかし,この過程において,この細菌と哺乳動物における相違は,むしろおおかたの予測をくつがえす大発見なのではないかと思うようになった.“予想と異なる実験結果が得られたときこそがチャンス”であることを実感するとともに,自然現象を真に理解するためには複数の手法を組み合わせたアプローチが不可欠であると再認識した.現在,GTPaseが抑制される機構,のちにそれが活性化される機構,さらには,シグナル配列がシグナル認識粒子からSecトランスロコンにうけわたされる機構を解明するため,試行錯誤をつづけている.
略歴:2014年 東京大学大学院理学系研究科博士課程 修了,同年よりスイスFederal Institute of Technology Zurich博士研究員.
研究テーマ:生体におけるタンパク質の代謝機構.
関心事:今後どうするか.
© 2018 小林 幹 Licensed under CC 表示 2.1 日本
(スイスFederal Institute of Technology Zurich,Department of Biology,Institute of Molecular Biology and Biophysics)
email:小林 幹
DOI: 10.7875/first.author.2018.041
Structure of a prehandover mammalian ribosomal SRP•SRP receptor targeting complex.
Kan Kobayashi, Ahmad Jomaa, Jae Ho Lee, Sowmya Chandrasekar, Daniel Boehringer, Shu-ou Shan, Nenad Ban
Science, 360, 323-327 (2018)
要 約
真核生物における膜タンパク質や分泌タンパク質の合成にはシグナル認識粒子およびシグナル認識粒子受容体が深く関与する.シグナル認識粒子は,これらのタンパク質のシグナル配列を合成しているリボソームと結合し,さらに,小胞体膜に存在するシグナル認識粒子受容体と結合することにより,これらのタンパク質を小胞体膜へと導く.この研究において,筆者らは,哺乳動物に由来するシグナル認識粒子,シグナル認識粒子受容体,シグナル配列を含むリボソームからなる複合体の構造を決定した.この構造において,シグナル認識粒子とシグナル認識粒子受容体との相互作用により,リボソームは小胞体膜に存在するタンパク質透過装置であるSecトランスロコンとの結合部位を露出させていた.さらに,生化学的な実験により,この構造においてシグナル認識粒子およびシグナル認識粒子受容体のGTPaseドメインと相互作用する部位はGTPの加水分解を抑制することがわかった.これは,GTPの加水分解にともなう複合体の解離を抑制することにより,Secトランスロコンへのうけわたしが完了するまでリボソームを小胞体膜にとどめておくためと考えられた.よって,この構造はリボソームおよびシグナル配列をSecトランスロコンへとうけわたす直前の状態であると考えられた.
はじめに
真核生物において,約30%のタンパク質は小胞体へと輸送され,この過程にはシグナル認識粒子(signal recognition particle:SRP)およびシグナル認識粒子受容体(SRP receptor:SR)が深くかかわる1,2).シグナル認識粒子はそれらのタンパク質のシグナル配列を合成しているリボソームを認識し3),さらに,小胞体膜に存在するシグナル認識粒子受容体とGTPに依存的に結合する4,5).そして,小胞体膜においてシグナル認識粒子およびシグナル認識粒子受容体は,リボソームおよびシグナル配列を小胞体膜に存在するタンパク質透過装置であるSecトランスロコンへとうけわたしたのち,GTPの加水分解によりリボソームから解離し4),小胞体へとうけわたされた新生タンパク質は細胞膜あるいは細胞の外へと輸送される.シグナル認識粒子は1つのRNA(SRP RNA)および6つのタンパク質(SRP9,SRP14,SRP19,SRP54,SRP68,SRP72)から構成される複合体であり1,6),これらのうち,SRP54がとくに重要な役割をはたす1).SRP54はリボソームと結合するN末端側のNGドメインおよびシグナル配列を認識するC末端側のMドメインからなる1,7).シグナル認識粒子受容体は2つのタンパク質SRαおよびSRβから構成され,SRβが小胞体膜と結合する1,8).SRαはSRβと結合するN末端側のSRXドメインおよびC末端側のNGドメインからなる1,9).SRαのNGドメインはSRP54のNGドメインとGTPに依存的にNGヘテロ二量体を形成することによりシグナル認識粒子と結合する5).しかし,ほかの構成タンパク質やドメイン(とくに,SRP68,SRP72,SRXドメイン,SRβ)の詳細な機能についてはわかっていなかった.そこで,この研究において,筆者らは,哺乳動物に由来するシグナル認識粒子,シグナル認識粒子受容体,シグナル配列を含むリボソームからなる複合体の構造を,クライオ電子顕微鏡を用いた単粒子解析により決定し,哺乳動物における新生タンパク質の小胞体への輸送機構を解明することを試みた.
1.シグナル認識粒子,シグナル認識粒子受容体,リボソームからなる複合体の全体構造
シグナル配列を含むリボソームはin vitro翻訳系により調製し,GTPの非加水分解アナログであるGMPPNPの存在のもとシグナル認識粒子およびシグナル認識粒子受容体を混合することにより複合体を調製した.そして,非晶質の氷に包埋した複合体をクライオ電子顕微鏡により観察し,収集したデータを単粒子解析することにより複合体のマップを計算した.試料にSecトランスロコンをくわえることによりシグナル認識粒子およびシグナル認識粒子受容体のマップが改善したが,マップにおいてSecトランスロコンと断定できる密度は確認されなかった.そして,最終的に得られた平均分解能3.7Åのマップに対し,すでにProtein Data Bankに登録されていたシグナル認識粒子およびシグナル認識粒子受容体の部分構造をあてはめることにより,シグナル認識粒子,シグナル認識粒子受容体,シグナル配列を含むリボソームからなる複合体の全体構造を決定した(図1,PDB ID:6FRK).先行研究において指摘されていたとおり,シグナル認識粒子受容体の存在のもとではSRP54のNGドメインはリボソームから解離しており,その結果,シグナル配列を認識したSRP54のMドメインに近接するリボソームのSecトランスロコン結合部位は露出していた10).一方,SRP RNAの遠位部位とよばれる領域には,GMPPNPを結合したNGヘテロ二量体,SRP68,SRP72,SRXドメイン,SRβからなる大きなタンパク質複合体が観察された.
2.SRP RNAの遠位部位の構造
SRP RNAの遠位部位においては,GMPPNPと結合したNGヘテロ二量体がSRXドメイン,SRβ,SRP68との広範な相互作用により固定されていた(図1).リボソームのSecトランスロコン結合部位をふさいでいたSRP54のNGドメインがSRαとNGヘテロ二量体を形成することによりそこから解離することを考慮すると5,10),これらのタンパク質(ドメイン)はリボソームから解離したNGヘテロ二量体がSRP RNAの遠位部位と結合するための足場としてはたらくと考えられた.また,SRP72も遠位部位においてSRP68と相互作用しており,このコンホメーションの安定化に寄与する可能性があった.
3.GTPase活性化部位の構造
NGヘテロ二量体のGTPase活性化部位にはSRP RNAのG232が接近しており,さらに,SRP72のC末端側の領域と相互作用していた(図2).そこで,SRP RNAのG232を改変したりSRP72のC末端側の領域の一部を欠損させたりした変異型のシグナル認識粒子を作製し,リボソーム,シグナル認識粒子受容体,シグナル配列の存在のもとGTPaseの活性を測定したところ,変異型のシグナル認識粒子においてはGTPase活性が上昇することがわかった.また,野生型のシグナル認識粒子に対しSRXドメインおよびSRβを欠損させたシグナル認識粒子受容体を用いた場合にも同様にGTPase活性の上昇が確認され,SRP RNAの遠位部位におけるNGヘテロ二量体との相互作用はNGヘテロ二量体のGTPase活性を抑制することが示唆された.NGヘテロ二量体によるGTPの加水分解によりシグナル認識粒子およびシグナル認識粒子受容体がリボソームから解離することを考えると4),このGTPase活性の抑制はリボソームおよびシグナル配列のSecトランスロコンへのうけわたしが完了するまでリボソームを小胞体膜にとどめるためと考えられた.よって,この構造はリボソームおよびシグナル配列をSecトランスロコンへとうけわたす直前の状態であると考えられた.
4.シグナル認識粒子およびシグナル認識粒子受容体による新生タンパク質の小胞体への輸送機構
以上の考察より,哺乳動物におけるシグナル認識粒子およびシグナル認識粒子受容体による新生タンパク質の小胞体への輸送について,以下のような機構が考えられた.まず,シグナル認識粒子はシグナル配列を合成しているリボソームを認識し,SRP54がMドメインによりシグナル配列と結合するとともに,NGドメインによりリボソームのSecトランスロコン結合部位と相互作用する7).つづいて,SRP54のNGドメインは小胞体膜においてSRαのNGドメインとGTPに依存的にNGヘテロ二量体を形成する.そして,GTPと結合したNGヘテロ二量体はリボソームから解離し,SRP68,SRXドメイン,SRβとの相互作用によりSRP RNAの遠位部位に固定される.この状態ではNGヘテロ二量体のGTPase活性はSRP72,SRP RNA,シグナル認識粒子受容体により抑制されており,リボソームは露出した結合部位を介してSecトランスロコンと結合し,シグナル配列はSecトランスロコンへとうけわたされる.最後に,NGヘテロ二量体はGTPを加水分解し,シグナル認識粒子およびシグナル認識粒子受容体はリボソームから解離する.
おわりに
これまで,シグナル認識粒子およびシグナル認識粒子受容体による新生タンパク質の膜への輸送機構に関する構造生物学的な研究は,おもに哺乳動物に比べはるかに小さく単純な構造をもつ細菌のオルソログを用いて進められてきた.この研究により解明された,哺乳動物に由来するシグナル認識粒子,シグナル認識粒子受容体,リボソームからなるより複雑な複合体の構造は,細菌とは異なる高等真核生物における新生タンパク質の膜への輸送機構の全容を解明するうえで大きな助けとなることはまちがいないだろう.
哺乳動物における構造が決定されたとき,SRP RNAのG232がNGヘテロ二量体のGTPase活性化部位に接近しているようすが細菌におけるGTPaseの活性化機構と酷似していたため11),これで哺乳動物のシグナル認識粒子およびシグナル認識粒子受容体によるGTPaseの活性化機構が解明されたものと考え,その流れで論文を書きはじめた.のちの実験において得られた,変異型のシグナル認識粒子においてGTPase活性が逆に上昇するという結果は衝撃的であり,論文の内容は大幅な変更を余儀なくされた.しかし,この過程において,この細菌と哺乳動物における相違は,むしろおおかたの予測をくつがえす大発見なのではないかと思うようになった.“予想と異なる実験結果が得られたときこそがチャンス”であることを実感するとともに,自然現象を真に理解するためには複数の手法を組み合わせたアプローチが不可欠であると再認識した.現在,GTPaseが抑制される機構,のちにそれが活性化される機構,さらには,シグナル配列がシグナル認識粒子からSecトランスロコンにうけわたされる機構を解明するため,試行錯誤をつづけている.
文 献
- Nyathi, Y., Wilkinson, B. M. & Pool, M. R.: Co-translational targeting and translocation of proteins to the endoplasmic reticulum. Biochim. Biophys. Acta, 1833, 2392-2402 (2013)[PubMed]
- Akopian, D., Shen, K., Zhang, X. et al.: Signal recognition particle: an essential protein-targeting machine. Annu. Rev. Biochem., 82, 693-721 (2013)[PubMed]
- Walter, P., Ibrahimi, I. & Blobel, G.: Translocation of proteins across the endoplasmic reticulum. I. Signal recognition protein (SRP) binds to in-vitro-assembled polysomes synthesizing secretory protein. J. Cell Biol., 91, 545-550 (1981)[PubMed]
- Rapiejko, P. J. & Gilmore, R.: Empty site forms of the SRP54 and SRα GTPases mediate targeting of ribosome-nascent chain complexes to the endoplasmic reticulum. Cell, 89, 703-713 (1997)[PubMed]
- Wild, K., Bange, G., Motiejunas, D. et al.: Structural basis for conserved regulation and adaptation of the signal recognition particle targeting complex. J. Mol. Biol., 428, 2880-2897 (2016)[PubMed]
- Walter, P. & Blobel, G.: Signal recognition particle contains a 7S RNA essential for protein translocation across the endoplasmic reticulum. Nature, 299, 691-698 (1982)[PubMed]
- Halic, M., Becker, T., Pool, M. R. et al.: Structure of the signal recognition particle interacting with the elongation-arrested ribosome. Nature, 427, 808-814 (2004)[PubMed]
- Miller, J. D., Tajima, S., Lauffer, L. et al.: The beta subunit of the signal recognition particle receptor is a transmembrane GTPase that anchors the alpha subunit, a peripheral membrane GTPase, to the endoplasmic reticulum membrane. J. Cell Biol., 128, 273-282 (1995)[PubMed]
- Young, J. C., Ursini, J., Legate, K. R. et al.: An amino-terminal domain containing hydrophobic and hydrophilic sequences binds the signal recognition particle receptor α subunit to the β subunit on the endoplasmic reticulum membrane. J. Biol. Chem., 270, 15650-15657 (1995)[PubMed]
- Halic, M., Gartmann, M., Schlenker, O. et al.: Signal recognition particle receptor exposes the ribosomal translocon binding site. Science, 312, 745-747 (2006)[PubMed]
- Voigts-Hoffmann, F., Schmitz, N., Shen, K. et al.: The structural basis of FtsY recruitment and GTPase activation by SRP RNA. Mol. Cell, 52, 643-654 (2013)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2014年 東京大学大学院理学系研究科博士課程 修了,同年よりスイスFederal Institute of Technology Zurich博士研究員.
研究テーマ:生体におけるタンパク質の代謝機構.
関心事:今後どうするか.
© 2018 小林 幹 Licensed under CC 表示 2.1 日本