TMEM16Fによる細胞膜におけるリン脂質のスクランブル
鈴木 淳・長田重一
(京都大学大学院医学研究科 医化学分野)
email:鈴木 淳,長田重一
DOI: 10.7875/first.author.2011.003
Calcium-dependent phospholipid scrambling by TMEM16F.
Jun Suzuki, Masato Umeda, Peter J. Sims, Shigekazu Nagata
Nature, 468, 834-838 (2010)
すべての動物細胞の細胞膜は脂質二重層からなるが,細胞膜を構成するリン脂質は外層と内層とで非対称的に分布している.このリン脂質の非対称的な分布は生命現象のさまざまな局面で崩壊する.たとえば,血小板が活性化されるとその表面にはホスファチジルセリンが露出し血液凝固反応の引き金となる.このホスファチジルセリンの露出はリン脂質を双方向に輸送するCa2+依存性のスクランブラーゼのはたらきによると考えられているが,その分子としての実体,作用機構などはまったく解明されていない.今回,筆者らは,8個の膜貫通領域をもち細胞膜に局在するタンパク質TMEM16FがCa2+に依存したホスファチジルセリンの細胞表面への露出に不可欠であることを見い出した.マウス細胞株Ba/F3をCa2+の非存在下でCa2+イオノフォアにより処理するとホスファチジルセリンを可逆的に露出した.この特徴を利用してFACSによる細胞の分取を19回くり返すことによりホスファチジルセリンを強く露出する細胞株を樹立した.この細胞株からcDNAライブラリーを作製し,発現クローニングによりBa/F3細胞にホスファチジルセリンを構成的に露出させるcDNAをクローニングした.このcDNAがコードするのは点変異の導入されたTMEM16Fで,これを発現する細胞は低濃度のCa2+に応答してホスファチジルセリンを露出させる能力を獲得していた.一方,野生型TMEM16FをBa/F細胞で過剰に発現させるとCa2+イオノフォアによるリン脂質のスクランブルが促進された.血小板がホスファチジルセリンを露出できないため血液が凝固しなくなるScott症候群とよばれる疾患が知られている.この疾患をもつ1人の患者では,TMEM16F遺伝子のイントロン12のスプライス受容部位に点変異が存在した.この変異によりエキソン13がスキップされエキソン14で翻訳が中断したため全長のTMEM16Fが生じていないことがわかった.
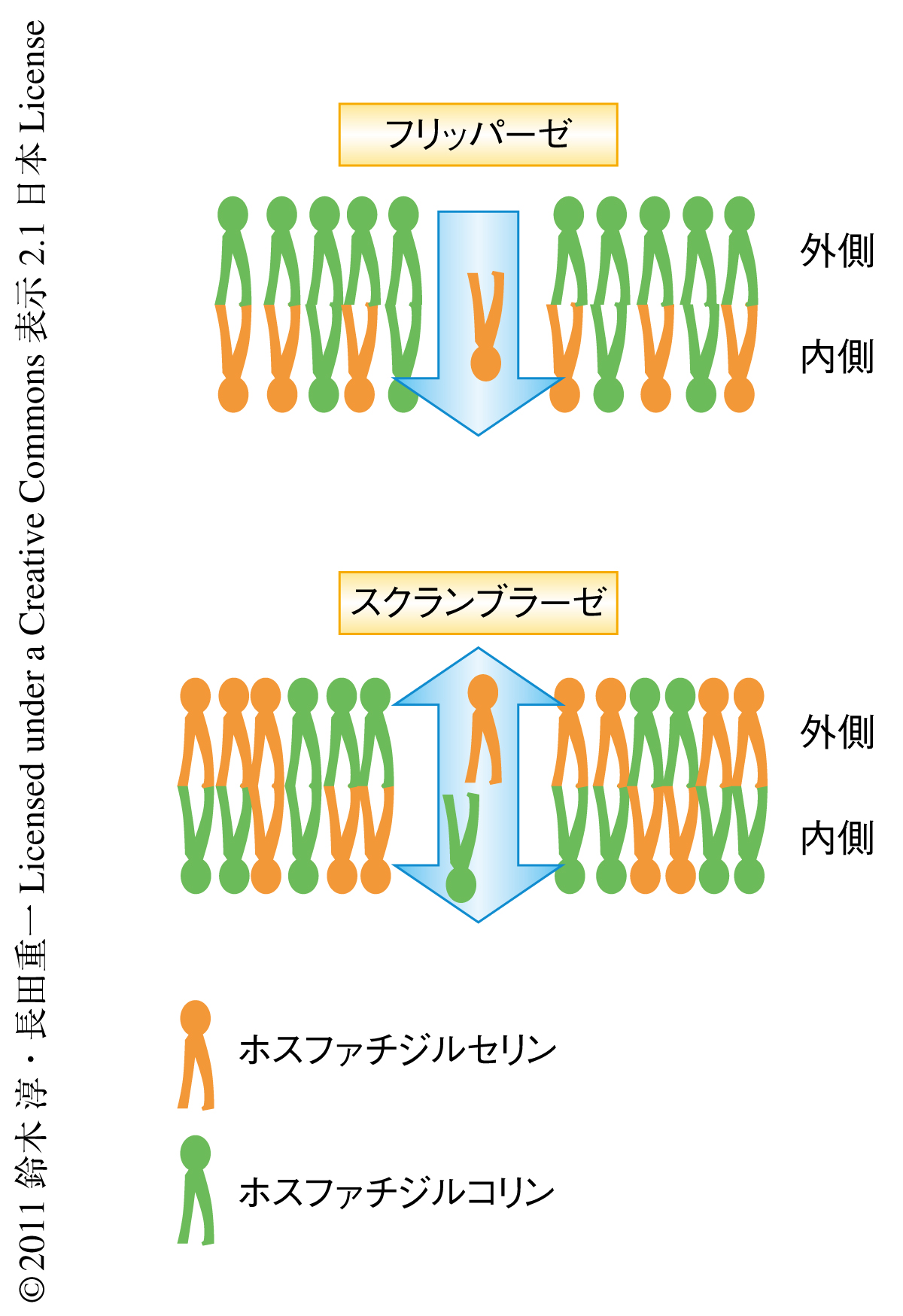
真核生物において細胞膜を構成するリン脂質は非対称性をもっており,ホスファチジルセリンは細胞膜の内側に,また,ホスファチジルコリンはおもに細胞膜の外側に位置している.ホスファチジルセリンの細胞膜の内側への輸送にはフリッパーゼ(aminophospholipid translocase)とよばれる酵素がかかわっており,ATPのエネルギーを用いてリン脂質の非対称性を維持している1)(図1).一方,血小板の活性化のときやアポトーシスのときにはこの非対称性が破綻しホスファチジルセリンが細胞表面に露出される.血小板におけるホスファチジルセリンの露出は血液凝固因子のはたらく足場として重要であり,血液凝固反応が効率的に進行するのに不可欠である2).また,アポトーシスのときのホスファチジルセリンの露出はマクロファージがアポトーシス細胞を死細胞として認識し貪食するために必要であり“eat-me-signal”として機能する3).これらのホスファチジルセリンの露出の過程においてはフリッパーゼが不活性化されることだけでは不十分で,Ca2+依存的なスクランブラーゼが活性化されることが重要であると考えられている4).スクランブラーゼはその名のとおり脂質をスクランブルさせる機能を保持していると考えられており,その結果としてホスファチジルセリンは細胞膜の外側に露出し,ホスファチジルコリンは内側に取り込まれる(図1).スクランブラーゼの存在は約30年前に仮定されたが,いまだその分子的な実体についてはわかっておらず,本当にそのような分子が存在するのかという点も含め分野は混沌としている.
まず,アポトーシスのときのホスファチジルセリンの露出においてCa2+依存的な経路が必要かどうかを検証した.マウスT細胞株WR19LにFasを過剰発現した細胞をFasリガンドにより刺激すると,細胞は1時間でアポトーシスにより死滅する.このとき,細胞内のCa2+をFluo4-AMにより検出するとCa2+濃度は上昇していた.そこで,細胞外にCa2+の存在する条件,細胞外のCa2+をEGTAによりキレートした条件,細胞内のCa2+をBAPTA-AMによりキレートした条件,でアポトーシスを誘導した.すると,すべての条件でFasリガンドにより処理した細胞においてカスパーゼ3が活性化されていた.しかしながら,細胞表面のホスファチジルセリンをAnnexin Vにより標識すると,Ca2+をキレートした条件においてその露出が著しく抑制されていた.これは,アポトーシスのときのホスファチジルセリンの露出はCa2+依存的に起こることを示しており,Ca2+に特化したホスファチジルセリンの露出の系を構築できればそれにかかわる分子の同定が可能なのではないかと考えた.
そこで,細胞内へのCa2+の流入のみでホスファチジルセリンが露出するかどうかを検討した.3日で100倍に増殖するという点と遺伝子導入が容易であるという点からマウスB細胞株Ba/F3を用い,Ca2+の流入にはCa2+イオノフォアA23187を用いた.細胞外に0.5 mMのCa2+の存在する条件において1μMのA23187で処理すると,細胞内にCa2+が流入し5分以内にホスファチジルセリンが露出した.しかしながら,15分経過するとすべての細胞が破裂し死滅した.これは,大量のCa2+の流入が細胞のチャネルなどを活性化しイオン濃度しいては浸透圧を変化させた結果だと考えられた.一方,細胞外にCa2+の存在しない条件において1μMのA23187で処理すると15分以内にホスファチジルセリンが露出したが細胞は破裂しなかった.この反応はCa2+に依存的であり,細胞内のCa2+をBAPTA-AMでキレートすると抑制された.つまり,細胞外にCa2+の存在しない条件では小胞体などに貯蓄されたCa2+が放出され,ホスファチジルセリンの露出を誘導したものと考えられた.
ついで,A23187刺激によりホスファチジルセリンを露出した細胞に対しBAPTA-AMで処理することによりCa2+をキレートすると,いちど露出したホスファチジルセリンが再び細胞膜の内側にもどった.そこで,ホスファチジルセリンを露出した細胞からA23187を除きCa2+を含まない培地で1日培養すると,つぎの日にはすべての細胞のホスファチジルセリンが細胞膜の内側にもどっていた.つまり,細胞外にCa2+の存在しない条件でA23187を処理することにより,生きた細胞が一過的にホスファチジルセリンを露出する系を構築することができた.
そこで,“生きた細胞が一過性にホスファチジルセリンを露出する”という特徴を活かし,ホスファチジルセリンの露出に感受性のある細胞を樹立しようと考えた.具体的には,細胞外にCa2+の存在しない条件でBa/F3細胞を1μMのA23187により刺激し,ホスファチジルセリンを高いレベルで露出した細胞(上位1~5%)をFACSにより分取した.細胞をCa2+を含まない培地で1日培養しホスファチジルセリンを細胞膜の内側にもどしたのち,Ca2+を含む培地で1週間ほど培養し,再度,FACSによる細胞の分取を行った.この過程を何回かくり返したのち,今度はA23187の濃度を段階的(500 nM,250 nM,125 nM)に下げながら刺激と分取とをくり返し,ホスファチジルセリンの露出に感受性のある細胞の濃縮を行った.最終的には,FACSによる細胞の分取を19回くり返すことで,親細胞(PS0細胞)ではホスファチジルセリンをほとんど露出しない125 nMのA23187という条件においてもすみやかにホスファチジルセリンを露出する細胞(PS19細胞)を樹立することができた.
それでは,このPS19細胞にはどのような変化が起こったのであろうか? ホスファチジルセリンを内側にとどめておくフリッパーゼの活性が弱くなっている可能性と,ホスファチジルセリンを外側に露出させるスクランブラーゼの活性が強くなっている可能性が考えられた.これらの可能性を検証するため,古くからがん細胞と正常細胞とのあいだで優性形質を決めるために用いられてきた細胞融合法により,PS0細胞とPS19細胞のどちらの形質が優性かを決めた.PS0細胞にはレトロウイルスベクターを用いてGFPとピューロマイシン耐性遺伝子を発現させ,PS19細胞にはDsRedとネオマイシン耐性遺伝子を発現させた.この2つの細胞をポリエンチレングリコールの存在下で細胞融合させ,ピューロマイシンとG418による薬剤選択ののち,GFPとDsRedの両方を発現する細胞を分取した.その核型を確かめたところ,PS0とPS19との融合細胞は3倍体もしくは4倍体になっていた.この細胞をA23187により刺激しホスファチジルセリンの露出の程度を確認したところ,PS19細胞とほぼ同程度にホスファチジルセリンを露出した.これは,ホスファチジルセリンの露出においてPS19細胞の形質が優性であることを示しており,フリッパーゼの活性が弱いこと(loss of function)よりも,スクランブラーゼの活性が強いこと(gain of function)により,ホスファチジルセリンが露出しやすくなったものと考えられた.
スクランブラーゼの活性上昇にかかわる分子をPS19細胞から同定するため,まずPS0細胞との量的な差に注目しマイクロアレイや2次元電気泳動によりmRNAや蛋白質の発現を比較した.しかしながら,これらの方法ではホスファチジルセリンの露出にかかわる分子を同定することはできなかった.そこで,量的なものと質的なものの両方をカバーできる発現クローニングを行うことにした.PS19細胞から100万個のcDNAを調製してレトロウイルスベクターに組み込み,PS0細胞に発現させたのち125 nMのA23187により刺激した.1回目の刺激では反応する細胞はほとんどなかったが,これは細胞数が少ないためと考え,死細胞を含むAnnexin Vに陽性を示す細胞を分取した.このA23187による刺激と細胞分取を3回くり返すとA23187刺激なしでもAnnexin Vに陽性となる細胞集団が現われた.最初,これらの細胞は死んでいるのではないかと考えたが,顕微鏡で観察するとほとんどの細胞が生存していた.すなわち,細胞が生きたままホスファチジルセリンを恒常的に露出していた.ホスファチジルセリンの非対称性の分布は生きていくために必須だと考えていた筆者らにとって,ホスファチジルセリンを露出したまま細胞が増殖できるという事実は大きな驚きであった.
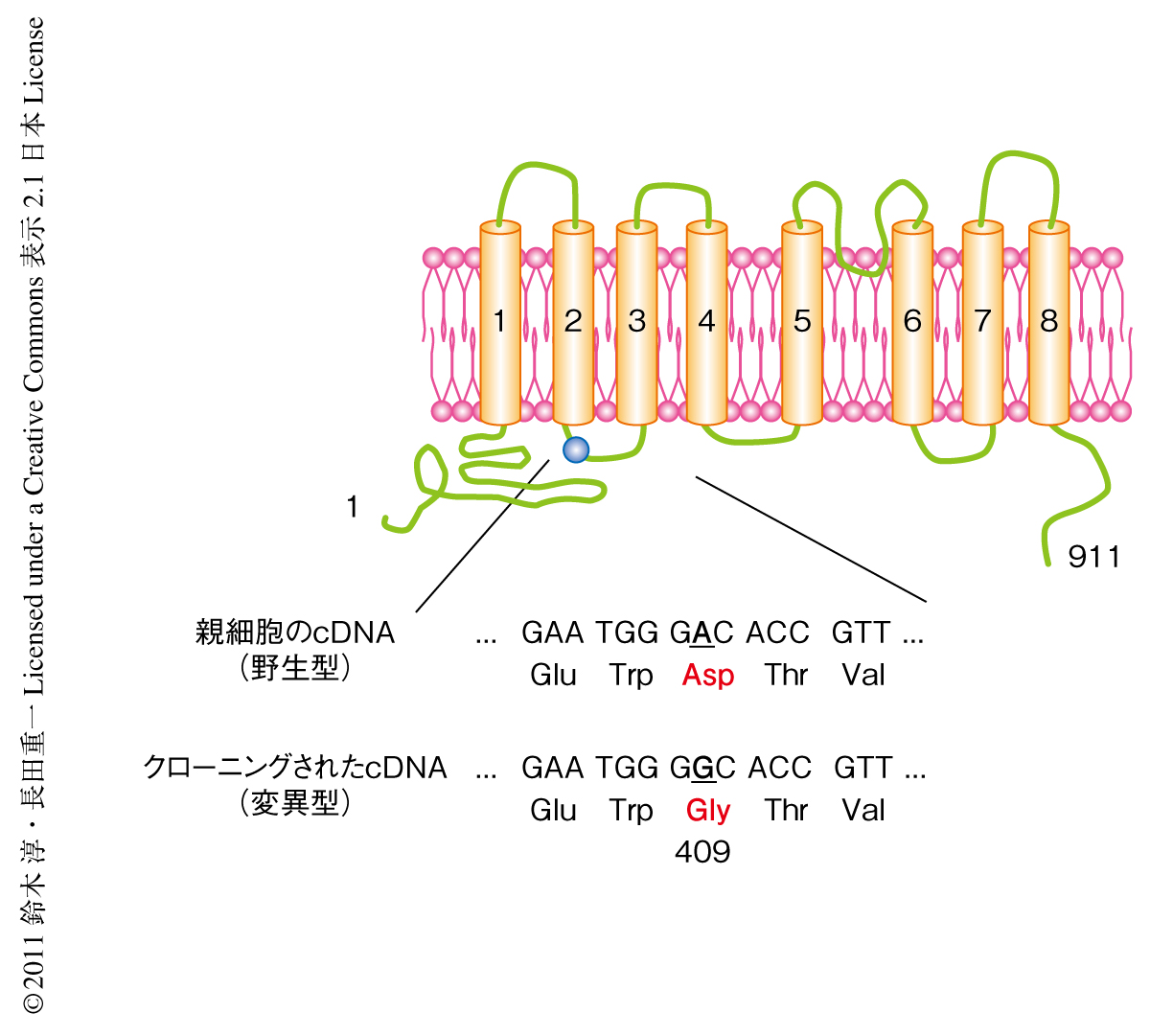
そこで,この細胞に導入されたcDNAをPCRにより増幅し,そのDNA配列を決定した.この配列を遺伝子データベースで検索し,このcDNAは8個の膜貫通領域をもつタンパク質TMEM16Fをコードするものと同定した.マイクロアレイの結果を見直してみると,TMEM16Fの発現レベルはPS0細胞とPS19細胞とで変化はなかった.しかしながら,クローニングされたPS19細胞に由来するTMEM16F遺伝子は1226番目のヌクレオチドに点変異が挿入され,その産物の409番目のアミノ酸残基はアスパラギン酸からグリシンに置換していた(図2).このD409G変異はPS0細胞には存在しておらず,PS19細胞から作製した異なるcDNAライブラリーにも認められたことから,PS0細胞からの19回の細胞分取の過程で導入されたものと考えられた.
TMEM16FとRFPとの融合タンパク質を293T細胞に発現させたところ細胞膜に局在した.つぎに,野生型TMEM16FおよびD409G変異型TMEM16FをBa/F3細胞に発現させた.すると,D409G変異型TMEM16Fを発現させた細胞においてホスファチジルセリンは恒常的に露出した.D409G変異型TMEM16FはA23187の刺激なしでホスファチジルセリンを露出することから,Ca2+に非依存的にホスファチジルセリンを露出しているのではないかと考え,細胞内のCa2+をBAPTA-AMによりキレートしたところホスファチジルセリンの露出は阻害された.そこで,TMEM16Fが細胞内のCa2+を上昇させるCa2+チャネルである可能性を考え,細胞内のCa2+濃度をFluo4-AMにより調べたが野生型TMEM16FあるいはD409G変異型TMEM16Fを発現する細胞はともにCa2+濃度に変化はなかった.また,A23187によるCa2+の流入効率もTMEM16Fの発現により影響をうけなかった.以上の結果から,D409G変異型TMEM16Fは内在性のCa2+濃度(100 nM)に応答してホスファチジルセリンを露出しているものと考えられた.
では,野生型TMEM16Fもホスファチジルセリンの露出にかかわっているのだろうか? 野生型TMEM16Fの発現はそれ自体ではホスファチジルセリンを露出しないが,A23187により刺激すると対照よりもすみやかにホスファチジルセリンを露出した.以上の結果から,TMEM16FはCa2+に依存してホスファチジルセリン露出を促すタンパク質,スクランブラーゼではないかと考えた.
ホスファチジルセリンの露出にかかわるスクランブラーゼはホスファチジルセリンに特異的なものではなくリン脂質を区別なく双方向に輸送すると考えられている.そこで,ホスファチジルセリンと同様に細胞膜の内側に存在するホスファチジルエタノールアミンが露出されるかどうかをホスファチジルエタノールアミン結合ペプチドであるRo09-0198 5) を用いて調べた.すると,D409G変異型TMEM16Fを発現させた細胞はホスファチジルエタノールアミンを恒常的に露出していた.野生型TMEM16Fはその発現のみではホスファチジルエタノールアミンを露出させないが,A23187により刺激すると対照よりもすみやかにホスファチジルエタノールアミンを露出した.以上より,TMEM16Fはホスファチジルセリンだけでなくホスファチジルエタノールアミンの露出も制御していることがわかった.
つぎに,通常は細胞膜の外側に存在するホスファチジルコリンやスフィンゴミエリンがTMEM16Fにより細胞に取り込まれるかどうかを確認した.ホスファチジルコリンやスフィンゴミエリンに対する特異的なプローブはないため,以前より使用されている蛍光標識されたホスファチジルコリン(NBD-ホスファチジルコリン)もしくはスフィンゴミエリン(NBD-スフィンゴミエリン)を用いた6).すると,D409G変異型TMEM16Fを発現させた細胞はNBD-ホスファチジルコリンおよびNBD-スフィンゴミエリンを刺激なしで恒常的に取り込むことがわかった.野生型TMEM16Fはその発現のみではこれらを取り込まないが,A23187により刺激すると対照よりもすみやかにこれらを取り込んだ.以上の結果より,TMEM16Fは内側の脂質の露出だけではなく,外側の脂質の取り込みも促進していることが示された.
この結果を確認するため,Ba/F3細胞において内在性のTMEM16Fの発現をshRNAによる遺伝子ノックダウンにより抑制したところ,ホスファチジルセリンおよびホスファチジルエタノールアミンの露出が抑制され,NBD-ホスファチジルコリンおよびNBD-スフィンゴミエリンの取り込みも阻害された.これらの結果から,TMEM16Fがリン脂質を双方向に輸送するスクランブラーゼそのもの,あるいは,その構成タンパク質であると結論した.
つぎに,TMEM16Fの生体での機能を明らかにしたいと考えた.最初の疑問であるアポトーシスのときのホスファチジルセリンの露出にかかわっているかどうかを調べることは当然であったが,この研究をはじめた当初から,Scott症候群という,血小板がホスファチジルセリンを露出できないことにより止血のできない患者の存在することがわかっていたため7),Scott症候群の患者,その両親,そして,健常者の不死化したB細胞について調べた8).Scott症候群の患者では血小板だけではなくリンパ球にもCa2+に依存したホスファチジルセリンの露出に欠陥のあることはいくつかのグループによって報告されていた.実際に,Scott症候群の患者のリンパ球株をA23187により刺激してもホスファチジルセリンは露出しなかった.
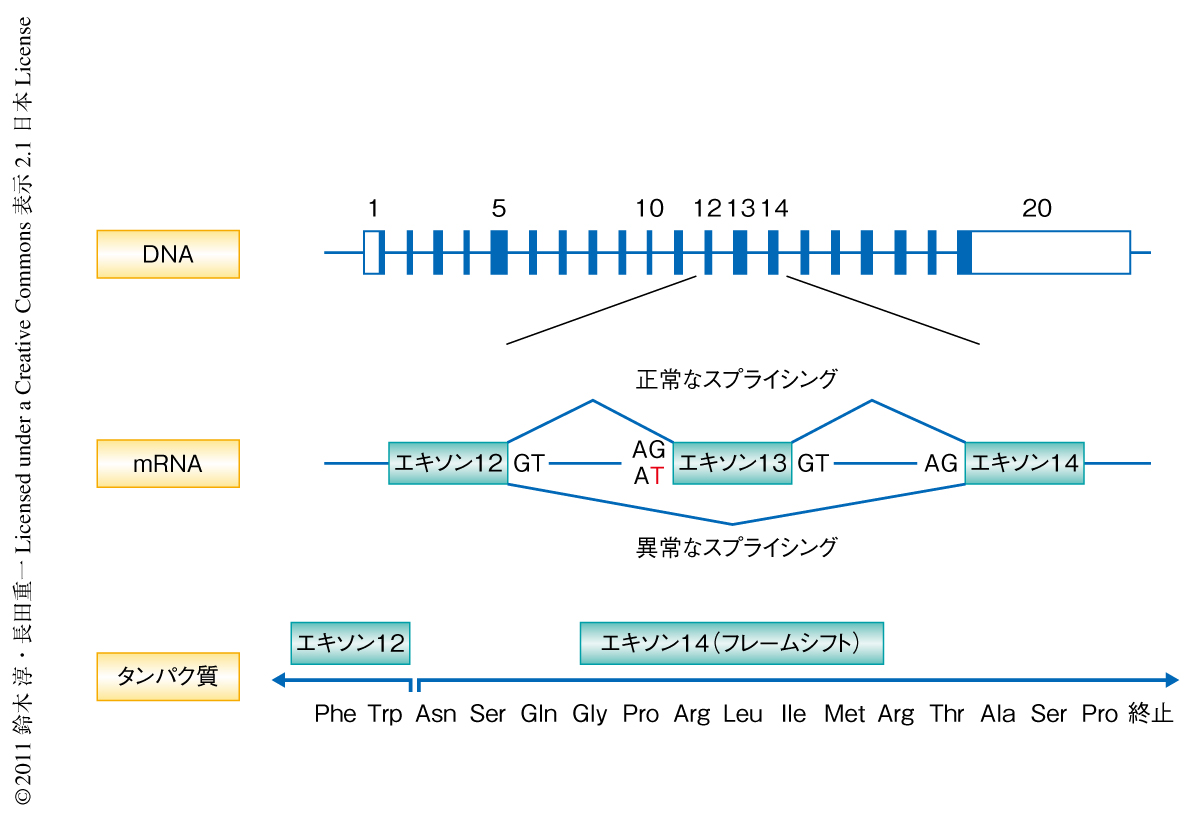
そこで,Scott症候群の患者のTMEM16F mRNAに変異があるのかどうかを調べるため,TMEM16F mRNAに対するcDNAを5’側と3’側に分けてRT-PCR法により増幅したところ,患者に由来するmRNAはTMEM16F遺伝子のエキソン13を完全に欠損していることがわかった.そこで,染色体にコードされるTMEM16F遺伝子のエキソン13の周辺の配列をダイレクトシークエンス法により調べると,いとこ結婚で生まれた患者ではイントロン12のスプライシング受容部位が両方の対立遺伝子においてAGからATに置換されており,また,その両親のTMEM16F遺伝子は同一部位の片側の対立遺伝子に変異が導入されていた.この患者では,TMEM16F遺伝子のイントロン12のスプライシング受容部位に変異が導入されたことでスプライシングの際にエキソン13がスキップされ,それによりタンパク質合成のフレームがずれてエキソン14において終止コドンが生じ,全長のタンパク質ができなくなったものと結論した(図3).以上より,TMEM16Fは活性化された血小板のホスファチジルセリンの露出に関与していると結論した.
当初は,ホスファチジルセリンを露出させるスクランブラーゼが本当に存在するのかということに疑問をもちながらはじめた研究であったが,TMEM16Fが実際にその機能を担っていることが明らかとなった.しかし,現在の段階では,TMEM16Fがスクランブラーゼとして直接にリン脂質を動かしているという可能性と,細胞の内外になんらかのイオンを通過させることで細胞膜でのリン脂質の動きを間接的に調節しているという可能性とがある.精製したTMEM16Fを用いて試験管内でスクランブラーゼ活性を再構成すること,あるいは,TMEM16Fの構造解析などによって,どちらの可能性が正しいかを明らかにする必要があろう.また,TMEM16Fがアポトーシスのときのホスファチジルセリンの露出にかかわっているのかどうかはTMEM16Fノックマウスに由来する細胞を用いることで明らかになるだろう.TMEM16は高等生物において10個のファミリーメンバーにより構成されており9),最初にCa2+活性化Cl-チャネルとして同定されたTMEM16Aにはホスファチジルセリンを露出する能力はない(鈴木 淳ら,未発表).TMEM16の10個のファミリーメンバーのなかでTMEM16F以外にリン脂質をスクランブルさせるメンバーがあるかどうかを検討する必要があろう.最後に,ホスファチジルセリンの露出はアポトーシスや血小板の活性化だけでなく,筋肉や骨の成熟,リンパ球の活性化などにおいてもみられると報告されている.TMEM16FをはじめTMEM16のファミリーメンバーがこれらの現象にかかわっているかどうかも興味深い.
略歴:2007年 大阪大学大学院医学系研究科博士課程 修了,同年 京都大学大学院医学研究科 博士研究員を経て,2010年より同 助教.
研究テーマ:細胞膜におけるリン脂質ホスファチジルセリンの露出の機構.
関心事:細胞膜におけるリン脂質の制御機構,また,その生理的な役割.
長田 重一(Shigekazu Nagata)
京都大学大学院医学研究科 教授.
研究室URL:http://www2.mfour.med.kyoto-u.ac.jp/~nagata/index.html
© 2011 鈴木 淳・長田重一 Licensed under CC 表示 2.1 日本
(京都大学大学院医学研究科 医化学分野)
email:鈴木 淳,長田重一
DOI: 10.7875/first.author.2011.003
Calcium-dependent phospholipid scrambling by TMEM16F.
Jun Suzuki, Masato Umeda, Peter J. Sims, Shigekazu Nagata
Nature, 468, 834-838 (2010)
要 約
すべての動物細胞の細胞膜は脂質二重層からなるが,細胞膜を構成するリン脂質は外層と内層とで非対称的に分布している.このリン脂質の非対称的な分布は生命現象のさまざまな局面で崩壊する.たとえば,血小板が活性化されるとその表面にはホスファチジルセリンが露出し血液凝固反応の引き金となる.このホスファチジルセリンの露出はリン脂質を双方向に輸送するCa2+依存性のスクランブラーゼのはたらきによると考えられているが,その分子としての実体,作用機構などはまったく解明されていない.今回,筆者らは,8個の膜貫通領域をもち細胞膜に局在するタンパク質TMEM16FがCa2+に依存したホスファチジルセリンの細胞表面への露出に不可欠であることを見い出した.マウス細胞株Ba/F3をCa2+の非存在下でCa2+イオノフォアにより処理するとホスファチジルセリンを可逆的に露出した.この特徴を利用してFACSによる細胞の分取を19回くり返すことによりホスファチジルセリンを強く露出する細胞株を樹立した.この細胞株からcDNAライブラリーを作製し,発現クローニングによりBa/F3細胞にホスファチジルセリンを構成的に露出させるcDNAをクローニングした.このcDNAがコードするのは点変異の導入されたTMEM16Fで,これを発現する細胞は低濃度のCa2+に応答してホスファチジルセリンを露出させる能力を獲得していた.一方,野生型TMEM16FをBa/F細胞で過剰に発現させるとCa2+イオノフォアによるリン脂質のスクランブルが促進された.血小板がホスファチジルセリンを露出できないため血液が凝固しなくなるScott症候群とよばれる疾患が知られている.この疾患をもつ1人の患者では,TMEM16F遺伝子のイントロン12のスプライス受容部位に点変異が存在した.この変異によりエキソン13がスキップされエキソン14で翻訳が中断したため全長のTMEM16Fが生じていないことがわかった.
はじめに
真核生物において細胞膜を構成するリン脂質は非対称性をもっており,ホスファチジルセリンは細胞膜の内側に,また,ホスファチジルコリンはおもに細胞膜の外側に位置している.ホスファチジルセリンの細胞膜の内側への輸送にはフリッパーゼ(aminophospholipid translocase)とよばれる酵素がかかわっており,ATPのエネルギーを用いてリン脂質の非対称性を維持している1)(図1).一方,血小板の活性化のときやアポトーシスのときにはこの非対称性が破綻しホスファチジルセリンが細胞表面に露出される.血小板におけるホスファチジルセリンの露出は血液凝固因子のはたらく足場として重要であり,血液凝固反応が効率的に進行するのに不可欠である2).また,アポトーシスのときのホスファチジルセリンの露出はマクロファージがアポトーシス細胞を死細胞として認識し貪食するために必要であり“eat-me-signal”として機能する3).これらのホスファチジルセリンの露出の過程においてはフリッパーゼが不活性化されることだけでは不十分で,Ca2+依存的なスクランブラーゼが活性化されることが重要であると考えられている4).スクランブラーゼはその名のとおり脂質をスクランブルさせる機能を保持していると考えられており,その結果としてホスファチジルセリンは細胞膜の外側に露出し,ホスファチジルコリンは内側に取り込まれる(図1).スクランブラーゼの存在は約30年前に仮定されたが,いまだその分子的な実体についてはわかっておらず,本当にそのような分子が存在するのかという点も含め分野は混沌としている.
1.アポトーシス細胞におけるホスファチジルセリンの露出
まず,アポトーシスのときのホスファチジルセリンの露出においてCa2+依存的な経路が必要かどうかを検証した.マウスT細胞株WR19LにFasを過剰発現した細胞をFasリガンドにより刺激すると,細胞は1時間でアポトーシスにより死滅する.このとき,細胞内のCa2+をFluo4-AMにより検出するとCa2+濃度は上昇していた.そこで,細胞外にCa2+の存在する条件,細胞外のCa2+をEGTAによりキレートした条件,細胞内のCa2+をBAPTA-AMによりキレートした条件,でアポトーシスを誘導した.すると,すべての条件でFasリガンドにより処理した細胞においてカスパーゼ3が活性化されていた.しかしながら,細胞表面のホスファチジルセリンをAnnexin Vにより標識すると,Ca2+をキレートした条件においてその露出が著しく抑制されていた.これは,アポトーシスのときのホスファチジルセリンの露出はCa2+依存的に起こることを示しており,Ca2+に特化したホスファチジルセリンの露出の系を構築できればそれにかかわる分子の同定が可能なのではないかと考えた.
2.Ca2+イオノフォアによるホスファチジルセリンの露出
そこで,細胞内へのCa2+の流入のみでホスファチジルセリンが露出するかどうかを検討した.3日で100倍に増殖するという点と遺伝子導入が容易であるという点からマウスB細胞株Ba/F3を用い,Ca2+の流入にはCa2+イオノフォアA23187を用いた.細胞外に0.5 mMのCa2+の存在する条件において1μMのA23187で処理すると,細胞内にCa2+が流入し5分以内にホスファチジルセリンが露出した.しかしながら,15分経過するとすべての細胞が破裂し死滅した.これは,大量のCa2+の流入が細胞のチャネルなどを活性化しイオン濃度しいては浸透圧を変化させた結果だと考えられた.一方,細胞外にCa2+の存在しない条件において1μMのA23187で処理すると15分以内にホスファチジルセリンが露出したが細胞は破裂しなかった.この反応はCa2+に依存的であり,細胞内のCa2+をBAPTA-AMでキレートすると抑制された.つまり,細胞外にCa2+の存在しない条件では小胞体などに貯蓄されたCa2+が放出され,ホスファチジルセリンの露出を誘導したものと考えられた.
ついで,A23187刺激によりホスファチジルセリンを露出した細胞に対しBAPTA-AMで処理することによりCa2+をキレートすると,いちど露出したホスファチジルセリンが再び細胞膜の内側にもどった.そこで,ホスファチジルセリンを露出した細胞からA23187を除きCa2+を含まない培地で1日培養すると,つぎの日にはすべての細胞のホスファチジルセリンが細胞膜の内側にもどっていた.つまり,細胞外にCa2+の存在しない条件でA23187を処理することにより,生きた細胞が一過的にホスファチジルセリンを露出する系を構築することができた.
3.ホスファチジルセリン露出に感受性のある細胞の樹立
そこで,“生きた細胞が一過性にホスファチジルセリンを露出する”という特徴を活かし,ホスファチジルセリンの露出に感受性のある細胞を樹立しようと考えた.具体的には,細胞外にCa2+の存在しない条件でBa/F3細胞を1μMのA23187により刺激し,ホスファチジルセリンを高いレベルで露出した細胞(上位1~5%)をFACSにより分取した.細胞をCa2+を含まない培地で1日培養しホスファチジルセリンを細胞膜の内側にもどしたのち,Ca2+を含む培地で1週間ほど培養し,再度,FACSによる細胞の分取を行った.この過程を何回かくり返したのち,今度はA23187の濃度を段階的(500 nM,250 nM,125 nM)に下げながら刺激と分取とをくり返し,ホスファチジルセリンの露出に感受性のある細胞の濃縮を行った.最終的には,FACSによる細胞の分取を19回くり返すことで,親細胞(PS0細胞)ではホスファチジルセリンをほとんど露出しない125 nMのA23187という条件においてもすみやかにホスファチジルセリンを露出する細胞(PS19細胞)を樹立することができた.
それでは,このPS19細胞にはどのような変化が起こったのであろうか? ホスファチジルセリンを内側にとどめておくフリッパーゼの活性が弱くなっている可能性と,ホスファチジルセリンを外側に露出させるスクランブラーゼの活性が強くなっている可能性が考えられた.これらの可能性を検証するため,古くからがん細胞と正常細胞とのあいだで優性形質を決めるために用いられてきた細胞融合法により,PS0細胞とPS19細胞のどちらの形質が優性かを決めた.PS0細胞にはレトロウイルスベクターを用いてGFPとピューロマイシン耐性遺伝子を発現させ,PS19細胞にはDsRedとネオマイシン耐性遺伝子を発現させた.この2つの細胞をポリエンチレングリコールの存在下で細胞融合させ,ピューロマイシンとG418による薬剤選択ののち,GFPとDsRedの両方を発現する細胞を分取した.その核型を確かめたところ,PS0とPS19との融合細胞は3倍体もしくは4倍体になっていた.この細胞をA23187により刺激しホスファチジルセリンの露出の程度を確認したところ,PS19細胞とほぼ同程度にホスファチジルセリンを露出した.これは,ホスファチジルセリンの露出においてPS19細胞の形質が優性であることを示しており,フリッパーゼの活性が弱いこと(loss of function)よりも,スクランブラーゼの活性が強いこと(gain of function)により,ホスファチジルセリンが露出しやすくなったものと考えられた.
4.ホスファチジルセリン露出因子の発現クローニング
スクランブラーゼの活性上昇にかかわる分子をPS19細胞から同定するため,まずPS0細胞との量的な差に注目しマイクロアレイや2次元電気泳動によりmRNAや蛋白質の発現を比較した.しかしながら,これらの方法ではホスファチジルセリンの露出にかかわる分子を同定することはできなかった.そこで,量的なものと質的なものの両方をカバーできる発現クローニングを行うことにした.PS19細胞から100万個のcDNAを調製してレトロウイルスベクターに組み込み,PS0細胞に発現させたのち125 nMのA23187により刺激した.1回目の刺激では反応する細胞はほとんどなかったが,これは細胞数が少ないためと考え,死細胞を含むAnnexin Vに陽性を示す細胞を分取した.このA23187による刺激と細胞分取を3回くり返すとA23187刺激なしでもAnnexin Vに陽性となる細胞集団が現われた.最初,これらの細胞は死んでいるのではないかと考えたが,顕微鏡で観察するとほとんどの細胞が生存していた.すなわち,細胞が生きたままホスファチジルセリンを恒常的に露出していた.ホスファチジルセリンの非対称性の分布は生きていくために必須だと考えていた筆者らにとって,ホスファチジルセリンを露出したまま細胞が増殖できるという事実は大きな驚きであった.
そこで,この細胞に導入されたcDNAをPCRにより増幅し,そのDNA配列を決定した.この配列を遺伝子データベースで検索し,このcDNAは8個の膜貫通領域をもつタンパク質TMEM16Fをコードするものと同定した.マイクロアレイの結果を見直してみると,TMEM16Fの発現レベルはPS0細胞とPS19細胞とで変化はなかった.しかしながら,クローニングされたPS19細胞に由来するTMEM16F遺伝子は1226番目のヌクレオチドに点変異が挿入され,その産物の409番目のアミノ酸残基はアスパラギン酸からグリシンに置換していた(図2).このD409G変異はPS0細胞には存在しておらず,PS19細胞から作製した異なるcDNAライブラリーにも認められたことから,PS0細胞からの19回の細胞分取の過程で導入されたものと考えられた.
5.TMEM16Fによるホスファチジルセリンの露出
TMEM16FとRFPとの融合タンパク質を293T細胞に発現させたところ細胞膜に局在した.つぎに,野生型TMEM16FおよびD409G変異型TMEM16FをBa/F3細胞に発現させた.すると,D409G変異型TMEM16Fを発現させた細胞においてホスファチジルセリンは恒常的に露出した.D409G変異型TMEM16FはA23187の刺激なしでホスファチジルセリンを露出することから,Ca2+に非依存的にホスファチジルセリンを露出しているのではないかと考え,細胞内のCa2+をBAPTA-AMによりキレートしたところホスファチジルセリンの露出は阻害された.そこで,TMEM16Fが細胞内のCa2+を上昇させるCa2+チャネルである可能性を考え,細胞内のCa2+濃度をFluo4-AMにより調べたが野生型TMEM16FあるいはD409G変異型TMEM16Fを発現する細胞はともにCa2+濃度に変化はなかった.また,A23187によるCa2+の流入効率もTMEM16Fの発現により影響をうけなかった.以上の結果から,D409G変異型TMEM16Fは内在性のCa2+濃度(100 nM)に応答してホスファチジルセリンを露出しているものと考えられた.
では,野生型TMEM16Fもホスファチジルセリンの露出にかかわっているのだろうか? 野生型TMEM16Fの発現はそれ自体ではホスファチジルセリンを露出しないが,A23187により刺激すると対照よりもすみやかにホスファチジルセリンを露出した.以上の結果から,TMEM16FはCa2+に依存してホスファチジルセリン露出を促すタンパク質,スクランブラーゼではないかと考えた.
6.TMEM16Fによるリン脂質のスクランブル
ホスファチジルセリンの露出にかかわるスクランブラーゼはホスファチジルセリンに特異的なものではなくリン脂質を区別なく双方向に輸送すると考えられている.そこで,ホスファチジルセリンと同様に細胞膜の内側に存在するホスファチジルエタノールアミンが露出されるかどうかをホスファチジルエタノールアミン結合ペプチドであるRo09-0198 5) を用いて調べた.すると,D409G変異型TMEM16Fを発現させた細胞はホスファチジルエタノールアミンを恒常的に露出していた.野生型TMEM16Fはその発現のみではホスファチジルエタノールアミンを露出させないが,A23187により刺激すると対照よりもすみやかにホスファチジルエタノールアミンを露出した.以上より,TMEM16Fはホスファチジルセリンだけでなくホスファチジルエタノールアミンの露出も制御していることがわかった.
つぎに,通常は細胞膜の外側に存在するホスファチジルコリンやスフィンゴミエリンがTMEM16Fにより細胞に取り込まれるかどうかを確認した.ホスファチジルコリンやスフィンゴミエリンに対する特異的なプローブはないため,以前より使用されている蛍光標識されたホスファチジルコリン(NBD-ホスファチジルコリン)もしくはスフィンゴミエリン(NBD-スフィンゴミエリン)を用いた6).すると,D409G変異型TMEM16Fを発現させた細胞はNBD-ホスファチジルコリンおよびNBD-スフィンゴミエリンを刺激なしで恒常的に取り込むことがわかった.野生型TMEM16Fはその発現のみではこれらを取り込まないが,A23187により刺激すると対照よりもすみやかにこれらを取り込んだ.以上の結果より,TMEM16Fは内側の脂質の露出だけではなく,外側の脂質の取り込みも促進していることが示された.
この結果を確認するため,Ba/F3細胞において内在性のTMEM16Fの発現をshRNAによる遺伝子ノックダウンにより抑制したところ,ホスファチジルセリンおよびホスファチジルエタノールアミンの露出が抑制され,NBD-ホスファチジルコリンおよびNBD-スフィンゴミエリンの取り込みも阻害された.これらの結果から,TMEM16Fがリン脂質を双方向に輸送するスクランブラーゼそのもの,あるいは,その構成タンパク質であると結論した.
7.Scott症候群におけるTMEM16Fの変異
つぎに,TMEM16Fの生体での機能を明らかにしたいと考えた.最初の疑問であるアポトーシスのときのホスファチジルセリンの露出にかかわっているかどうかを調べることは当然であったが,この研究をはじめた当初から,Scott症候群という,血小板がホスファチジルセリンを露出できないことにより止血のできない患者の存在することがわかっていたため7),Scott症候群の患者,その両親,そして,健常者の不死化したB細胞について調べた8).Scott症候群の患者では血小板だけではなくリンパ球にもCa2+に依存したホスファチジルセリンの露出に欠陥のあることはいくつかのグループによって報告されていた.実際に,Scott症候群の患者のリンパ球株をA23187により刺激してもホスファチジルセリンは露出しなかった.
そこで,Scott症候群の患者のTMEM16F mRNAに変異があるのかどうかを調べるため,TMEM16F mRNAに対するcDNAを5’側と3’側に分けてRT-PCR法により増幅したところ,患者に由来するmRNAはTMEM16F遺伝子のエキソン13を完全に欠損していることがわかった.そこで,染色体にコードされるTMEM16F遺伝子のエキソン13の周辺の配列をダイレクトシークエンス法により調べると,いとこ結婚で生まれた患者ではイントロン12のスプライシング受容部位が両方の対立遺伝子においてAGからATに置換されており,また,その両親のTMEM16F遺伝子は同一部位の片側の対立遺伝子に変異が導入されていた.この患者では,TMEM16F遺伝子のイントロン12のスプライシング受容部位に変異が導入されたことでスプライシングの際にエキソン13がスキップされ,それによりタンパク質合成のフレームがずれてエキソン14において終止コドンが生じ,全長のタンパク質ができなくなったものと結論した(図3).以上より,TMEM16Fは活性化された血小板のホスファチジルセリンの露出に関与していると結論した.
おわりに
当初は,ホスファチジルセリンを露出させるスクランブラーゼが本当に存在するのかということに疑問をもちながらはじめた研究であったが,TMEM16Fが実際にその機能を担っていることが明らかとなった.しかし,現在の段階では,TMEM16Fがスクランブラーゼとして直接にリン脂質を動かしているという可能性と,細胞の内外になんらかのイオンを通過させることで細胞膜でのリン脂質の動きを間接的に調節しているという可能性とがある.精製したTMEM16Fを用いて試験管内でスクランブラーゼ活性を再構成すること,あるいは,TMEM16Fの構造解析などによって,どちらの可能性が正しいかを明らかにする必要があろう.また,TMEM16Fがアポトーシスのときのホスファチジルセリンの露出にかかわっているのかどうかはTMEM16Fノックマウスに由来する細胞を用いることで明らかになるだろう.TMEM16は高等生物において10個のファミリーメンバーにより構成されており9),最初にCa2+活性化Cl-チャネルとして同定されたTMEM16Aにはホスファチジルセリンを露出する能力はない(鈴木 淳ら,未発表).TMEM16の10個のファミリーメンバーのなかでTMEM16F以外にリン脂質をスクランブルさせるメンバーがあるかどうかを検討する必要があろう.最後に,ホスファチジルセリンの露出はアポトーシスや血小板の活性化だけでなく,筋肉や骨の成熟,リンパ球の活性化などにおいてもみられると報告されている.TMEM16FをはじめTMEM16のファミリーメンバーがこれらの現象にかかわっているかどうかも興味深い.
文 献
- Daleke, D.: Phospholipid flippases. J. Biol. Chem., 282, 821-825 (2007)[PubMed]
- Zwaal, R. F., Comfurius, P. & Bervers, E. M.: Lipid-protein interactions in blood coagulation. Biochim. Biophys. Acta, 1376, 433-453 (1998)[PubMed]
- Nagata, S., Hanayama, R., & Kawane, K.: Autoimmunity and the clearance of dead cells. Cell, 140, 619-630 (2010)[PubMed]
- Balasubramanian, K. & Schroit, A. J.: Aminophospholipid asymmetry: A matter of life and death. Annu. Rev. Physiol., 65, 701-734 (2003)[PubMed]
- Emoto, K., Toyama-Sorimachi, N., Karasuyama, H. et al.: Exposure of phosphatidylethanolamine on the surface of apoptotic cells. Exp. Cell Res., 232, 430-434 (1997)[PubMed]
- Williamson, P., Christie, A., Kohlin, T. et al.: Phospholipid scramblase activation pathways in lymphocytes. Biochemistry, 40, 8065-8072 (2001)[PubMed]
- Weiss, H. & Lages, B.: Family studies in Scott syndrome. Blood, 90, 475-476 (1997)[PubMed]
- Kojima, H., Newton-Nash, D., Weiss, H. J. et al.: Production and characterization of transformed B-lymphocytes expressing the membrane defect of Scott syndrome. J. Clin. Invest., 94, 2237-2244 (1994)[PubMed]
- Galietta, L.: The TMEM16 protein family: a new class of chloride channels? Biophys. J., 97, 3047-3053 (2009)[PubMed]
著者プロフィール
略歴:2007年 大阪大学大学院医学系研究科博士課程 修了,同年 京都大学大学院医学研究科 博士研究員を経て,2010年より同 助教.
研究テーマ:細胞膜におけるリン脂質ホスファチジルセリンの露出の機構.
関心事:細胞膜におけるリン脂質の制御機構,また,その生理的な役割.
長田 重一(Shigekazu Nagata)
京都大学大学院医学研究科 教授.
研究室URL:http://www2.mfour.med.kyoto-u.ac.jp/~nagata/index.html
© 2011 鈴木 淳・長田重一 Licensed under CC 表示 2.1 日本