ピルビン酸キナーゼMのアイソフォームPkm1はがんの増殖を細胞自律的に促進する
盛田麻美・佐藤 卓・田沼延公
(宮城県立がんセンター研究所 がん薬物療法研究部)
email:田沼延公
DOI: 10.7875/first.author.2018.038
PKM1 confers metabolic advantages and promotes cell-autonomous tumor cell growth.
Mami Morita, Taku Sato, Miyuki Nomura, Yoshimi Sakamoto, Yui Inoue, Ryota Tanaka, Shigemi Ito, Koreyuki Kurosawa, Kazunori Yamaguchi, Yuki Sugiura, Hiroshi Takizaki, Yoji Yamashita, Ryuichi Katakura, Ikuro Sato, Masaaki Kawai, Yoshinori Okada, Hitomi Watanabe, Gen Kondoh, Shoko Matsumoto, Ayako Kishimoto, Miki Obata, Masaki Matsumoto, Tatsuro Fukuhara, Hozumi Motohashi, Makoto Suematsu, Masaaki Komatsu, Keiichi I. Nakayama, Toshio Watanabe, Tomoyoshi Soga, Hiroshi Shima, Makoto Maemondo, Nobuhiro Tanuma
Cancer Cell, 33, 355-367.e7 (2018)
がんにはグルコースが好気的に代謝されにくいというWarburg効果があるが,その意義についてはよくわかっていない.この研究において,筆者らは,Warburg効果の鍵をにぎる解糖系の酵素ピルビン酸キナーゼMの新たな遺伝子改変マウスを作出することなどにより,Warburg効果には細胞の生存あるいは増殖に対しむしろ不利にはたらく面のあることを明らかにした.ピルビン酸キナーゼMには選択的スプライシングにより産生される2つのアイソフォームPkm1およびPkm2が存在し,そのうち,Pkm2の選択的な発現がWarburg効果の成立には必須とされており,ほとんどのがん細胞はPkm1ではなくPkm2を圧倒的に高く発現する.ところが,マウスにおける発がん実験や移植モデルにおける解析において,Pkm1はPkm2よりもがんの増殖を促進することがわかった.Pkm1はPkm2と比べ代謝活性が高く,そのため,グルコース代謝の全般を亢進する.小細胞肺がんを典型とする肺神経内分泌腫瘍においてはPkm1の発現が高く,このPkm1の発現は小細胞肺がんの増殖に必須であった.これらの結果は,Pkm2によるグルコース代謝の制限が発がんに必須であるという定説に対する強い反証となるとともに,肺神経内分泌腫瘍のような一部のがんにおいてPkm1やその関連する形質が新たな治療の標的になる可能性が示された.
がん細胞が大量のグルコースを取り込むことは疑いない.大量に取り込まれたグルコースはグルコースが好気的に代謝されにくいというWarburg効果にしたがい,ミトコンドリアにおけるクエン酸回路などの異化反応よりも核酸やNADPHの生合成に動員される.そうすることにより,がんは代謝のメリットを多く享受しているというのがこれまでのもっとも一般的な解釈と思われる.
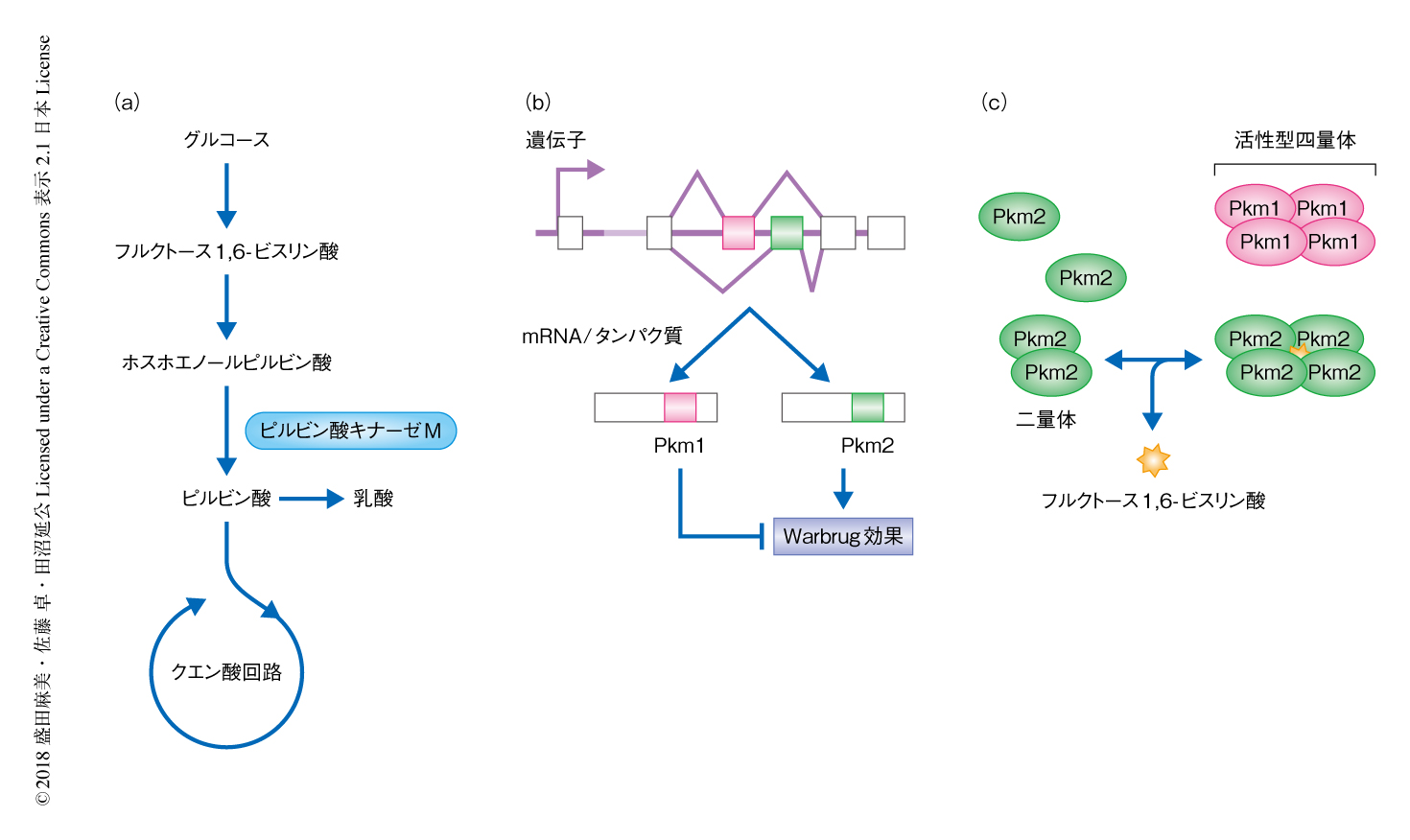
この仮説がつくられる過程において大きな役割をはたしたもののひとつが,がんとPkm2のストーリーである1).ピルビン酸キナーゼMは解糖系の最終の段階,ホスホエノールピルビン酸からピルビン酸への反応を触媒する(図1).この酵素には選択的スプライシングにより産生される2つのアイソフォームPkm1およびPkm2が存在し,このうち,Pkm2の選択的な発現がWarburg効果に必須とされる.脳や筋肉などにおいておもに発現するPkm1が構成的な高活性型なのに対し,通常,Pkm2は活性が低く維持されており,Pkm2の活性化には解糖系の中間産物であるフルクトース1,6-ビスリン酸などのアロステリック因子が必要になる.そのため,Pkm2を発現する細胞においてはグルコースに由来する炭素のクエン酸回路への流入が制限される.Pkm2がグルコースからクエン酸回路への流入を抑制しつつ,なぜ,乳酸の産生を促進させるのかは完全な謎である.
ともかくも,大半のがん細胞がPkm2を高く発現することは,がんの一般的な性質としてのWarburg効果と符合するとみられている1).当初,Pkm2のもたらすWarburg効果はがんの増殖を促進すると考えられてきた2).ところが,いくつかの実験的な発がんモデルにおいて,Pkm2ノックアウトマウスにてがんの促進が示された3-5).それらをうけ,Pkm2およびWarburg効果はがんに対し本当に促進的といえるのか,疑問の声があがっていた.
Pkm遺伝子のエキソン10を欠失させたPkm2ノックアウトマウスにおいては,Pkm2の欠損とともに代償的なPkm1の発現が起こる3,4).しかし,その代償的なPkm1の発現量と,もともとのPkm1およびPkm2の発現量とのあいだにはへだたりがあり,そのため,このモデルにおいてPkm1とPkm2の機能を比較するのは困難であった.この問題を解決するため,新たにピルビン酸キナーゼMの選択的スプライシングが起こらないマウスを作出した.すなわち,Pkm1をコードするcDNAあるいはPkm2をコードするcDNAの後半の部分をポリA付加シグナルとともにエキソン8の途中にシームレスにノックインした.これらのノックインマウスはPkm1あるいはPkm2のいずれか片方のみをほぼ同じレベルで発現した.Pkm1ノックインマウスおよびPkm2ノックインマウスはいっけん正常に生育し繁殖も可能であった.
これらのノックインマウスを用いてKras遺伝子に依存的な肺発がん実験,あるいは,全身性の化学発がん実験を実施したところ,Pkm1ノックインマウスにおいては,野生型のマウスあるいはPkm2ノックインマウスと比べ,がんの発生や進展が促進されることがわかった.これらのノックインマウスに由来する胎仔線維芽細胞および肺上皮細胞を用いた形質転換および移植実験から,Pkm1によるがんの促進作用はがん細胞に自律的なものと考えられた.
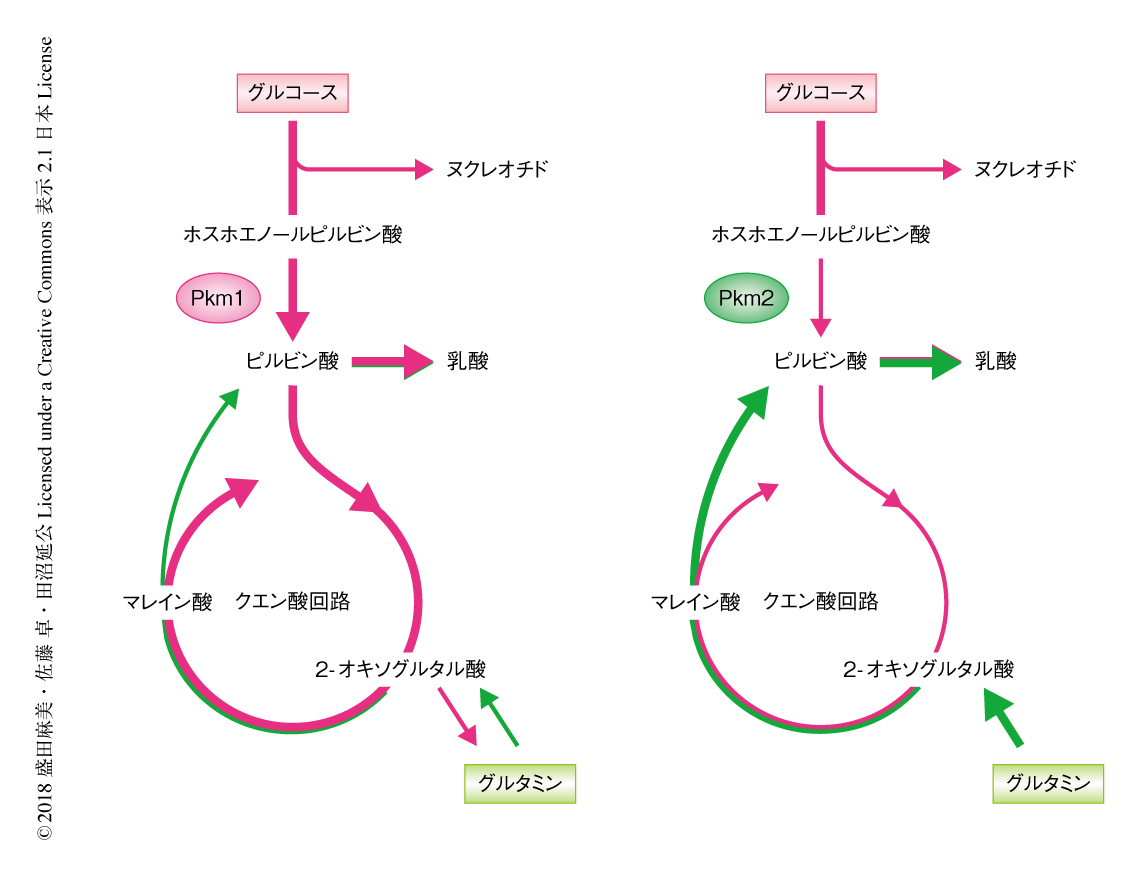
Pkm1を発現する細胞とPkm2を発現する細胞の代謝を比較するため,形質転換したマウス胎仔線維芽細胞において13Cにより標識したグルコースを用いてトレーサー実験を実施した.その結果,グルコースに由来する炭素のクエン酸回路への流入がPkm1により促進されていた.また,これまで提唱されていたモデルとは異なり1,4),Pkm1により核酸や各種のアミノ酸の生合成がさまたげられることはないこともわかった.
また,グルコースに由来する乳酸の産生もPkm1により促進されたが,Pkm1あるいはPkm2と乳酸の産生の制御については少々複雑であった.Pkm1によりグルコースから乳酸への変換が亢進される一方,これまでの報告と一致して2),細胞において産生される乳酸の総量はPkm2ノックインマウスに由来する細胞のほうが高い傾向にあった.つまり,Pkm2はグルコースに由来する乳酸の産生を制限しつつ,ほかの炭素源からの乳酸の産生を促進することが示唆された.
これらの結果の原因を探るため,13Cにより標識したグルタミンを用いてトレーサー実験を実施した.Pkm2ノックインマウスに由来する細胞においては,Pkm1ノックインマウスに由来する細胞と比べ,グルタミンがアスパラギン酸,ピルビン酸,アラニン,乳酸へとより活発に代謝されていることがわかった(図2).
以上から,Pkm1が各種の生体成分の生合成をさまたげることなくグルコースの異化を亢進すること,一方で,栄養源としてのグルタミンの利用を減弱させることが明らかにされた.
エネルギーの好気的な産生を担うミトコンドリアには,その電子伝達系の機能が低下した場合,活性酸素を生じて細胞に損傷をあたえてしまうという面がある.Pkm1あるいはPkm2によるエネルギー代謝への影響をより詳細に調べるため,Pkm1ノックインマウスあるいはPkm2ノックインマウスに由来する肺上皮細胞のミトコンドリアを解析した.その結果,Pkm2ノックインマウスに由来する肺上皮細胞には,活性酸素を発生しやすい劣化したミトコンドリアが蓄積していることが示唆された.また,ストレス条件のもとや移植したがんなどにて,Pkm1ノックインマウスに由来する肺上皮細胞においては必須アミノ酸を中心に各種のアミノ酸の量が高く維持されていた.これらの結果から,Pkm1がオートファジーおよびマイトファジーを促進することが示唆された.
そこで,Pkm1ノックインマウスに由来する細胞およびPkm2ノックインマウスに由来する細胞において,オートファジーに必須とされるATG7をゲノム編集技術を用いて欠損させた.ATG7の欠損によりPkm1ノックインマウスに由来する胎仔線維芽細胞のがん原性が大きく損なわれたことなどから,がんの増殖においてオートファジーあるいはマイトファジーは促進的な作用をもつことがわかった.一連の結果から,Pkm1はオートファジーを亢進し,この面においてもがんに代謝におけるメリットをもたらすことが強く示唆された.
小細胞肺がんを典型とする肺神経内分泌腫瘍はすべての肺がんのうち15~20%をしめる.それ以外の肺がんと比べ,初回の抗がん剤治療あるいは放射線治療が効きやすい傾向にあるが,その大半は再発をきたし,予後はむしろ悪い.マウスの正常な組織においてPkm1あるいはPkm2の発現を注意深く解析することにより,正常な肺気管支の神経内分泌細胞は上皮細胞の系列としては例外的にPkm1を発現することが見い出された.最近の研究により,この細胞は肺神経内分泌腫瘍の起源となる細胞と考えられている6).そこで,肺神経内分泌腫瘍におけるPkm1およびPkm2の発現を調べ,そのほかのがん種における発現と比較した.
手術により得た検体の検討においては,腺がんや扁平上皮がんなどそれ以外の肺がんと比べ,肺神経内分泌腫瘍においてはPkm1 mRNAのレベルが高く,Pkm1とPkm2の比も有意に高かった.細胞株の解析においても,肺神経内分泌腫瘍に由来する細胞株はそれ以外の細胞株と比べ,いちじるしく高いPkm1の発現量,また,Pkm1とPkm2の比を示した.これらの結果から,腺がんや扁平上皮がんと比べ,肺神経内分泌腫瘍においてはPkm1の発現量が高く,その性質は株化ののちも維持されることが明らかにされた.
質量分析を用いた絶対定量により,小細胞肺がん細胞株においてPkm1がPkm1とPkm2の合計にしめる割合は16~40%ともとめられた.つまり,小細胞肺がん細胞株においてはPkm1とPkm2が混在することになる.そのような状況において,多量体の形成によるPkm1あるいはPkm2の活性の制御はどうなっているのかを検討した.すると,小細胞肺がん細胞株においては,アロステリック因子の低下をひき起こすグルコース飢餓の条件においてもPkm2が四量体として存在することがわかった.in vitroにおける再構成実験などから,Pkm1とPkm2が共存すると両者はアロステリック因子なしに活性型の四量体を形成することがわかった.これらの結果から,Pkm1にはPkm2を活性化する能力のあることが示唆された.
小細胞肺がんにおけるPkm1の発現の意義について調べるため,ヒトの小細胞肺がん細胞株を親株として,Pkm1あるいはPkm2の一方を同じ程度に発現する細胞株を作製し,その増殖について調べた.その結果,Pkm2を単独で発現する細胞においては増殖はいちじしく減弱していた.したがって,少なくとも検討した小細胞肺がん細胞株においては,Pkm1に起因する高いピルビン酸キナーゼ活性が増殖あるいは生存の維持に必須であることが示唆された.
がんとピルビン酸キナーゼMのアイソフォームの制御をめぐっては議論がつづいていたが,この研究において,筆者らは,新たなモデルマウスを作製してひとつの結論に達した.がんにおいて,Pkm1はPkm2よりも細胞自律的に増殖を促進することがいくつもの実験系において明らかにされた.また,これまで,増殖している細胞においては発現しないとされていたPkm1がヒトのがんの一部のサブセットにおいて高く発現し,それらがん細胞の増殖あるいは生存をささえていることが明らかにされた.少なくとも,グルコースの好気的な代謝の抑制は各種の生体成分の生合成の維持に必須という従来の仮説は再考する必要があるだろう.実際に,最近,がんにおいてはクエン酸回路が正常な組織を比べより活発であるという報告が主流になりつつある7,8).
Pkm1によるがんの促進作用は,これまで,グルコース代謝の全身性の異常によるとされてきたPkm2ノックアウトマウスにおいてみられるがんの促進の現象を3,5),うまく説明するように思われた.この研究においては,少なくとも形質転換したマウス胎仔線維芽細胞あるいは肺上皮細胞において,Pkm1によるグルコースの異化の亢進はオートファジーおよびマイトファジーの活性化を介してアミノ酸の量の維持や劣化したミトコンドリアの除去に貢献することが示唆された.一般に,オートファジーは栄養(とくに,アミノ酸)飢餓に対する応答と考えられており,予想外であった.現時点において,Pkm1がオートファジーを活性化する機序はよくわかっておらず,今後,明らかにする必要があると思われる.ところで,Pkm2については非代謝性の機能も多く報告されていて,それらのほとんどはPkm2に特異的とされている9,10).しかし,この研究においては,Pkm2の非代謝性の機能について,たとえば,HIF-1との協調やSTAT3のリン酸化への貢献は確認されなかった.
この研究においてPkm1の重要性が確認された小細胞肺がんを含む肺神経内分泌腫瘍の治療をめぐっては,この15~20年のあいだ,根本的な進歩がなかった.近年の大規模なゲノム解析により,肺神経内分泌腫瘍におけるTP53遺伝子やRb1遺伝子の同時の機能の欠損が明らかにされたが,同時に,現時点で創薬の可能なゲノム変異はほとんど存在しないことも明らかにされている11).今後,Pkm1やその関連する形質を標的として,新たな肺神経内分泌腫瘍の治療の開発に挑戦したいと考えている.
略歴:2016年 東北大学大学院医学系研究科博士課程 修了,同年より宮城県立がんセンター研究所 特任研究員.
研究テーマ:肺がんの治療法の開発.
抱負:肺がんに対する新たな治療法の開発をめざして研究を進めたい.
佐藤 卓(Taku Sato)
宮城県立がんセンター研究所 特任研究員.
田沼 延公(Nobuhiro Tanuma)
宮城県立がんセンター研究所 主任研究員.
© 2018 盛田麻美・佐藤 卓・田沼延公 Licensed under CC 表示 2.1 日本
(宮城県立がんセンター研究所 がん薬物療法研究部)
email:田沼延公
DOI: 10.7875/first.author.2018.038
PKM1 confers metabolic advantages and promotes cell-autonomous tumor cell growth.
Mami Morita, Taku Sato, Miyuki Nomura, Yoshimi Sakamoto, Yui Inoue, Ryota Tanaka, Shigemi Ito, Koreyuki Kurosawa, Kazunori Yamaguchi, Yuki Sugiura, Hiroshi Takizaki, Yoji Yamashita, Ryuichi Katakura, Ikuro Sato, Masaaki Kawai, Yoshinori Okada, Hitomi Watanabe, Gen Kondoh, Shoko Matsumoto, Ayako Kishimoto, Miki Obata, Masaki Matsumoto, Tatsuro Fukuhara, Hozumi Motohashi, Makoto Suematsu, Masaaki Komatsu, Keiichi I. Nakayama, Toshio Watanabe, Tomoyoshi Soga, Hiroshi Shima, Makoto Maemondo, Nobuhiro Tanuma
Cancer Cell, 33, 355-367.e7 (2018)
要 約
がんにはグルコースが好気的に代謝されにくいというWarburg効果があるが,その意義についてはよくわかっていない.この研究において,筆者らは,Warburg効果の鍵をにぎる解糖系の酵素ピルビン酸キナーゼMの新たな遺伝子改変マウスを作出することなどにより,Warburg効果には細胞の生存あるいは増殖に対しむしろ不利にはたらく面のあることを明らかにした.ピルビン酸キナーゼMには選択的スプライシングにより産生される2つのアイソフォームPkm1およびPkm2が存在し,そのうち,Pkm2の選択的な発現がWarburg効果の成立には必須とされており,ほとんどのがん細胞はPkm1ではなくPkm2を圧倒的に高く発現する.ところが,マウスにおける発がん実験や移植モデルにおける解析において,Pkm1はPkm2よりもがんの増殖を促進することがわかった.Pkm1はPkm2と比べ代謝活性が高く,そのため,グルコース代謝の全般を亢進する.小細胞肺がんを典型とする肺神経内分泌腫瘍においてはPkm1の発現が高く,このPkm1の発現は小細胞肺がんの増殖に必須であった.これらの結果は,Pkm2によるグルコース代謝の制限が発がんに必須であるという定説に対する強い反証となるとともに,肺神経内分泌腫瘍のような一部のがんにおいてPkm1やその関連する形質が新たな治療の標的になる可能性が示された.
はじめに
がん細胞が大量のグルコースを取り込むことは疑いない.大量に取り込まれたグルコースはグルコースが好気的に代謝されにくいというWarburg効果にしたがい,ミトコンドリアにおけるクエン酸回路などの異化反応よりも核酸やNADPHの生合成に動員される.そうすることにより,がんは代謝のメリットを多く享受しているというのがこれまでのもっとも一般的な解釈と思われる.
この仮説がつくられる過程において大きな役割をはたしたもののひとつが,がんとPkm2のストーリーである1).ピルビン酸キナーゼMは解糖系の最終の段階,ホスホエノールピルビン酸からピルビン酸への反応を触媒する(図1).この酵素には選択的スプライシングにより産生される2つのアイソフォームPkm1およびPkm2が存在し,このうち,Pkm2の選択的な発現がWarburg効果に必須とされる.脳や筋肉などにおいておもに発現するPkm1が構成的な高活性型なのに対し,通常,Pkm2は活性が低く維持されており,Pkm2の活性化には解糖系の中間産物であるフルクトース1,6-ビスリン酸などのアロステリック因子が必要になる.そのため,Pkm2を発現する細胞においてはグルコースに由来する炭素のクエン酸回路への流入が制限される.Pkm2がグルコースからクエン酸回路への流入を抑制しつつ,なぜ,乳酸の産生を促進させるのかは完全な謎である.
ともかくも,大半のがん細胞がPkm2を高く発現することは,がんの一般的な性質としてのWarburg効果と符合するとみられている1).当初,Pkm2のもたらすWarburg効果はがんの増殖を促進すると考えられてきた2).ところが,いくつかの実験的な発がんモデルにおいて,Pkm2ノックアウトマウスにてがんの促進が示された3-5).それらをうけ,Pkm2およびWarburg効果はがんに対し本当に促進的といえるのか,疑問の声があがっていた.
1.Pkm1はPkm2よりも細胞自律的にがんの増殖を促進する
Pkm遺伝子のエキソン10を欠失させたPkm2ノックアウトマウスにおいては,Pkm2の欠損とともに代償的なPkm1の発現が起こる3,4).しかし,その代償的なPkm1の発現量と,もともとのPkm1およびPkm2の発現量とのあいだにはへだたりがあり,そのため,このモデルにおいてPkm1とPkm2の機能を比較するのは困難であった.この問題を解決するため,新たにピルビン酸キナーゼMの選択的スプライシングが起こらないマウスを作出した.すなわち,Pkm1をコードするcDNAあるいはPkm2をコードするcDNAの後半の部分をポリA付加シグナルとともにエキソン8の途中にシームレスにノックインした.これらのノックインマウスはPkm1あるいはPkm2のいずれか片方のみをほぼ同じレベルで発現した.Pkm1ノックインマウスおよびPkm2ノックインマウスはいっけん正常に生育し繁殖も可能であった.
これらのノックインマウスを用いてKras遺伝子に依存的な肺発がん実験,あるいは,全身性の化学発がん実験を実施したところ,Pkm1ノックインマウスにおいては,野生型のマウスあるいはPkm2ノックインマウスと比べ,がんの発生や進展が促進されることがわかった.これらのノックインマウスに由来する胎仔線維芽細胞および肺上皮細胞を用いた形質転換および移植実験から,Pkm1によるがんの促進作用はがん細胞に自律的なものと考えられた.
2.Pkm1はグルコース代謝を亢進させる
Pkm1を発現する細胞とPkm2を発現する細胞の代謝を比較するため,形質転換したマウス胎仔線維芽細胞において13Cにより標識したグルコースを用いてトレーサー実験を実施した.その結果,グルコースに由来する炭素のクエン酸回路への流入がPkm1により促進されていた.また,これまで提唱されていたモデルとは異なり1,4),Pkm1により核酸や各種のアミノ酸の生合成がさまたげられることはないこともわかった.
また,グルコースに由来する乳酸の産生もPkm1により促進されたが,Pkm1あるいはPkm2と乳酸の産生の制御については少々複雑であった.Pkm1によりグルコースから乳酸への変換が亢進される一方,これまでの報告と一致して2),細胞において産生される乳酸の総量はPkm2ノックインマウスに由来する細胞のほうが高い傾向にあった.つまり,Pkm2はグルコースに由来する乳酸の産生を制限しつつ,ほかの炭素源からの乳酸の産生を促進することが示唆された.
これらの結果の原因を探るため,13Cにより標識したグルタミンを用いてトレーサー実験を実施した.Pkm2ノックインマウスに由来する細胞においては,Pkm1ノックインマウスに由来する細胞と比べ,グルタミンがアスパラギン酸,ピルビン酸,アラニン,乳酸へとより活発に代謝されていることがわかった(図2).
以上から,Pkm1が各種の生体成分の生合成をさまたげることなくグルコースの異化を亢進すること,一方で,栄養源としてのグルタミンの利用を減弱させることが明らかにされた.
3.Pkm1はオートファジーおよびマイトファジーを促進する
エネルギーの好気的な産生を担うミトコンドリアには,その電子伝達系の機能が低下した場合,活性酸素を生じて細胞に損傷をあたえてしまうという面がある.Pkm1あるいはPkm2によるエネルギー代謝への影響をより詳細に調べるため,Pkm1ノックインマウスあるいはPkm2ノックインマウスに由来する肺上皮細胞のミトコンドリアを解析した.その結果,Pkm2ノックインマウスに由来する肺上皮細胞には,活性酸素を発生しやすい劣化したミトコンドリアが蓄積していることが示唆された.また,ストレス条件のもとや移植したがんなどにて,Pkm1ノックインマウスに由来する肺上皮細胞においては必須アミノ酸を中心に各種のアミノ酸の量が高く維持されていた.これらの結果から,Pkm1がオートファジーおよびマイトファジーを促進することが示唆された.
そこで,Pkm1ノックインマウスに由来する細胞およびPkm2ノックインマウスに由来する細胞において,オートファジーに必須とされるATG7をゲノム編集技術を用いて欠損させた.ATG7の欠損によりPkm1ノックインマウスに由来する胎仔線維芽細胞のがん原性が大きく損なわれたことなどから,がんの増殖においてオートファジーあるいはマイトファジーは促進的な作用をもつことがわかった.一連の結果から,Pkm1はオートファジーを亢進し,この面においてもがんに代謝におけるメリットをもたらすことが強く示唆された.
4.肺神経内分泌腫瘍のPkm1に対する依存性
小細胞肺がんを典型とする肺神経内分泌腫瘍はすべての肺がんのうち15~20%をしめる.それ以外の肺がんと比べ,初回の抗がん剤治療あるいは放射線治療が効きやすい傾向にあるが,その大半は再発をきたし,予後はむしろ悪い.マウスの正常な組織においてPkm1あるいはPkm2の発現を注意深く解析することにより,正常な肺気管支の神経内分泌細胞は上皮細胞の系列としては例外的にPkm1を発現することが見い出された.最近の研究により,この細胞は肺神経内分泌腫瘍の起源となる細胞と考えられている6).そこで,肺神経内分泌腫瘍におけるPkm1およびPkm2の発現を調べ,そのほかのがん種における発現と比較した.
手術により得た検体の検討においては,腺がんや扁平上皮がんなどそれ以外の肺がんと比べ,肺神経内分泌腫瘍においてはPkm1 mRNAのレベルが高く,Pkm1とPkm2の比も有意に高かった.細胞株の解析においても,肺神経内分泌腫瘍に由来する細胞株はそれ以外の細胞株と比べ,いちじるしく高いPkm1の発現量,また,Pkm1とPkm2の比を示した.これらの結果から,腺がんや扁平上皮がんと比べ,肺神経内分泌腫瘍においてはPkm1の発現量が高く,その性質は株化ののちも維持されることが明らかにされた.
質量分析を用いた絶対定量により,小細胞肺がん細胞株においてPkm1がPkm1とPkm2の合計にしめる割合は16~40%ともとめられた.つまり,小細胞肺がん細胞株においてはPkm1とPkm2が混在することになる.そのような状況において,多量体の形成によるPkm1あるいはPkm2の活性の制御はどうなっているのかを検討した.すると,小細胞肺がん細胞株においては,アロステリック因子の低下をひき起こすグルコース飢餓の条件においてもPkm2が四量体として存在することがわかった.in vitroにおける再構成実験などから,Pkm1とPkm2が共存すると両者はアロステリック因子なしに活性型の四量体を形成することがわかった.これらの結果から,Pkm1にはPkm2を活性化する能力のあることが示唆された.
小細胞肺がんにおけるPkm1の発現の意義について調べるため,ヒトの小細胞肺がん細胞株を親株として,Pkm1あるいはPkm2の一方を同じ程度に発現する細胞株を作製し,その増殖について調べた.その結果,Pkm2を単独で発現する細胞においては増殖はいちじしく減弱していた.したがって,少なくとも検討した小細胞肺がん細胞株においては,Pkm1に起因する高いピルビン酸キナーゼ活性が増殖あるいは生存の維持に必須であることが示唆された.
おわりに
がんとピルビン酸キナーゼMのアイソフォームの制御をめぐっては議論がつづいていたが,この研究において,筆者らは,新たなモデルマウスを作製してひとつの結論に達した.がんにおいて,Pkm1はPkm2よりも細胞自律的に増殖を促進することがいくつもの実験系において明らかにされた.また,これまで,増殖している細胞においては発現しないとされていたPkm1がヒトのがんの一部のサブセットにおいて高く発現し,それらがん細胞の増殖あるいは生存をささえていることが明らかにされた.少なくとも,グルコースの好気的な代謝の抑制は各種の生体成分の生合成の維持に必須という従来の仮説は再考する必要があるだろう.実際に,最近,がんにおいてはクエン酸回路が正常な組織を比べより活発であるという報告が主流になりつつある7,8).
Pkm1によるがんの促進作用は,これまで,グルコース代謝の全身性の異常によるとされてきたPkm2ノックアウトマウスにおいてみられるがんの促進の現象を3,5),うまく説明するように思われた.この研究においては,少なくとも形質転換したマウス胎仔線維芽細胞あるいは肺上皮細胞において,Pkm1によるグルコースの異化の亢進はオートファジーおよびマイトファジーの活性化を介してアミノ酸の量の維持や劣化したミトコンドリアの除去に貢献することが示唆された.一般に,オートファジーは栄養(とくに,アミノ酸)飢餓に対する応答と考えられており,予想外であった.現時点において,Pkm1がオートファジーを活性化する機序はよくわかっておらず,今後,明らかにする必要があると思われる.ところで,Pkm2については非代謝性の機能も多く報告されていて,それらのほとんどはPkm2に特異的とされている9,10).しかし,この研究においては,Pkm2の非代謝性の機能について,たとえば,HIF-1との協調やSTAT3のリン酸化への貢献は確認されなかった.
この研究においてPkm1の重要性が確認された小細胞肺がんを含む肺神経内分泌腫瘍の治療をめぐっては,この15~20年のあいだ,根本的な進歩がなかった.近年の大規模なゲノム解析により,肺神経内分泌腫瘍におけるTP53遺伝子やRb1遺伝子の同時の機能の欠損が明らかにされたが,同時に,現時点で創薬の可能なゲノム変異はほとんど存在しないことも明らかにされている11).今後,Pkm1やその関連する形質を標的として,新たな肺神経内分泌腫瘍の治療の開発に挑戦したいと考えている.
文 献
- Vander Heiden, M. G., Cantley, L. C. & Thompson, C. B.: Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science, 324, 1029-1033 (2009)[PubMed]
- Christofk, H. R., Vander Heiden, M. G., Harris, M. H. et al.: The M2 splice isoform of pyruvate kinase is important for cancer metabolism and tumour growth. Nature, 452, 230-233 (2008)[PubMed]
- Israelsen, W. J., Dayton, T. L., Davidson, S. M. et al.: PKM2 isoform-specific deletion reveals a differential requirement for pyruvate kinase in tumor cells. Cell, 155, 397-409 (2013)[PubMed]
- Lunt, S. Y., Muralidhar, V., Hosios, A. M. et al.: Pyruvate kinase isoform expression alters nucleotide synthesis to impact cell proliferation. Mol. Cell, 57, 95-107 (2015)[PubMed]
- Dayton, T. L., Gocheva, V., Miller, K. M. et al.: Germline loss of PKM2 promotes metabolic distress and hepatocellular carcinoma. Genes Dev, 30, 1020-1033 (2016)[PubMed]
- Asselin-Labat, M. L. & Filby, C. E.: Adult lung stem cells and their contribution to lung tumourigenesis. Open Biol., 2, 120094 (2012)[PubMed]
- Kerr, E. M., Gaude, E., Turrell, F. K. et al.: Mutant Kras copy number defines metabolic reprogramming and therapeutic susceptibilities. Nature, 531, 110-113 (2016)[PubMed]
- Hensley, C. T., Faubert, B., Yuan, Q. et al.: Metabolic heterogeneity in human lung tumors. Cell, 164, 681-694 (2016)[PubMed]
- Luo, W., Hu, H., Chang, R. et al.: Pyruvate kinase M2 is a PHD3-stimulated coactivator for hypoxia-inducible factor 1. Cell, 145, 732-744 (2011)[PubMed]
- Gao, X., Wang, H., Yang, J. J. et al.: Pyruvate kinase M2 regulates gene transcription by acting as a protein kinase. Mol. Cell, 45, 598-609 (2012)[PubMed]
- George, J., Lim, J. S., Jang, S. J. et al.: Comprehensive genomic profiles of small cell lung cancer. Nature, 524, 47-53 (2015)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2016年 東北大学大学院医学系研究科博士課程 修了,同年より宮城県立がんセンター研究所 特任研究員.
研究テーマ:肺がんの治療法の開発.
抱負:肺がんに対する新たな治療法の開発をめざして研究を進めたい.
佐藤 卓(Taku Sato)
宮城県立がんセンター研究所 特任研究員.
田沼 延公(Nobuhiro Tanuma)
宮城県立がんセンター研究所 主任研究員.
© 2018 盛田麻美・佐藤 卓・田沼延公 Licensed under CC 表示 2.1 日本