ZAPSは抗ウイルス応答において活性化されるRIG-Iの強力な調節因子である
早川清雄・亀山武志・高岡晃教
(北海道大学遺伝子病制御研究所 分子生体防御分野)
email:高岡晃教
DOI: 10.7875/first.author.2011.007
ZAPS is a potent stimulator of signaling mediated by the RNA helicase RIG-I during antiviral responses.
Sumio Hayakawa, Souichi Shiratori, Hiroaki Yamato, Takeshi Kameyama, Chihiro Kitatsuji, Fumi Kashigi, Showhey Goto, Shoichiro Kameoka, Daisuke Fujikura, Taisho Yamada, Tatsuaki Mizutani, Mika Kazumata, Maiko Sato, Junji Tanaka, Masahiro Asaka, Yusuke Ohba, Tadaaki Miyazaki, Masahiro Imamura, Akinori Takaoka
Nature Immunology, 12, 37-44 (2011)
ポリ(ADP-リボース)ポリメラーゼはDNA修復など多くの生理的な機能を担っている.筆者らは今回,そのスーパーファミリーのメンバーであるPARP-13/ZAPの短いタイプのアイソフォームについて,その発現がRIG-Iを介するシグナルで増強され,RIG-Iを介する自然免疫応答を強力に増強するタンパク質であることを見い出し,ZAPSと名づけた.ZAPSはRIG-IのリガンドとなるRNAによる刺激に依存してRIG-Iと会合し,そのオリゴマー化やATPase活性を増強することでIRF3やNF-κBなどの転写因子の活性化を強く誘導した.さらに,各種のヒト細胞においてZAPSの発現を抑制または欠損させると,RNAによる刺激やインフルエンザウイルスなどのウイルスの感染によりひき起こされるインターフェロンαやインターフェロンβ,そのほかの炎症性サイトカインの産生が強く抑制された.今回の研究から,ZAPSはRIG-Iを介する自然免疫シグナル経路において重要な調節因子であることが示され,感染症の治療の新しいターゲットタンパク質ともなりうる可能性が示唆された.
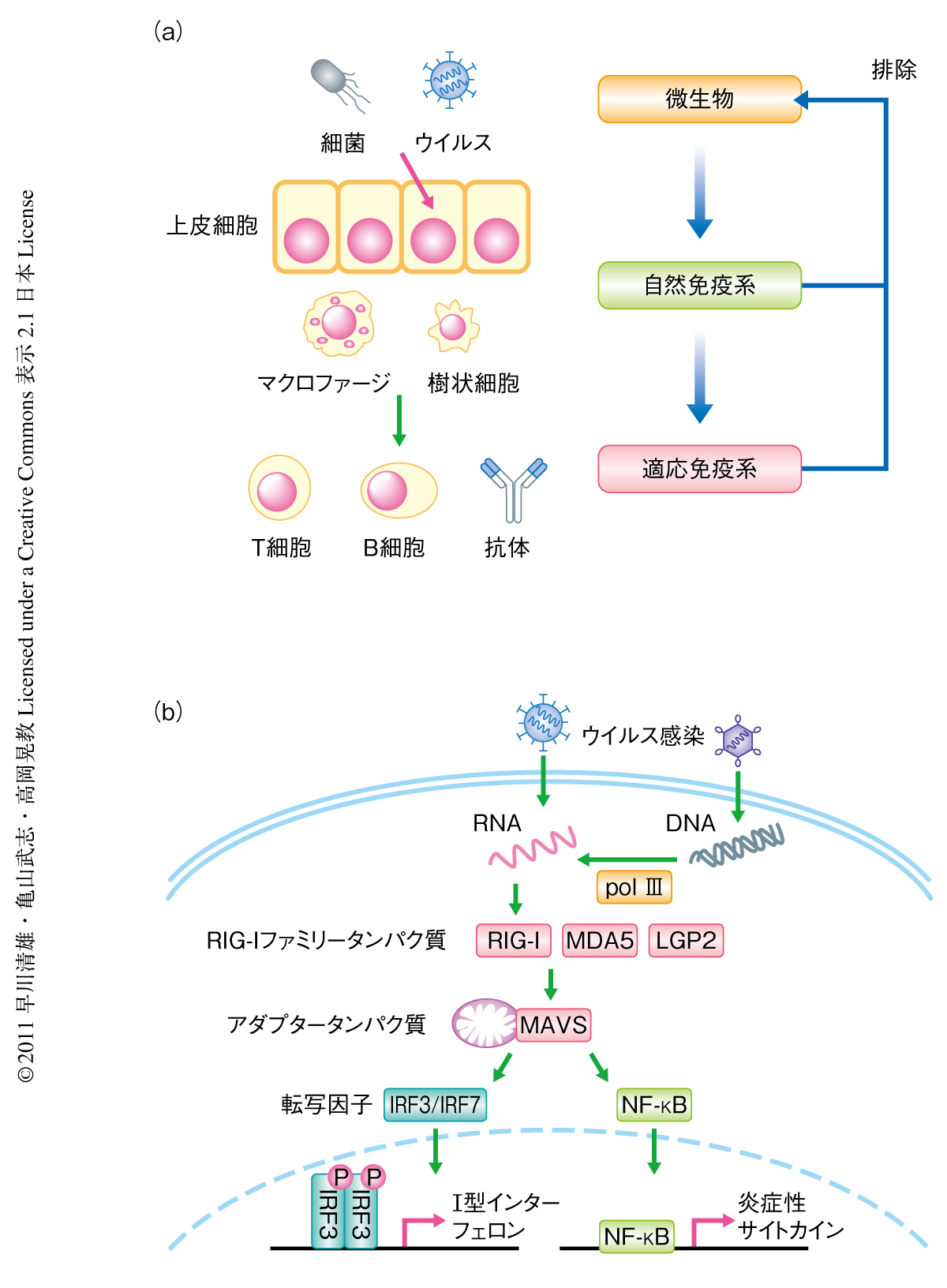
われわれの体には侵入した微生物を排除しようとする免疫機構が備えられている.ウイルス感染や細菌感染が起こった際にまず第1段階として活性化されるのが自然免疫である(図1a).自然免疫応答は脊椎動物のみならず無脊椎動物を含む多くの生物に備えられている.自然免疫応答の活性化は,感染の最前線でパターン認識受容体(pattern recognition receptors:PRRs)が微生物に由来する核酸やリポ多糖類(LPS),ペプチドグリカンなどの構成分子(pathogen-associated molecular patterns:PAMPs)を認識することからはじまる.パターン認識受容体のなかでもとくにウイルス感染の場合,ウイルスに由来するRNAが認識の対象となり,細胞質に存在するパターン認識受容体であるRIG-I(retinoic acid inducible gene I)やMDA-5(melanoma differentiation associated gene 5)などのRIG-Iファミリーがその認識に関与している1)(図1b).RNAヘリカーゼであるRIG-IがウイルスRNAを認識するとRIG-Iに構造変化が生じ,そのN末端領域にあるCARD(caspase recuitment domain)と,同じくCARDをもつ下流のアダプタータンパク質IPS-1(別名:MAVS,VISA,Cardif)とが互いのCARDを介して相互作用する.ひきつづき,TBK1などのキナーゼがリクルートされて,転写因子であるIRF3,IRF7,または,NF-κBが活性化される.活性化されたこれらの転写因子はすみやかに核に移行し,I型インターフェロンを発現誘導することでいちはやく病原体の排除機構が作動する.
今回,筆者らが着目したポリ(ADP-リボース)ポリメラーゼ(PARP)は,現在,ヒトでは少なくとも17種類が知られており,その酵素活性に依存的または非依存的に細胞分裂や細胞周期の調節,DNA修復や細胞死の誘導などの多くの生理的な機能を担っている一方,各種の炎症や変性疾患の病因とも関与していることが報告されている2-5).とくにPARP-13/ZAPはMoloneyマウス白血病ウイルスなどある特定のウイルスに由来するmRNAに結合し分解することでウイルスの複製を阻害していることが報告されている3,6,7).しかしながら,PARPスーパーファミリーと宿主のパターン認識受容体を介する自然免疫応答との関連性についてはこれまで明らかにされていなかった.
この研究では,PARP-13/ZAPの短いタイプのアイソフォームであるZAPSがRIG-Iの活性化を調節するタンパク質であることを同定し,とくにインフルエンザウイルスの感染における役割に焦点をあて解析を進めた.
核酸によって誘導される自然免疫応答におけるPARPスーパーファミリーの役割を解明するため,微生物の感染をはじめ,炎症,免疫応答との関連性が報告されていたPARP-1,PARP-2,PARP-7,PARP-9,PARP-12,PARP-13/ZAPをヒト胎児腎細胞に由来するHEK293T細胞に外因性に発現させ,3pRNA(RIG-Iのリガンドとなる5’側に三リン酸修飾をもつRNA),ポリ(rI:rC),ポリ(dA:dT)をトランスフェクションすることにより誘導される自然免疫応答への影響を検討した.PARP-1やPARP-2,PARP-9についてはわずかな増強効果を認める一方で,PARP-13/ZAPを発現させた細胞では対照となる細胞と比較してインターフェロンβのmRNAの発現を10倍近くも増強することがわかった.PARP-7とPARP-12に関してはインターフェロンβの発現に対する増強効果は認められなかった.刺激に用いた核酸はいずれもHEK293T細胞においてRIG-I経路を活性化することが知られていることから,RIG-I経路におけるPARP-13/ZAPの役割についてさらに検討を進めることにした.
これまでPARP-13/ZAPには2つのアイソフォーム,すなわち,PARPドメインをもつ全長のアイソフォームであるZAPと,PARPドメインをもたない短いタイプのアイソフォームとが知られている8).これらのアイソフォームについてインターフェロンβの発現に対する増強効果を比較したところ,どちらのアイソフォームも増強効果を示すものの,全長のアイソフォームと比較して短いタイプのアイソフォームはインターフェロンβの発現をより強く誘導した.また,興味深いことに,短いタイプのアイソフォームは全長のアイソフォームと比較して,3pRNA刺激およびインターフェロンα処理によって強く誘導されることから,とくに短いタイプのアイソフォームをZAPS(ZAP, short form)と名づけ,RIG-Iシグナル経路における役割についてさらに解析を進めた.
まず,RIG-Iを介するI型インターフェロン応答にZAPSがあたえる影響について検討した.HEK293T細胞にZAPSを過剰に発現させたところ,時間依存的またはZAPSの発現ベクター量に依存的に3pRNA刺激によってインターフェロンβのみならずインターフェロンαの発現誘導が強く増強された.さらに,ZAPSの発現をそのsiRNAによりノックダウンしたヒト由来の細胞(HEK293T細胞,A549細胞,HeLa細胞,THP-1細胞,MRC-5細胞,CD14陽性単球)に対し3pRNAやインフルエンザウイルス由来のゲノムRNAを細胞質にトランスフェクションすると,I型インターフェロンの遺伝子発現の誘導が有意に抑制された.これは,インターフェロン応答のみならず,そのほかのサイトカインの誘導においても同様に認められた.そこで,ZAPSの発現をsiRNAによりノックダウンしたHEK293T細胞に対し,ルシフェラーゼレポーターアッセイ,ネイティブポリアクリルアミドゲル電気泳動,および,ゲルシフトアッセイによる解析を行ったところ,RIG-Iの下流ではたらく転写因子IRF3およびNF-κBの活性が抑制されていた.これらの結果は,ZAPSがRIG-I経路のどこかのステップに関与していることを示していた.そこで,RIG-I経路の関連シグナル分子であるSTINGやMAVS,および,RIG-Iに対するsiRNAとともに,ZAPSの発現ベクターを共導入したところ,ZAPSはRIG-Iを介するシグナル経路のなかでもRIG-Iの近傍においてRIG-Iの活性化に関与していることを示唆する結果が得られた.
ZAPSはRIG-Iの近傍で関与しているという結果が得られたことから,ZAPSがRIG-Iと会合するかどうかについて,共焦点レーザー顕微鏡による解析およびFRET(fluorescence resonance energy transfer,蛍光共鳴エネルギー移動)解析を行った.3pRNAによる刺激に依存してZAPSとRIG-Iとは細胞質に共局在することが観察され,さらに,同じ部位にFRETシグナルを検出することができた.さらに,RIG-IとZAPSとの結合性について免疫沈降法により検討した.ヒト由来の細胞(HEK293T細胞,A549細胞,MRC-5細胞)において,3pRNA刺激あるいはRIG-I経路を活性化することで知られるニューカッスル病ウイルスによる感染に依存してZAPSとRIG-Iとの会合が確認された.また,大腸菌に由来する組換えタンパク質を用いた表面プラズモン共鳴(surface plasmon resonance:SPR)解析によって分子間の相互作用を調べたところ,ZAPSはRIG-Iと直接結合することが明らかになった.
RIG-Iの活性化の過程にはオリゴマー化やATPaseの活性化,そして,MAVSとの相互作用が含まれる9,10).実際に,HEK293T細胞にタグつきのRIG-Iを発現させてそのオリゴマー化を検出する系において,siRNAによりZAPSの発現をノックダウンした場合,ニューカッスル病ウイルス感染により誘導されるRIG-Iのオリゴマー化が抑制された.また,大腸菌に由来する組換えRIG-Iを用いて3pRNA刺激によるATPase活性の変動を定量すると,同時にくわえた組換えZAPSの量に依存してATPase活性は上昇した.これらのデータと一致して,siRNAによりZAPSの発現をノックダウンしたHEK293T細胞では共発現させたRIG-IとMAVSとの会合が有意に減少することが免疫沈降法により確認された.これらの結果から,ZAPSはRIG-Iと会合することによりRIG-Iの活性化プロセスを増強する作用のあることが示された.
RIG-Iはインフルエンザウイルスおよびニューカッスル病ウイルスの感染の際にウイルスに由来するRNAを認識して自然免疫系を活性化させる10).そこで,ヒト肺に由来する細胞株A549においてsiRNAによりZAPSの発現をノックダウンさせ,インフルエンザウイルスまたはニューカッスル病ウイルスを感染させてインターフェロンやサイトカインの発現を定量RT-PCRおよびELISA法を用いて定量した.その結果,ウイルス感染後6時間あるいは12時間で,インターフェロンα1およびインターフェロンβをはじめ,各種のサイトカイン(インターロイキン6やTNF,CXCL10)のRNAレベルでの発現が顕著に抑制され,24時間後のインターフェロンβの産生誘導もタンパク質レベルで有意に抑制されていた.さらに,siRNAによりZAPSの発現をノックダウンした細胞ではウイルスの複製を反映するウイルスゲノムからの遺伝子の発現が有意に増加していた.さらに興味深いことに,逆に,ZAPSの発現を外因性に増加させると,インフルエンザウイルス感染によるインターフェロンβの発現レベルが強力に増強されウイルス量も大きく減少していた.これらの結果から,ZAPSはI型インターフェロンおよび炎症性サイトカインの発現誘導を正に制御しており,ウイルスに対する感染防御という観点から重要な役割を担っていることが示唆された.
最後に,ZAPSの重要性を検証するため,特異的なジンクフィンガーヌクレアーゼを使用してHEK293T細胞においてZAPSをノックアウトした複数の細胞を樹立した.この細胞を用いてニューカッスル病ウイルスの感染や3pRNA刺激を行ったところ,インターフェロンβおよび炎症性サイトカインの発現誘導が顕著に阻害された.また,この細胞にZAPSをもどすことによりこの応答性は回復した.以上の結果から,ZAPSはウイルス感染におけるRIG-Iを介する自然免疫応答において重要な調節因子であることが示された.
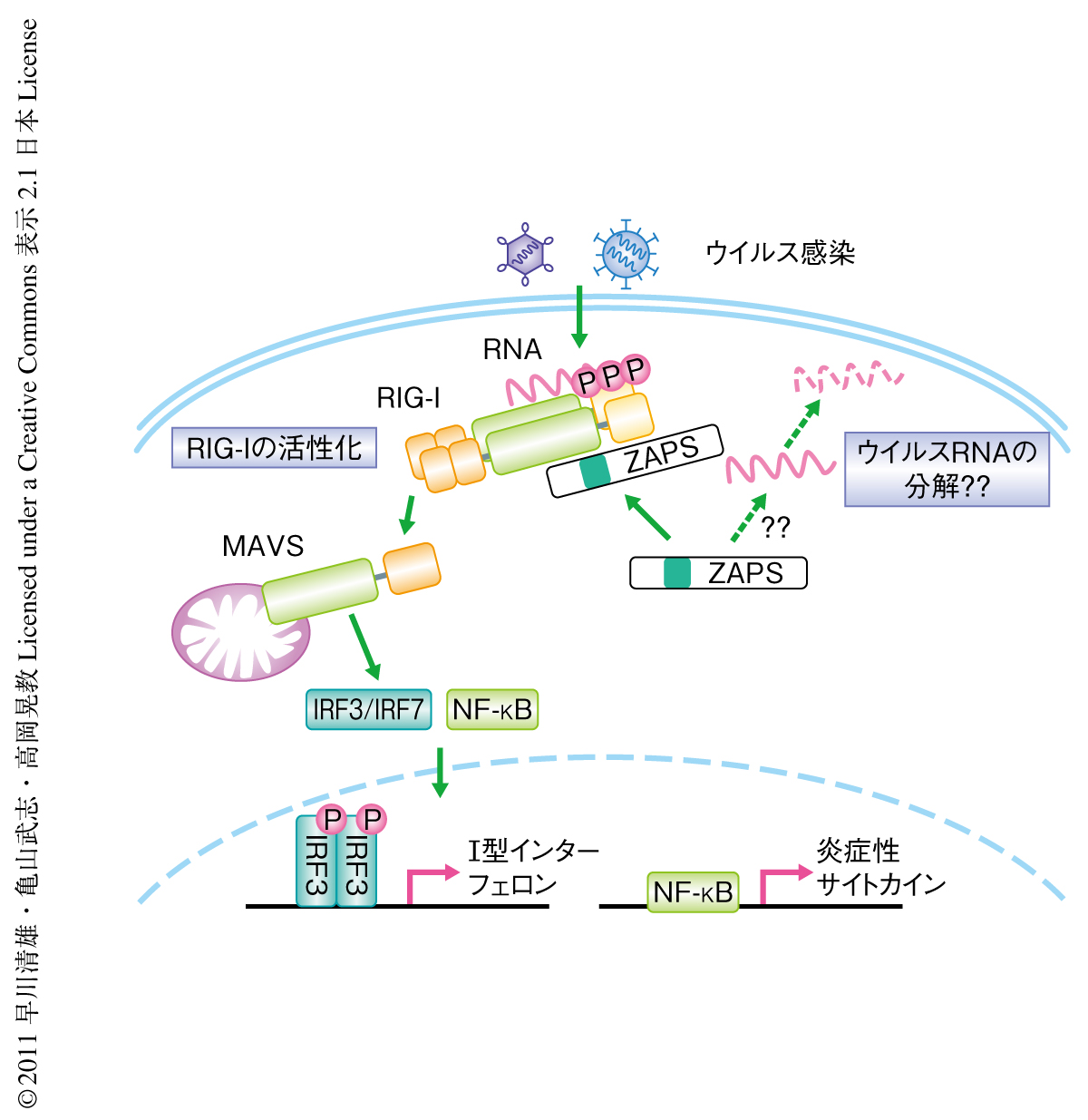
自然免疫系における微生物の認識機構においてはパターン認識受容体の存在が重要である.ウイルス感染のときにはおもにウイルスに由来するDNAやRNAが標的となり,これらの核酸の認識にかかわるパターン認識受容体が活性化されてI型インターフェロンの遺伝子発現をはじめとする自然免疫応答が誘導される.さらに,核酸を認識するパターン認識受容体の活性化はウイルスや細胞の種類により異なっていることがわかってきた.このようななか,とくにRIG-Iは多くのRNAウイルスのみならずDNAウイルスにおいてもその関連性が報告されており,ウイルス感染防御において重要なパターン認識受容体であると位置づけられる.今回の研究において,PARP-13/ZAPの短いタイプのアイソフォームであるZAPSがこのRIG-Iと直接結合してその活性化を正に調節するタンパク質因子であることが示された(図2).さらに,実際にRIG-I経路を活性化するインフルエンザウイルスやニューカッスル病ウイルスの感染において,ZAPSはRIG-Iシグナルを強く活性化し感染防御力を増強する作用のあることが示唆された.
これまでに,PARP-13/ZAPの全長のアイソフォームは特定のウイルスのmRNAを分解することが報告されている3).その短いタイプのアイソフォームであるZAPSが,RIG-Iを活性化するRNAウイルス全般に対し全長のアイソフォームと同様にそのmRNAの分解活性をもっているかどうかは明らかではなく,興味深い点である.もしその活性をもっているようであれば,今回,見い出されたRIG-Iを介する自然免疫シグナルの増強作用のほかウイルスのmRNAを直接的に分解する作用も示すことになり,ウイルス感染に対し2つの局面から生体を防御するユニークなメディエーターであるといえる(図2).さらに,この2つのモードの切り替えの制御がどのようなしくみで行われているかについても今後の興味深い課題であろう.実際に,PARP-13/ZAPの全長のアイソフォームはp72ヘリカーゼと会合しエクソソームを利用してmRNAを分解するという経路が提示されているが,一方で,ZAPSもヘリカーゼ活性をもつRIG-Iと会合することが示された.これら異なったヘリカーゼとの会合がZAPSの2つの異なった機能の切り替え制御にかかわっている可能性が考えられる.
RIG-Iはインフルエンザウイルスをはじめ,C型肝炎ウイルス,麻疹ウイルス,日本脳炎ウイルスなど多くのウイルスに対するパターン認識受容体であり,これらいずれのウイルスも社会的に大きな問題となっているヒト感染症をひき起こす.今後,ZAPSを介するRIG-Iシグナルの増強機構についてさらに詳細な解析を行うことによって,ヒト感染症に対する新たな治療や予防に貢献したいと考えている.
略歴:2002年 静岡県立大学大学院生活健康科学研究科博士課程 修了,同年 東京大学大学院医学系研究科 博士研究員,2003年 近畿大学医学部 助教を経て,2007年より北海道大学遺伝子病制御研究所 助教.
研究テーマ:がんと免疫における自然免疫応答の分子機構の解析.
抱負:“食”は健康な体を維持するために欠かせません.健康な体を維持することができてはじめて,生体が備えるさまざまな生体防御機能が発揮されます.“食”をとおして,病気にならない体をつくる,疾患の予防や改善に貢献できる研究を進めていきたいと思っています.
亀山 武志(Takeshi Kameyama)
北海道大学遺伝子病制御研究所 博士研究員.
高岡 晃教(Akinori Takaoka)
北海道大学遺伝子病制御研究所 教授,同 附属感染癌研究センター センター長 併任.
研究室URL:http://www.igm.hokudai.ac.jp/sci/
© 2011 早川清雄・亀山武志・高岡晃教 Licensed under CC 表示 2.1 日本
(北海道大学遺伝子病制御研究所 分子生体防御分野)
email:高岡晃教
DOI: 10.7875/first.author.2011.007
ZAPS is a potent stimulator of signaling mediated by the RNA helicase RIG-I during antiviral responses.
Sumio Hayakawa, Souichi Shiratori, Hiroaki Yamato, Takeshi Kameyama, Chihiro Kitatsuji, Fumi Kashigi, Showhey Goto, Shoichiro Kameoka, Daisuke Fujikura, Taisho Yamada, Tatsuaki Mizutani, Mika Kazumata, Maiko Sato, Junji Tanaka, Masahiro Asaka, Yusuke Ohba, Tadaaki Miyazaki, Masahiro Imamura, Akinori Takaoka
Nature Immunology, 12, 37-44 (2011)
要 約
ポリ(ADP-リボース)ポリメラーゼはDNA修復など多くの生理的な機能を担っている.筆者らは今回,そのスーパーファミリーのメンバーであるPARP-13/ZAPの短いタイプのアイソフォームについて,その発現がRIG-Iを介するシグナルで増強され,RIG-Iを介する自然免疫応答を強力に増強するタンパク質であることを見い出し,ZAPSと名づけた.ZAPSはRIG-IのリガンドとなるRNAによる刺激に依存してRIG-Iと会合し,そのオリゴマー化やATPase活性を増強することでIRF3やNF-κBなどの転写因子の活性化を強く誘導した.さらに,各種のヒト細胞においてZAPSの発現を抑制または欠損させると,RNAによる刺激やインフルエンザウイルスなどのウイルスの感染によりひき起こされるインターフェロンαやインターフェロンβ,そのほかの炎症性サイトカインの産生が強く抑制された.今回の研究から,ZAPSはRIG-Iを介する自然免疫シグナル経路において重要な調節因子であることが示され,感染症の治療の新しいターゲットタンパク質ともなりうる可能性が示唆された.
はじめに
われわれの体には侵入した微生物を排除しようとする免疫機構が備えられている.ウイルス感染や細菌感染が起こった際にまず第1段階として活性化されるのが自然免疫である(図1a).自然免疫応答は脊椎動物のみならず無脊椎動物を含む多くの生物に備えられている.自然免疫応答の活性化は,感染の最前線でパターン認識受容体(pattern recognition receptors:PRRs)が微生物に由来する核酸やリポ多糖類(LPS),ペプチドグリカンなどの構成分子(pathogen-associated molecular patterns:PAMPs)を認識することからはじまる.パターン認識受容体のなかでもとくにウイルス感染の場合,ウイルスに由来するRNAが認識の対象となり,細胞質に存在するパターン認識受容体であるRIG-I(retinoic acid inducible gene I)やMDA-5(melanoma differentiation associated gene 5)などのRIG-Iファミリーがその認識に関与している1)(図1b).RNAヘリカーゼであるRIG-IがウイルスRNAを認識するとRIG-Iに構造変化が生じ,そのN末端領域にあるCARD(caspase recuitment domain)と,同じくCARDをもつ下流のアダプタータンパク質IPS-1(別名:MAVS,VISA,Cardif)とが互いのCARDを介して相互作用する.ひきつづき,TBK1などのキナーゼがリクルートされて,転写因子であるIRF3,IRF7,または,NF-κBが活性化される.活性化されたこれらの転写因子はすみやかに核に移行し,I型インターフェロンを発現誘導することでいちはやく病原体の排除機構が作動する.
今回,筆者らが着目したポリ(ADP-リボース)ポリメラーゼ(PARP)は,現在,ヒトでは少なくとも17種類が知られており,その酵素活性に依存的または非依存的に細胞分裂や細胞周期の調節,DNA修復や細胞死の誘導などの多くの生理的な機能を担っている一方,各種の炎症や変性疾患の病因とも関与していることが報告されている2-5).とくにPARP-13/ZAPはMoloneyマウス白血病ウイルスなどある特定のウイルスに由来するmRNAに結合し分解することでウイルスの複製を阻害していることが報告されている3,6,7).しかしながら,PARPスーパーファミリーと宿主のパターン認識受容体を介する自然免疫応答との関連性についてはこれまで明らかにされていなかった.
この研究では,PARP-13/ZAPの短いタイプのアイソフォームであるZAPSがRIG-Iの活性化を調節するタンパク質であることを同定し,とくにインフルエンザウイルスの感染における役割に焦点をあて解析を進めた.
1.PARPスーパーファミリーとI型インターフェロン応答とのかかわり
核酸によって誘導される自然免疫応答におけるPARPスーパーファミリーの役割を解明するため,微生物の感染をはじめ,炎症,免疫応答との関連性が報告されていたPARP-1,PARP-2,PARP-7,PARP-9,PARP-12,PARP-13/ZAPをヒト胎児腎細胞に由来するHEK293T細胞に外因性に発現させ,3pRNA(RIG-Iのリガンドとなる5’側に三リン酸修飾をもつRNA),ポリ(rI:rC),ポリ(dA:dT)をトランスフェクションすることにより誘導される自然免疫応答への影響を検討した.PARP-1やPARP-2,PARP-9についてはわずかな増強効果を認める一方で,PARP-13/ZAPを発現させた細胞では対照となる細胞と比較してインターフェロンβのmRNAの発現を10倍近くも増強することがわかった.PARP-7とPARP-12に関してはインターフェロンβの発現に対する増強効果は認められなかった.刺激に用いた核酸はいずれもHEK293T細胞においてRIG-I経路を活性化することが知られていることから,RIG-I経路におけるPARP-13/ZAPの役割についてさらに検討を進めることにした.
これまでPARP-13/ZAPには2つのアイソフォーム,すなわち,PARPドメインをもつ全長のアイソフォームであるZAPと,PARPドメインをもたない短いタイプのアイソフォームとが知られている8).これらのアイソフォームについてインターフェロンβの発現に対する増強効果を比較したところ,どちらのアイソフォームも増強効果を示すものの,全長のアイソフォームと比較して短いタイプのアイソフォームはインターフェロンβの発現をより強く誘導した.また,興味深いことに,短いタイプのアイソフォームは全長のアイソフォームと比較して,3pRNA刺激およびインターフェロンα処理によって強く誘導されることから,とくに短いタイプのアイソフォームをZAPS(ZAP, short form)と名づけ,RIG-Iシグナル経路における役割についてさらに解析を進めた.
2.ZAPSはRIG-Iを介するI型インターフェロンの産生を増強する
まず,RIG-Iを介するI型インターフェロン応答にZAPSがあたえる影響について検討した.HEK293T細胞にZAPSを過剰に発現させたところ,時間依存的またはZAPSの発現ベクター量に依存的に3pRNA刺激によってインターフェロンβのみならずインターフェロンαの発現誘導が強く増強された.さらに,ZAPSの発現をそのsiRNAによりノックダウンしたヒト由来の細胞(HEK293T細胞,A549細胞,HeLa細胞,THP-1細胞,MRC-5細胞,CD14陽性単球)に対し3pRNAやインフルエンザウイルス由来のゲノムRNAを細胞質にトランスフェクションすると,I型インターフェロンの遺伝子発現の誘導が有意に抑制された.これは,インターフェロン応答のみならず,そのほかのサイトカインの誘導においても同様に認められた.そこで,ZAPSの発現をsiRNAによりノックダウンしたHEK293T細胞に対し,ルシフェラーゼレポーターアッセイ,ネイティブポリアクリルアミドゲル電気泳動,および,ゲルシフトアッセイによる解析を行ったところ,RIG-Iの下流ではたらく転写因子IRF3およびNF-κBの活性が抑制されていた.これらの結果は,ZAPSがRIG-I経路のどこかのステップに関与していることを示していた.そこで,RIG-I経路の関連シグナル分子であるSTINGやMAVS,および,RIG-Iに対するsiRNAとともに,ZAPSの発現ベクターを共導入したところ,ZAPSはRIG-Iを介するシグナル経路のなかでもRIG-Iの近傍においてRIG-Iの活性化に関与していることを示唆する結果が得られた.
3.ZAPSはRIG-Iと直接会合する
ZAPSはRIG-Iの近傍で関与しているという結果が得られたことから,ZAPSがRIG-Iと会合するかどうかについて,共焦点レーザー顕微鏡による解析およびFRET(fluorescence resonance energy transfer,蛍光共鳴エネルギー移動)解析を行った.3pRNAによる刺激に依存してZAPSとRIG-Iとは細胞質に共局在することが観察され,さらに,同じ部位にFRETシグナルを検出することができた.さらに,RIG-IとZAPSとの結合性について免疫沈降法により検討した.ヒト由来の細胞(HEK293T細胞,A549細胞,MRC-5細胞)において,3pRNA刺激あるいはRIG-I経路を活性化することで知られるニューカッスル病ウイルスによる感染に依存してZAPSとRIG-Iとの会合が確認された.また,大腸菌に由来する組換えタンパク質を用いた表面プラズモン共鳴(surface plasmon resonance:SPR)解析によって分子間の相互作用を調べたところ,ZAPSはRIG-Iと直接結合することが明らかになった.
RIG-Iの活性化の過程にはオリゴマー化やATPaseの活性化,そして,MAVSとの相互作用が含まれる9,10).実際に,HEK293T細胞にタグつきのRIG-Iを発現させてそのオリゴマー化を検出する系において,siRNAによりZAPSの発現をノックダウンした場合,ニューカッスル病ウイルス感染により誘導されるRIG-Iのオリゴマー化が抑制された.また,大腸菌に由来する組換えRIG-Iを用いて3pRNA刺激によるATPase活性の変動を定量すると,同時にくわえた組換えZAPSの量に依存してATPase活性は上昇した.これらのデータと一致して,siRNAによりZAPSの発現をノックダウンしたHEK293T細胞では共発現させたRIG-IとMAVSとの会合が有意に減少することが免疫沈降法により確認された.これらの結果から,ZAPSはRIG-Iと会合することによりRIG-Iの活性化プロセスを増強する作用のあることが示された.
4.RNAウイルス感染におけるZAPSの役割
RIG-Iはインフルエンザウイルスおよびニューカッスル病ウイルスの感染の際にウイルスに由来するRNAを認識して自然免疫系を活性化させる10).そこで,ヒト肺に由来する細胞株A549においてsiRNAによりZAPSの発現をノックダウンさせ,インフルエンザウイルスまたはニューカッスル病ウイルスを感染させてインターフェロンやサイトカインの発現を定量RT-PCRおよびELISA法を用いて定量した.その結果,ウイルス感染後6時間あるいは12時間で,インターフェロンα1およびインターフェロンβをはじめ,各種のサイトカイン(インターロイキン6やTNF,CXCL10)のRNAレベルでの発現が顕著に抑制され,24時間後のインターフェロンβの産生誘導もタンパク質レベルで有意に抑制されていた.さらに,siRNAによりZAPSの発現をノックダウンした細胞ではウイルスの複製を反映するウイルスゲノムからの遺伝子の発現が有意に増加していた.さらに興味深いことに,逆に,ZAPSの発現を外因性に増加させると,インフルエンザウイルス感染によるインターフェロンβの発現レベルが強力に増強されウイルス量も大きく減少していた.これらの結果から,ZAPSはI型インターフェロンおよび炎症性サイトカインの発現誘導を正に制御しており,ウイルスに対する感染防御という観点から重要な役割を担っていることが示唆された.
5.ヒトに由来する細胞におけるZAPSの重要性
最後に,ZAPSの重要性を検証するため,特異的なジンクフィンガーヌクレアーゼを使用してHEK293T細胞においてZAPSをノックアウトした複数の細胞を樹立した.この細胞を用いてニューカッスル病ウイルスの感染や3pRNA刺激を行ったところ,インターフェロンβおよび炎症性サイトカインの発現誘導が顕著に阻害された.また,この細胞にZAPSをもどすことによりこの応答性は回復した.以上の結果から,ZAPSはウイルス感染におけるRIG-Iを介する自然免疫応答において重要な調節因子であることが示された.
おわりに
自然免疫系における微生物の認識機構においてはパターン認識受容体の存在が重要である.ウイルス感染のときにはおもにウイルスに由来するDNAやRNAが標的となり,これらの核酸の認識にかかわるパターン認識受容体が活性化されてI型インターフェロンの遺伝子発現をはじめとする自然免疫応答が誘導される.さらに,核酸を認識するパターン認識受容体の活性化はウイルスや細胞の種類により異なっていることがわかってきた.このようななか,とくにRIG-Iは多くのRNAウイルスのみならずDNAウイルスにおいてもその関連性が報告されており,ウイルス感染防御において重要なパターン認識受容体であると位置づけられる.今回の研究において,PARP-13/ZAPの短いタイプのアイソフォームであるZAPSがこのRIG-Iと直接結合してその活性化を正に調節するタンパク質因子であることが示された(図2).さらに,実際にRIG-I経路を活性化するインフルエンザウイルスやニューカッスル病ウイルスの感染において,ZAPSはRIG-Iシグナルを強く活性化し感染防御力を増強する作用のあることが示唆された.
これまでに,PARP-13/ZAPの全長のアイソフォームは特定のウイルスのmRNAを分解することが報告されている3).その短いタイプのアイソフォームであるZAPSが,RIG-Iを活性化するRNAウイルス全般に対し全長のアイソフォームと同様にそのmRNAの分解活性をもっているかどうかは明らかではなく,興味深い点である.もしその活性をもっているようであれば,今回,見い出されたRIG-Iを介する自然免疫シグナルの増強作用のほかウイルスのmRNAを直接的に分解する作用も示すことになり,ウイルス感染に対し2つの局面から生体を防御するユニークなメディエーターであるといえる(図2).さらに,この2つのモードの切り替えの制御がどのようなしくみで行われているかについても今後の興味深い課題であろう.実際に,PARP-13/ZAPの全長のアイソフォームはp72ヘリカーゼと会合しエクソソームを利用してmRNAを分解するという経路が提示されているが,一方で,ZAPSもヘリカーゼ活性をもつRIG-Iと会合することが示された.これら異なったヘリカーゼとの会合がZAPSの2つの異なった機能の切り替え制御にかかわっている可能性が考えられる.
RIG-Iはインフルエンザウイルスをはじめ,C型肝炎ウイルス,麻疹ウイルス,日本脳炎ウイルスなど多くのウイルスに対するパターン認識受容体であり,これらいずれのウイルスも社会的に大きな問題となっているヒト感染症をひき起こす.今後,ZAPSを介するRIG-Iシグナルの増強機構についてさらに詳細な解析を行うことによって,ヒト感染症に対する新たな治療や予防に貢献したいと考えている.
文 献
- Yoneyama, M. & Fujita, T.: RNA recognition and signal transduction by RIG-I-like receptors. Immunol. Rev., 227, 54-65 (2009)[PubMed]
- Hakme, A., Wong, H. K., Dantzer, F. et al.: The expanding field of poly(ADP-ribosyl)ation reactions. 'Protein Modifications: Beyond the Usual Suspects' Review Series. EMBO Rep., 9, 1094-1100 (2008)[PubMed]
- Gao, G., Guo, X. & Goff, S. P.: Inhibition of retroviral RNA production by ZAP, a CCCH-type zinc finger protein. Science, 297, 1703-1706 (2002)[PubMed]
- Hassa, P. O. & Hottiger, M. O.: The diverse biological roles of mammalian PARPS, a small but powerful family of poly-ADP-ribose polymerases. Front. Biosci., 13, 3046-3082 (2008)[PubMed]
- Schreiber, V., Dantzer, F., Ame, J.C. & de Murcia, G.: Poly(ADP-ribose): novel functions for an old molecule. Nat Rev Mol Cell Biol 7, 517-528 (2006)[PubMed]
- Chen, G., Guo, X., Lv, F. et al.: p72 DEAD box RNA helicase is required for optimal function of the zinc-finger antiviral protein. Proc. Natl. Acad. Sci. USA, 105, 4352-4357 (2008)[PubMed]
- Zhu, Y. & Gao, G.: ZAP-mediated mRNA degradation. RNA Biol., 5, 65-67 (2008)[PubMed]
- Kerns, J. A., Emerman, M. & Malik, H. S.: Positive selection and increased antiviral activity associated with the PARP-containing isoform of human zinc-finger antiviral protein. PLoS Genet., 4, e21 (2008)[PubMed]
- Cui, S., Eisenacher, K., Kirchhofer, A. et al.: The C-terminal regulatory domain is the RNA 5'-triphosphate sensor of RIG-I. Mol. Cell., 29, 169-179 (2008)[PubMed]
- Takeuchi, O. & Akira, S.: Pattern recognition receptors and inflammation. Cell, 140, 805-820 (2010)[PubMed]
著者プロフィール
略歴:2002年 静岡県立大学大学院生活健康科学研究科博士課程 修了,同年 東京大学大学院医学系研究科 博士研究員,2003年 近畿大学医学部 助教を経て,2007年より北海道大学遺伝子病制御研究所 助教.
研究テーマ:がんと免疫における自然免疫応答の分子機構の解析.
抱負:“食”は健康な体を維持するために欠かせません.健康な体を維持することができてはじめて,生体が備えるさまざまな生体防御機能が発揮されます.“食”をとおして,病気にならない体をつくる,疾患の予防や改善に貢献できる研究を進めていきたいと思っています.
亀山 武志(Takeshi Kameyama)
北海道大学遺伝子病制御研究所 博士研究員.
高岡 晃教(Akinori Takaoka)
北海道大学遺伝子病制御研究所 教授,同 附属感染癌研究センター センター長 併任.
研究室URL:http://www.igm.hokudai.ac.jp/sci/
© 2011 早川清雄・亀山武志・高岡晃教 Licensed under CC 表示 2.1 日本