インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞は固形がんに対し強い治療効果を発揮する
安達圭志・玉田耕治
(山口大学大学院医学系研究科 免疫学講座)
email:玉田耕治
DOI: 10.7875/first.author.2018.035
IL-7 and CCL19 expression in CAR-T cells improves immune cell infiltration and CAR-T cell survival in the tumor.
Keishi Adachi, Yosuke Kano, Tomohiko Nagai, Namiko Okuyama, Yukimi Sakoda, Koji Tamada
Nature Biotechnology, 36, 346-351 (2018)
キメラ抗原受容体発現T細胞療法は悪性の血液腫瘍に対し著明な治療効果を発揮し,2017年には米国において承認されたことから注目をあつめているが,一方で,固形がんに対しては治療効果が乏しいとされてきた.固形がんに対するキメラ抗原受容体発現T細胞療法においては,がんへのキメラ抗原受容体発現T細胞の集積およびそこでの増殖が重要と考えられているが,現状ではこの問題を解決する技術は確立されておらず,キメラ抗原受容体発現T細胞療法における最大の課題のひとつとなっていた.この研究において,筆者らは,インターロイキン7およびケモカインCCL19を同時に産生する能力をもつキメラ抗原受容体発現T細胞を開発した.このキメラ抗原受容体発現T細胞は,固形がんの複数のモデルにおいてがんの内部にT細胞および樹状細胞の浸潤をひき起こし,宿主のT細胞と協調して強力な抗がん効果を発揮することが確認された.また,このキメラ抗原受容体発現T細胞の投与によりがんに対する長期的な免疫記憶が形成され,がんの再発の予防効果を発揮する可能性が示された.これらのことから,今回,開発された次世代型のキメラ抗原受容体発現T細胞療法は,固形がんに対する画期的な治療法になることが期待される.
1981年以降,わが国においてはがんが死亡原因の第1位になっており,現在でもその上昇傾向に歯止めはかかっていない.厚生労働省の統計によれば,2016年の死亡総数においてがんのしめる割合は28.5%であり,これは,この年の全死亡者の約3.5人に1人ががんにより死亡した計算になる.そのため,がんに対する効果的な治療法および再発の予防法の開発が急務となっている.
がん免疫療法は従来の3大標準治療法,すなわち,外科療法,化学療法,放射線療法の適用が困難な難治性あるいは進行性のがんに対する治療法として研究が進められてきた.とくに,キメラ抗原受容体(chimeric antigen receptor:CAR)の遺伝子を導入することによりがんに対する反応性を高めたT細胞を投与するキメラ抗原受容体発現T細胞療法は有望な新技術として注目されている1,2).現在,キメラ抗原受容体発現T細胞療法の臨床試験は欧米や中国を中心に進行しており,なかでも,CD19を標的としたB細胞性の白血病やリンパ腫などに対するキメラ抗原受容体発現T細胞療法においてはすぐれた治療効果が報告され2-4),2017年には米国食品医薬品局によりB細胞性の造血器腫瘍に対し認可された.
しかし,現在のキメラ抗原受容体発現T細胞療法は完成されたものではなく,さらなる発展のためには克服すべき問題点も指摘されている.とくに,固形がんに対して治療効果が乏しいという点はきわめて重要な課題となっており,その原因のひとつとして,キメラ抗原受容体発現T細胞をがんへと集積させて増殖させることが困難であるという点が考えられている5,6).筆者らは,患者に備わる免疫機能を制御する能力を付与することにより固形がんに対してもすぐれた治療効果を発揮しうるキメラ抗原受容体発現T細胞を開発する研究に取り組んでおり,この研究においては,T細胞の生存や増殖を刺激するサイトカインであるインターロイキン7 7),および,T細胞や樹状細胞の遊走を刺激するケモカインであるCCL19 8,9) を利用した.これらのタンパク質はリンパ節においてT細胞や樹状細胞の集積した構造を形成するために重要であることが報告されている10,11).これらの性質に着目し,がんの内部においてT細胞や樹状細胞が集積する構造を形成することができれば固形がんに対するキメラ抗原受容体発現T細胞療法の効果を高めることが可能であると考え,キメラ抗原受容体発現T細胞にインターロイキン7およびCCL19を同時に産生する能力を付与した.
なお,がんに対するキメラ抗原受容体発現T細胞療法については,保仙 直毅, 領域融合レビュー, 6, e005 (2017) も参照されたい.
ピコルナウイルスに由来する自己切断能をもつ2Aペプチドを利用して,がん抗原に特異的なキメラ抗原受容体とともに,インターロイキン7およびCCL19をひとつの細胞に同時に発現させるコンストラクトを作製し,レトロウイルスベクターを用いてマウスのプライマリーT細胞に遺伝子導入した.フローサイトメーターを用いてこのT細胞におけるキメラ抗原受容体の発現について検討したところ,インターロイキン7やCCL19を産生しない従来型のキメラ抗原受容体発現T細胞と比べ若干は低下したものの,キメラ抗原受容体の十分な発現が確認された.また,ELISA法によりインターロイキン7およびCCL19の産生が確認された.
in vitroにおいて,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞の免疫機能を従来型のキメラ抗原受容体発現T細胞と比較した.細胞傷害活性を測定した結果,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞は従来型のキメラ抗原受容体発現T細胞と同等の腫瘍傷害活性をもつことが判明した.キメラ抗原受容体発現T細胞から産生されるインターロイキン7の生理活性について検討したところ,従来型のキメラ抗原受容体発現T細胞に比べ,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞において,生存能および増殖能は有意に増強されていた.一方,キメラ抗原受容体発現T細胞から産生されるCCL19の生理活性についてT細胞および樹状細胞を標的としたトランスウェルアッセイにより検討した結果,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞の細胞遊走活性は従来型のキメラ抗原受容体発現T細胞と比較して有意に増強されていることが明らかにされた.
in vivoにおいてインターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞の抗がん効果を従来型のキメラ抗原受容体発現T細胞と比較した.DBA/2系統のマウスに対し,人工的な抗原としてヒトのCD20を遺伝子導入した同系の肥満細胞腫P815細胞株を皮下に接種し,腫瘤の形成が確認されたのち,キメラ抗原受容体発現T細胞を静脈に投与した.その結果,従来型のキメラ抗原受容体発現T細胞の投与によりがんの増殖は軽度に抑制されたものの最終的にはほぼすべてのマウスが死亡したのに対し,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞の投与によりすべてのマウスにおいてがんの寛解が認められ140日以上も生存した.同様の結果は,肺がん株あるいは膵がん株を用いたマウスモデルにおいても得られた.これらのことから,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞はきわめて強い抗がん効果をもつことが明らかにされた.また,インターロイキン7のみを産生するキメラ抗原受容体発現T細胞,および,CCL19のみを産生するキメラ抗原受容体発現T細胞を作製し,それぞれを単独で投与した場合,あるいは,両者を混合して投与した場合の抗がん効果について検討したところ,いずれにおいても,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞と比較して抗がん効果の弱いことが判明した.このことから,キメラ抗原受容体発現T細胞からインターロイキン7およびCCL19の両方が同時に産生されることが強力な抗がん効果に必須であることが示された.
コンジェニックマウスを用いてインターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞を投与したのち,がんの内部にどのような細胞が集積しているのかを検討したところ,投与したキメラ抗原受容体発現T細胞だけでなく,投与をうけた宿主の樹状細胞やT細胞も集積しており,がんの内部に混在して浸潤していることが判明した.さらに,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞による治療において宿主のT細胞を除去したところ,キメラ抗原受容体発現T細胞による抗がん効果は減弱した.このことから,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞の投与により発揮される強力な抗がん効果においては,投与したキメラ抗原受容体発現T細胞だけでなく,投与をうけた宿主のT細胞も重要であることが示された.
インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞による治療によりがんを排除したのち100日以上が経過したマウスに対し,ヒトのCD20を導入したP815細胞株を左側の腹部に,導入していないP815細胞株を右側の腹部に,それぞれ再接種した.対照のナイーブマウスにおいては接種したP815細胞株はともに増殖した一方,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞による治療をうけたマウスにおいてはヒトのCD20を導入したP815細胞株の増殖は認められなかった.このことから,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞による治療により,がんに対する長期の免疫記憶が効率的に形成されることが明らかにされた.
また,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞による治療をうけたマウスにおいては,キメラ抗原受容体の標的となるヒトのCD20を発現していないP815細胞株に対しても顕著な増殖の抑制が認められた.この現象から,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞の投与によりがんが排除される過程において,エピトープスプレッディング,すなわち,少数のドミナントなエピトープに対する免疫応答により多くのサブドミナントなエピトープに対する免疫応答が2次的にひき起こされたことが示唆された.インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞の投与ののち,マウスの体内においてはキメラ抗原受容体とその標的となるヒトのCD20との反応のみならず,それとは異なるP815細胞株に特有のがん抗原を認識するT細胞も活性化されて抗がん効果を発揮し,がんの排除ののちには両者が免疫記憶を形成すると考えられた.
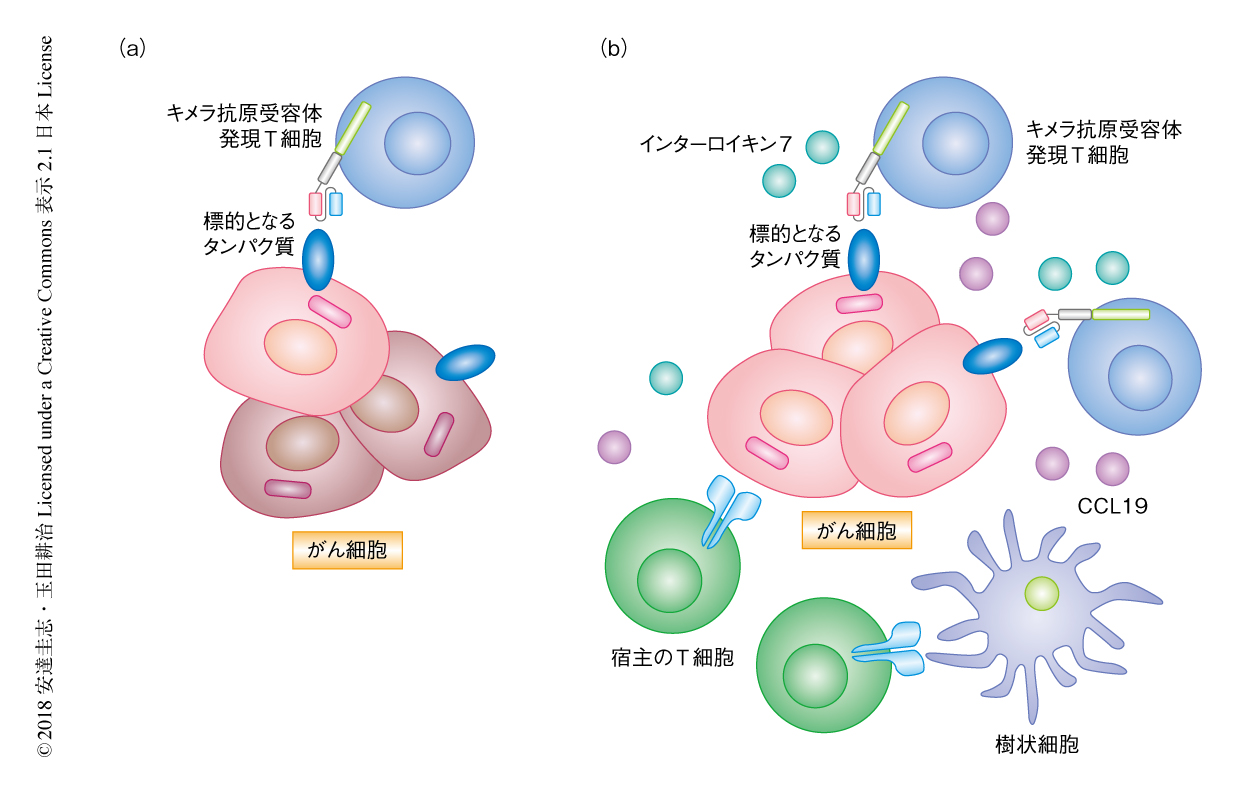
今回の研究により,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞の投与により固形がんの内部にT細胞や樹状細胞の浸潤がひき起こされ,キメラ抗原受容体発現T細胞と宿主のT細胞とが協調して強力な抗がん効果が発揮されること,その宿主のT細胞との協調作用の機序としてエピトープスプレッディングの関与が考えられること,さらに,がん細胞に対する長期的な免疫記憶が形成されることによりがんの再発を予防できる可能性があること,などが明らかにされた(図1).
これまで,キメラ抗原受容体発現T細胞については,がん細胞を直接的に傷害する機能ばかりに注目があつまっていた.しかし,今回のインターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞は,患者のからだにもともと備わる免疫機能を制御して協調作用をひき起こすタンパク質のデリバリーシステムとしての役割も担っており,これまでのキメラ抗原受容体発現T細胞の概念を大きく変えるパラダイムシフトといえる.今回,開発された次世代型のキメラ抗原受容体発現T細胞は,これまで,悪性の造血器腫瘍に対しおもな有効性を示してきたキメラ抗原受容体発現T細胞療法の適応範囲を固形がんにまで拡大させる,がんの画期的な治療法につながることが期待される.
略歴:2003年 兵庫医科大学大学院医学研究科 修了,同年 同 ポストドクトラルフェロー,2005年 米国Stanford大学 ポストドクトラルフェロー,同 Research Associate,同 Research Specialist,2010年 長崎大学熱帯医学研究所 特任助教,2012年 山口大学大学院医学系研究科 助教を経て,2018年より同 講師.
研究テーマ:がん免疫学,がん免疫治療学.
抱負:既存の観点にとらわれないシーズの開発をめざしたい.
玉田 耕治(Koji Tamada)
山口大学大学院医学系研究科 教授.
研究室URL:http://ds.cc.yamaguchi-u.ac.jp/~immunol/
© 2018 安達圭志・玉田耕治 Licensed under CC 表示 2.1 日本
(山口大学大学院医学系研究科 免疫学講座)
email:玉田耕治
DOI: 10.7875/first.author.2018.035
IL-7 and CCL19 expression in CAR-T cells improves immune cell infiltration and CAR-T cell survival in the tumor.
Keishi Adachi, Yosuke Kano, Tomohiko Nagai, Namiko Okuyama, Yukimi Sakoda, Koji Tamada
Nature Biotechnology, 36, 346-351 (2018)
要 約
キメラ抗原受容体発現T細胞療法は悪性の血液腫瘍に対し著明な治療効果を発揮し,2017年には米国において承認されたことから注目をあつめているが,一方で,固形がんに対しては治療効果が乏しいとされてきた.固形がんに対するキメラ抗原受容体発現T細胞療法においては,がんへのキメラ抗原受容体発現T細胞の集積およびそこでの増殖が重要と考えられているが,現状ではこの問題を解決する技術は確立されておらず,キメラ抗原受容体発現T細胞療法における最大の課題のひとつとなっていた.この研究において,筆者らは,インターロイキン7およびケモカインCCL19を同時に産生する能力をもつキメラ抗原受容体発現T細胞を開発した.このキメラ抗原受容体発現T細胞は,固形がんの複数のモデルにおいてがんの内部にT細胞および樹状細胞の浸潤をひき起こし,宿主のT細胞と協調して強力な抗がん効果を発揮することが確認された.また,このキメラ抗原受容体発現T細胞の投与によりがんに対する長期的な免疫記憶が形成され,がんの再発の予防効果を発揮する可能性が示された.これらのことから,今回,開発された次世代型のキメラ抗原受容体発現T細胞療法は,固形がんに対する画期的な治療法になることが期待される.
はじめに
1981年以降,わが国においてはがんが死亡原因の第1位になっており,現在でもその上昇傾向に歯止めはかかっていない.厚生労働省の統計によれば,2016年の死亡総数においてがんのしめる割合は28.5%であり,これは,この年の全死亡者の約3.5人に1人ががんにより死亡した計算になる.そのため,がんに対する効果的な治療法および再発の予防法の開発が急務となっている.
がん免疫療法は従来の3大標準治療法,すなわち,外科療法,化学療法,放射線療法の適用が困難な難治性あるいは進行性のがんに対する治療法として研究が進められてきた.とくに,キメラ抗原受容体(chimeric antigen receptor:CAR)の遺伝子を導入することによりがんに対する反応性を高めたT細胞を投与するキメラ抗原受容体発現T細胞療法は有望な新技術として注目されている1,2).現在,キメラ抗原受容体発現T細胞療法の臨床試験は欧米や中国を中心に進行しており,なかでも,CD19を標的としたB細胞性の白血病やリンパ腫などに対するキメラ抗原受容体発現T細胞療法においてはすぐれた治療効果が報告され2-4),2017年には米国食品医薬品局によりB細胞性の造血器腫瘍に対し認可された.
しかし,現在のキメラ抗原受容体発現T細胞療法は完成されたものではなく,さらなる発展のためには克服すべき問題点も指摘されている.とくに,固形がんに対して治療効果が乏しいという点はきわめて重要な課題となっており,その原因のひとつとして,キメラ抗原受容体発現T細胞をがんへと集積させて増殖させることが困難であるという点が考えられている5,6).筆者らは,患者に備わる免疫機能を制御する能力を付与することにより固形がんに対してもすぐれた治療効果を発揮しうるキメラ抗原受容体発現T細胞を開発する研究に取り組んでおり,この研究においては,T細胞の生存や増殖を刺激するサイトカインであるインターロイキン7 7),および,T細胞や樹状細胞の遊走を刺激するケモカインであるCCL19 8,9) を利用した.これらのタンパク質はリンパ節においてT細胞や樹状細胞の集積した構造を形成するために重要であることが報告されている10,11).これらの性質に着目し,がんの内部においてT細胞や樹状細胞が集積する構造を形成することができれば固形がんに対するキメラ抗原受容体発現T細胞療法の効果を高めることが可能であると考え,キメラ抗原受容体発現T細胞にインターロイキン7およびCCL19を同時に産生する能力を付与した.
なお,がんに対するキメラ抗原受容体発現T細胞療法については,保仙 直毅, 領域融合レビュー, 6, e005 (2017) も参照されたい.
1.インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞の作製
ピコルナウイルスに由来する自己切断能をもつ2Aペプチドを利用して,がん抗原に特異的なキメラ抗原受容体とともに,インターロイキン7およびCCL19をひとつの細胞に同時に発現させるコンストラクトを作製し,レトロウイルスベクターを用いてマウスのプライマリーT細胞に遺伝子導入した.フローサイトメーターを用いてこのT細胞におけるキメラ抗原受容体の発現について検討したところ,インターロイキン7やCCL19を産生しない従来型のキメラ抗原受容体発現T細胞と比べ若干は低下したものの,キメラ抗原受容体の十分な発現が確認された.また,ELISA法によりインターロイキン7およびCCL19の産生が確認された.
2.インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞のin vitroにおける免疫機能の解析
in vitroにおいて,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞の免疫機能を従来型のキメラ抗原受容体発現T細胞と比較した.細胞傷害活性を測定した結果,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞は従来型のキメラ抗原受容体発現T細胞と同等の腫瘍傷害活性をもつことが判明した.キメラ抗原受容体発現T細胞から産生されるインターロイキン7の生理活性について検討したところ,従来型のキメラ抗原受容体発現T細胞に比べ,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞において,生存能および増殖能は有意に増強されていた.一方,キメラ抗原受容体発現T細胞から産生されるCCL19の生理活性についてT細胞および樹状細胞を標的としたトランスウェルアッセイにより検討した結果,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞の細胞遊走活性は従来型のキメラ抗原受容体発現T細胞と比較して有意に増強されていることが明らかにされた.
3.インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞のin vivoにおける抗がん効果の検討
in vivoにおいてインターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞の抗がん効果を従来型のキメラ抗原受容体発現T細胞と比較した.DBA/2系統のマウスに対し,人工的な抗原としてヒトのCD20を遺伝子導入した同系の肥満細胞腫P815細胞株を皮下に接種し,腫瘤の形成が確認されたのち,キメラ抗原受容体発現T細胞を静脈に投与した.その結果,従来型のキメラ抗原受容体発現T細胞の投与によりがんの増殖は軽度に抑制されたものの最終的にはほぼすべてのマウスが死亡したのに対し,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞の投与によりすべてのマウスにおいてがんの寛解が認められ140日以上も生存した.同様の結果は,肺がん株あるいは膵がん株を用いたマウスモデルにおいても得られた.これらのことから,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞はきわめて強い抗がん効果をもつことが明らかにされた.また,インターロイキン7のみを産生するキメラ抗原受容体発現T細胞,および,CCL19のみを産生するキメラ抗原受容体発現T細胞を作製し,それぞれを単独で投与した場合,あるいは,両者を混合して投与した場合の抗がん効果について検討したところ,いずれにおいても,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞と比較して抗がん効果の弱いことが判明した.このことから,キメラ抗原受容体発現T細胞からインターロイキン7およびCCL19の両方が同時に産生されることが強力な抗がん効果に必須であることが示された.
コンジェニックマウスを用いてインターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞を投与したのち,がんの内部にどのような細胞が集積しているのかを検討したところ,投与したキメラ抗原受容体発現T細胞だけでなく,投与をうけた宿主の樹状細胞やT細胞も集積しており,がんの内部に混在して浸潤していることが判明した.さらに,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞による治療において宿主のT細胞を除去したところ,キメラ抗原受容体発現T細胞による抗がん効果は減弱した.このことから,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞の投与により発揮される強力な抗がん効果においては,投与したキメラ抗原受容体発現T細胞だけでなく,投与をうけた宿主のT細胞も重要であることが示された.
インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞による治療によりがんを排除したのち100日以上が経過したマウスに対し,ヒトのCD20を導入したP815細胞株を左側の腹部に,導入していないP815細胞株を右側の腹部に,それぞれ再接種した.対照のナイーブマウスにおいては接種したP815細胞株はともに増殖した一方,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞による治療をうけたマウスにおいてはヒトのCD20を導入したP815細胞株の増殖は認められなかった.このことから,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞による治療により,がんに対する長期の免疫記憶が効率的に形成されることが明らかにされた.
また,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞による治療をうけたマウスにおいては,キメラ抗原受容体の標的となるヒトのCD20を発現していないP815細胞株に対しても顕著な増殖の抑制が認められた.この現象から,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞の投与によりがんが排除される過程において,エピトープスプレッディング,すなわち,少数のドミナントなエピトープに対する免疫応答により多くのサブドミナントなエピトープに対する免疫応答が2次的にひき起こされたことが示唆された.インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞の投与ののち,マウスの体内においてはキメラ抗原受容体とその標的となるヒトのCD20との反応のみならず,それとは異なるP815細胞株に特有のがん抗原を認識するT細胞も活性化されて抗がん効果を発揮し,がんの排除ののちには両者が免疫記憶を形成すると考えられた.
おわりに
今回の研究により,インターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞の投与により固形がんの内部にT細胞や樹状細胞の浸潤がひき起こされ,キメラ抗原受容体発現T細胞と宿主のT細胞とが協調して強力な抗がん効果が発揮されること,その宿主のT細胞との協調作用の機序としてエピトープスプレッディングの関与が考えられること,さらに,がん細胞に対する長期的な免疫記憶が形成されることによりがんの再発を予防できる可能性があること,などが明らかにされた(図1).
これまで,キメラ抗原受容体発現T細胞については,がん細胞を直接的に傷害する機能ばかりに注目があつまっていた.しかし,今回のインターロイキン7およびCCL19を産生するキメラ抗原受容体発現T細胞は,患者のからだにもともと備わる免疫機能を制御して協調作用をひき起こすタンパク質のデリバリーシステムとしての役割も担っており,これまでのキメラ抗原受容体発現T細胞の概念を大きく変えるパラダイムシフトといえる.今回,開発された次世代型のキメラ抗原受容体発現T細胞は,これまで,悪性の造血器腫瘍に対しおもな有効性を示してきたキメラ抗原受容体発現T細胞療法の適応範囲を固形がんにまで拡大させる,がんの画期的な治療法につながることが期待される.
文 献
- Maude, S. L., Teachey, D. T., Porter, D. L. et al.: CD19-targeted chimeric antigen receptor T-cell therapy for acute lymphoblastic leukemia. Blood, 125, 4017-4023 (2015)[PubMed]
- Duong, C. P., Yong, C. S., Kershaw, M. H. et al.: Cancer immunotherapy utilizing gene-modified T cells: from the bench to the clinic. Mol. Immunol., 67, 46-57 (2015)[PubMed]
- Srivastava, S. & Riddell, S. R.: Engineering CAR-T cells: design concepts. Trends Immunol., 36, 494-502 (2015)[PubMed]
- Ramos, C. A., Savoldo, B. & Dotti, G.: CD19-CAR trials. Cancer J., 20, 112-118 (2014)[PubMed]
- Rosenberg, S. A. & Restifo, N. P.: Adoptive cell transfer as personalized immunotherapy for human cancer. Science, 348, 62-68 (2015)[PubMed]
- Kakarla, S. & Gottschalk, S.: CAR T cells for solid tumors: armed and ready to go? Cancer J., 20, 151-155 (2014)[PubMed]
- Fry, T. J. & Mackall, C. L.: Interleukin-7: master regulator of peripheral T-cell homeostasis? Trends Immunol., 22, 564-571 (2001)[PubMed]
- Yoshida, R., Nagira, M., Imai, T. et al.: EBI1-ligand chemokine (ELC) attracts a broad spectrum of lymphocytes: activated T cells strongly up-regulate CCR7 and efficiently migrate toward ELC. Int. Immunol., 10, 901-910 (1998)[PubMed]
- Kellermann, S. A., Hudak, S., Oldham, E. R. et al.: The CC chemokine receptor-7 ligands 6Ckine and macrophage inflammatory protein-3β are potent chemoattractants for in vitro- and in vivo-derived dendritic cells. J. Immunol., 162, 3859-3864 (1999)[PubMed]
- Link, A., Vogt, T. K., Favre S. et al.: Fibroblastic reticular cells in lymph nodes regulate the homeostasis of naive T cells. Nat. Immunol., 8, 1255-1265 (2007)[PubMed]
- Luther, S. A., Bidgol, A., Hargreaves, D. C. et al.: Differing activities of homeostatic chemokines CCL19, CCL21, and CXCL12 in lymphocyte and dendritic cell recruitment and lymphoid neogenesis. J. Immunol., 169, 424-433 (2002)[PubMed]
著者プロフィール
略歴:2003年 兵庫医科大学大学院医学研究科 修了,同年 同 ポストドクトラルフェロー,2005年 米国Stanford大学 ポストドクトラルフェロー,同 Research Associate,同 Research Specialist,2010年 長崎大学熱帯医学研究所 特任助教,2012年 山口大学大学院医学系研究科 助教を経て,2018年より同 講師.
研究テーマ:がん免疫学,がん免疫治療学.
抱負:既存の観点にとらわれないシーズの開発をめざしたい.
玉田 耕治(Koji Tamada)
山口大学大学院医学系研究科 教授.
研究室URL:http://ds.cc.yamaguchi-u.ac.jp/~immunol/
© 2018 安達圭志・玉田耕治 Licensed under CC 表示 2.1 日本