β2アドレナリン受容体による2型自然リンパ球の応答の抑制
森山 彩野
(米国Cornell大学Weill Cornell Medicine,Department of Microbiology and Immunology)
email:森山彩野
DOI: 10.7875/first.author.2018.034
β2-adrenergic receptor-mediated negative regulation of group 2 innate lymphoid cell responses.
Saya Moriyama, Jonathan R. Brestoff, Anne-Laure Flamar, Jesper B. Moeller, Christoph S. N. Klose, Lucille C. Rankin, Naomi A. Yudanin, Laurel A. Monticelli, Gregory Garbès Putzel, Hans-Reimer Rodewald, David Artis
Science, 359, 1056-1061 (2018)
寄生虫やアレルゲンといったさまざまな刺激により生体において2型炎症応答がひき起こされる.2型自然リンパ球は2型サイトカインを産生し2型炎症応答において重要な役割を担うが,その制御機構についてはいまだ不明な点が多い.免疫細胞は免疫系だけではなく神経系によっても制御される.これまで,筆者らを含めた複数の研究グループにより,神経伝達物質であるニューロメジンによる2型自然リンパ球の活性化が報告されているが,神経伝達物質が2型自然リンパ球の応答の抑制にかかわるのかどうか,また,その機構については不明であった.この研究において,筆者らは,2型自然リンパ球には神経伝達物質ノルアドレナリンの受容体のひとつであるβ2アドレナリン受容体が発現し,その応答を抑制的に制御することを見い出した.
2型炎症応答においては,インターロイキン5やインターロイキン13といった2型サイトカインや抗体の産生,さまざまなエフェクター細胞の分化および活性化が起こり,粘液の産生や平滑筋の収縮がひき起こされ,体内から刺激物質が排除される1).2型自然リンパ球とよばれる自然免疫細胞は腸管,肺,皮膚,脂肪組織,リンパ組織などに存在し,インターロイキン33やインターロイキン25といった炎症性サイトカインの刺激をうけて増殖および活性化し2型サイトカインを産生する2).腸管寄生線虫であるNippostrongylus brasiliensisを感染させたマウスには強い2型炎症応答がもたらされ,感染の初期における2型サイトカインの産生はおもに2型自然リンパ球によることが報告されている3).したがって,2型自然リンパ球の機能の制御は2型炎症応答において重要であると考えられるが,その制御機構はいまだ完全には解明されていない.これまで,さまざまな臓器に神経細胞が存在し,免疫細胞の機能も制御することが明らかにされてきた4-6).2017年,筆者らを含めた複数の研究グループにより,神経伝達物質であるニューロメジンによる2型自然リンパ球の活性化が報告されたが7-9),この研究において,筆者らは,2型自然リンパ球にはアドレナリン作動性ニューロンから分泌されるノルアドレナリンの受容体のひとつであるβ2アドレナリン受容体が発現し,また,2型自然リンパ球の応答はβ2アドレナリン受容体により抑制的に制御されることを明らかにした.
RNAシークエンス法により,マウスの腸管に由来する2型自然リンパ球はβ2アドレナリン受容体を発現することが見い出された.腸管,肺,リンパ組織に由来する自然リンパ球においてβ2アドレナリン受容体をコードする遺伝子の発現を解析したところ,それぞれの組織に存在する2型自然リンパ球はβ2アドレナリン受容体を高く発現し,また,そのほかのアドレナリン受容体はほとんど発現していなかった.ヒトの肺および末梢血に由来する2型自然リンパ球においてもβ2アドレナリン受容体の発現がみられた.腸管および腸間膜リンパ節における2型自然リンパ球の局在を免疫組織学的に解析したところ,腸管においては絨毛部および粘膜下層に存在し,その近傍にはアドレナリン作動性ニューロンが観察された.一方,腸間膜リンパ節において2型自然リンパ球は濾胞とT細胞領域の境界領域,T細胞領域,髄質部に観察された.これらの場所にはアドレナリン作動性ニューロンの分布が報告されている4,5).これらのことから,腸管および腸間膜リンパ節に存在する2型自然リンパ球はβ2アドレナリン受容体を発現し,近傍のアドレナリン作動性ニューロンから分泌されるノルアドレナリンを受容することが示唆された.
β2アドレナリン受容体が2型炎症応答を制御するかどうかを明らかにするため,β2アドレナリン受容体ノックアウトマウスに腸管寄生線虫であるN. brasiliensisを感染させたところ,腸間膜リンパ節において野生型のマウスより多くの2型自然リンパ球および好酸球が存在した.また,β2アドレナリン受容体ノックアウトマウスの腸管においては野生型のマウスより多くのゴブレット細胞(粘膜分泌細胞)が観察された.マウスに経皮感染したN. brasiliensisは肺に炎症をもたらし,感染ののち3~4日で腸管に到達して強い2型炎症応答をひき起こして,感染ののち約10日で体内から排除される.そこで,感染から7日目の腸管において寄生虫体の数を測定したところ,β2アドレナリン受容体ノックアウトマウスにおいては野生型のマウスより少なかった.これらのことから,β2アドレナリン受容体ノックアウトマウスにおいては2型自然リンパ球の応答および2型免疫応答が亢進し寄生虫の排除が促進されると考えられた.一方,マウスにβ2アドレナリン受容体作動薬を投与したうえでN. brasiliensisを感染させたところ,腸間膜リンパ節における2型自然リンパ球の数は対照のマウスより少なくなり,また,2型自然リンパ球によるインターロイキン5およびインターロイキン13の産生能も低下し,さらに,好酸球の数もゴブレット細胞の数も少なく,対照のマウスよりも腸管からの寄生虫の排除が抑制されていた.これらの結果から,β2アドレナリン受容体への刺激は2型自然リンパ球の応答および2型免疫応答を抑制することが示された.
このβ2アドレナリン受容体への刺激による変化は2型自然リンパ球によるものかどうかを明らかにすることを試みた.β2アドレナリン受容体はヘルパーT細胞においても発現しその分化,機能,細胞移動を制御することが報告されており,また,獲得免疫系はN. brasiliensisの排除に重要な役割をはたすことから,抗CD4抗体を投与することによりヘルパーT細胞を除いたマウスに対し,β2アドレナリン受容体作動薬を投与したうえでN. brasiliensisを感染させた.その結果,2型自然リンパ球および好酸球の数は対照のマウスより少なくなり,寄生虫の排除は抑制された.また,2型自然リンパ球にはインターロイキン7受容体が発現することを利用し,インターロイキン7受容体の発現のもとβ2アドレナリン受容体を欠損するマウスにN. brasiliensisを感染させたところ,2型自然リンパ球の増加および寄生虫体の数の減少がみられた.さらに,T細胞,B細胞,自然リンパ球をもたないRag2 Il2rgダブルノックアウトマウスに野生型のマウスあるいはβ2アドレナリン受容体ノックアウトマウスに由来する2型自然リンパ球の前駆細胞を移植し,移植した細胞が2型自然リンパ球へ分化したのちN. brasiliensisを感染させたところ,β2アドレナリン受容体を欠損した2型自然リンパ球をもつマウスにおいては野生型の2型自然リンパ球をもつマウスに比べ2型自然リンパ球および好酸球の増加がみられた.これらのことから,2型自然リンパ球に発現するβ2アドレナリン受容体は2型自然リンパ球の応答を抑制し,2型免疫応答を抑制することが示唆された.
マウスおよびヒトの肺に存在する2型自然リンパ球にもβ2アドレナリン受容体が発現し,また,アドレナリン作動性ニューロンは肺組織および気道にはりめぐらされている.N. brasiliensisは腸管だけでなく肺にも炎症をもたらすことから,感染ののちの肺組織を解析したところ,β2アドレナリン受容体ノックアウトマウスにおいては野生型のマウスに比べ2型自然リンパ球の増加が亢進していた.さらに,インターロイキン33あるいは真菌Alteria alternataの抽出液を鼻腔に投与して肺に炎症をひき起こしたところ,β2アドレナリン受容体の刺激による2型自然リンパ球の増加の抑制および2型自然リンパ球に由来するサイトカインの産生の抑制がみられた.これらのことから,肺における2型自然リンパ球の応答もβ2アドレナリン受容体により抑制され,炎症応答を抑制することが示唆された.
β2アドレナリン受容体が2型自然リンパ球の応答を抑制する機構について明らかにするため,β2アドレナリン受容体への刺激に応じて2型自然リンパ球において生じる変化の検出を試みた.β2アドレナリン受容体作動薬を投与したマウスにN. brasiliensisを感染させ,腸間膜リンパ節から単離した2型自然リンパ球における遺伝子の発現をRNAシークエンス法により網羅的に解析した.β2アドレナリン受容体作動薬を投与したマウスにおいて発現の低くなった遺伝子を抽出しエンリッチメント解析を実施したところ,細胞周期や細胞分裂に関連する遺伝子が高いスコアを示し,β2アドレナリン受容体が細胞の増殖の抑制に関与することが示唆された.
β2アドレナリン受容体作動薬を投与したマウスにN. brasiliensisを感染させ,細胞増殖のマーカーであるKi-67の発現を解析したところ,2型自然リンパ球においてKi-67陽性の細胞の割合が低下していた.さらに,寄生虫に感染した際の2型自然リンパ球の活性化に重要な役割をもつ炎症性サイトカインであるインターロイキン33をβ2アドレナリン受容体ノックアウトマウスに投与してKi-67の発現を解析したところ,2型自然リンパ球においてKi-67陽性の細胞の割合が上昇していた.これらの結果は,N. brasiliensisの感染ののちにみられたβ2アドレナリン受容体ノックアウトマウスにおける2型自然リンパ球の増加,および,β2アドレナリン受容体作動薬を投与したマウスにおける2型自然リンパ球の減少と一致した.また,β2アドレナリン受容体作動薬を投与したマウスにN. brasiliensisとは異なる腸管寄生線虫としてHeligmosomoides polygyrusを感染させてKi-67の発現を解析したところ,2型自然リンパ球においてKi-67陽性の細胞の割合が低下していた.これらのことから,β2アドレナリン受容体は寄生虫の感染に対する応答の際に2型自然リンパ球の増殖を抑制することが考えられた.
マウスの腸管から2型自然リンパ球を単離し,蛍光試薬により細胞を染色したのちβ2アドレナリン受容体作動薬の存在下において培養したところ,増殖の抑制がみられた.また,異なるコンジェニック系のβ2アドレナリン受容体ノックアウトマウスおよび野生型のマウスの骨髄細胞をX線を照射したマウスに移植して骨髄キメラマウスを作製し,再構成ののち腸間膜に存在する2型自然リンパ球を解析したところ,N. brasiliensisを感染させていないキメラマウスにおいてはβ2アドレナリン受容体を欠損した2型自然リンパ球も野生型の2型自然リンパ球も同じくらい存在したが,N. brasiliensisを感染させたキメラマウスにおいてはβ2アドレナリン受容体を欠損した2型自然リンパ球のほうが野生型の2型自然リンパ球よりも多く存在した.これらのことから,β2アドレナリン受容体により2型自然リンパ球は内因性に増殖が抑制されることが示唆された.
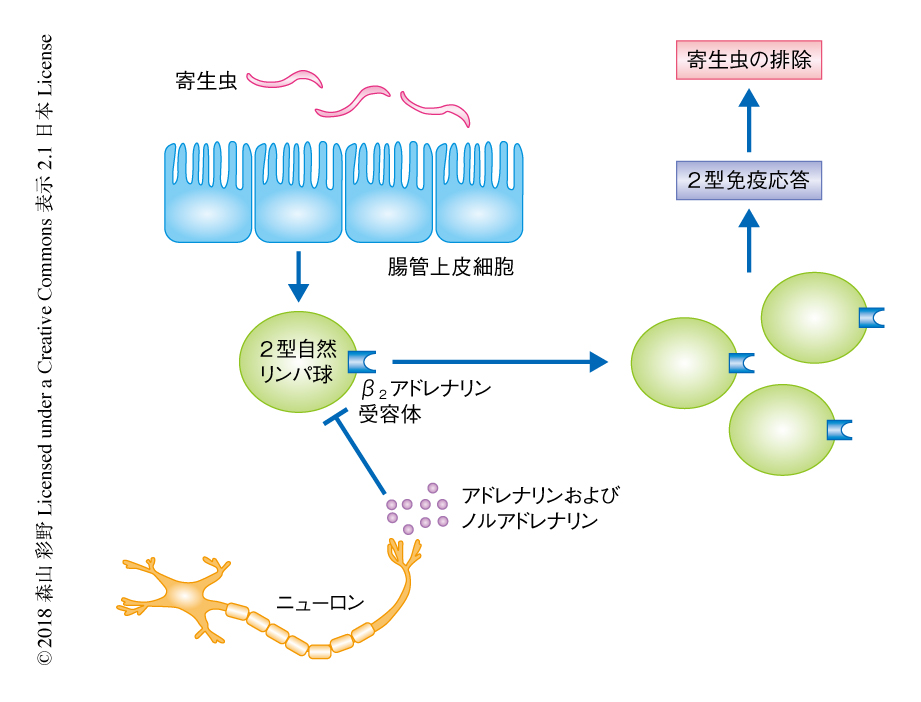
以上のことから,2型自然リンパ球に発現するβ2アドレナリン受容体は炎症応答の初期において2型自然リンパ球の増殖を阻害し,過剰な2型炎症応答を抑制すると考えられた(図1).寄生虫の感染の前後において2型自然リンパ球におけるβ2アドレナリン受容体の発現を解析すると,未感作の状態において発現はもっとも高く,感染に対する応答が進行すると発現は低下したことから,β2アドレナリン受容体による2型自然リンパ球の応答の制御は感染の初期に起こり,過度の炎症による損傷を抑制し寄生虫を効果的に排除できるよう炎症応答を制御すると考えられた.2型自然リンパ球は感染からの回復期や慢性炎症においてもはたらいており,β2アドレナリン受容体がこれらの制御にもかかわるのかどうか,さらなる解明が期待される.
略歴:2012年 大阪大学大学院生命機能研究科博士課程 修了,同年 理化学研究所免疫・アレルギー科学総合研究センター 研究員を経て,2015年より米国Cornell大学Weill Cornell Medicineにて博士研究員.
研究テーマ:神経系による免疫細胞の制御.自然リンパ球による炎症応答の制御.
© 2018 森山 彩野 Licensed under CC 表示 2.1 日本
(米国Cornell大学Weill Cornell Medicine,Department of Microbiology and Immunology)
email:森山彩野
DOI: 10.7875/first.author.2018.034
β2-adrenergic receptor-mediated negative regulation of group 2 innate lymphoid cell responses.
Saya Moriyama, Jonathan R. Brestoff, Anne-Laure Flamar, Jesper B. Moeller, Christoph S. N. Klose, Lucille C. Rankin, Naomi A. Yudanin, Laurel A. Monticelli, Gregory Garbès Putzel, Hans-Reimer Rodewald, David Artis
Science, 359, 1056-1061 (2018)
要 約
寄生虫やアレルゲンといったさまざまな刺激により生体において2型炎症応答がひき起こされる.2型自然リンパ球は2型サイトカインを産生し2型炎症応答において重要な役割を担うが,その制御機構についてはいまだ不明な点が多い.免疫細胞は免疫系だけではなく神経系によっても制御される.これまで,筆者らを含めた複数の研究グループにより,神経伝達物質であるニューロメジンによる2型自然リンパ球の活性化が報告されているが,神経伝達物質が2型自然リンパ球の応答の抑制にかかわるのかどうか,また,その機構については不明であった.この研究において,筆者らは,2型自然リンパ球には神経伝達物質ノルアドレナリンの受容体のひとつであるβ2アドレナリン受容体が発現し,その応答を抑制的に制御することを見い出した.
はじめに
2型炎症応答においては,インターロイキン5やインターロイキン13といった2型サイトカインや抗体の産生,さまざまなエフェクター細胞の分化および活性化が起こり,粘液の産生や平滑筋の収縮がひき起こされ,体内から刺激物質が排除される1).2型自然リンパ球とよばれる自然免疫細胞は腸管,肺,皮膚,脂肪組織,リンパ組織などに存在し,インターロイキン33やインターロイキン25といった炎症性サイトカインの刺激をうけて増殖および活性化し2型サイトカインを産生する2).腸管寄生線虫であるNippostrongylus brasiliensisを感染させたマウスには強い2型炎症応答がもたらされ,感染の初期における2型サイトカインの産生はおもに2型自然リンパ球によることが報告されている3).したがって,2型自然リンパ球の機能の制御は2型炎症応答において重要であると考えられるが,その制御機構はいまだ完全には解明されていない.これまで,さまざまな臓器に神経細胞が存在し,免疫細胞の機能も制御することが明らかにされてきた4-6).2017年,筆者らを含めた複数の研究グループにより,神経伝達物質であるニューロメジンによる2型自然リンパ球の活性化が報告されたが7-9),この研究において,筆者らは,2型自然リンパ球にはアドレナリン作動性ニューロンから分泌されるノルアドレナリンの受容体のひとつであるβ2アドレナリン受容体が発現し,また,2型自然リンパ球の応答はβ2アドレナリン受容体により抑制的に制御されることを明らかにした.
1.2型自然リンパ球はβ2アドレナリン受容体を発現する
RNAシークエンス法により,マウスの腸管に由来する2型自然リンパ球はβ2アドレナリン受容体を発現することが見い出された.腸管,肺,リンパ組織に由来する自然リンパ球においてβ2アドレナリン受容体をコードする遺伝子の発現を解析したところ,それぞれの組織に存在する2型自然リンパ球はβ2アドレナリン受容体を高く発現し,また,そのほかのアドレナリン受容体はほとんど発現していなかった.ヒトの肺および末梢血に由来する2型自然リンパ球においてもβ2アドレナリン受容体の発現がみられた.腸管および腸間膜リンパ節における2型自然リンパ球の局在を免疫組織学的に解析したところ,腸管においては絨毛部および粘膜下層に存在し,その近傍にはアドレナリン作動性ニューロンが観察された.一方,腸間膜リンパ節において2型自然リンパ球は濾胞とT細胞領域の境界領域,T細胞領域,髄質部に観察された.これらの場所にはアドレナリン作動性ニューロンの分布が報告されている4,5).これらのことから,腸管および腸間膜リンパ節に存在する2型自然リンパ球はβ2アドレナリン受容体を発現し,近傍のアドレナリン作動性ニューロンから分泌されるノルアドレナリンを受容することが示唆された.
2.寄生虫の感染に対する応答はβ2アドレナリン受容体により抑制される
β2アドレナリン受容体が2型炎症応答を制御するかどうかを明らかにするため,β2アドレナリン受容体ノックアウトマウスに腸管寄生線虫であるN. brasiliensisを感染させたところ,腸間膜リンパ節において野生型のマウスより多くの2型自然リンパ球および好酸球が存在した.また,β2アドレナリン受容体ノックアウトマウスの腸管においては野生型のマウスより多くのゴブレット細胞(粘膜分泌細胞)が観察された.マウスに経皮感染したN. brasiliensisは肺に炎症をもたらし,感染ののち3~4日で腸管に到達して強い2型炎症応答をひき起こして,感染ののち約10日で体内から排除される.そこで,感染から7日目の腸管において寄生虫体の数を測定したところ,β2アドレナリン受容体ノックアウトマウスにおいては野生型のマウスより少なかった.これらのことから,β2アドレナリン受容体ノックアウトマウスにおいては2型自然リンパ球の応答および2型免疫応答が亢進し寄生虫の排除が促進されると考えられた.一方,マウスにβ2アドレナリン受容体作動薬を投与したうえでN. brasiliensisを感染させたところ,腸間膜リンパ節における2型自然リンパ球の数は対照のマウスより少なくなり,また,2型自然リンパ球によるインターロイキン5およびインターロイキン13の産生能も低下し,さらに,好酸球の数もゴブレット細胞の数も少なく,対照のマウスよりも腸管からの寄生虫の排除が抑制されていた.これらの結果から,β2アドレナリン受容体への刺激は2型自然リンパ球の応答および2型免疫応答を抑制することが示された.
このβ2アドレナリン受容体への刺激による変化は2型自然リンパ球によるものかどうかを明らかにすることを試みた.β2アドレナリン受容体はヘルパーT細胞においても発現しその分化,機能,細胞移動を制御することが報告されており,また,獲得免疫系はN. brasiliensisの排除に重要な役割をはたすことから,抗CD4抗体を投与することによりヘルパーT細胞を除いたマウスに対し,β2アドレナリン受容体作動薬を投与したうえでN. brasiliensisを感染させた.その結果,2型自然リンパ球および好酸球の数は対照のマウスより少なくなり,寄生虫の排除は抑制された.また,2型自然リンパ球にはインターロイキン7受容体が発現することを利用し,インターロイキン7受容体の発現のもとβ2アドレナリン受容体を欠損するマウスにN. brasiliensisを感染させたところ,2型自然リンパ球の増加および寄生虫体の数の減少がみられた.さらに,T細胞,B細胞,自然リンパ球をもたないRag2 Il2rgダブルノックアウトマウスに野生型のマウスあるいはβ2アドレナリン受容体ノックアウトマウスに由来する2型自然リンパ球の前駆細胞を移植し,移植した細胞が2型自然リンパ球へ分化したのちN. brasiliensisを感染させたところ,β2アドレナリン受容体を欠損した2型自然リンパ球をもつマウスにおいては野生型の2型自然リンパ球をもつマウスに比べ2型自然リンパ球および好酸球の増加がみられた.これらのことから,2型自然リンパ球に発現するβ2アドレナリン受容体は2型自然リンパ球の応答を抑制し,2型免疫応答を抑制することが示唆された.
3.肺における2型自然リンパ球の応答はβ2アドレナリン受容体により抑制される
マウスおよびヒトの肺に存在する2型自然リンパ球にもβ2アドレナリン受容体が発現し,また,アドレナリン作動性ニューロンは肺組織および気道にはりめぐらされている.N. brasiliensisは腸管だけでなく肺にも炎症をもたらすことから,感染ののちの肺組織を解析したところ,β2アドレナリン受容体ノックアウトマウスにおいては野生型のマウスに比べ2型自然リンパ球の増加が亢進していた.さらに,インターロイキン33あるいは真菌Alteria alternataの抽出液を鼻腔に投与して肺に炎症をひき起こしたところ,β2アドレナリン受容体の刺激による2型自然リンパ球の増加の抑制および2型自然リンパ球に由来するサイトカインの産生の抑制がみられた.これらのことから,肺における2型自然リンパ球の応答もβ2アドレナリン受容体により抑制され,炎症応答を抑制することが示唆された.
4.β2アドレナリン受容体は2型自然リンパ球の増殖を抑制する
β2アドレナリン受容体が2型自然リンパ球の応答を抑制する機構について明らかにするため,β2アドレナリン受容体への刺激に応じて2型自然リンパ球において生じる変化の検出を試みた.β2アドレナリン受容体作動薬を投与したマウスにN. brasiliensisを感染させ,腸間膜リンパ節から単離した2型自然リンパ球における遺伝子の発現をRNAシークエンス法により網羅的に解析した.β2アドレナリン受容体作動薬を投与したマウスにおいて発現の低くなった遺伝子を抽出しエンリッチメント解析を実施したところ,細胞周期や細胞分裂に関連する遺伝子が高いスコアを示し,β2アドレナリン受容体が細胞の増殖の抑制に関与することが示唆された.
β2アドレナリン受容体作動薬を投与したマウスにN. brasiliensisを感染させ,細胞増殖のマーカーであるKi-67の発現を解析したところ,2型自然リンパ球においてKi-67陽性の細胞の割合が低下していた.さらに,寄生虫に感染した際の2型自然リンパ球の活性化に重要な役割をもつ炎症性サイトカインであるインターロイキン33をβ2アドレナリン受容体ノックアウトマウスに投与してKi-67の発現を解析したところ,2型自然リンパ球においてKi-67陽性の細胞の割合が上昇していた.これらの結果は,N. brasiliensisの感染ののちにみられたβ2アドレナリン受容体ノックアウトマウスにおける2型自然リンパ球の増加,および,β2アドレナリン受容体作動薬を投与したマウスにおける2型自然リンパ球の減少と一致した.また,β2アドレナリン受容体作動薬を投与したマウスにN. brasiliensisとは異なる腸管寄生線虫としてHeligmosomoides polygyrusを感染させてKi-67の発現を解析したところ,2型自然リンパ球においてKi-67陽性の細胞の割合が低下していた.これらのことから,β2アドレナリン受容体は寄生虫の感染に対する応答の際に2型自然リンパ球の増殖を抑制することが考えられた.
マウスの腸管から2型自然リンパ球を単離し,蛍光試薬により細胞を染色したのちβ2アドレナリン受容体作動薬の存在下において培養したところ,増殖の抑制がみられた.また,異なるコンジェニック系のβ2アドレナリン受容体ノックアウトマウスおよび野生型のマウスの骨髄細胞をX線を照射したマウスに移植して骨髄キメラマウスを作製し,再構成ののち腸間膜に存在する2型自然リンパ球を解析したところ,N. brasiliensisを感染させていないキメラマウスにおいてはβ2アドレナリン受容体を欠損した2型自然リンパ球も野生型の2型自然リンパ球も同じくらい存在したが,N. brasiliensisを感染させたキメラマウスにおいてはβ2アドレナリン受容体を欠損した2型自然リンパ球のほうが野生型の2型自然リンパ球よりも多く存在した.これらのことから,β2アドレナリン受容体により2型自然リンパ球は内因性に増殖が抑制されることが示唆された.
おわりに
以上のことから,2型自然リンパ球に発現するβ2アドレナリン受容体は炎症応答の初期において2型自然リンパ球の増殖を阻害し,過剰な2型炎症応答を抑制すると考えられた(図1).寄生虫の感染の前後において2型自然リンパ球におけるβ2アドレナリン受容体の発現を解析すると,未感作の状態において発現はもっとも高く,感染に対する応答が進行すると発現は低下したことから,β2アドレナリン受容体による2型自然リンパ球の応答の制御は感染の初期に起こり,過度の炎症による損傷を抑制し寄生虫を効果的に排除できるよう炎症応答を制御すると考えられた.2型自然リンパ球は感染からの回復期や慢性炎症においてもはたらいており,β2アドレナリン受容体がこれらの制御にもかかわるのかどうか,さらなる解明が期待される.
文 献
- Pulendran, B. & Artis, D.: New paradigms in type 2 immunity. Science, 337, 431-435 (2012)[PubMed]
- Klose, C. S. & Artis, D.: Innate lymphoid cells as regulators of immunity, inflammation and tissue homeostasis. Nat. Immunol., 17, 765-774 (2016)[PubMed]
- Price, A. E., Liang, H. E., Sullivan, B. M. et al.: Systemically dispersed innate IL-13-expressing cells in type 2 immunity. Proc. Natl. Acad. Sci. USA, 107, 11489-11494 (2010)[PubMed]
- Felten, D. L., Felten, S. Y., Carlson, S. L. et al.: Noradrenergic and peptidergic innervation of lymphoid tissue. J. Immunol., 135, 755s-765s (1985)[PubMed]
- Livnat, S., Felten, S. Y., Carlson, S. L. et al.: Involvement of peripheral and central catecholamine systems in neural-immune interactions. J. Neuroimmunol., 10, 5-30 (1985)[PubMed]
- Furness, J. B.: The enteric nervous system and neurogastroenterology. Nat. Rev. Gastroenterol. Hepatol., 9, 286-294 (2012)[PubMed]
- Klose, C. S. N., Mahlakoiv, T., Moeller, J. B. et al.: The neuropeptide neuromedin U stimulates innate lymphoid cells and type 2 inflammation. Nature, 549, 282-286 (2017)[PubMed]
- Wallrapp, A., Riesenfeld, S. J., Burkett, P. R. et al.: The neuropeptide NMU amplifies ILC2-driven allergic lung inflammation. Nature, 549, 351-356 (2017)[PubMed]
- Cardoso, V., Chesne, J., Ribeiro, H. et al.: Neuronal regulation of type 2 innate lymphoid cells via neuromedin U. Nature, 549, 277-281 (2017)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2012年 大阪大学大学院生命機能研究科博士課程 修了,同年 理化学研究所免疫・アレルギー科学総合研究センター 研究員を経て,2015年より米国Cornell大学Weill Cornell Medicineにて博士研究員.
研究テーマ:神経系による免疫細胞の制御.自然リンパ球による炎症応答の制御.
© 2018 森山 彩野 Licensed under CC 表示 2.1 日本