糖転移酵素EarPによる翻訳因子EF-PのArgのラムノシル化の構造的な基盤
仙石 徹・横山茂之・柳沢達男
(理化学研究所 横山構造生物学研究室)
email:柳沢達男
DOI: 10.7875/first.author.2018.033
Structural basis of protein arginine rhamnosylation by glycosyltransferase EarP.
Toru Sengoku, Takehiro Suzuki, Naoshi Dohmae, Chiduru Watanabe, Teruki Honma, Yasushi Hikida, Yoshiki Yamaguchi, Hideyuki Takahashi, Shigeyuki Yokoyama, Tatsuo Yanagisawa
Nature Chemical Biology, 14, 368-374 (2018)
リボソームはタンパク質を合成する際にProを多く含む配列においてしばしば停止する.EF-Pは停止したリボソームを正常にもどしタンパク質の合成を再開させる翻訳因子である.近年,髄膜炎菌などの細菌において,新規の糖転移酵素EarPがdTDP-ラムノースを補因子としてEF-PのArg32をラムノシル化し,それによりEF-Pを活性化させることが明らかにされた.この研究において,筆者らは,EarPによるEF-Pの認識機構およびArgのラムノシル化の反応機構について解明するため,髄膜炎菌に由来するEarPの結晶構造を,アポ型,dTDP-ラムノースとの複合体,EF-PのドメインIとの複合体の3つの状態について解析した.EarPは糖転移酵素スーパーファミリーBに特徴的な2個のタンデムにならんだロスマンフォールドドメインをもっていた.EF-PのドメインIはEarPのN末端ドメインと結合し,そのβシート構造の全域にわたりEarPと多くの親水的な相互作用および疎水的な相互作用を形成していた.dTDP-ラムノースはEarPの2つのドメインのあいだの溝と結合しており,ラムノースの部分は糖転移反応に適さない“いす型”のコンフォメーションをとっていた.EF-Pとの結合にともないEarPのラムノース結合ポケットの形状が変化し,“いす型”でなく糖転移反応に適した“ねじれ舟型”を収納することができるようになった.以上の結果から,EF-Pとの結合がこのようなラムノースのコンフォメーションの変化を誘起してEarPによるラムノシル化を進行させるという新たな機構が提唱された.EarPは淋菌,緑膿菌,百日咳菌など臨床的に重要な一部の病原菌にも保存されており,この研究において解析された立体構造および反応機構の知見は,これらEarPをもつ細菌のみを狙い撃つ狭域性の抗菌剤の開発に道を開くことが期待される.
遺伝暗号の翻訳装置であるリボソームは,合成中のポリペプチドにProが連続する配列が含まれるとしばしば停滞してタンパク質の合成を停止する.EF-Pおよびその真核生物のオーソログであるeIF-5Aは,そのような停滞したリボソームにはたらきかけタンパク質の合成を再開させる翻訳因子である1-3).ペプチド転移反応はリボソームの奥まった内部において起こっており,EF-P/eIF-5Aはそこにアクセスするため翻訳後修飾をうけた非常に長いアミノ酸側鎖を用いる.たとえば,大腸菌やサルモネラ菌のEF-PにおいてはLysがβリジル化され4-6),酵母やヒトなどの真核生物のeIF-5AにおいてはLysがハイプシン化される7).近年,筆者らの研究グループおよびほかの研究グループにより,シェワネラ菌,緑膿菌,髄膜炎菌などの一部の真正細菌においてEF-Pは特定のArg(髄膜炎菌においてはArg32)がラムノシル化をされて機能することが明らかにされた8-10).これは,Argのラムノシル化についての最初の報告であり,この反応は新規の糖転移酵素EarPにより触媒される.
タンパク質はさまざまな糖により修飾されてその機能が制御され,それに対応して多くの糖転移酵素が存在する.これまで,いくつかの糖転移酵素については基質タンパク質との複合体として構造が決定されているが,それらは複数のタンパク質を基質とする,すなわち,幅広い基質特異性をもつものであった.これらの複合体の構造において,糖転移酵素はおもに基質タンパク質の主鎖と相互作用を形成しており,基質タンパク質のかたちのみを認識するものであった11).一方で,EarPは知られているかぎりEF-Pのみを基質とするが,そのような厳密な基質特異性の構造的な基盤は明らかにされていなかった.
糖転移酵素はその生成物において糖のアノマー型(C1炭素における立体化学)が変化するinverting酵素と変化しないretaining酵素とに分類され12),EarPはinverting酵素と考えられる13).ほとんどのinverting酵素はSN2反応機構を用い,糖受容体が糖供与体のC1炭素を求核攻撃することにより反応が進行する.多くの糖供与体はSN2反応の脱離基がアキシアル位置をしめており立体障害なく反応が進行する.ところが,ラムノースの供与体であるdTDP-ラムノースにおいては,ラムノースの部分がエネルギー的に最安定な1C4コンフォメーションをとると,SN2反応の脱離基となるdTDPの部分はエカトリアル位置をしめる.このコンフォメーションにおいては,ラムノース環の立体障害により求核基はC1炭素を攻撃することができない.EarPがどのようにラムノース供与体と結合するのか,また,どのような反応機構によりラムノースを転移するのかは不明であった.
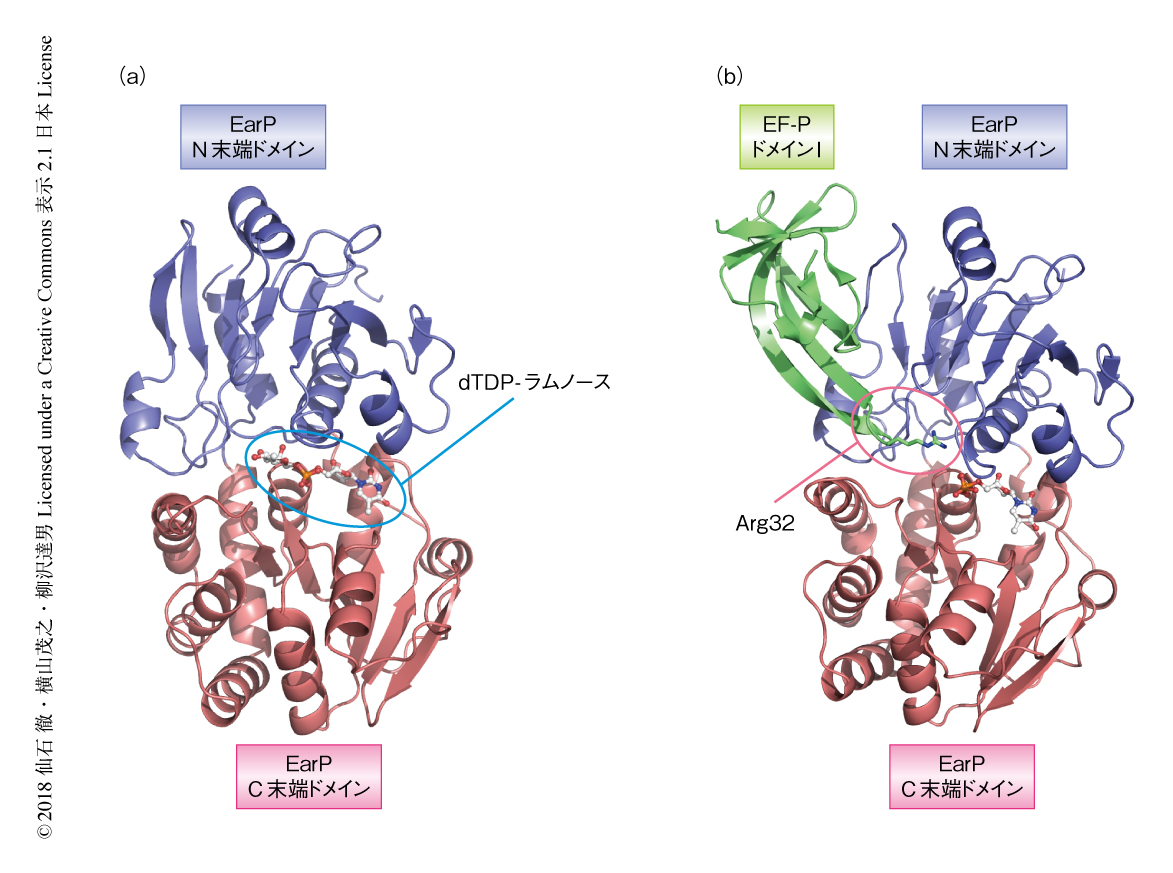
EarPによるEF-Pの認識機構およびArgのラムノシル化の反応機構について明らかにするため,髄膜炎菌に由来するEarPの結晶構造を,アポ型(PDB ID:5WXJ)およびdTDP-ラムノースとの複合体(PDB ID:5XVR,図1a)として決定した.EarPは2つのロスマンフォールドドメインをタンデムにもつ糖転移酵素スーパーファミリーBに属しており,なかでも,GT1ファミリーと構造類似度がもっとも高かった.dTDP-ラムノースはEarPの2つのドメインのあいだの溝と結合していた.
EF-Pは3つのドメインをもつが,そのうちArg32を含むドメインIは単独でEarPによりラムノシル化されることがわかった.そこで,EarPとEF-PのドメインIとの複合体を共結晶化しその立体構造を決定した(PDB ID:5WXK,図1b).EF-PのドメインIはEarPのN末端ドメインと結合しており,EF-PのArg32の側鎖はドメインIから突き出てEarPのAsp16やAsp20などと相互作用していた.これにくわえ,EF-PのドメインIはそのβシート構造の全域にわたりEarPと多くの親水的な相互作用および疎水的な相互作用を形成していた.すなわち,EarPはEF-PのドメインIのかたちと配列の両方を認識することにより高い特異性を実現していることがわかった.これは,これまでに報告された,ゆるい特異性をもつ糖転移酵素の基質の認識機構と対照的であった.
EarPは多くの保存された残基を介してEF-Pと相互作用を形成していた.これらの残基の重要性および機能について調べるため,EarPの変異体を作製してEF-Pとの結合活性およびラムノシル化活性について調べた.その結果,EF-PのArg32からはなれた位置でEF-Pと相互作用を形成するEarPの残基は,EF-Pとの結合およびラムノシル化の両方に重要であることが明らかにされた.一方,EF-PのArg32と相互作用するEarPの残基に置換が導入された場合,EF-Pとの結合活性についてはさほど大きな影響はみられなかったのに対し,ラムノシル化活性は大きく低下した.とくに,EF-PのArg32のグアニジンの部分と相互作用するEarPのAsp20については,Ala置換体とAsn置換体のいずれについても活性が完全に消失した.構造的に相同な糖転移酵素においてEarPのAsp20に相当する位置にはSN2反応における一般塩基触媒としてはたらく残基が存在する12).これらの結果から,EarPもAsp20を一般塩基触媒とするSN2型の反応機構を用いることが明らかにされた.
dTDP-ラムノースはEarPの2つのドメインのあいだの溝と結合しており,おもにC末端ドメインの残基と相互作用を形成していた.dTDPの部分はEarPと多くの水素結合を形成し,チミジン塩基に特異的に認識されていた.一方,ラムノースの部分はEarPとただひとつの水素結合しか形成しておらず,もっともエネルギー的に安定な“いす型”の1C4コンフォメーションをとっていた.
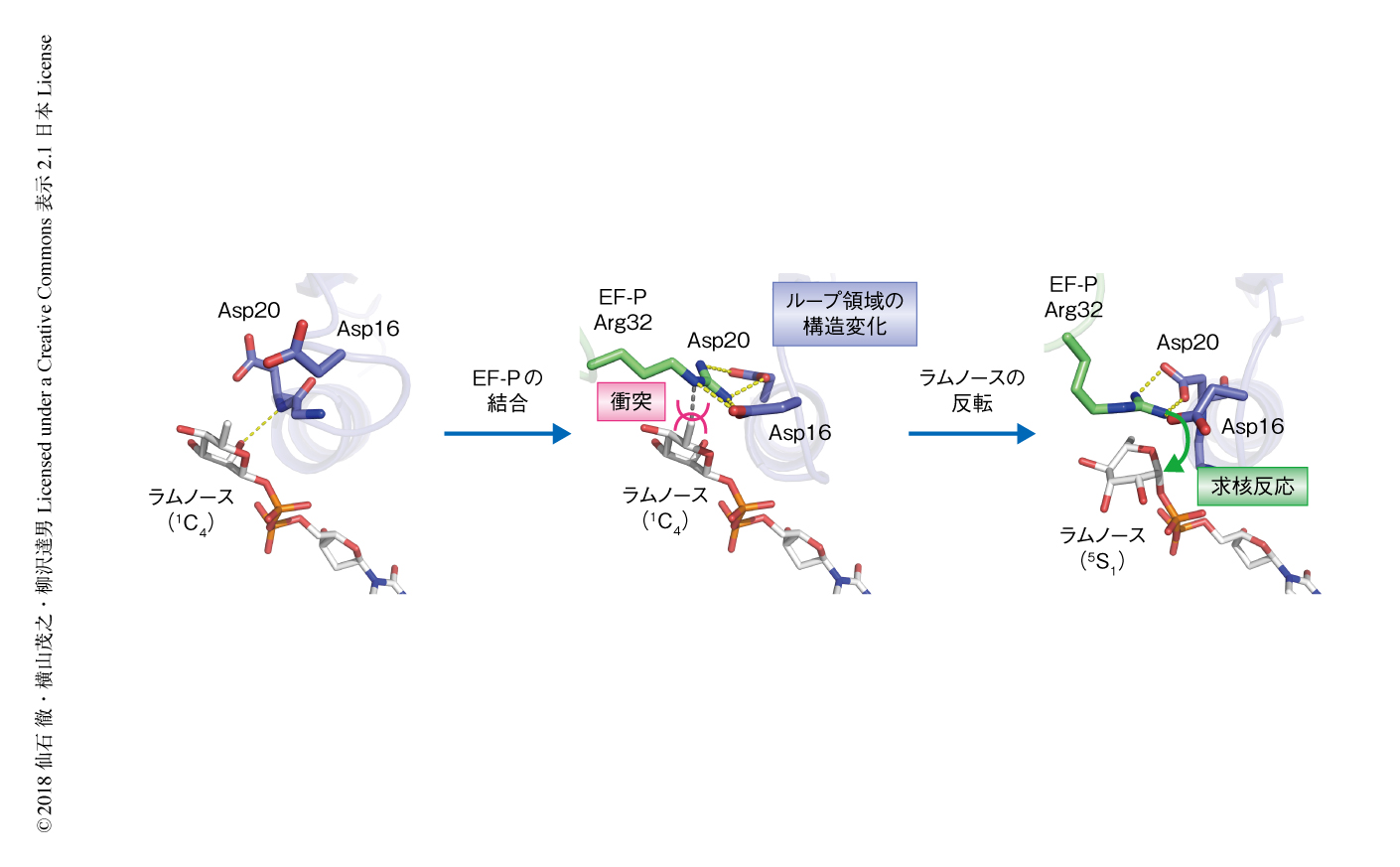
EarP,dTDP-ラムノース,EF-Pからなる三重複合体のモデル構造を構築した.単純にEarPとdTDP-ラムノースとの複合体とEarPとEF-Pとの複合体を重ね合わせたところ,EF-PのArg32とラムノースが立体的に衝突してしまった.すなわち,EF-PとdTDP-ラムノースとの結合にはなんらかのコンフォメーションの変化が必要であった.実際に,EarPのAsp20を含むループ領域の構造はEF-Pとの複合体とdTDP-ラムノースとの複合体とで異なっており,それにともない,ラムノース結合ポケットのかたちも変化していた.そこで,EF-Pとの複合体においてラムノース結合ポケットに収まりうるラムノースのコンフォメーションを探索し,分子動力学計算により構造を最適化したところ,“ねじれ舟型”の5S1コンフォメーションとその類似型のみが見い出された.これらのコンフォメーションにおいて,SN2反応における脱離基であるdTDPはアキシアル位置をしめており,EF-PのArg32はラムノース環との立体障害なしにC1炭素を求核攻撃することが可能であった.dTDP-ラムノースとの複合体においては,EarPのAsp20を含むループ領域との立体障害により,ラムノースは5S1コンフォメーションをとりえないことが明らかにされた.
以上の結果から,以下のような反応機構が提唱された(図2).EarPはまずdTDP-ラムノースと結合し,その際にラムノース環はエネルギー的に安定な1C4コンフォメーションをとる.このコンフォメーションにおいてSN2反応は起こりにくく,それによりEarPは非特異的なArgのラムノシル化やdTDP-ラムノースのむだな加水分解をふせいでいる.EF-PがEarPと結合する際に,EF-PのArg32との立体障害およびEarPのループ領域の構造変化によりラムノースは5S1コンフォメーションへと変化する.これによりEF-PのArg32によるラムノースのC1炭素に対する求核攻撃が立体化学的に可能になり,SN2反応によるEF-PのArg32のラムノシル化が起こる.
この研究において,筆者らは,従来の糖転移酵素にはみられない,“いす型”から“ねじれ舟型”への反転をともなうArgのラムノシル化の新たな反応機構を提唱した.EarPの構造生物学的な研究は,厳密な基質特異性を示す糖転移酵素による基質の認識機構および反応機構を詳細に説明した最初の例である.
Arg32をもつEF-Pは細菌全体の10%前後であるが,それらの細菌においてほとんどの場合EarPが保存されている.EF-Pのラムノシル化は緑膿菌においては感染性や抗生物質に対する耐性にかかわり8,9),髄膜炎菌においては正常な増殖に必要であることが確かめられている10).EarPは緑膿菌,髄膜炎菌のほか淋菌や百日咳菌などの臨床において重要な病原菌にも存在するが,ヒトには存在しない.そのため,EarPに特異的な阻害剤が開発されれば,これらの病原菌にのみはたらき耐性菌の出現を抑える狭域性の抗生物質につながるかもしれない.この研究において明らかにされたEarPによる独特なラムノシル化の反応機構は,特異的な阻害剤の開発に有用な手がかりをあたえるであろう.
略歴:2004年 東京大学大学院理学系研究科博士課程 修了,同年 理化学研究所ゲノム科学総合研究センター リサーチアソシエイト,2007年 米国Rockefeller大学 博士研究員,2010年 理化学研究所生命分子システム基盤研究領域 研究員を経て,2013年より理化学研究所 研究員.
研究テーマ:遺伝子の発現制御の構造生物学.
横山 茂之(Shigeyuki Yokoyama)
理化学研究所 上席研究員.
柳沢 達男(Tatsuo Yanagisawa)
理化学研究所 研究員.
© 2018 仙石 徹・横山茂之・柳沢達男 Licensed under CC 表示 2.1 日本
(理化学研究所 横山構造生物学研究室)
email:柳沢達男
DOI: 10.7875/first.author.2018.033
Structural basis of protein arginine rhamnosylation by glycosyltransferase EarP.
Toru Sengoku, Takehiro Suzuki, Naoshi Dohmae, Chiduru Watanabe, Teruki Honma, Yasushi Hikida, Yoshiki Yamaguchi, Hideyuki Takahashi, Shigeyuki Yokoyama, Tatsuo Yanagisawa
Nature Chemical Biology, 14, 368-374 (2018)
要 約
リボソームはタンパク質を合成する際にProを多く含む配列においてしばしば停止する.EF-Pは停止したリボソームを正常にもどしタンパク質の合成を再開させる翻訳因子である.近年,髄膜炎菌などの細菌において,新規の糖転移酵素EarPがdTDP-ラムノースを補因子としてEF-PのArg32をラムノシル化し,それによりEF-Pを活性化させることが明らかにされた.この研究において,筆者らは,EarPによるEF-Pの認識機構およびArgのラムノシル化の反応機構について解明するため,髄膜炎菌に由来するEarPの結晶構造を,アポ型,dTDP-ラムノースとの複合体,EF-PのドメインIとの複合体の3つの状態について解析した.EarPは糖転移酵素スーパーファミリーBに特徴的な2個のタンデムにならんだロスマンフォールドドメインをもっていた.EF-PのドメインIはEarPのN末端ドメインと結合し,そのβシート構造の全域にわたりEarPと多くの親水的な相互作用および疎水的な相互作用を形成していた.dTDP-ラムノースはEarPの2つのドメインのあいだの溝と結合しており,ラムノースの部分は糖転移反応に適さない“いす型”のコンフォメーションをとっていた.EF-Pとの結合にともないEarPのラムノース結合ポケットの形状が変化し,“いす型”でなく糖転移反応に適した“ねじれ舟型”を収納することができるようになった.以上の結果から,EF-Pとの結合がこのようなラムノースのコンフォメーションの変化を誘起してEarPによるラムノシル化を進行させるという新たな機構が提唱された.EarPは淋菌,緑膿菌,百日咳菌など臨床的に重要な一部の病原菌にも保存されており,この研究において解析された立体構造および反応機構の知見は,これらEarPをもつ細菌のみを狙い撃つ狭域性の抗菌剤の開発に道を開くことが期待される.
はじめに
遺伝暗号の翻訳装置であるリボソームは,合成中のポリペプチドにProが連続する配列が含まれるとしばしば停滞してタンパク質の合成を停止する.EF-Pおよびその真核生物のオーソログであるeIF-5Aは,そのような停滞したリボソームにはたらきかけタンパク質の合成を再開させる翻訳因子である1-3).ペプチド転移反応はリボソームの奥まった内部において起こっており,EF-P/eIF-5Aはそこにアクセスするため翻訳後修飾をうけた非常に長いアミノ酸側鎖を用いる.たとえば,大腸菌やサルモネラ菌のEF-PにおいてはLysがβリジル化され4-6),酵母やヒトなどの真核生物のeIF-5AにおいてはLysがハイプシン化される7).近年,筆者らの研究グループおよびほかの研究グループにより,シェワネラ菌,緑膿菌,髄膜炎菌などの一部の真正細菌においてEF-Pは特定のArg(髄膜炎菌においてはArg32)がラムノシル化をされて機能することが明らかにされた8-10).これは,Argのラムノシル化についての最初の報告であり,この反応は新規の糖転移酵素EarPにより触媒される.
タンパク質はさまざまな糖により修飾されてその機能が制御され,それに対応して多くの糖転移酵素が存在する.これまで,いくつかの糖転移酵素については基質タンパク質との複合体として構造が決定されているが,それらは複数のタンパク質を基質とする,すなわち,幅広い基質特異性をもつものであった.これらの複合体の構造において,糖転移酵素はおもに基質タンパク質の主鎖と相互作用を形成しており,基質タンパク質のかたちのみを認識するものであった11).一方で,EarPは知られているかぎりEF-Pのみを基質とするが,そのような厳密な基質特異性の構造的な基盤は明らかにされていなかった.
糖転移酵素はその生成物において糖のアノマー型(C1炭素における立体化学)が変化するinverting酵素と変化しないretaining酵素とに分類され12),EarPはinverting酵素と考えられる13).ほとんどのinverting酵素はSN2反応機構を用い,糖受容体が糖供与体のC1炭素を求核攻撃することにより反応が進行する.多くの糖供与体はSN2反応の脱離基がアキシアル位置をしめており立体障害なく反応が進行する.ところが,ラムノースの供与体であるdTDP-ラムノースにおいては,ラムノースの部分がエネルギー的に最安定な1C4コンフォメーションをとると,SN2反応の脱離基となるdTDPの部分はエカトリアル位置をしめる.このコンフォメーションにおいては,ラムノース環の立体障害により求核基はC1炭素を攻撃することができない.EarPがどのようにラムノース供与体と結合するのか,また,どのような反応機構によりラムノースを転移するのかは不明であった.
1.糖転移酵素EarPの構造およびその比較
EarPによるEF-Pの認識機構およびArgのラムノシル化の反応機構について明らかにするため,髄膜炎菌に由来するEarPの結晶構造を,アポ型(PDB ID:5WXJ)およびdTDP-ラムノースとの複合体(PDB ID:5XVR,図1a)として決定した.EarPは2つのロスマンフォールドドメインをタンデムにもつ糖転移酵素スーパーファミリーBに属しており,なかでも,GT1ファミリーと構造類似度がもっとも高かった.dTDP-ラムノースはEarPの2つのドメインのあいだの溝と結合していた.
EF-Pは3つのドメインをもつが,そのうちArg32を含むドメインIは単独でEarPによりラムノシル化されることがわかった.そこで,EarPとEF-PのドメインIとの複合体を共結晶化しその立体構造を決定した(PDB ID:5WXK,図1b).EF-PのドメインIはEarPのN末端ドメインと結合しており,EF-PのArg32の側鎖はドメインIから突き出てEarPのAsp16やAsp20などと相互作用していた.これにくわえ,EF-PのドメインIはそのβシート構造の全域にわたりEarPと多くの親水的な相互作用および疎水的な相互作用を形成していた.すなわち,EarPはEF-PのドメインIのかたちと配列の両方を認識することにより高い特異性を実現していることがわかった.これは,これまでに報告された,ゆるい特異性をもつ糖転移酵素の基質の認識機構と対照的であった.
2.EarPの変異体の解析
EarPは多くの保存された残基を介してEF-Pと相互作用を形成していた.これらの残基の重要性および機能について調べるため,EarPの変異体を作製してEF-Pとの結合活性およびラムノシル化活性について調べた.その結果,EF-PのArg32からはなれた位置でEF-Pと相互作用を形成するEarPの残基は,EF-Pとの結合およびラムノシル化の両方に重要であることが明らかにされた.一方,EF-PのArg32と相互作用するEarPの残基に置換が導入された場合,EF-Pとの結合活性についてはさほど大きな影響はみられなかったのに対し,ラムノシル化活性は大きく低下した.とくに,EF-PのArg32のグアニジンの部分と相互作用するEarPのAsp20については,Ala置換体とAsn置換体のいずれについても活性が完全に消失した.構造的に相同な糖転移酵素においてEarPのAsp20に相当する位置にはSN2反応における一般塩基触媒としてはたらく残基が存在する12).これらの結果から,EarPもAsp20を一般塩基触媒とするSN2型の反応機構を用いることが明らかにされた.
3.dTDP-ラムノースとの結合
dTDP-ラムノースはEarPの2つのドメインのあいだの溝と結合しており,おもにC末端ドメインの残基と相互作用を形成していた.dTDPの部分はEarPと多くの水素結合を形成し,チミジン塩基に特異的に認識されていた.一方,ラムノースの部分はEarPとただひとつの水素結合しか形成しておらず,もっともエネルギー的に安定な“いす型”の1C4コンフォメーションをとっていた.
4.EF-PのArg32のラムノシル化の反応機構
EarP,dTDP-ラムノース,EF-Pからなる三重複合体のモデル構造を構築した.単純にEarPとdTDP-ラムノースとの複合体とEarPとEF-Pとの複合体を重ね合わせたところ,EF-PのArg32とラムノースが立体的に衝突してしまった.すなわち,EF-PとdTDP-ラムノースとの結合にはなんらかのコンフォメーションの変化が必要であった.実際に,EarPのAsp20を含むループ領域の構造はEF-Pとの複合体とdTDP-ラムノースとの複合体とで異なっており,それにともない,ラムノース結合ポケットのかたちも変化していた.そこで,EF-Pとの複合体においてラムノース結合ポケットに収まりうるラムノースのコンフォメーションを探索し,分子動力学計算により構造を最適化したところ,“ねじれ舟型”の5S1コンフォメーションとその類似型のみが見い出された.これらのコンフォメーションにおいて,SN2反応における脱離基であるdTDPはアキシアル位置をしめており,EF-PのArg32はラムノース環との立体障害なしにC1炭素を求核攻撃することが可能であった.dTDP-ラムノースとの複合体においては,EarPのAsp20を含むループ領域との立体障害により,ラムノースは5S1コンフォメーションをとりえないことが明らかにされた.
以上の結果から,以下のような反応機構が提唱された(図2).EarPはまずdTDP-ラムノースと結合し,その際にラムノース環はエネルギー的に安定な1C4コンフォメーションをとる.このコンフォメーションにおいてSN2反応は起こりにくく,それによりEarPは非特異的なArgのラムノシル化やdTDP-ラムノースのむだな加水分解をふせいでいる.EF-PがEarPと結合する際に,EF-PのArg32との立体障害およびEarPのループ領域の構造変化によりラムノースは5S1コンフォメーションへと変化する.これによりEF-PのArg32によるラムノースのC1炭素に対する求核攻撃が立体化学的に可能になり,SN2反応によるEF-PのArg32のラムノシル化が起こる.
おわりに
この研究において,筆者らは,従来の糖転移酵素にはみられない,“いす型”から“ねじれ舟型”への反転をともなうArgのラムノシル化の新たな反応機構を提唱した.EarPの構造生物学的な研究は,厳密な基質特異性を示す糖転移酵素による基質の認識機構および反応機構を詳細に説明した最初の例である.
Arg32をもつEF-Pは細菌全体の10%前後であるが,それらの細菌においてほとんどの場合EarPが保存されている.EF-Pのラムノシル化は緑膿菌においては感染性や抗生物質に対する耐性にかかわり8,9),髄膜炎菌においては正常な増殖に必要であることが確かめられている10).EarPは緑膿菌,髄膜炎菌のほか淋菌や百日咳菌などの臨床において重要な病原菌にも存在するが,ヒトには存在しない.そのため,EarPに特異的な阻害剤が開発されれば,これらの病原菌にのみはたらき耐性菌の出現を抑える狭域性の抗生物質につながるかもしれない.この研究において明らかにされたEarPによる独特なラムノシル化の反応機構は,特異的な阻害剤の開発に有用な手がかりをあたえるであろう.
文 献
- Ude, S., Lassak, J. & Starosta, A. L. et al.: Translation elongation factor EF-P alleviates ribosome stalling at polyproline stretches. Science, 339, 82-85 (2013)[PubMed]
- Doerfel, L. K., Wohlgemuth, I., Kothe, C. et al.: EF-P is essential for rapid synthesis of proteins containing consecutive proline residues. Science, 339, 85-88 (2013)[PubMed]
- Lassak, J., Wilson, D. N. & Jung, K.: Stall no more at polyproline stretches with the translation elongation factors EF-P and IF-5A. Mol. Microbiol., 99, 219-235 (2016)[PubMed]
- Navarre, W. W., Zou, S. B., Roy, H. et al.: PoxA, YjeK, and elongation factor P coordinately modulate virulence and drug resistance in Salmonella enterica. Mol. Cell, 39, 209-221 (2010)[PubMed]
- Yanagisawa, T., Sumida, T., Ishii, R. et al.: A paralog of lysyl-tRNA synthetase aminoacylates a conserved lysine residue in translation elongation factor P. Nat. Struct. Mol. Biol., 17, 1136-1143 (2010)[PubMed] [新着論文レビュー]
- Roy, H., Zou, S. B., Bullwinkle, T. J. et al.: The tRNA synthetase paralog PoxA modifies elongation factor-P with (R)-β-lysine. Nat. Chem. Biol., 7, 667-669 (2011)[PubMed]
- Park, M. H.: The post-translational synthesis of a polyamine-derived amino acid, hypusine, in the eukaryotic translation initiation factor 5A (eIF5A). J. Biochem., 139, 161-169 (2006)[PubMed]
- Lassak, J., Keilhauer, E. C., Furst, M. et al.: Arginine-rhamnosylation as new strategy to activate translation elongation factor P. Nat. Chem. Biol., 11, 266-270 (2015)[PubMed]
- Rajkovic, A., Erickson, S., Witzky, A. et al.: Cyclic rhamnosylated elongation factor P establishes antibiotic resistance in Pseudomonas aeruginosa. MBio, 6, e00823 (2015)[PubMed]
- Yanagisawa, T., Takahashi, H., Suzuki, T. et al.: Neisseria meningitidis translation elongation factor P and its active-site arginine residue are essential for cell viability. PLoS One, 11, e0147907 (2016)[PubMed]
- Hurtado-Guerrero, R. & Davies, G. J.: Recent structural and mechanistic insights into post-translational enzymatic glycosylation. Curr. Opin. Chem. Biol., 16, 479-487 (2012)[PubMed]
- Lairson, L. L., Henrissat, B., Davies, G. J. et al.: Glycosyltransferases: structures, functions, and mechanisms. Annu. Rev. Biochem., 77, 521-555 (2008)[PubMed]
- Li, X., Krafczyk, R., Macosek, J. et al.: Resolving the α-glycosidic linkage of arginine-rhamnosylated translation elongation factor P triggers generation of the first ArgRha specific antibody. Chem. Sci., 7, 6995-7001 (2016)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2004年 東京大学大学院理学系研究科博士課程 修了,同年 理化学研究所ゲノム科学総合研究センター リサーチアソシエイト,2007年 米国Rockefeller大学 博士研究員,2010年 理化学研究所生命分子システム基盤研究領域 研究員を経て,2013年より理化学研究所 研究員.
研究テーマ:遺伝子の発現制御の構造生物学.
横山 茂之(Shigeyuki Yokoyama)
理化学研究所 上席研究員.
柳沢 達男(Tatsuo Yanagisawa)
理化学研究所 研究員.
© 2018 仙石 徹・横山茂之・柳沢達男 Licensed under CC 表示 2.1 日本