エンハンサーHS2によるGATA-3に依存的なインターロイキン4の産生制御
田中伸弥1・本村泰隆2・久保允人2
(1理化学研究所免疫アレルギー科学総合研究センター シグナルネットワーク研究チーム,2東京理科大学生命科学研究所 生命工学技術研究部門)
email:田中伸弥,久保允人
DOI: 10.7875/first.author.2011.004
The enhancer HS2 critically regulates GATA-3-mediated Il4 transcription in TH2 cells.
Shinya Tanaka, Yasutaka Motomura, Yoshie Suzuki, Ryoji Yagi, Hiromasa Inoue, Shoichiro Miyatake, Masato Kubo
Nature Immunology, 12, 77-85 (2011)
ヘルパーT細胞はそれぞれ固有のサイトカインを産生することにより獲得免疫系の中心を担う免疫細胞であるが,そのうちTh2細胞は抗体の産生を制御するとともにアレルギー疾患にかかわるものとして知られている.Th2細胞は抗原刺激によりナイーブT細胞から分化し,アレルギー病態に関与する一連のサイトカインIL-4,IL-5,IL-13を産生する.これらはTh2サイトカインとよばれ,それぞれをコードする遺伝子は哺乳類では同一の染色体に近接して存在し同調して発現する.この分化過程を制御するマスターレギュレーターとしてGATA-3が知られているが,GATA-3がどのように複数の遺伝子のスイッチを同時に制御するのか,その分子機構は明らかになっていなかった.今回の筆者らの研究は,それぞれのTh2サイトカイン遺伝子には別々のスイッチが存在し,GATA-3はそれらのスイッチを同時に入れていることを明らかにした.IL-4遺伝子の場合は第2イントロンに存在するHS2がそのスイッチであり,IL-13遺伝子の場合はCGREという部位がそれに相当した.GATA-3はこれらの部位に結合してクロマチン構造を変化させることによりいちどに複数のサイトカイン遺伝子のスイッチを制御していること,また,アレルギー病態の形成にも重要な役割を担っていることが明らかになった.
Th2細胞(2型ヘルパーT細胞)はIL-4,IL-5,IL-13などTh2サイトカインとよばれるサイトカインを発現することにより寄生虫の排除に寄与し,また,とくにIL-4はB細胞における特異的な抗原に対する抗体の産生を誘導するサイトカインである(IL:インターロイキン).そのため,Th2サイトカインは花粉症などに代表されるアレルギー反応に深く関与することでも知られている.Th2細胞はナイーブT細胞より分化し,その運命決定はIL-4によって誘導されるGATA-3がTh2サイトカイン遺伝子を同時に制御するマスターレギュレーターとしてはたらくことで規定されている1).このGATA-3によるTh2サイトカイン遺伝子のスイッチ制御機構の解明は長いあいだ議論がつづいており,T細胞の分化を理解するうえで非常に重要な課題である.とくに,IL-4遺伝子の転写についてはこれまで精力的に研究が行われ,1998年にクロマチン構造変化,ヒストン修飾といったエピジェネティックな変化がTh2細胞の分化にともなう転写制御に関与するという報告がなされて以来,遺伝子レベルにおけるエピジェネティックな制御にも注目が集まるようになった.多くの遺伝子と同様に,IL-4遺伝子にもDNaseIに対して高感受性を示す部位(hypersensitive site:HS)が複数存在することが明らかにされ2,3),このような転写因子が結合しやすいと考えられる部位の多くが保存された非コード配列(conserved non-coding sequence:CNS)に相当することから,これらの部位が転写制御にかかわる可能性が想定された.DNaseI高感受性部位のなかにTh2サイトカイン遺伝子のスイッチを制御する部位が存在するという可能性について,これら部位のノックアウトマウスあるいはレポーターマウスなどさまざまな手法を用いて解析されてきたが,これまで明確に説明することはできなかった.また,複数の遺伝子の発現が単一の遺伝子座調節領域(locus control region:LCR)によって制御されているという仮説も提唱された4).一方で,Th2細胞においてこれらTh2サイトカインの発現はつねに同期するわけではないという多数の報告もありLCRでは説明がつかない現象も存在する5).さらに,GATA-3がいかにしてTh2細胞の分化を規定するのかという問題も未解決のまま残されていた.この研究は,これら行き詰っていた多くの疑問に光をあてるものであった.
筆者らは,転写制御部位としてはたらきうる保存された非コード配列またはDNaseI高感受性部位を網羅的に解析する目的で,それぞれの部位を欠損したマウスを作製しそれらノックアウトマウスに由来するTh2細胞におけるIL-4の産生能を解析した.IL-4遺伝子とIL-13遺伝子のあいだに存在するCNS1,IL-4遺伝子の3’側の遠位に存在するCNS2,IL-4遺伝子の3’側の近位に位置する3’側非翻訳領域の欠損によって,それぞれ,30%,40%,50%のIL-4の産生減少がみられた.一方で,IL-4遺伝子の第2イントロンに存在するHS2の欠損によりIL-4の産生は10%以下に減少した.今回,筆者らが用いたノックアウトマウスのラインナップは主要な保存された非コード配列およびDNaseI高感受性部位をほぼカバーしていた.以上のことから,HS2がTh2細胞におけるIL-4の産生制御に必須の部位であること示された.
つぎに,生体におけるHS2の重要性を検討するため,水酸化アルミニウムと混合したオバルブミンで野生型マウスおよびHS2ノックアウトマウスを免疫することによってオバルブミン特異的な抗体産生応答を評価した.HS2ノックアウトマウスにおいてIL-4で誘導されるIgG1の産生は野生型マウスの10%程度にまで減少しており,さらに,IgEの産生にいたっては検出限界以下であった.一方で,インターフェロンγによって誘導されるIgG2cの産生はHS2ノックアウトマウスにおいて50倍以上も増加していた.さらに,アレルギー反応のひとつである気道性過敏症のモデルを用いてHS2の役割を検討した.野生型マウスおよびHS2ノックアウトマウスを水酸化アルミニウムと混合したオバルブミンで免疫したのち,オバルブミンの噴霧を行いアセチルコリン依存的な気道の収縮を測定したところ,HS2ノックアウトマウスでは気道狭窄が顕著に抑制されていた.さらに,炎症を誘導する免疫細胞の浸潤について検討を行ったところ,HS2ノックアウトマウスでは好酸球の浸潤がほぼ完全に抑制されていた.よって,HS2は生体における抗体産生またはアレルギー反応の促進に重要な役割を担っていることが示された.
IL-13は気道における炎症に必須のサイトカインであるが,その産生の制御機構にはいまだ不明な点が多い.Th2細胞のIL-13遺伝子プロモーターでは2つの部位でクロマチン構造変化の起こることが報告されており,そのうち,遠位に位置するCGRE(conserved GATA-3 responsive element)はTh2細胞においてIL-4遺伝子およびIL-13遺伝子に形成されるヒストンアセチル化修飾を制御していることが示唆されている6).そのことから,CGREノックアウトマウスを作製することによりCGREによるIL-4およびIL-13の産生制御能を検討した.CGREノックアウトマウスに由来するTh2細胞では野生型のTh2細胞と比べ顕著にIL-13の産生能が減少することがわかった.しかし一方で,IL-4などほかのTh2サイトカイン産生能に変化はみられなかった.以上のことから,CGREがTh2細胞におけるIL-13の産生に不可欠であることが明らかになった.一方で,CGREはIL-4およびIL-5の産生を制御しておらず,また,HS2ノックアウトマウスおよびCNS2ノックアウトマウスの解析によってIL-4遺伝子に存在するこれらのDNaseI高感受性部位はIL-13およびIL-5の産生能に影響を及ぼさないことが明らかになっている.これらの知見は,Th2サイトカイン遺伝子が別々の非コード配列によって制御されるという説を支持するものであった.
以前に筆者らは,Th2細胞においてGATA-3がIL-4遺伝子のHS2の近傍に強く結合することを見い出している.そのことから,Th2細胞の分化にGATA-3のHS2への結合が必須であるかどうかを検討するため,GATA-3の発現しないTh1細胞への分化条件下において,レトロウイルスを用いて野生型T細胞またはHS2ノックアウトマウスに由来するT細胞にGATA-3を強制発現させた.GATA-3の発現によって野生型T細胞はTh2細胞に分化したが,HS2ノックアウトマウスに由来するT細胞ではIL-4の産生はほとんど認められなかった.よって,Th2細胞におけるIL-4の産生にはGATA-3がHS2に結合することが必須であることが明らかになった.また一方で,HS2の欠損下においてもGATA-3の強制発現によってIL-5およびIL-13の産生は誘導された.さらに,Th1細胞への分化条件下においてCGREノックアウトマウスに由来するT細胞にGATA-3を導入することにより,IL-13の産生は誘導できなかったもののIL-4の産生は認められた.これらの知見は,Th2サイトカイン遺伝子の制御が単一の制御部位によって担われるというより,むしろ個々の遺伝子にあるDNaseI高感受性部位により別々に制御されていることを示唆していた.
つぎに,いかにしてGATA-3がIL-4の産生を制御しているかについて検討を行った.はじめに,IL-4遺伝子およびIL-13遺伝子のDNaseI高感受性部位について,IL-4を産生しないTh1細胞とTh2細胞におけるヒストンのアセチル化修飾,および,ヒストンH3の4番目のリジン残基に対するメチル化修飾を検討した.これら2つの修飾は遺伝子の転写の可能なことを示すクロマチン修飾である.抗原刺激ののちの経時的な解析により,刺激後24時間ではTh1細胞,Th2細胞ともにヒストンアセチル化修飾が起こるが,72時間後にはTh2細胞においてのみヒストンアセチル化修飾が維持されていることがわかった.一方で,ヒストンH3の4番目のリジン残基のメチル化修飾については,抗原刺激ののち48時間および72時間においてTh2細胞に特異的に認められた.つぎに,HS2ノックアウトマウスに由来するT細胞を用いて同様の解析を行った.抗原刺激ののち24時間におけるヒストンアセチル化修飾は,野生型T細胞およびHS2ノックアウトマウスに由来するT細胞のいずれにおいても認められたが,HS2ノックアウトT細胞においては時間経過とともにヒストンアセチル化修飾の維持がみられなくなった.また,ヒストンH3の4番目のリジン残基のメチル化修飾は,HS2の欠損によりCGREを除くIL-4遺伝子のDNaseI高感受性部位で顕著に減少していた.以上のことから,GATA-3はHS2に結合し,IL-4遺伝子の全体におけるヒストンアセチル化修飾の維持,または,ヒストンH3の4番目のリジン残基のメチル化修飾の誘導を介することにより,IL-4遺伝子を転写の可能なクロマチン構造とすることによってIL-4の産生を正に制御するエンハンサーとして機能していることが示唆された.さらに,クロマチン免疫沈降-マイクロアレイ法を用いた包括的な解析により,HS2の欠損によって起こるヒストン修飾の不全はIL-4遺伝子の周辺に限局して起こることが明らかになった.
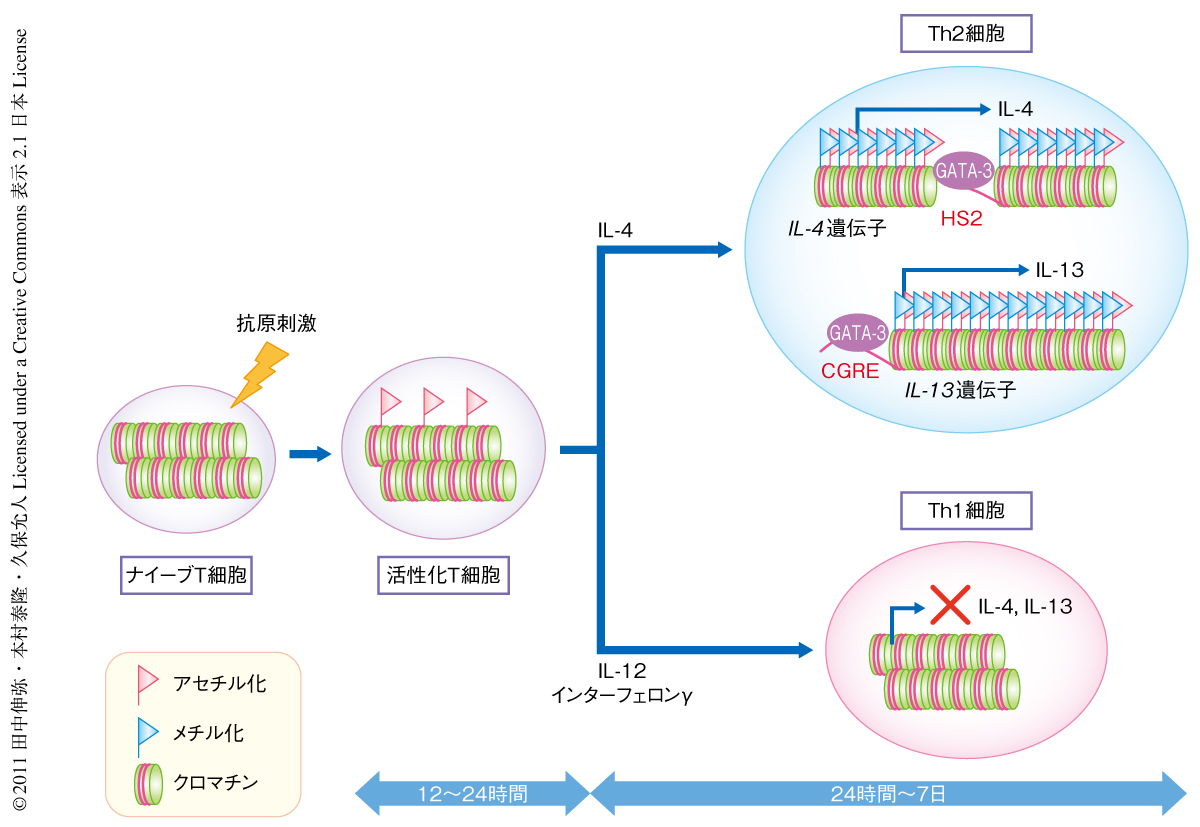
これまでに述べた知見からTh2細胞の分化過程におけるIL-4の産生制御について考察する(図1).まず,抗原刺激によってIL-4遺伝子の全体に一過性のヒストンアセチル化修飾が形成される.IL-4のシグナルによってGATA-3の発現が起こり,GATA-3はHS2と結合する.この結合がヒストンアセチル化修飾の維持,ヒストンH3の4番目のリジン残基のメチル化修飾の誘導をひき起こし,IL-4遺伝子を転写の可能なクロマチン構造とする.GATA-3はIL-4遺伝子のプロモーター活性を直接には誘導しないこと7),Th2細胞の分化ののちにGATA-3を欠損させてもIL-4の産生は完全には消失しないこと8),を考えると,GATA-3の役割はおそらくHS2に結合することによってIL-4遺伝子に転写の可能なクロマチン構造を形成することにあると思われた.また,抗原刺激によって起こる一過性のヒストンアセチル化修飾はGATA-3などの転写因子が標的配列に結合する機会をあたえるために起こるものと推測された.また,HS2がIL-4遺伝子に存在するほかのDNaseI高感受性部位におけるヒストン修飾を制御していることが明らかにされた.しかし一方で,HS2が個々の細胞でIL-4遺伝子の各DNaseI高感受性部位を制御しているかどうかは明確ではなく,今後,単一細胞レベルでの解析が必要である.今回の研究においてエンハンサーHS2を介したGATA-3によるIL-4の産生制御が明らかになったことで,新たな免疫制御の可能性につながるものと期待される.
略歴:2007年 東京理科大学大学院生命科学研究科博士課程 修了,同年 理化学研究所免疫アレルギー科学総合研究センター 特別研究員を経て,2009年より米国Texas大学MD Anderson Cancer Center研究員.
研究テーマ:ヘルパーT細胞分化制御の解明.
本村 泰隆(Yasutaka Motomura)
東京理科大学生命科学研究所 ポストドクトラル.
久保 允人(Masato Kubo)
東京理科大学生命科学研究所 教授,理化学研究所免疫アレルギー科学総合研究センター チームリーダー.
研究室URL:http://www.rs.noda.tus.ac.jp/~ribsjm/kubolab/
© 2011 田中伸弥・本村泰隆・久保允人 Licensed under CC 表示 2.1 日本
(1理化学研究所免疫アレルギー科学総合研究センター シグナルネットワーク研究チーム,2東京理科大学生命科学研究所 生命工学技術研究部門)
email:田中伸弥,久保允人
DOI: 10.7875/first.author.2011.004
The enhancer HS2 critically regulates GATA-3-mediated Il4 transcription in TH2 cells.
Shinya Tanaka, Yasutaka Motomura, Yoshie Suzuki, Ryoji Yagi, Hiromasa Inoue, Shoichiro Miyatake, Masato Kubo
Nature Immunology, 12, 77-85 (2011)
要 約
ヘルパーT細胞はそれぞれ固有のサイトカインを産生することにより獲得免疫系の中心を担う免疫細胞であるが,そのうちTh2細胞は抗体の産生を制御するとともにアレルギー疾患にかかわるものとして知られている.Th2細胞は抗原刺激によりナイーブT細胞から分化し,アレルギー病態に関与する一連のサイトカインIL-4,IL-5,IL-13を産生する.これらはTh2サイトカインとよばれ,それぞれをコードする遺伝子は哺乳類では同一の染色体に近接して存在し同調して発現する.この分化過程を制御するマスターレギュレーターとしてGATA-3が知られているが,GATA-3がどのように複数の遺伝子のスイッチを同時に制御するのか,その分子機構は明らかになっていなかった.今回の筆者らの研究は,それぞれのTh2サイトカイン遺伝子には別々のスイッチが存在し,GATA-3はそれらのスイッチを同時に入れていることを明らかにした.IL-4遺伝子の場合は第2イントロンに存在するHS2がそのスイッチであり,IL-13遺伝子の場合はCGREという部位がそれに相当した.GATA-3はこれらの部位に結合してクロマチン構造を変化させることによりいちどに複数のサイトカイン遺伝子のスイッチを制御していること,また,アレルギー病態の形成にも重要な役割を担っていることが明らかになった.
はじめに
Th2細胞(2型ヘルパーT細胞)はIL-4,IL-5,IL-13などTh2サイトカインとよばれるサイトカインを発現することにより寄生虫の排除に寄与し,また,とくにIL-4はB細胞における特異的な抗原に対する抗体の産生を誘導するサイトカインである(IL:インターロイキン).そのため,Th2サイトカインは花粉症などに代表されるアレルギー反応に深く関与することでも知られている.Th2細胞はナイーブT細胞より分化し,その運命決定はIL-4によって誘導されるGATA-3がTh2サイトカイン遺伝子を同時に制御するマスターレギュレーターとしてはたらくことで規定されている1).このGATA-3によるTh2サイトカイン遺伝子のスイッチ制御機構の解明は長いあいだ議論がつづいており,T細胞の分化を理解するうえで非常に重要な課題である.とくに,IL-4遺伝子の転写についてはこれまで精力的に研究が行われ,1998年にクロマチン構造変化,ヒストン修飾といったエピジェネティックな変化がTh2細胞の分化にともなう転写制御に関与するという報告がなされて以来,遺伝子レベルにおけるエピジェネティックな制御にも注目が集まるようになった.多くの遺伝子と同様に,IL-4遺伝子にもDNaseIに対して高感受性を示す部位(hypersensitive site:HS)が複数存在することが明らかにされ2,3),このような転写因子が結合しやすいと考えられる部位の多くが保存された非コード配列(conserved non-coding sequence:CNS)に相当することから,これらの部位が転写制御にかかわる可能性が想定された.DNaseI高感受性部位のなかにTh2サイトカイン遺伝子のスイッチを制御する部位が存在するという可能性について,これら部位のノックアウトマウスあるいはレポーターマウスなどさまざまな手法を用いて解析されてきたが,これまで明確に説明することはできなかった.また,複数の遺伝子の発現が単一の遺伝子座調節領域(locus control region:LCR)によって制御されているという仮説も提唱された4).一方で,Th2細胞においてこれらTh2サイトカインの発現はつねに同期するわけではないという多数の報告もありLCRでは説明がつかない現象も存在する5).さらに,GATA-3がいかにしてTh2細胞の分化を規定するのかという問題も未解決のまま残されていた.この研究は,これら行き詰っていた多くの疑問に光をあてるものであった.
1.HS2はTh2細胞におけるIL-4遺伝子の転写制御に必須の役割をはたす
筆者らは,転写制御部位としてはたらきうる保存された非コード配列またはDNaseI高感受性部位を網羅的に解析する目的で,それぞれの部位を欠損したマウスを作製しそれらノックアウトマウスに由来するTh2細胞におけるIL-4の産生能を解析した.IL-4遺伝子とIL-13遺伝子のあいだに存在するCNS1,IL-4遺伝子の3’側の遠位に存在するCNS2,IL-4遺伝子の3’側の近位に位置する3’側非翻訳領域の欠損によって,それぞれ,30%,40%,50%のIL-4の産生減少がみられた.一方で,IL-4遺伝子の第2イントロンに存在するHS2の欠損によりIL-4の産生は10%以下に減少した.今回,筆者らが用いたノックアウトマウスのラインナップは主要な保存された非コード配列およびDNaseI高感受性部位をほぼカバーしていた.以上のことから,HS2がTh2細胞におけるIL-4の産生制御に必須の部位であること示された.
2.HS2ノックアウトマウスにおける抗原特異的な抗体産生または気道性過敏反応
つぎに,生体におけるHS2の重要性を検討するため,水酸化アルミニウムと混合したオバルブミンで野生型マウスおよびHS2ノックアウトマウスを免疫することによってオバルブミン特異的な抗体産生応答を評価した.HS2ノックアウトマウスにおいてIL-4で誘導されるIgG1の産生は野生型マウスの10%程度にまで減少しており,さらに,IgEの産生にいたっては検出限界以下であった.一方で,インターフェロンγによって誘導されるIgG2cの産生はHS2ノックアウトマウスにおいて50倍以上も増加していた.さらに,アレルギー反応のひとつである気道性過敏症のモデルを用いてHS2の役割を検討した.野生型マウスおよびHS2ノックアウトマウスを水酸化アルミニウムと混合したオバルブミンで免疫したのち,オバルブミンの噴霧を行いアセチルコリン依存的な気道の収縮を測定したところ,HS2ノックアウトマウスでは気道狭窄が顕著に抑制されていた.さらに,炎症を誘導する免疫細胞の浸潤について検討を行ったところ,HS2ノックアウトマウスでは好酸球の浸潤がほぼ完全に抑制されていた.よって,HS2は生体における抗体産生またはアレルギー反応の促進に重要な役割を担っていることが示された.
3.CGREによるIL-13の産生制御
IL-13は気道における炎症に必須のサイトカインであるが,その産生の制御機構にはいまだ不明な点が多い.Th2細胞のIL-13遺伝子プロモーターでは2つの部位でクロマチン構造変化の起こることが報告されており,そのうち,遠位に位置するCGRE(conserved GATA-3 responsive element)はTh2細胞においてIL-4遺伝子およびIL-13遺伝子に形成されるヒストンアセチル化修飾を制御していることが示唆されている6).そのことから,CGREノックアウトマウスを作製することによりCGREによるIL-4およびIL-13の産生制御能を検討した.CGREノックアウトマウスに由来するTh2細胞では野生型のTh2細胞と比べ顕著にIL-13の産生能が減少することがわかった.しかし一方で,IL-4などほかのTh2サイトカイン産生能に変化はみられなかった.以上のことから,CGREがTh2細胞におけるIL-13の産生に不可欠であることが明らかになった.一方で,CGREはIL-4およびIL-5の産生を制御しておらず,また,HS2ノックアウトマウスおよびCNS2ノックアウトマウスの解析によってIL-4遺伝子に存在するこれらのDNaseI高感受性部位はIL-13およびIL-5の産生能に影響を及ぼさないことが明らかになっている.これらの知見は,Th2サイトカイン遺伝子が別々の非コード配列によって制御されるという説を支持するものであった.
4.GATA-3はHS2を介してクロマチン構造変化を制御する
以前に筆者らは,Th2細胞においてGATA-3がIL-4遺伝子のHS2の近傍に強く結合することを見い出している.そのことから,Th2細胞の分化にGATA-3のHS2への結合が必須であるかどうかを検討するため,GATA-3の発現しないTh1細胞への分化条件下において,レトロウイルスを用いて野生型T細胞またはHS2ノックアウトマウスに由来するT細胞にGATA-3を強制発現させた.GATA-3の発現によって野生型T細胞はTh2細胞に分化したが,HS2ノックアウトマウスに由来するT細胞ではIL-4の産生はほとんど認められなかった.よって,Th2細胞におけるIL-4の産生にはGATA-3がHS2に結合することが必須であることが明らかになった.また一方で,HS2の欠損下においてもGATA-3の強制発現によってIL-5およびIL-13の産生は誘導された.さらに,Th1細胞への分化条件下においてCGREノックアウトマウスに由来するT細胞にGATA-3を導入することにより,IL-13の産生は誘導できなかったもののIL-4の産生は認められた.これらの知見は,Th2サイトカイン遺伝子の制御が単一の制御部位によって担われるというより,むしろ個々の遺伝子にあるDNaseI高感受性部位により別々に制御されていることを示唆していた.
つぎに,いかにしてGATA-3がIL-4の産生を制御しているかについて検討を行った.はじめに,IL-4遺伝子およびIL-13遺伝子のDNaseI高感受性部位について,IL-4を産生しないTh1細胞とTh2細胞におけるヒストンのアセチル化修飾,および,ヒストンH3の4番目のリジン残基に対するメチル化修飾を検討した.これら2つの修飾は遺伝子の転写の可能なことを示すクロマチン修飾である.抗原刺激ののちの経時的な解析により,刺激後24時間ではTh1細胞,Th2細胞ともにヒストンアセチル化修飾が起こるが,72時間後にはTh2細胞においてのみヒストンアセチル化修飾が維持されていることがわかった.一方で,ヒストンH3の4番目のリジン残基のメチル化修飾については,抗原刺激ののち48時間および72時間においてTh2細胞に特異的に認められた.つぎに,HS2ノックアウトマウスに由来するT細胞を用いて同様の解析を行った.抗原刺激ののち24時間におけるヒストンアセチル化修飾は,野生型T細胞およびHS2ノックアウトマウスに由来するT細胞のいずれにおいても認められたが,HS2ノックアウトT細胞においては時間経過とともにヒストンアセチル化修飾の維持がみられなくなった.また,ヒストンH3の4番目のリジン残基のメチル化修飾は,HS2の欠損によりCGREを除くIL-4遺伝子のDNaseI高感受性部位で顕著に減少していた.以上のことから,GATA-3はHS2に結合し,IL-4遺伝子の全体におけるヒストンアセチル化修飾の維持,または,ヒストンH3の4番目のリジン残基のメチル化修飾の誘導を介することにより,IL-4遺伝子を転写の可能なクロマチン構造とすることによってIL-4の産生を正に制御するエンハンサーとして機能していることが示唆された.さらに,クロマチン免疫沈降-マイクロアレイ法を用いた包括的な解析により,HS2の欠損によって起こるヒストン修飾の不全はIL-4遺伝子の周辺に限局して起こることが明らかになった.
おわりに
これまでに述べた知見からTh2細胞の分化過程におけるIL-4の産生制御について考察する(図1).まず,抗原刺激によってIL-4遺伝子の全体に一過性のヒストンアセチル化修飾が形成される.IL-4のシグナルによってGATA-3の発現が起こり,GATA-3はHS2と結合する.この結合がヒストンアセチル化修飾の維持,ヒストンH3の4番目のリジン残基のメチル化修飾の誘導をひき起こし,IL-4遺伝子を転写の可能なクロマチン構造とする.GATA-3はIL-4遺伝子のプロモーター活性を直接には誘導しないこと7),Th2細胞の分化ののちにGATA-3を欠損させてもIL-4の産生は完全には消失しないこと8),を考えると,GATA-3の役割はおそらくHS2に結合することによってIL-4遺伝子に転写の可能なクロマチン構造を形成することにあると思われた.また,抗原刺激によって起こる一過性のヒストンアセチル化修飾はGATA-3などの転写因子が標的配列に結合する機会をあたえるために起こるものと推測された.また,HS2がIL-4遺伝子に存在するほかのDNaseI高感受性部位におけるヒストン修飾を制御していることが明らかにされた.しかし一方で,HS2が個々の細胞でIL-4遺伝子の各DNaseI高感受性部位を制御しているかどうかは明確ではなく,今後,単一細胞レベルでの解析が必要である.今回の研究においてエンハンサーHS2を介したGATA-3によるIL-4の産生制御が明らかになったことで,新たな免疫制御の可能性につながるものと期待される.
文 献
- Zheng, W. & Flavell, R. A.: The transcription factor GATA-3 is necessary and sufficient for Th2 cytokine gene expression in CD4 T cells. Cell, 89, 587-596 (1997)[PubMed]
- Agarwal, S. & Rao, A.: Modulation of chromatin structure regulates cytokine gene expression during T cell differentiation. Immunity, 9, 765-775 (1998)[PubMed]
- Takemoto, N., Koyano-Nakagawa, N., Yokota, T. et al.: Th2-specific DNase I-hypersensitive sites in the murine IL-13 and IL-4 intergenic region. Int. Immunol., 10, 1981-1985 (1998)[PubMed]
- Lee, G. R., Fields, P. E., Griffin, T. J. et al.: Regulation of the Th2 cytokine locus by a locus control region. Immunity, 19, 145-153 (2003)[PubMed]
- Guo, L., Hu-Li, J. & Paul, W. E.: Probabilistic regulation in TH2 cells accounts for monoallelic expression of IL-4 and IL-13. Immunity, 23, 89-99 (2005)[PubMed]
- Yamashita, M., Ukai-Tadenuma, M., Kimura, M. et al.: Identification of a conserved GATA3 response element upstream proximal from the interleukin-13 gene locus. J. Biol. Chem., 277, 42399-42408 (2002)[PubMed]
- Zhang, D. H., Yang, L. & Ray, A.: Differential responsiveness of the IL-5 and IL-4 genes to transcription factor GATA-3. J. Immunol., 161, 3817-3821 (1998)[PubMed]
- Zhu, J., Min, B., Hu-Li, J. et al.: Conditional deletion of Gata3 shows its essential function in TH1-TH2 responses. Nat. Immunol., 5, 1157-1165 (2004)[PubMed]
著者プロフィール
略歴:2007年 東京理科大学大学院生命科学研究科博士課程 修了,同年 理化学研究所免疫アレルギー科学総合研究センター 特別研究員を経て,2009年より米国Texas大学MD Anderson Cancer Center研究員.
研究テーマ:ヘルパーT細胞分化制御の解明.
本村 泰隆(Yasutaka Motomura)
東京理科大学生命科学研究所 ポストドクトラル.
久保 允人(Masato Kubo)
東京理科大学生命科学研究所 教授,理化学研究所免疫アレルギー科学総合研究センター チームリーダー.
研究室URL:http://www.rs.noda.tus.ac.jp/~ribsjm/kubolab/
© 2011 田中伸弥・本村泰隆・久保允人 Licensed under CC 表示 2.1 日本