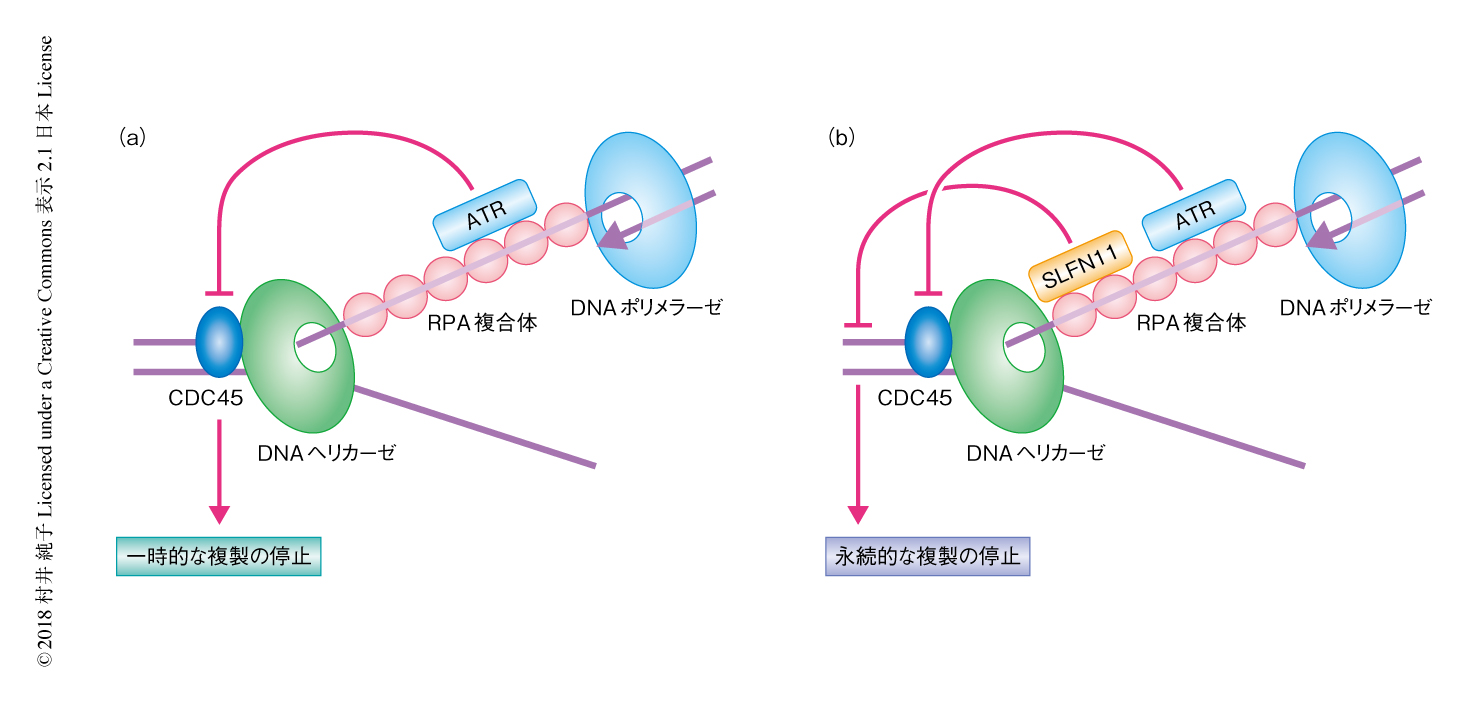
SLFN11はDNA複製にストレスがかかったとき複製フォークの進行を阻害する
村井 純子
(米国NIH National Cancer Institute,Center for Cancer Research,Developmental Therapeutics Branch)
email:村井純子
DOI: 10.7875/first.author.2018.030
SLFN11 blocks stressed replication forks independently of ATR.
Junko Murai, Sai-Wen Tang, Elisabetta Leo, Simone A. Baechler, Christophe E. Redon, Hongliang Zhang, Muthana Al Abo, Vinodh N. Rajapakse, Eijiro Nakamura, Lisa M. Miller Jenkins, Mirit I. Aladjem, Yves Pommier
Molecular Cell, 69, 371-384.e6 (2018)
SLFN11遺伝子は,独立した2つの大規模ながんデータベースの解析により,DNA障害型の抗がん剤への感受性とmRNAの発現量とがもっとも高く相関すると報告された遺伝子である.しかしながら,SLFN11の高発現が薬剤感受性に寄与する機構についてはほとんどわかっていなかった.この研究において,筆者らは,1)DNAが損傷をうけたときSLFN11は複製フォークに結合すること,2)SLFN11は複製の開始は阻害しないがそののちの複製フォークの進行を阻害すること,3)SLFN11はそれ自体のもつATPase活性をつかってクロマチンを開いた構造に変換すること,4)これらのSLFN11の機能はATRに依存的なS期チェックポイントとは独立していること,5)複製の開始を強制的に起こすCHK1阻害剤の存在下においてもSLFN11の複製フォークへの結合および複製フォークの進行の阻害は起こること,を明らかにした.以上より,SLFN11はDNAが損傷をうけたときに複製フォークに結合し,クロマチンの構造を変化させ複製フォークの進行,すなわち,複製を阻害することがわかった.SLFN11による複製の阻害は永続的であり,長期にわたるS期の停止が薬剤感受性に寄与すると考えられた.
SLFNファミリーは哺乳類のみにみつかっており,おおむね,細胞の分化や増殖の抑制にかかわる.SLFN11はヒトには存在するが,マウスにはホモログはない1).SLFN11はヘリカーゼ活性ドメインをもち核に存在する.
DNAを標的にした抗がん剤としては,古くから使われているプラチナ製剤,トポイソメラーゼ阻害剤,DNA複製阻害剤がある.これらの薬剤は,がん種によっては第1選択薬として使われているほどメジャーであるが,効果の予測に使えるバイオマーカーはみつかっていなかった.2012年,独立した2つの大規模ながんデータベース,NCI-60およびCancer Cell Line Encyclopediaの解析により,DNA障害型の抗がん剤への感受性とmRNAの発現量とがもっとも高く相関する遺伝子としてSLFN11遺伝子が報告された2,3).そののち,がん細胞株,患者に由来する異種移植,患者のデータを用いて,SLFN11とDNA障害型の薬剤感受性との相関がつぎつぎと報告されている.また,SLFN11は,2018年から卵巣がんの治療薬として日本において認可されたPARP阻害剤の感受性にも強くかかわる4).PARP阻害剤はもともとDNA修復阻害剤として開発されたが,のちの研究により,PARPとDNAとの複合体を形成する作用によりDNA障害剤として機能することがわかった5,6).これらのことから,SLFN11は広範なDNA障害型の抗がん剤に対し効果の予測に使えるバイオマーカーとしての可能性がある.さらに,SLFN11遺伝子の発現レベルは,Cancer Cell Line Encyclopediaにおける約1000種類の細胞株においてみるかぎり,きわめて低いか(50%以下)高いか(50%以上)のいずれかであり,そのオン-オフの頻度と二極性のパターンから汎用性の高いバイオマーカーとなることが期待される.しかしながら,SLFN11がDNA障害型の抗がん剤の感受性を増強させる機構についてはほとんどわかっていなかった.
これまで,S期に起こるDNAの損傷に対する細胞の応答としては,唯一,ATRに依存性のS期チェックポイントが知られていた.これは,DNAの損傷に対しATRのもつキナーゼの活性化により下流のCHK1が活性化し,その下流のCDK1が不活性化されることにより複製フォークの進行の速度を低下させ,新たな複製フォークによる複製の開始を阻害するものである.この機能は,DNAが損傷をうけたときに複製フォークがそこに衝突する際の新たな損傷をふせぐため,および,修復のための時間をかせぐために有用で,細胞の生存に有利にはたらく.実際,SLFN11を高発現している白血病細胞株CCRF-CEM細胞,および,そのSLFN11ノックアウト細胞にDNA障害剤であるカンプトテシンを投与したところ,4時間後には両方の細胞ともに複製が阻害されATRが活性化していた.この複製の阻害がATRに依存性のS期チェックポイントによるものであるなら,ATR阻害剤の投与により複製の阻害は解除されるはずである.SLFN11ノックアウト細胞においては予想どおり複製の阻害は解除されたが,野生型の細胞においては複製の阻害がつづいた.カンプトテシンの投与を継続して24時間後,SLFN11ノックアウト細胞においてはATRがひきつづき活性化しているにもかかわらず複製は再開し細胞は生存していたが,野生型の細胞は永続的に複製を停止しS期の細胞は死にはじめていた.つまり,ATRによる複製の停止は一時的で細胞の生存をおびやかさない一方,SLFN11はATRとは独立して永続的に複製を阻害し細胞死を誘導することがわかった.
SLFN11がどこで複製を阻害するのか蛍光免疫染色法により検討したところ,カンプトテシンの投与の4時間後にSLFN11はクロマチンに結合し,特徴的な染色パターンを示すことがわかった.このSLFN11の染色部位は新規にDNAが合成されている部位とほぼ一致した.つまり,SLFN11は複製フォークに結合することがわかった.抗SLFN11抗体を用いた免疫沈降-質量分析法による解析により,SLFN11はカンプトテシンの存在下において,DNAヘリカーゼ複合体MCM2-7のサブユニットのひとつMCM3と結合することもわかった.
以前の報告において,SLFN11は1本鎖DNAにポリマー構造を形成するRPA1と結合することが示されており7),そのことはあらためて確認された.カンプトテシンの投与によりS期チェックポイントがはたらき,複製フォークが停止することによりDNAポリメラーゼとDNAヘリカーゼとのあいだにすき間が生じて1本鎖DNAが露出し,そこにRPA複合体がポリマー構造を形成することが知られている.これらを総合すると,DNAの損傷に応答しSLFN11がRPA1およびMCM3を介して複製フォークに結合することが示唆された.
ATRに依存性のS期チェックポイントにおいては,進行中の複製フォークを停止させるとともに新たな複製の開始を阻害する.DNAファイバーアッセイによりSLFN11は進行中の複製フォークの停止には関与しないことが明らかにされた.それでは,SLFN11は複製の開始それ自体を阻害するのか,あるいは,複製の開始ののちの複製フォークの進行を阻害するのか? 複製の開始にはCDK1に依存的に起こる複製フォークへのCDC45のリクルートが必須である.免疫蛍光染色法により,SLFN11は複製フォークへのCDC45のリクルートを阻害しないことがわかった.SLFN11は複製の開始の直後に起こる複製フォークへのPCNAのリクルートも阻害しなかった.しかしながら,カンプトテシンおよびATR阻害剤を併用することにより強制的な複製の開始を起こしてDNAポリメラーゼとDNAヘリカーゼとのあいだのすき間を広げることによるRPA複合体の過剰な蓄積が,SLFN11ノックアウト細胞においてみられた一方,野生型の細胞においてはみられなかったことから,SLFN11は異常な複製フォークの進行を阻害することがわかった.
さらに,複製開始点および複製開始の頻度をゲノムワイドかつ網羅的に解析する手法である新生鎖DNA-seq法を用いて,SLFN11が複製の開始におよぼす影響について検討した.その結果,カンプトテシンの投与により,複製開始点は変化しなかったが複製開始の頻度は有意に低下した.この低下は,野生型の細胞およびSLFN11ノックアウト細胞とも,ATR阻害剤の投与により対照と同じレベルにまで回復した.つまり,SLFN11は複製の開始には影響しないことがさらに確認された.
SLFN11の薬剤感受性や複製を停止させる機能にはATPase活性が必要であった.ATPase活性がクロマチンの構造になんらかの影響をおよぼす可能性を考え,クロマチンの開いた構造および閉じた構造をゲノムワイドにマッピングするATAC-seq法により解析した.その結果,カンプトテシンの非存在下において,転写のさかんな遺伝子のプロモーター領域においては1 kb以下の範囲で野生型の細胞およびSLFN11ノックアウト細胞ともシグナルピークが認められた.カンプトテシンの投与の2~4時間後,SLFN11ノックアウト細胞においてはシグナルピークの幅および高さともほとんど変化はなかったが,野生型の細胞においてはゲノムワイドにシグナルピークの幅および高さとも増強していた.このシグナルのピークの増強はATPase活性を欠失させたSLFN11を発現させた細胞においてはみられなかった.また,ATAC-seq法によるシグナルピークの約50%は,新生鎖DNA-seq法により同定された複製開始点と隣接していた.これらのことより,カンプトテシンの存在下において,SLFN11は複製の開始の直後の複製フォークに結合し,それ自体のもつATPase活性をつかってクロマチンを開いた構造に変換し,なんらかの機序により複製を阻害すると考えられた.
ここまでは,カンプトテシンを用いて複製フォークの停止を起こす,あるいは,カンプトテシンとATR阻害剤を組み合わせることにより強制的に複製の開始を起こしてSLFN11の機能を解析した.カンプトテシンによるDNAの直接の損傷はSLFN11が機能するために必要なのだろうか? DNAの直接の損傷なくSLFN11を複製フォークに集積させる方法としてCHK1阻害剤を用いた.CHK1阻害剤はCDK1を活性化させ,強制的に複製の開始を起こす.ATR阻害剤にも同様のはたらきはあるが,単剤としての機能はCHK1阻害剤のほうが1000倍ほど高い.CHK1阻害剤の投与の4時間後,RPA複合体およびSLFN11のクロマチンへの集積が認められ,SLFN11は複製フォーク結合タンパク質であるCDC45と共局在した.さらに,SLFN11ノックアウト細胞に比べ,野生型の細胞においてはRPA複合体の集積が少なく,複製は抑制されていた.このことから,直接的なDNAの損傷がなくとも,RPA複合体が複製フォークに集積する状況においてSLFN11は複製フォークに結合しその進行を阻害することがわかった.
この研究により,SLFN11が薬剤感受性を増強させる機構が部分的に解明された(図1).今後の課題は,SLFN11によるクロマチンの開いた構造への変換がどのように複製の停止につながるかという点である.現在,考えているシナリオは,SLFN11のもつヘリカーゼ活性により複製されるべき2本鎖DNAがさきに1本鎖にほどかれてしまい,DNAヘリカーゼ複合体MCM2-7はほどくべき2本鎖DNAが1本鎖になっているためさきに進めなくなる,すなわち,複製が停止するというものである.たとえるなら,ファスナーを開くとき,途中でさきに開いている部分があると,スライダーがその部分で止まってしまうような感じである.長期にわたるS期の停止により複製フォークが崩壊し細胞死が誘導されることは以前より報告があるので,SLFN11によるS期の停止が薬剤感受性に影響すると考えてよいと思うが,S期の停止から細胞死にいたる過程についてはさらに解析する必要があるかもしれない.
SLFN11は,2012年よりまえにはほとんど解析の対象とはされていない無名のタンパク質であったが,バイオインフォマテクスを駆使した2つの論文2,3) により,はじめて知られるところとなった.SLFN11のあるなしで薬剤感受性の差は明らかであり,また,S期の停止の機能もきわめて明瞭である.よくぞこれほど重要なタンパク質が2012年までみつからずにいたなと思う.それまで見過ごされてきた要因として,細胞生物学的な研究において歴史的に頻用されてきた細胞株において,軒並みSLFN11の発現量がきわめて低いことが考えられる.SLFN11を高発現する細胞は複製に対するストレスに弱いため実験材料として扱いづらい結果,SLFN11の発現の低い細胞が汎用されるようになったのかもしれない.また,マウスにSLFN11のホモログがみつかっていないことも要因として考えられる.
SLFN11は基礎研究における見地からも臨床における見地からも興味深い.基礎研究においては,SLFN11遺伝子にはがん抑制遺伝子としての機能があるのか,クロマチンの開いた構造への変換により複製の停止のほかに何が起こるのか,SLFN11はなぜ進化的に現われたのかなど,そして,臨床においては,DNA障害型の抗がん剤の感受性を予測するバイオマーカーとしての可能性である.現時点では,PARP阻害剤に関してはBRCA遺伝子の変異がバイオマーカーとして認められているほか,DNA障害型の抗がん剤の感受性を予測するバイオマーカーは存在しない.SLFN11はパラフィン切片からの組織化学免疫染色法により検出が可能で,約50%のがん細胞において発現の低下が認められていることから,低コストかつ汎用性の高いバイオマーカーとして期待される.
略歴:2008年 大阪大学大学院医学系研究科 修了,2009年 米国Dana Farber Cancer Institutes,2010年 米国NIH National Cancer Institute,2012年 京都大学大学院医学研究科 助教を経て,2015年より米国NIH National Cancer InstituteにてResearch Fellow.
研究テーマ:DNAの修復とがん.SLFN11の機能.
© 2018 村井 純子 Licensed under CC 表示 2.1 日本
(米国NIH National Cancer Institute,Center for Cancer Research,Developmental Therapeutics Branch)
email:村井純子
DOI: 10.7875/first.author.2018.030
SLFN11 blocks stressed replication forks independently of ATR.
Junko Murai, Sai-Wen Tang, Elisabetta Leo, Simone A. Baechler, Christophe E. Redon, Hongliang Zhang, Muthana Al Abo, Vinodh N. Rajapakse, Eijiro Nakamura, Lisa M. Miller Jenkins, Mirit I. Aladjem, Yves Pommier
Molecular Cell, 69, 371-384.e6 (2018)
要 約
SLFN11遺伝子は,独立した2つの大規模ながんデータベースの解析により,DNA障害型の抗がん剤への感受性とmRNAの発現量とがもっとも高く相関すると報告された遺伝子である.しかしながら,SLFN11の高発現が薬剤感受性に寄与する機構についてはほとんどわかっていなかった.この研究において,筆者らは,1)DNAが損傷をうけたときSLFN11は複製フォークに結合すること,2)SLFN11は複製の開始は阻害しないがそののちの複製フォークの進行を阻害すること,3)SLFN11はそれ自体のもつATPase活性をつかってクロマチンを開いた構造に変換すること,4)これらのSLFN11の機能はATRに依存的なS期チェックポイントとは独立していること,5)複製の開始を強制的に起こすCHK1阻害剤の存在下においてもSLFN11の複製フォークへの結合および複製フォークの進行の阻害は起こること,を明らかにした.以上より,SLFN11はDNAが損傷をうけたときに複製フォークに結合し,クロマチンの構造を変化させ複製フォークの進行,すなわち,複製を阻害することがわかった.SLFN11による複製の阻害は永続的であり,長期にわたるS期の停止が薬剤感受性に寄与すると考えられた.
はじめに
SLFNファミリーは哺乳類のみにみつかっており,おおむね,細胞の分化や増殖の抑制にかかわる.SLFN11はヒトには存在するが,マウスにはホモログはない1).SLFN11はヘリカーゼ活性ドメインをもち核に存在する.
DNAを標的にした抗がん剤としては,古くから使われているプラチナ製剤,トポイソメラーゼ阻害剤,DNA複製阻害剤がある.これらの薬剤は,がん種によっては第1選択薬として使われているほどメジャーであるが,効果の予測に使えるバイオマーカーはみつかっていなかった.2012年,独立した2つの大規模ながんデータベース,NCI-60およびCancer Cell Line Encyclopediaの解析により,DNA障害型の抗がん剤への感受性とmRNAの発現量とがもっとも高く相関する遺伝子としてSLFN11遺伝子が報告された2,3).そののち,がん細胞株,患者に由来する異種移植,患者のデータを用いて,SLFN11とDNA障害型の薬剤感受性との相関がつぎつぎと報告されている.また,SLFN11は,2018年から卵巣がんの治療薬として日本において認可されたPARP阻害剤の感受性にも強くかかわる4).PARP阻害剤はもともとDNA修復阻害剤として開発されたが,のちの研究により,PARPとDNAとの複合体を形成する作用によりDNA障害剤として機能することがわかった5,6).これらのことから,SLFN11は広範なDNA障害型の抗がん剤に対し効果の予測に使えるバイオマーカーとしての可能性がある.さらに,SLFN11遺伝子の発現レベルは,Cancer Cell Line Encyclopediaにおける約1000種類の細胞株においてみるかぎり,きわめて低いか(50%以下)高いか(50%以上)のいずれかであり,そのオン-オフの頻度と二極性のパターンから汎用性の高いバイオマーカーとなることが期待される.しかしながら,SLFN11がDNA障害型の抗がん剤の感受性を増強させる機構についてはほとんどわかっていなかった.
1.SLFN11はATRとは独立してDNAが損傷をうけたときに複製を阻害する
これまで,S期に起こるDNAの損傷に対する細胞の応答としては,唯一,ATRに依存性のS期チェックポイントが知られていた.これは,DNAの損傷に対しATRのもつキナーゼの活性化により下流のCHK1が活性化し,その下流のCDK1が不活性化されることにより複製フォークの進行の速度を低下させ,新たな複製フォークによる複製の開始を阻害するものである.この機能は,DNAが損傷をうけたときに複製フォークがそこに衝突する際の新たな損傷をふせぐため,および,修復のための時間をかせぐために有用で,細胞の生存に有利にはたらく.実際,SLFN11を高発現している白血病細胞株CCRF-CEM細胞,および,そのSLFN11ノックアウト細胞にDNA障害剤であるカンプトテシンを投与したところ,4時間後には両方の細胞ともに複製が阻害されATRが活性化していた.この複製の阻害がATRに依存性のS期チェックポイントによるものであるなら,ATR阻害剤の投与により複製の阻害は解除されるはずである.SLFN11ノックアウト細胞においては予想どおり複製の阻害は解除されたが,野生型の細胞においては複製の阻害がつづいた.カンプトテシンの投与を継続して24時間後,SLFN11ノックアウト細胞においてはATRがひきつづき活性化しているにもかかわらず複製は再開し細胞は生存していたが,野生型の細胞は永続的に複製を停止しS期の細胞は死にはじめていた.つまり,ATRによる複製の停止は一時的で細胞の生存をおびやかさない一方,SLFN11はATRとは独立して永続的に複製を阻害し細胞死を誘導することがわかった.
2.SLFN11は複製フォークに結合する
SLFN11がどこで複製を阻害するのか蛍光免疫染色法により検討したところ,カンプトテシンの投与の4時間後にSLFN11はクロマチンに結合し,特徴的な染色パターンを示すことがわかった.このSLFN11の染色部位は新規にDNAが合成されている部位とほぼ一致した.つまり,SLFN11は複製フォークに結合することがわかった.抗SLFN11抗体を用いた免疫沈降-質量分析法による解析により,SLFN11はカンプトテシンの存在下において,DNAヘリカーゼ複合体MCM2-7のサブユニットのひとつMCM3と結合することもわかった.
以前の報告において,SLFN11は1本鎖DNAにポリマー構造を形成するRPA1と結合することが示されており7),そのことはあらためて確認された.カンプトテシンの投与によりS期チェックポイントがはたらき,複製フォークが停止することによりDNAポリメラーゼとDNAヘリカーゼとのあいだにすき間が生じて1本鎖DNAが露出し,そこにRPA複合体がポリマー構造を形成することが知られている.これらを総合すると,DNAの損傷に応答しSLFN11がRPA1およびMCM3を介して複製フォークに結合することが示唆された.
3.SLFN11は複製の開始は阻害しないがのちの複製フォークの進行を阻害する
ATRに依存性のS期チェックポイントにおいては,進行中の複製フォークを停止させるとともに新たな複製の開始を阻害する.DNAファイバーアッセイによりSLFN11は進行中の複製フォークの停止には関与しないことが明らかにされた.それでは,SLFN11は複製の開始それ自体を阻害するのか,あるいは,複製の開始ののちの複製フォークの進行を阻害するのか? 複製の開始にはCDK1に依存的に起こる複製フォークへのCDC45のリクルートが必須である.免疫蛍光染色法により,SLFN11は複製フォークへのCDC45のリクルートを阻害しないことがわかった.SLFN11は複製の開始の直後に起こる複製フォークへのPCNAのリクルートも阻害しなかった.しかしながら,カンプトテシンおよびATR阻害剤を併用することにより強制的な複製の開始を起こしてDNAポリメラーゼとDNAヘリカーゼとのあいだのすき間を広げることによるRPA複合体の過剰な蓄積が,SLFN11ノックアウト細胞においてみられた一方,野生型の細胞においてはみられなかったことから,SLFN11は異常な複製フォークの進行を阻害することがわかった.
さらに,複製開始点および複製開始の頻度をゲノムワイドかつ網羅的に解析する手法である新生鎖DNA-seq法を用いて,SLFN11が複製の開始におよぼす影響について検討した.その結果,カンプトテシンの投与により,複製開始点は変化しなかったが複製開始の頻度は有意に低下した.この低下は,野生型の細胞およびSLFN11ノックアウト細胞とも,ATR阻害剤の投与により対照と同じレベルにまで回復した.つまり,SLFN11は複製の開始には影響しないことがさらに確認された.
4.SLFN11はそれ自体のもつATPase活性をつかってクロマチンを開いた構造に変換する
SLFN11の薬剤感受性や複製を停止させる機能にはATPase活性が必要であった.ATPase活性がクロマチンの構造になんらかの影響をおよぼす可能性を考え,クロマチンの開いた構造および閉じた構造をゲノムワイドにマッピングするATAC-seq法により解析した.その結果,カンプトテシンの非存在下において,転写のさかんな遺伝子のプロモーター領域においては1 kb以下の範囲で野生型の細胞およびSLFN11ノックアウト細胞ともシグナルピークが認められた.カンプトテシンの投与の2~4時間後,SLFN11ノックアウト細胞においてはシグナルピークの幅および高さともほとんど変化はなかったが,野生型の細胞においてはゲノムワイドにシグナルピークの幅および高さとも増強していた.このシグナルのピークの増強はATPase活性を欠失させたSLFN11を発現させた細胞においてはみられなかった.また,ATAC-seq法によるシグナルピークの約50%は,新生鎖DNA-seq法により同定された複製開始点と隣接していた.これらのことより,カンプトテシンの存在下において,SLFN11は複製の開始の直後の複製フォークに結合し,それ自体のもつATPase活性をつかってクロマチンを開いた構造に変換し,なんらかの機序により複製を阻害すると考えられた.
5.CHK1阻害剤により強制的に複製の開始を起こしてもSLFN11の複製フォークへの結合および複製フォークの進行は起こる
ここまでは,カンプトテシンを用いて複製フォークの停止を起こす,あるいは,カンプトテシンとATR阻害剤を組み合わせることにより強制的に複製の開始を起こしてSLFN11の機能を解析した.カンプトテシンによるDNAの直接の損傷はSLFN11が機能するために必要なのだろうか? DNAの直接の損傷なくSLFN11を複製フォークに集積させる方法としてCHK1阻害剤を用いた.CHK1阻害剤はCDK1を活性化させ,強制的に複製の開始を起こす.ATR阻害剤にも同様のはたらきはあるが,単剤としての機能はCHK1阻害剤のほうが1000倍ほど高い.CHK1阻害剤の投与の4時間後,RPA複合体およびSLFN11のクロマチンへの集積が認められ,SLFN11は複製フォーク結合タンパク質であるCDC45と共局在した.さらに,SLFN11ノックアウト細胞に比べ,野生型の細胞においてはRPA複合体の集積が少なく,複製は抑制されていた.このことから,直接的なDNAの損傷がなくとも,RPA複合体が複製フォークに集積する状況においてSLFN11は複製フォークに結合しその進行を阻害することがわかった.
おわりに
この研究により,SLFN11が薬剤感受性を増強させる機構が部分的に解明された(図1).今後の課題は,SLFN11によるクロマチンの開いた構造への変換がどのように複製の停止につながるかという点である.現在,考えているシナリオは,SLFN11のもつヘリカーゼ活性により複製されるべき2本鎖DNAがさきに1本鎖にほどかれてしまい,DNAヘリカーゼ複合体MCM2-7はほどくべき2本鎖DNAが1本鎖になっているためさきに進めなくなる,すなわち,複製が停止するというものである.たとえるなら,ファスナーを開くとき,途中でさきに開いている部分があると,スライダーがその部分で止まってしまうような感じである.長期にわたるS期の停止により複製フォークが崩壊し細胞死が誘導されることは以前より報告があるので,SLFN11によるS期の停止が薬剤感受性に影響すると考えてよいと思うが,S期の停止から細胞死にいたる過程についてはさらに解析する必要があるかもしれない.
SLFN11は,2012年よりまえにはほとんど解析の対象とはされていない無名のタンパク質であったが,バイオインフォマテクスを駆使した2つの論文2,3) により,はじめて知られるところとなった.SLFN11のあるなしで薬剤感受性の差は明らかであり,また,S期の停止の機能もきわめて明瞭である.よくぞこれほど重要なタンパク質が2012年までみつからずにいたなと思う.それまで見過ごされてきた要因として,細胞生物学的な研究において歴史的に頻用されてきた細胞株において,軒並みSLFN11の発現量がきわめて低いことが考えられる.SLFN11を高発現する細胞は複製に対するストレスに弱いため実験材料として扱いづらい結果,SLFN11の発現の低い細胞が汎用されるようになったのかもしれない.また,マウスにSLFN11のホモログがみつかっていないことも要因として考えられる.
SLFN11は基礎研究における見地からも臨床における見地からも興味深い.基礎研究においては,SLFN11遺伝子にはがん抑制遺伝子としての機能があるのか,クロマチンの開いた構造への変換により複製の停止のほかに何が起こるのか,SLFN11はなぜ進化的に現われたのかなど,そして,臨床においては,DNA障害型の抗がん剤の感受性を予測するバイオマーカーとしての可能性である.現時点では,PARP阻害剤に関してはBRCA遺伝子の変異がバイオマーカーとして認められているほか,DNA障害型の抗がん剤の感受性を予測するバイオマーカーは存在しない.SLFN11はパラフィン切片からの組織化学免疫染色法により検出が可能で,約50%のがん細胞において発現の低下が認められていることから,低コストかつ汎用性の高いバイオマーカーとして期待される.
文 献
- Mavrommatis, E., Fish, E. N. & Platanias, L. C.: The schlafen family of proteins and their regulation by interferons. J. Interferon Cytokine Res., 33, 206-210 (2013)[PubMed]
- Zoppoli, G., Regairaz, M., Leo, E. G. et al.: Putative DNA/RNA helicase Schlafen-11 (SLFN11) sensitizes cancer cells to DNA-damaging agents. Proc. Natl. Acad. Sci. USA, 109, 15030-15035 (2012)[PubMed]
- Barretina, J., Caponigro, G., Stransky, N. et al.: The Cancer Cell Line Encyclopedia enables predictive modelling of anticancer drug sensitivity. Nature, 483, 603-607 (2012)[PubMed]
- Murai, J., Feng, Y., Yu, G. K. et al.: Resistance to PARP inhibitors by SLFN11 inactivation can be overcome by ATR inhibition. Oncotarget, 7, 76534-76550 (2016)[PubMed]
- Murai, J., Huang, S. Y., Renaud, A. et al.: Stereospecific PARP trapping by BMN 673 and comparison with olaparib and rucaparib. Mol. Cancer Ther., 13, 433-443 (2014)[PubMed]
- Murai, J., Huang, S. Y., Das, B. B. et al.: Trapping of PARP1 and PARP2 by clinical PARP inhibitors. Cancer Res., 72, 5588-5599 (2012)[PubMed]
- Mu, Y., Lou, J., Srivastava, M. et al.: SLFN11 inhibits checkpoint maintenance and homologous recombination repair. EMBO Rep., 17, 94-109 (2016)[PubMed]
著者プロフィール
略歴:2008年 大阪大学大学院医学系研究科 修了,2009年 米国Dana Farber Cancer Institutes,2010年 米国NIH National Cancer Institute,2012年 京都大学大学院医学研究科 助教を経て,2015年より米国NIH National Cancer InstituteにてResearch Fellow.
研究テーマ:DNAの修復とがん.SLFN11の機能.
© 2018 村井 純子 Licensed under CC 表示 2.1 日本