放射線誘導性腸線維症に対する好酸球の除去による新規の治療の機構
植松 智・武村直紀
(千葉大学大学院医学研究院 粘膜免疫学)
email:植松 智
DOI: 10.7875/first.author.2018.029
Eosinophil depletion suppresses radiation-induced small intestinal fibrosis.
Naoki Takemura , Yosuke Kurashima, Yuki Mori, Kazuki Okada, Takayuki Ogino, Hideki Osawa, Hirosih Matsuno, Lamichhane Aayam, Satoshi Kaneto, Eun Jeong Park, Shintaro Sato, Kouta Matsunaga, Yusuke Tamura, Yasuo Ouchi, Yutaro Kumagai, Daichi Kobayashi, Yutaka Suzuki, Yoshichika Yoshioka, Junichi Nishimura, Masaki Mori, Ken J. Ishii, Mark E. Rothenberg, Hiroshi Kiyono, Shizuo Akira, Satoshi Uematsu
Science Translational Medicine, 10, eaan0333 (2018)
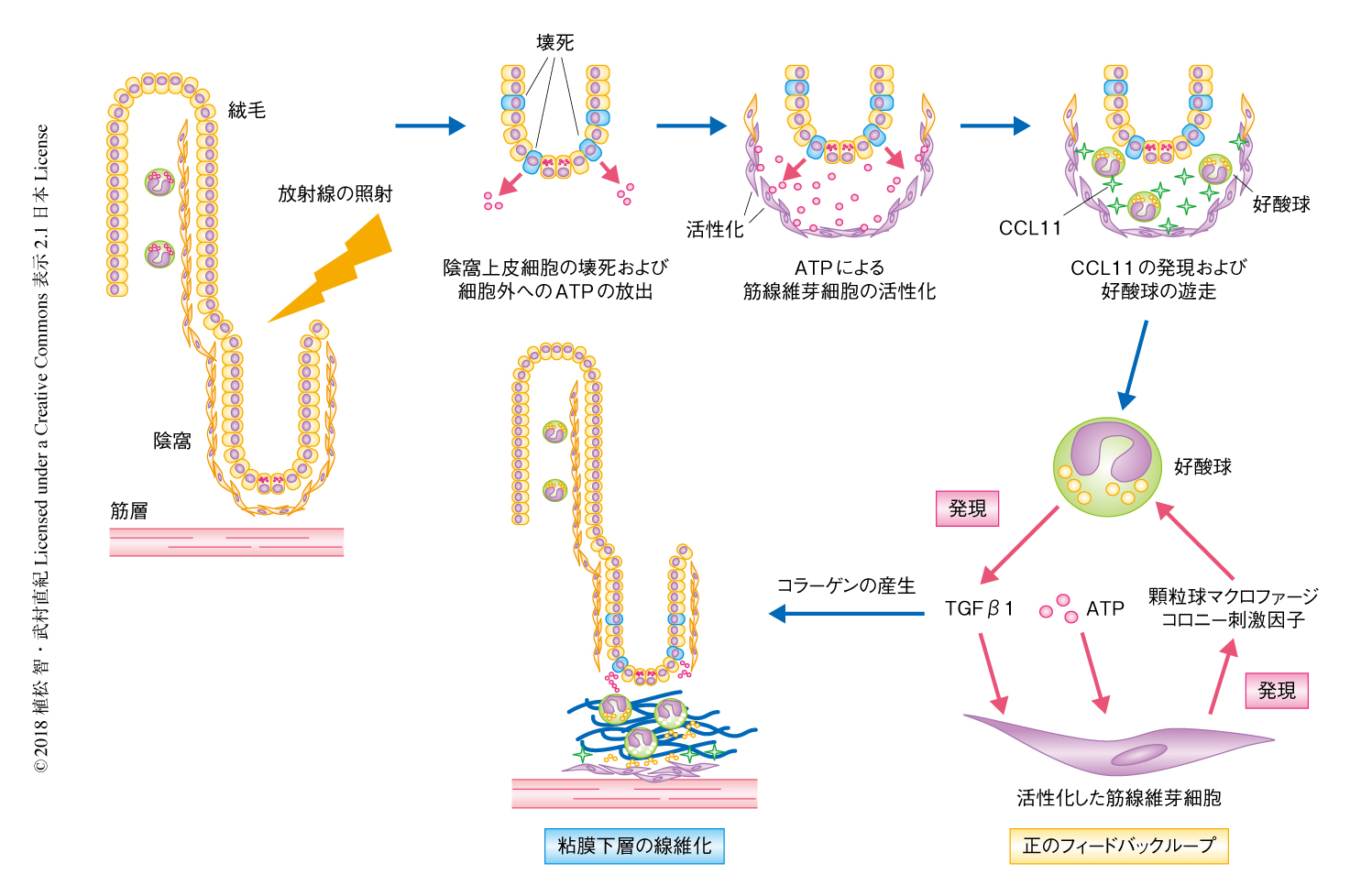
放射線誘導性腸線維症は腹部に対する放射線療法により起こる重篤な合併症である.マウスの腹部への放射線の照射は小腸の粘膜下層の組織に好酸球を過剰に蓄積させ放射線誘導性腸線維症をひき起こしたが,好酸球を欠損したマウスにおいて放射線誘導性腸線維症は顕著に改善された.放射線の照射による陰窩上皮細胞の壊死は,ATPの細胞外への放出を介して筋線維芽細胞にケモカインCCL11を発現させ,好酸球を遊走させた.活性化した筋線維芽細胞は顆粒球マクロファージコロニー刺激因子を産生し,顆粒球マクロファージコロニー刺激因子により活性化された好酸球はTGFβ1を産生して筋線維芽細胞の線維化を促進した.抗インターロイキン5受容体α抗体の投与は腸内の好酸球を枯渇させ,放射線誘導性腸線維症を非常に効果的に抑制した.以上のことから,好酸球が放射線誘導性腸線維症の病因として同定され,好酸球を標的とした放射線誘導性腸線維症の新しい治療戦略が示された.
放射線の照射ののちには,さまざまな組織において放射線障害が起こる1).なかでも,とくに小腸は放射線に対する感受性が高い.放射線療法においては,放射線障害を最小限に抑えるため放射線を分割して照射するなどの多くの努力がなされている.しかしながら,骨盤内腫瘍や腹膜転移がんの治療のため腹部に対し放射線療法を施した際には,下痢,出血,陰窩上皮細胞の細胞死といった放射線障害が認められることがある2-4).そのなかでもっとも重篤な副作用は,放射線の照射から数か月後に起こる放射線誘導性腸線維症である2,3).放射線誘導性腸線維症は腸の狭窄および線維化により閉塞をひき起こす.患者の生活の質をいちじるしく低下させる副作用であるが,その治療法は確立されていない.
免疫応答は炎症およびのちの組織の線維化に必須である5,6).自然免疫は組織の損傷に応答して炎症をひき起こすが,獲得免疫はこれらの応答を増強し維持する.さらに,大量の細胞外マトリックスを産生する筋線維芽細胞の分化および活性化は線維性疾患における重要な段階である7).種々の免疫細胞は損傷した組織に浸潤し,サイトカインおよび成長因子の発現を介して,線維芽細胞,血管周皮細胞/壁細胞,骨髄細胞を含む前駆細胞を成熟した筋線維芽細胞へと分化させる5-7).免疫細胞のうち,T細胞,とくにTh2細胞は多くの線維性疾患の進行において重要である8).しかしながら,放射線誘導性腸線維症の詳細な発症の機構については不明であった.
放射線誘導性腸線維症の病理学的な機構について検討するため,鉛ブロックにより頭部,胸部,四肢を遮蔽したマウスの腹部に放射線を照射することにより,ヒトの放射線誘導性腸線維症とよく類似したマウスモデルを確立した9).放射線の照射から12週間のちには,浮腫および筋層の炎症をともなう腸管粘膜層の肥厚をひき起こす典型的な形態学的な特徴を示した.小腸の陰窩上皮細胞の直下には一層の筋線維芽細胞が存在し,さまざまなサイトカインや成長因子を産生し幹細胞のニッチを提供すると考えられている10).放射線の照射ののち,筋線維芽細胞は筋層にむかって移動し,陰窩上皮細胞と筋線維芽細胞のあいだの粘膜下層にはコラーゲンの顕著な沈着が認められた.
放射線誘導性腸線維症マウスモデルにおいて線維化を起こした粘膜下層の組織には,好酸球の過剰な浸潤が観察された.透過型電子顕微鏡による観察において,放射線誘導性腸線維症マウスモデルの腸の絨毛の好酸球は,健康な腸の絨毛の好酸球と同様の形態学的な特徴を示したが,放射線の照射ののち粘膜下層に浸潤した好酸球には脱顆粒が認められた.このような脱顆粒した好酸球は炎症性疾患およびアレルギー性疾患においてよく観察され,活性化した細胞であると考えられる.そこで,放射線誘導性腸線維症における好酸球の関与について,好酸球を欠損したマウスを用いて検討した.その結果,腹部への放射線の照射から12週間のちの好酸球を欠損したマウスにおいて,粘膜下層のコラーゲンの沈着は顕著に減少していた.また,好酸球を欠損したマウスに放射線の照射ののち好酸球を移入すると,粘膜下層において顕著な線維化がもたらされた.したがって,放射線誘導性腸線維症の発症に好酸球は必須であることがわかった.
放射線誘導性腸線維症において好酸球はどのように粘膜下層に動員されるか検討した.ケモカインCCL11は炎症の部位に発現し,多数の疾患において好酸球を遊走させることが知られている.また,ほかの器官とは異なり小腸において恒常的に発現し,好酸球の粘膜固有層への動員を制御する.CCL11が放射線誘導性腸線維症における粘膜下層への好酸球の浸潤に関与するかどうかを確認するため,腸内の好酸球におけるCCL11の受容体の発現について調べた.CCL11はCCR3およびCCR5のリガンドであるが,腸の好酸球においてはCCR3の発現のみが検出された.また,CCR3ノックアウトマウスあるいは抗CCR3中和抗体を反復投与したマウスにおいては,粘膜下層への好酸球の浸潤および放射線の照射ののちの線維化が顕著に抑制された.以上のことから,好酸球はCCL11およびCCR3を介する経路により粘膜下層に動員されることがわかった.
放射線の照射ののち,どの細胞がCCL11の産生に関与するか検討した.Ccl11 mRNAに対するin situハイブリダイゼーションにおいて,放射線の照射のまえにはCcl11 mRNAは粘膜下層にまったく検出されなかったが,照射ののち,筋線維芽細胞においてCcl11 mRNAが顕著に検出された.以上のことから,放射線の照射ののち筋線維芽細胞が活性化され,それらが発現するCCL11により粘膜下層に好酸球が遊走することがわかった.
放射線の照射ののち,筋線維芽細胞がどのように活性化されるかについて検討した.慢性期においては,陰窩上皮細胞が持続的に壊死を起こしていた.細胞が壊死したときに細胞外に放出されるATPによるP2X受容体の活性化は,肺,腎臓,肝臓,膵臓,心臓を含むさまざまな臓器において線維性疾患の発症に寄与する.P2X受容体のアンタゴニストにより処理したマウスにおいて,好酸球の浸潤および線維化は有意に抑制された.また,小腸からの細胞外へのATPの放出を測定したところ,放射線の照射の直後には検出されなかったが,慢性期においては顕著に検出された.実際,ATPにより筋線維芽細胞を刺激すると,CCL11が特異的に発現した.以上のことから,慢性期における陰窩上皮細胞の壊死によりATPが細胞外に放出され,それにより筋線維芽細胞が活性化されてCCL11が発現することが明らかにされた.
粘膜下層に浸潤した好酸球が放射線誘導性腸線維症においてどのように活性化されるかについて検討した.通常,好酸球はアレルギーおよび寄生虫に感染したときにTh2細胞や2型自然リンパ球を介し活性化される.しかしながら,放射線誘導性腸線維症においてTh2細胞も2型自然リンパ球も関与しないことがわかった.そこで,放射線の照射ののち活性化した筋線維芽細胞が,好酸球の遊走だけでなく活性化にもかかわるかどうか検証した.筋線維芽細胞へのATPによる刺激は,インターロイキン33および顆粒球マクロファージコロニー刺激因子のmRNAレベルでの発現を有意に上昇させた.腸の好酸球において,インターロイキン33の受容体であるST2は発現していなかったが,顆粒球マクロファージコロニー刺激因子の受容体は発現していた.好酸球を顆粒球マクロファージコロニー刺激因子により刺激すると,線維化に必須のサイトカインであるTGFβ1が有意に発現した.さらに,顆粒球マクロファージコロニー刺激因子により刺激された好酸球に由来するTGFβ1は,筋線維芽細胞によるI型コラーゲンのmRNAレベルでの発現を顕著に上昇させた.以上のことから,好酸球と筋線維芽細胞との相互作用により粘膜下層における線維化が進展することが明らかにされた(図1).
好酸球を標的とした治療の効果について検討するため,好酸球に発現するインターロイキン5受容体αに対する抗体を投与し,放射線誘導性腸線維症に対する有効性について評価した.この抗インターロイキン5受容体α抗体は,インターロイキン5受容体に対する拮抗作用だけでなく,抗体に依存性の細胞傷害の増強により循環する好酸球をほぼ完全に枯渇させる.放射線の照射の4週間まえから4週間ごとに抗インターロイキン5受容体α抗体をくり返し投与したところ,照射から13週間のちにおいて,腸の好酸球は80~90%も減少しており,粘膜下層への好酸球の浸潤および線維化は顕著に減少した.したがって,抗インターロイキン5受容体α抗体による治療は放射線誘導性腸線維症を抑制するための有望な戦略であることがわかった.
この研究においては,放射線誘導性腸線維症のマウスモデルの作製により,線維化を起こした粘膜下層の組織への活性化した好酸球の浸潤が見い出された.そして,これまで発症の機構が不明であった放射線誘導性腸線維症について,好酸球と筋線維芽細胞との相互作用がその病因に重要であることがわかった.放射線誘導性腸線維症マウスモデルにおいてインターロイキン5受容体αを標的とした好酸球の除去により病状が顕著に改善されたことから,これまで治療法のなかった放射線誘導性腸線維症の新しい治療法となることが期待される.
略歴:2004年 大阪大学大学院医学系研究科 修了,同年 大阪大学微生物病研究所 助手,2009年 大阪大学免疫学フロンティア研究センター 特任准教授を経て,2012年より東京大学医科学研究所 特任教授,2014年より千葉大学大学院医学研究院 教授.
研究テーマ:腸管の粘膜固有層における自然免疫細胞の解析.次世代の粘膜ワクチンの開発.腸管における微生物叢の網羅的なメタゲノムの解析を基盤とした治療への応用.
抱負:革新的な研究成果と治療応用をめざします!
研究室URL:http://www.m.chiba-u.ac.jp/class/mucosa/
武村 直紀(Naoki Takemura)
千葉大学大学院医学研究院 講師.
© 2018 植松 智・武村直紀 Licensed under CC 表示 2.1 日本
(千葉大学大学院医学研究院 粘膜免疫学)
email:植松 智
DOI: 10.7875/first.author.2018.029
Eosinophil depletion suppresses radiation-induced small intestinal fibrosis.
Naoki Takemura , Yosuke Kurashima, Yuki Mori, Kazuki Okada, Takayuki Ogino, Hideki Osawa, Hirosih Matsuno, Lamichhane Aayam, Satoshi Kaneto, Eun Jeong Park, Shintaro Sato, Kouta Matsunaga, Yusuke Tamura, Yasuo Ouchi, Yutaro Kumagai, Daichi Kobayashi, Yutaka Suzuki, Yoshichika Yoshioka, Junichi Nishimura, Masaki Mori, Ken J. Ishii, Mark E. Rothenberg, Hiroshi Kiyono, Shizuo Akira, Satoshi Uematsu
Science Translational Medicine, 10, eaan0333 (2018)
要 約
放射線誘導性腸線維症は腹部に対する放射線療法により起こる重篤な合併症である.マウスの腹部への放射線の照射は小腸の粘膜下層の組織に好酸球を過剰に蓄積させ放射線誘導性腸線維症をひき起こしたが,好酸球を欠損したマウスにおいて放射線誘導性腸線維症は顕著に改善された.放射線の照射による陰窩上皮細胞の壊死は,ATPの細胞外への放出を介して筋線維芽細胞にケモカインCCL11を発現させ,好酸球を遊走させた.活性化した筋線維芽細胞は顆粒球マクロファージコロニー刺激因子を産生し,顆粒球マクロファージコロニー刺激因子により活性化された好酸球はTGFβ1を産生して筋線維芽細胞の線維化を促進した.抗インターロイキン5受容体α抗体の投与は腸内の好酸球を枯渇させ,放射線誘導性腸線維症を非常に効果的に抑制した.以上のことから,好酸球が放射線誘導性腸線維症の病因として同定され,好酸球を標的とした放射線誘導性腸線維症の新しい治療戦略が示された.
はじめに
放射線の照射ののちには,さまざまな組織において放射線障害が起こる1).なかでも,とくに小腸は放射線に対する感受性が高い.放射線療法においては,放射線障害を最小限に抑えるため放射線を分割して照射するなどの多くの努力がなされている.しかしながら,骨盤内腫瘍や腹膜転移がんの治療のため腹部に対し放射線療法を施した際には,下痢,出血,陰窩上皮細胞の細胞死といった放射線障害が認められることがある2-4).そのなかでもっとも重篤な副作用は,放射線の照射から数か月後に起こる放射線誘導性腸線維症である2,3).放射線誘導性腸線維症は腸の狭窄および線維化により閉塞をひき起こす.患者の生活の質をいちじるしく低下させる副作用であるが,その治療法は確立されていない.
免疫応答は炎症およびのちの組織の線維化に必須である5,6).自然免疫は組織の損傷に応答して炎症をひき起こすが,獲得免疫はこれらの応答を増強し維持する.さらに,大量の細胞外マトリックスを産生する筋線維芽細胞の分化および活性化は線維性疾患における重要な段階である7).種々の免疫細胞は損傷した組織に浸潤し,サイトカインおよび成長因子の発現を介して,線維芽細胞,血管周皮細胞/壁細胞,骨髄細胞を含む前駆細胞を成熟した筋線維芽細胞へと分化させる5-7).免疫細胞のうち,T細胞,とくにTh2細胞は多くの線維性疾患の進行において重要である8).しかしながら,放射線誘導性腸線維症の詳細な発症の機構については不明であった.
1.放射線誘導性腸線維症のマウスモデルの作製
放射線誘導性腸線維症の病理学的な機構について検討するため,鉛ブロックにより頭部,胸部,四肢を遮蔽したマウスの腹部に放射線を照射することにより,ヒトの放射線誘導性腸線維症とよく類似したマウスモデルを確立した9).放射線の照射から12週間のちには,浮腫および筋層の炎症をともなう腸管粘膜層の肥厚をひき起こす典型的な形態学的な特徴を示した.小腸の陰窩上皮細胞の直下には一層の筋線維芽細胞が存在し,さまざまなサイトカインや成長因子を産生し幹細胞のニッチを提供すると考えられている10).放射線の照射ののち,筋線維芽細胞は筋層にむかって移動し,陰窩上皮細胞と筋線維芽細胞のあいだの粘膜下層にはコラーゲンの顕著な沈着が認められた.
2.腸管の好酸球は放射線誘導性腸線維症の発症に必須である
放射線誘導性腸線維症マウスモデルにおいて線維化を起こした粘膜下層の組織には,好酸球の過剰な浸潤が観察された.透過型電子顕微鏡による観察において,放射線誘導性腸線維症マウスモデルの腸の絨毛の好酸球は,健康な腸の絨毛の好酸球と同様の形態学的な特徴を示したが,放射線の照射ののち粘膜下層に浸潤した好酸球には脱顆粒が認められた.このような脱顆粒した好酸球は炎症性疾患およびアレルギー性疾患においてよく観察され,活性化した細胞であると考えられる.そこで,放射線誘導性腸線維症における好酸球の関与について,好酸球を欠損したマウスを用いて検討した.その結果,腹部への放射線の照射から12週間のちの好酸球を欠損したマウスにおいて,粘膜下層のコラーゲンの沈着は顕著に減少していた.また,好酸球を欠損したマウスに放射線の照射ののち好酸球を移入すると,粘膜下層において顕著な線維化がもたらされた.したがって,放射線誘導性腸線維症の発症に好酸球は必須であることがわかった.
3.筋線維芽細胞により産生されたCCL11は粘膜下層に好酸球を遊走させる
放射線誘導性腸線維症において好酸球はどのように粘膜下層に動員されるか検討した.ケモカインCCL11は炎症の部位に発現し,多数の疾患において好酸球を遊走させることが知られている.また,ほかの器官とは異なり小腸において恒常的に発現し,好酸球の粘膜固有層への動員を制御する.CCL11が放射線誘導性腸線維症における粘膜下層への好酸球の浸潤に関与するかどうかを確認するため,腸内の好酸球におけるCCL11の受容体の発現について調べた.CCL11はCCR3およびCCR5のリガンドであるが,腸の好酸球においてはCCR3の発現のみが検出された.また,CCR3ノックアウトマウスあるいは抗CCR3中和抗体を反復投与したマウスにおいては,粘膜下層への好酸球の浸潤および放射線の照射ののちの線維化が顕著に抑制された.以上のことから,好酸球はCCL11およびCCR3を介する経路により粘膜下層に動員されることがわかった.
放射線の照射ののち,どの細胞がCCL11の産生に関与するか検討した.Ccl11 mRNAに対するin situハイブリダイゼーションにおいて,放射線の照射のまえにはCcl11 mRNAは粘膜下層にまったく検出されなかったが,照射ののち,筋線維芽細胞においてCcl11 mRNAが顕著に検出された.以上のことから,放射線の照射ののち筋線維芽細胞が活性化され,それらが発現するCCL11により粘膜下層に好酸球が遊走することがわかった.
4.陰窩上皮細胞の壊死により放出されたATPにより筋線維芽細胞は活性化する
放射線の照射ののち,筋線維芽細胞がどのように活性化されるかについて検討した.慢性期においては,陰窩上皮細胞が持続的に壊死を起こしていた.細胞が壊死したときに細胞外に放出されるATPによるP2X受容体の活性化は,肺,腎臓,肝臓,膵臓,心臓を含むさまざまな臓器において線維性疾患の発症に寄与する.P2X受容体のアンタゴニストにより処理したマウスにおいて,好酸球の浸潤および線維化は有意に抑制された.また,小腸からの細胞外へのATPの放出を測定したところ,放射線の照射の直後には検出されなかったが,慢性期においては顕著に検出された.実際,ATPにより筋線維芽細胞を刺激すると,CCL11が特異的に発現した.以上のことから,慢性期における陰窩上皮細胞の壊死によりATPが細胞外に放出され,それにより筋線維芽細胞が活性化されてCCL11が発現することが明らかにされた.
5.筋線維芽細胞に由来する顆粒球マクロファージコロニー刺激因子により活性化された好酸球は粘膜下層における線維化を促進する
粘膜下層に浸潤した好酸球が放射線誘導性腸線維症においてどのように活性化されるかについて検討した.通常,好酸球はアレルギーおよび寄生虫に感染したときにTh2細胞や2型自然リンパ球を介し活性化される.しかしながら,放射線誘導性腸線維症においてTh2細胞も2型自然リンパ球も関与しないことがわかった.そこで,放射線の照射ののち活性化した筋線維芽細胞が,好酸球の遊走だけでなく活性化にもかかわるかどうか検証した.筋線維芽細胞へのATPによる刺激は,インターロイキン33および顆粒球マクロファージコロニー刺激因子のmRNAレベルでの発現を有意に上昇させた.腸の好酸球において,インターロイキン33の受容体であるST2は発現していなかったが,顆粒球マクロファージコロニー刺激因子の受容体は発現していた.好酸球を顆粒球マクロファージコロニー刺激因子により刺激すると,線維化に必須のサイトカインであるTGFβ1が有意に発現した.さらに,顆粒球マクロファージコロニー刺激因子により刺激された好酸球に由来するTGFβ1は,筋線維芽細胞によるI型コラーゲンのmRNAレベルでの発現を顕著に上昇させた.以上のことから,好酸球と筋線維芽細胞との相互作用により粘膜下層における線維化が進展することが明らかにされた(図1).
6.抗インターロイキン5受容体α抗体は放射線誘導性腸線維症を抑制する
好酸球を標的とした治療の効果について検討するため,好酸球に発現するインターロイキン5受容体αに対する抗体を投与し,放射線誘導性腸線維症に対する有効性について評価した.この抗インターロイキン5受容体α抗体は,インターロイキン5受容体に対する拮抗作用だけでなく,抗体に依存性の細胞傷害の増強により循環する好酸球をほぼ完全に枯渇させる.放射線の照射の4週間まえから4週間ごとに抗インターロイキン5受容体α抗体をくり返し投与したところ,照射から13週間のちにおいて,腸の好酸球は80~90%も減少しており,粘膜下層への好酸球の浸潤および線維化は顕著に減少した.したがって,抗インターロイキン5受容体α抗体による治療は放射線誘導性腸線維症を抑制するための有望な戦略であることがわかった.
おわりに
この研究においては,放射線誘導性腸線維症のマウスモデルの作製により,線維化を起こした粘膜下層の組織への活性化した好酸球の浸潤が見い出された.そして,これまで発症の機構が不明であった放射線誘導性腸線維症について,好酸球と筋線維芽細胞との相互作用がその病因に重要であることがわかった.放射線誘導性腸線維症マウスモデルにおいてインターロイキン5受容体αを標的とした好酸球の除去により病状が顕著に改善されたことから,これまで治療法のなかった放射線誘導性腸線維症の新しい治療法となることが期待される.
文 献
- Yarnold, J. & Brotons, M. C.: Pathogenetic mechanisms in radiation fibrosis. Radiother. Oncol., 97, 149-161 (2010)[PubMed]
- Haydont, V. & Vozenin-Brotons, M. C.: Maintenance of radiation-induced intestinal fibrosis: cellular and molecular features. World J. Gastroenterol., 13, 2675-2683 (2007)[PubMed]
- Hauer-Jensen, M., Denham, J. W. & Andreyev, H. J.: Radiation enteropathy: pathogenesis, treatment and prevention. Nat. Rev. Gastroenterol. Hepatol., 11, 470-479 (2014)[PubMed]
- Takemura, N., Kawasaki, T., Kunisawa, J. et al.: Blockade of TLR3 protects mice from lethal radiation-induced gastrointestinal syndrome. Nat. Commun., 5, 3492 (2014)[PubMed]
- Wynn, T. A. & Ramalingam, T. R.: Mechanisms of fibrosis: therapeutic translation for fibrotic disease. Nat. Med., 18, 1028-1040 (2012)[PubMed]
- Wick, G., Grundtman, C., Mayerl, C. et al.: The immunology of fibrosis. Annu. Rev. Immunol., 31, 107-135 (2013)[PubMed]
- Kramann, R., DiRocco, D. P. & Humphreys, B. D.: Understanding the origin, activation and regulation of matrix-producing myofibroblasts for treatment of fibrotic disease. J. Pathol., 231, 273-289 (2013)[PubMed]
- Gieseck, R. L. 3rd, Wilson, M. S. & Wynn, T. A.: Type 2 immunity in tissue repair and fibrosis. Nat. Rev. Immunol., 18, 62-76 (2018)[PubMed]
- Okoshi, K., Kubo, H., Nagayama, S. et al.: All-trans-retinoic acid attenuates radiation-induced intestinal fibrosis in mice. J. Surg. Res., 150, 53-59 (2008)[PubMed]
- Eyden, B.: The myofibroblast: phenotypic characterization as a prerequisite to understanding its functions in translational medicine. J. Cell. Mol. Med., 12, 22-37 (2008)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2004年 大阪大学大学院医学系研究科 修了,同年 大阪大学微生物病研究所 助手,2009年 大阪大学免疫学フロンティア研究センター 特任准教授を経て,2012年より東京大学医科学研究所 特任教授,2014年より千葉大学大学院医学研究院 教授.
研究テーマ:腸管の粘膜固有層における自然免疫細胞の解析.次世代の粘膜ワクチンの開発.腸管における微生物叢の網羅的なメタゲノムの解析を基盤とした治療への応用.
抱負:革新的な研究成果と治療応用をめざします!
研究室URL:http://www.m.chiba-u.ac.jp/class/mucosa/
武村 直紀(Naoki Takemura)
千葉大学大学院医学研究院 講師.
© 2018 植松 智・武村直紀 Licensed under CC 表示 2.1 日本