新規のスプライソソーム阻害薬の前臨床試験および作用機序の解明
吉見 昭秀
(米国Memorial Sloan Kettering Cancer Center,Human Oncology and Pathogenesis Program)
email:吉見昭秀
DOI: 10.7875/first.author.2018.028
H3B-8800, an orally available small-molecule splicing modulator, induces lethality in spliceosome-mutant cancers.
Michael Seiler, Akihide Yoshimi, Rachel Darman, Betty Chan, Gregg Keaney, Michael Thomas, Anant A. Agrawal, Benjamin Caleb, Alfredo Csibi, Eckley Sean, Peter Fekkes, Craig Karr, Virginia Klimek, George Lai, Linda Lee, Pavan Kumar, Stanley Chun-Wei Lee, Xiang Liu, Crystal Mackenzie, Carol Meeske, Yoshiharu Mizui, Eric Padron, Eunice Park, Ermira Pazolli, Shouyong Peng, Sudeep Prajapati, Justin Taylor, Teng Teng, John Wang, Markus Warmuth, Huilan Yao, Lihua Yu, Ping Zhu, Omar Abdel-Wahab, Peter G. Smith, Silvia Buonamici
Nature Medicine, 24, 497-504 (2018)
スプライシング因子をコードする遺伝子の変異はがん,とくに,造血器腫瘍において頻繁にみられ,これらの変異をもつ細胞は野生型のスプライシング因子の機能に依存して生存している.現在,スプライシング因子を標的とした治療は臨床的に確立されておらず,さまざまながんの治療の成績を向上させるうえでスプライソソーム阻害薬の開発は急務である.この研究において,筆者らは,新規のスプライソソーム阻害薬H3B-8800がSFb3複合体に結合してその機能を抑制することを示した.また,H3B-8800がスプライシング因子をコードする遺伝子に変異をもつ細胞をin vivoにおいて選択的に駆逐することが,急性骨髄性白血病および新規に樹立した慢性骨髄単球性白血病の異種移植モデルにおいて示された.さらに,H3B-8800は従来のスプライソソーム阻害薬と比較して,より短いGCリッチなイントロンを標的としてイントロンリテンションをひき起こし,ゲノムの全体において遺伝子の発現を変化させることが明らかにされた.これらの標的となった遺伝子にはスプライシング因子をコードする遺伝子が有意に多く含まれ,H3B-8800はSFb3複合体の直接的な阻害だけでなく,スプライソソームの機能をより広範に抑制することにより,スプライシング因子をコードする遺伝子に変異をもつ細胞に対し選択的に細胞死をひき起こす機序が解明された.
スプライシング因子をコードする遺伝子の変異ががん,とくに,造血器腫瘍において高頻度に認められることが2011年にはじめて報告されて以来1,2),スプライシング因子をコードする遺伝子の変異がどのようにスプライシングの異常をきたすのか,その機序を中心に研究が進められてきた.スプライシングとは,mRNA前駆体からイントロンを除去して成熟mRNAを産生する過程のことをさすが,それぞれ異なるスプライシング因子をコードするSF3B1遺伝子,SRSF2遺伝子,U2AF1遺伝子の変異は,骨髄異形成症候群,慢性骨髄単球性白血病,慢性リンパ性白血病など造血器腫瘍だけでなく,乳がん,肺がん,膵がんなど固形腫瘍においても認められることが,のちの研究により明らかにされた3).これらのスプライシング因子をコードする遺伝子の変異はホットスポットとよばれる特定のアミノ酸をコードする部位にヘテロ変異として集中することから,いわゆる,機能欠損型の変異とは異なることが示唆されてきた.野生型のSF3B1はU2snRNPとよばれる複合体に含まれ,イントロンにおいて分岐部位配列(branch point sequence:BPS)を認識してイントロンの除去に機能するが,Lys700がGluに置換したSF3B1変異体は3’側のエクソンの直前にあるAG配列ではなく,それよりも5’側にあるAG配列をあやまって使ってしまうため,本来はイントロンとして除去されるべき配列が成熟mRNAに残存し,結果として,mRNAの分解や異常なタンパク質の産生につながる.このように,変異型のスプライシング因子はその配列認識に異常をきたし,ゲノムの全体においてスプライシングの異常をひき起こすことが知られている.
これらのスプライシング因子をコードする遺伝子の変異がどのように造血器腫瘍あるいは固形腫瘍の発症にかかわるかについては研究の途上であるが,スプライシング因子をコードする遺伝子に変異をもつ細胞は,その生存を野生型のスプライシング因子に依存しており4-6),スプライシングの遺伝学的あるいは薬理学的な阻害に対し高い感受性をもつことが示唆されてきた.ところが,スプライソソーム阻害薬の前臨床試験においては,スプライシング因子をコードする遺伝子に変異をもつ腫瘍細胞を効果的に除去する治療の最適化がなされておらず,また,臨床への応用も進んでいない.多くの造血器腫瘍,とくに,骨髄異形成症候群や慢性骨髄単球性白血病に対する治療の成績の現状はとうてい満足できるものではなく,スプライシング因子をコードする遺伝子の変異を標的とした治療法が確立されれば,造血器腫瘍の全体,また,一部の固形腫瘍に対する治療の成績の向上に寄与するであろう.この研究において,筆者らは,新規のスプライソソーム阻害薬の臨床への応用を進めるため,H3B-8800とよばれる小分子スプライソソーム阻害薬の開発,前臨床試験,作用機序の解明に取り組んだ.
H3B-8800は従来からスプライソソームの阻害薬として知られる天然化合物pladienolideと競合的にSF3b複合体と結合する小分子として同定された.pladienolideはもともと,VEGF遺伝子のプロモーターの制御のもと低酸素において誘導される遺伝子の発現を阻害する目的で実施された天然化合物のスクリーニングにおいて同定された小分子であり,グリオーマにおいて低酸素シグナルや細胞の増殖を抑制することにより腫瘍を抑制する効果が示唆されていたが,のちに,SF3b複合体がその標的であることが示された7).実際に,この研究においても,H3B-8800はin vitroにおいて野生型のSF3B1および変異型のSF3B1によるスプライシングを阻害することが確認された.野生型のSF3B1遺伝子,あるいは,変異型のSF3B1遺伝子をもつ膵がん細胞株Panc05.04細胞にH3B-8800を投与したところ,変異型のSF3B1遺伝子をもつ細胞に対してのみ細胞死をひき起こした.同様の経緯で同定されたE7107というスプライソソーム阻害薬にはこのような選択性は認められず,H3B-8800は変異型のSF3B1遺伝子をもつ細胞に対し高い選択性をもつことが確認された.さらに,pladienolideおよびH3B-8800の存在のもとで長期にわたり培養することにより,pladienolideおよびH3B-8800に対し耐性を獲得した細胞株が樹立された8).これらの細胞株のエクソームシークエンスを実施したところ,SF3B1のArg1074がHisに置換する変異,および,PHF5AのTrp36がCysに置換する変異が同定された.PHF5Aは分岐部位配列の認識にかかわるSF3b複合体の構成タンパク質として知られており,これらの結果から,あらためてH3B-8800のSF3b複合体に対する選択性が確認された.なお,H3B-8800のアナログであるE7107の臨床試験は視神経障害の副作用のため中止されたことを付記する.
H3B-8800のin vivoにおける効果について検証した.CRISPR-Cas9系を用いて白血病細胞株K562細胞にSF3B1のLys700がGluに置換する変異を導入し,NSGマウスの皮下に移植したうえで,H3B-8800の経口投与により治療した.その結果,SF3B1遺伝子に変異をもつK562細胞を移植したマウスは腫瘍が縮小したが,野生型のK562細胞を移植したマウスに対して効果はなかった.より高濃度のH3B-8800の経口投与により,野生型のK562細胞を移植したマウスにおいても腫瘍の縮小がみられた一方,SF3B1遺伝子に変異をもつK562細胞を移植したマウスにおいては腫瘍の増殖が完全に抑制された.同様の結果は,SF3B1のLys700がGluに置換する変異をもつ白血病細胞株HNT-34細胞においても得られた.この異種移植の系においては,腫瘍におけるH3B-8800の濃度は血漿における濃度とほぼ等しく,また,治療の開始から1時間後にはすでに正常なスプライシングおよび異常なスプライシングにおいて用量に依存的な影響が認められ,治療の開始から24時間後にはスプライシングは治療のまえの状態にもどることが確認された.
前臨床試験として,急性骨髄性白血病の患者の試料を用いた異種移植の系においてH3B-8800の効果を検証した.NSGSマウスをレシピエントとし,SF3B1のLys700がGluに置換する変異,および,NRAS遺伝子変異,急性骨髄性白血病をひき起こす遺伝子変異をもつ患者の試料,また,対照としてKRAS遺伝子変異,WT1遺伝子変異,MLL1遺伝子変異をもつがスプライシング因子をコードする遺伝子には変異をもたない患者の試料を骨髄移植した.移植した細胞の生着を確認したのち,H3B-8800を10日間にわたり経口投与し,骨髄,脾臓,肝臓,肺,末梢血中におけるヒトCD45陽性細胞およびマウスCD45陽性細胞のキメリズムを比較した.その結果,SF3B1遺伝子に変異をもつ細胞の異種移植においてはいずれの臓器においてもヒトCD45陽性細胞のキメリズムが顕著に減少していたのに対し,野生型の細胞の異種移植においてはほとんど治療の効果は認められなかった.また,最終の経口投与から3時間後にレシピエントのマウスから骨髄細胞を採取してヒトCD45に陽性の細胞を分取したところ,白血病細胞株の異種移植においてみられたのと同様のスプライシングの変化が観察された.これらの結果から,H3B-8800はin vivoにおいてもSF3B1遺伝子に変異をもつ急性骨髄性白血病に対し特異的に細胞死をひき起こす効果をもつことが示唆された.
スプライシング因子をコードする遺伝子に変異をもつ細胞は,その生存を野生型のスプライシング因子に依存していること,また,スプライシング因子をコードするSF3B1遺伝子に変異をもつ白血病に対しH3B-8800はすぐれた効果を示したことから,べつのスプライシング因子をコードするSRSF2遺伝子に変異をもつモデルにおいてH3B-8800の効果を検証した.慢性骨髄単球性白血病においては約半数の症例にSRSF2遺伝子の変異が認められるが,生存の期間を延長するような治療法はほぼ皆無であることから,慢性骨髄単球性白血病のモデルを用いた治療の効果の検証がもとめられる.ところが,これまで薬効の評価の可能な細胞株や異種移植モデルは存在しなかったことから,慢性骨髄単球性白血病の異種移植モデルの樹立を試みた.レシピエントとしては,さきと同じく,NSGSマウスを使った.NSGSマウスはヒトのサイトカイン,とくに顆粒球マクロファージコロニー刺激因子を発現するが,慢性骨髄単球性白血病の患者の細胞においては顆粒球マクロファージコロニー刺激因子に対する感受性が亢進しており顆粒球マクロファージコロニー刺激因子に依存的にSTAT5が活性化されることがNSGSマウスを選択したおもな理由である.また,患者の試料に含まれる正常な細胞の生着を可能なかぎりふせぐため,CD34をマーカーとして未分化な画分を分取し,また,生着の効率を高めるため細胞は骨髄へ直接に注射した.その結果,レシピエントのマウスは中央値38日で慢性骨髄単球性白血病を発症して死亡した.死亡時の骨髄にはヒトCD45が25~96%も存在し,また,白血病細胞の浸潤によると思われる重度の貧血および血小板の減少を呈していた.この異種移植モデルにおいて,白血病細胞は細胞の表面にヒトCD33,ヒトCD14,ヒトCD16のいずれか,あるいは,その複数を発現しており,慢性骨髄単球性白血病に矛盾しない骨髄単球系への分化の傾向をもつ細胞であった.また,ヒトCD45に陽性の細胞を分取してターゲットシークエンスを実施したところ,患者の試料にみられる遺伝子の変異およびそれらのバリアントのアリル頻度が異種移植モデルにおいても忠実に再現されていることが確認された9).
これらの結果から,この慢性骨髄単球性白血病の異種移植モデルは,in vivoにおいて薬効を評価するには最適なロバストなモデルであると考えられたため,慢性骨髄単球性白血病の6人の患者の試料(うち,3人がSRSF2遺伝子に変異をもつ)をNSGSマウスに骨髄移植し,H3B-8800の治療の効果について検討した.その結果,SF3B1遺伝子に変異をもつ急性骨髄性白血病の異種移植モデルと同様に,H3B-8800はSRSF2遺伝子に変異をもつ慢性骨髄単球性白血病の異種移植モデルに対し選択的にすぐれた効果を示した.また,一般的に治療抵抗性といわれる白血病幹細胞とされる画分に対しても,H3B-8800は細胞死をひき起こす効果を示した.したがって,H3B-8800はin vivoにおいてスプライシング因子をコードする遺伝子に変異をもつ白血病に対し特異的に細胞死をひき起こす効果をもつと考えられた.
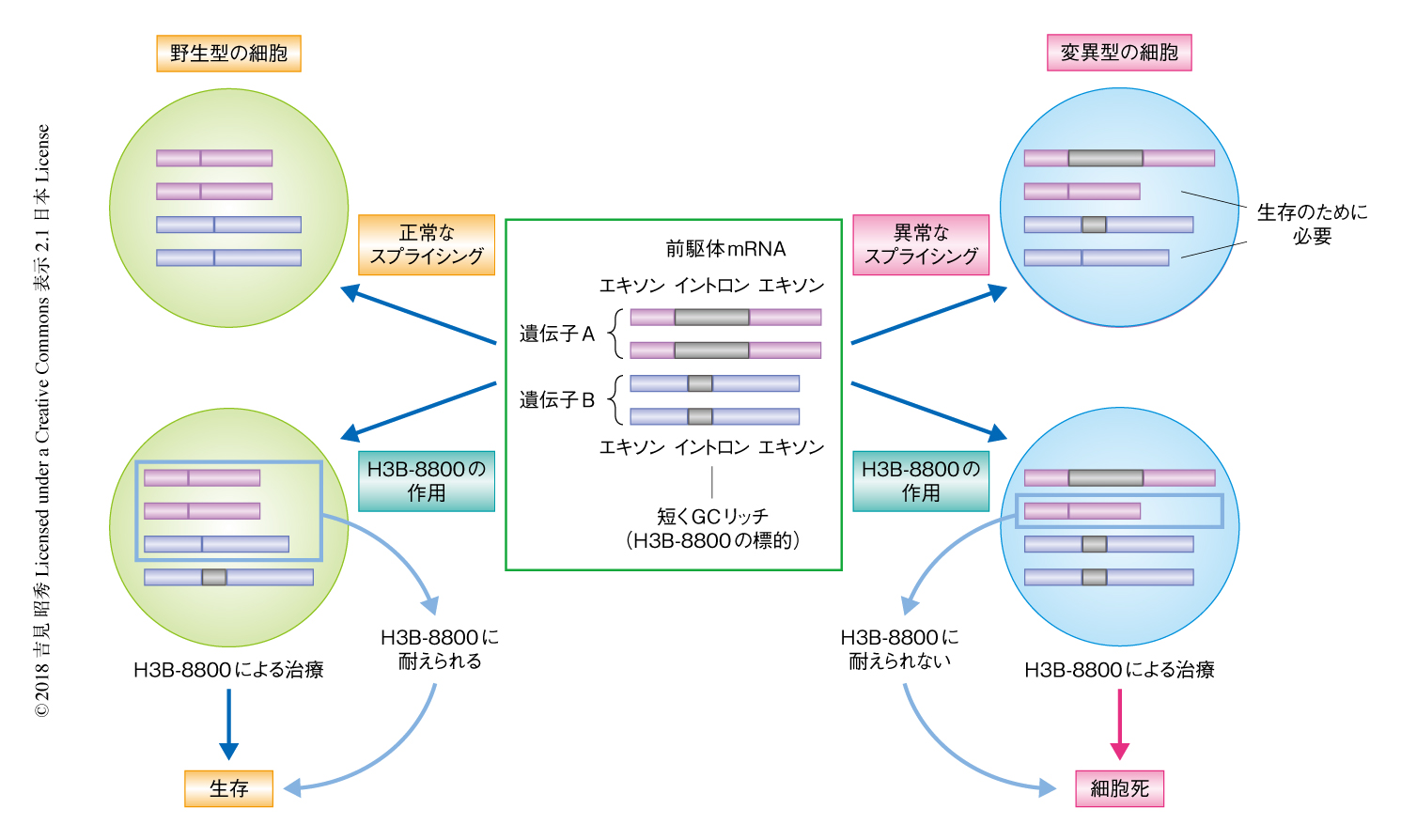
スプライシング因子をコードする遺伝子に変異をもつ細胞に対するH3B-8800の特異的な効果の機序について検討するため,H3B-8800により治療した,Lys700がGluに置換したSF3B1をもつK562細胞のRNAシークエンスを実施した.その結果,H3B-8800はおもにイントロンリテンションおよびエキソンスキッピングをひき起こし,これらのスプライシングの異常をもつ遺伝子の多くはその発現が低下していた.一方で,野生型のK562細胞およびLys700がGluに置換したSF3B1をもつK562細胞において,H3B-8800による治療によりひき起こされるスプライシングの変化はほぼ同様であった. スプライシングの変化をより詳細に検証したところ,治療によりイントロンリテンションの起こったイントロンは,その27%が短くかつGCリッチであり,スプライシングされたイントロン(イントロンリテンションが起こらなかったイントロン)とは有意な差が認められた(図1).同様の効果は,Lys700がGluに置換した変異をもつ急性リンパ芽球性白血病細胞株においても認められた.また,H3B-8800のアナログであるE7107ではこのような効果はみられなかったことから,短くGCリッチなイントロンにイントロンリテンションを起こすのはH3B-8800に特異的な効果であることがわかった.
H3B-8800によりひき起こされた短くGCリッチなイントロンをもつ遺伝子の欠失が,H3B-8800によるスプライシング因子をコードする遺伝子に変異をもつ細胞に対する感受性の亢進に寄与する機序を説明するため,これらの遺伝子のエンリッチメント解析を実施した.その結果,これらの遺伝子にはスプライシングそのものにかかわる遺伝子が濃縮されていることがわかった.そのなかには,スプライシングに必須なU2AF2をコードする遺伝子も含まれており,実際に,H3B-8800の用量に依存してU2AF2遺伝子においてイントロンリテンションが起こり,U2AF2の発現量は低下した.しかしながら,U2AF2遺伝子の全長cDNAの過剰発現ではH3B-8800による細胞死からレスキューされず,H3B-8800はほかの多数のスプライシング因子の発現量に影響をおよぼして細胞死をひき起こす可能性が示唆された.実際に,スプライシング因子の制御に寄与することが知られているSRPK1キナーゼも,H3B-8800の用量に依存して発現量が低下した.スプライシング因子をコードする遺伝子に変異をもつ細胞は野生型のスプライシング因子に依存して生存することから,野生型の細胞と比較した際に,H3B-8800による治療によりひき起こされるさらなるスプライソソームの阻害に対しより脆弱で,治療の感受性が亢進するものと考えられた(図1).
この研究において,H3B-8800がスプライシング因子をコードする遺伝子に変異をもつ細胞に対し選択的に細胞死をひき起こる小分子スプライソソーム阻害剤であることが示された.また,H3B-8800は従来のスプライソソーム阻害剤と比較して,より短くGCリッチな配列をもつイントロンを標的とすることにより,SF3b複合体に対する直接的な阻害だけでなく,ほかのスプライソソームの構成タンパク質の発現を抑制しスプライシングを効率的に阻害することが明らかにされた.このことは,野生型のスプライシング因子に依存して生存するスプライシング因子をコードする遺伝子に変異をもつ細胞に対し,H3B-8800が細胞死をひき起こす高い効果をもつことの理論的な裏づけになると考えられた.異なるスプライシング因子をコードするSF3B1遺伝子,SRSF2遺伝子,U2AF1遺伝子の変異はそれぞれ異なるスプライシングの異常をきたすことが知られているが,さきに述べたことから,いずれのスプライシング因子をコードする遺伝子に変異をもつ細胞に対してもH3B-8800が有効である可能性が示唆された.また,この研究において新たに開発された慢性骨髄単球性白血病の異種移植モデルは,さまざまな薬剤の薬効の評価に適すると同時に,慢性骨髄単球性白血病における白血病幹細胞の研究をはじめとする,これまでアプローチが困難であった病態の研究に有用かつ汎用性の高いモデルとなりうる.現在,H3B-8800の骨髄異形成症候群,慢性骨髄単球性白血病,急性骨髄性白血病に対する第1相試験が進行中であり,造血器腫瘍および固形腫瘍の治療を一変させる薬剤として,今後の安全性および有効性の評価が期待される.
略歴:2011年 東京大学大学院医学系研究科博士課程 修了,同 特任助教を経て,2015年より米国Memorial Sloan Kettering Cancer Center客員研究員.
研究テーマ:造血器腫瘍の生物学的な解析および新規の治療法の開発.
関心事:スプライシングの異常による病態の解明.スプライシングを起点にしたがんの新しい治療.
© 2018 吉見 昭秀 Licensed under CC 表示 2.1 日本
(米国Memorial Sloan Kettering Cancer Center,Human Oncology and Pathogenesis Program)
email:吉見昭秀
DOI: 10.7875/first.author.2018.028
H3B-8800, an orally available small-molecule splicing modulator, induces lethality in spliceosome-mutant cancers.
Michael Seiler, Akihide Yoshimi, Rachel Darman, Betty Chan, Gregg Keaney, Michael Thomas, Anant A. Agrawal, Benjamin Caleb, Alfredo Csibi, Eckley Sean, Peter Fekkes, Craig Karr, Virginia Klimek, George Lai, Linda Lee, Pavan Kumar, Stanley Chun-Wei Lee, Xiang Liu, Crystal Mackenzie, Carol Meeske, Yoshiharu Mizui, Eric Padron, Eunice Park, Ermira Pazolli, Shouyong Peng, Sudeep Prajapati, Justin Taylor, Teng Teng, John Wang, Markus Warmuth, Huilan Yao, Lihua Yu, Ping Zhu, Omar Abdel-Wahab, Peter G. Smith, Silvia Buonamici
Nature Medicine, 24, 497-504 (2018)
要 約
スプライシング因子をコードする遺伝子の変異はがん,とくに,造血器腫瘍において頻繁にみられ,これらの変異をもつ細胞は野生型のスプライシング因子の機能に依存して生存している.現在,スプライシング因子を標的とした治療は臨床的に確立されておらず,さまざまながんの治療の成績を向上させるうえでスプライソソーム阻害薬の開発は急務である.この研究において,筆者らは,新規のスプライソソーム阻害薬H3B-8800がSFb3複合体に結合してその機能を抑制することを示した.また,H3B-8800がスプライシング因子をコードする遺伝子に変異をもつ細胞をin vivoにおいて選択的に駆逐することが,急性骨髄性白血病および新規に樹立した慢性骨髄単球性白血病の異種移植モデルにおいて示された.さらに,H3B-8800は従来のスプライソソーム阻害薬と比較して,より短いGCリッチなイントロンを標的としてイントロンリテンションをひき起こし,ゲノムの全体において遺伝子の発現を変化させることが明らかにされた.これらの標的となった遺伝子にはスプライシング因子をコードする遺伝子が有意に多く含まれ,H3B-8800はSFb3複合体の直接的な阻害だけでなく,スプライソソームの機能をより広範に抑制することにより,スプライシング因子をコードする遺伝子に変異をもつ細胞に対し選択的に細胞死をひき起こす機序が解明された.
はじめに
スプライシング因子をコードする遺伝子の変異ががん,とくに,造血器腫瘍において高頻度に認められることが2011年にはじめて報告されて以来1,2),スプライシング因子をコードする遺伝子の変異がどのようにスプライシングの異常をきたすのか,その機序を中心に研究が進められてきた.スプライシングとは,mRNA前駆体からイントロンを除去して成熟mRNAを産生する過程のことをさすが,それぞれ異なるスプライシング因子をコードするSF3B1遺伝子,SRSF2遺伝子,U2AF1遺伝子の変異は,骨髄異形成症候群,慢性骨髄単球性白血病,慢性リンパ性白血病など造血器腫瘍だけでなく,乳がん,肺がん,膵がんなど固形腫瘍においても認められることが,のちの研究により明らかにされた3).これらのスプライシング因子をコードする遺伝子の変異はホットスポットとよばれる特定のアミノ酸をコードする部位にヘテロ変異として集中することから,いわゆる,機能欠損型の変異とは異なることが示唆されてきた.野生型のSF3B1はU2snRNPとよばれる複合体に含まれ,イントロンにおいて分岐部位配列(branch point sequence:BPS)を認識してイントロンの除去に機能するが,Lys700がGluに置換したSF3B1変異体は3’側のエクソンの直前にあるAG配列ではなく,それよりも5’側にあるAG配列をあやまって使ってしまうため,本来はイントロンとして除去されるべき配列が成熟mRNAに残存し,結果として,mRNAの分解や異常なタンパク質の産生につながる.このように,変異型のスプライシング因子はその配列認識に異常をきたし,ゲノムの全体においてスプライシングの異常をひき起こすことが知られている.
これらのスプライシング因子をコードする遺伝子の変異がどのように造血器腫瘍あるいは固形腫瘍の発症にかかわるかについては研究の途上であるが,スプライシング因子をコードする遺伝子に変異をもつ細胞は,その生存を野生型のスプライシング因子に依存しており4-6),スプライシングの遺伝学的あるいは薬理学的な阻害に対し高い感受性をもつことが示唆されてきた.ところが,スプライソソーム阻害薬の前臨床試験においては,スプライシング因子をコードする遺伝子に変異をもつ腫瘍細胞を効果的に除去する治療の最適化がなされておらず,また,臨床への応用も進んでいない.多くの造血器腫瘍,とくに,骨髄異形成症候群や慢性骨髄単球性白血病に対する治療の成績の現状はとうてい満足できるものではなく,スプライシング因子をコードする遺伝子の変異を標的とした治療法が確立されれば,造血器腫瘍の全体,また,一部の固形腫瘍に対する治療の成績の向上に寄与するであろう.この研究において,筆者らは,新規のスプライソソーム阻害薬の臨床への応用を進めるため,H3B-8800とよばれる小分子スプライソソーム阻害薬の開発,前臨床試験,作用機序の解明に取り組んだ.
1.H3B-8800はSF3b複合体の機能を選択的に抑制する
H3B-8800は従来からスプライソソームの阻害薬として知られる天然化合物pladienolideと競合的にSF3b複合体と結合する小分子として同定された.pladienolideはもともと,VEGF遺伝子のプロモーターの制御のもと低酸素において誘導される遺伝子の発現を阻害する目的で実施された天然化合物のスクリーニングにおいて同定された小分子であり,グリオーマにおいて低酸素シグナルや細胞の増殖を抑制することにより腫瘍を抑制する効果が示唆されていたが,のちに,SF3b複合体がその標的であることが示された7).実際に,この研究においても,H3B-8800はin vitroにおいて野生型のSF3B1および変異型のSF3B1によるスプライシングを阻害することが確認された.野生型のSF3B1遺伝子,あるいは,変異型のSF3B1遺伝子をもつ膵がん細胞株Panc05.04細胞にH3B-8800を投与したところ,変異型のSF3B1遺伝子をもつ細胞に対してのみ細胞死をひき起こした.同様の経緯で同定されたE7107というスプライソソーム阻害薬にはこのような選択性は認められず,H3B-8800は変異型のSF3B1遺伝子をもつ細胞に対し高い選択性をもつことが確認された.さらに,pladienolideおよびH3B-8800の存在のもとで長期にわたり培養することにより,pladienolideおよびH3B-8800に対し耐性を獲得した細胞株が樹立された8).これらの細胞株のエクソームシークエンスを実施したところ,SF3B1のArg1074がHisに置換する変異,および,PHF5AのTrp36がCysに置換する変異が同定された.PHF5Aは分岐部位配列の認識にかかわるSF3b複合体の構成タンパク質として知られており,これらの結果から,あらためてH3B-8800のSF3b複合体に対する選択性が確認された.なお,H3B-8800のアナログであるE7107の臨床試験は視神経障害の副作用のため中止されたことを付記する.
2.H3B-8800の急性骨髄性白血病に対する選択的な効果
H3B-8800のin vivoにおける効果について検証した.CRISPR-Cas9系を用いて白血病細胞株K562細胞にSF3B1のLys700がGluに置換する変異を導入し,NSGマウスの皮下に移植したうえで,H3B-8800の経口投与により治療した.その結果,SF3B1遺伝子に変異をもつK562細胞を移植したマウスは腫瘍が縮小したが,野生型のK562細胞を移植したマウスに対して効果はなかった.より高濃度のH3B-8800の経口投与により,野生型のK562細胞を移植したマウスにおいても腫瘍の縮小がみられた一方,SF3B1遺伝子に変異をもつK562細胞を移植したマウスにおいては腫瘍の増殖が完全に抑制された.同様の結果は,SF3B1のLys700がGluに置換する変異をもつ白血病細胞株HNT-34細胞においても得られた.この異種移植の系においては,腫瘍におけるH3B-8800の濃度は血漿における濃度とほぼ等しく,また,治療の開始から1時間後にはすでに正常なスプライシングおよび異常なスプライシングにおいて用量に依存的な影響が認められ,治療の開始から24時間後にはスプライシングは治療のまえの状態にもどることが確認された.
前臨床試験として,急性骨髄性白血病の患者の試料を用いた異種移植の系においてH3B-8800の効果を検証した.NSGSマウスをレシピエントとし,SF3B1のLys700がGluに置換する変異,および,NRAS遺伝子変異,急性骨髄性白血病をひき起こす遺伝子変異をもつ患者の試料,また,対照としてKRAS遺伝子変異,WT1遺伝子変異,MLL1遺伝子変異をもつがスプライシング因子をコードする遺伝子には変異をもたない患者の試料を骨髄移植した.移植した細胞の生着を確認したのち,H3B-8800を10日間にわたり経口投与し,骨髄,脾臓,肝臓,肺,末梢血中におけるヒトCD45陽性細胞およびマウスCD45陽性細胞のキメリズムを比較した.その結果,SF3B1遺伝子に変異をもつ細胞の異種移植においてはいずれの臓器においてもヒトCD45陽性細胞のキメリズムが顕著に減少していたのに対し,野生型の細胞の異種移植においてはほとんど治療の効果は認められなかった.また,最終の経口投与から3時間後にレシピエントのマウスから骨髄細胞を採取してヒトCD45に陽性の細胞を分取したところ,白血病細胞株の異種移植においてみられたのと同様のスプライシングの変化が観察された.これらの結果から,H3B-8800はin vivoにおいてもSF3B1遺伝子に変異をもつ急性骨髄性白血病に対し特異的に細胞死をひき起こす効果をもつことが示唆された.
3.新規の慢性骨髄単球性白血病の異種移植モデルの樹立およびH3B-8800のin vivoにおける薬効の評価
スプライシング因子をコードする遺伝子に変異をもつ細胞は,その生存を野生型のスプライシング因子に依存していること,また,スプライシング因子をコードするSF3B1遺伝子に変異をもつ白血病に対しH3B-8800はすぐれた効果を示したことから,べつのスプライシング因子をコードするSRSF2遺伝子に変異をもつモデルにおいてH3B-8800の効果を検証した.慢性骨髄単球性白血病においては約半数の症例にSRSF2遺伝子の変異が認められるが,生存の期間を延長するような治療法はほぼ皆無であることから,慢性骨髄単球性白血病のモデルを用いた治療の効果の検証がもとめられる.ところが,これまで薬効の評価の可能な細胞株や異種移植モデルは存在しなかったことから,慢性骨髄単球性白血病の異種移植モデルの樹立を試みた.レシピエントとしては,さきと同じく,NSGSマウスを使った.NSGSマウスはヒトのサイトカイン,とくに顆粒球マクロファージコロニー刺激因子を発現するが,慢性骨髄単球性白血病の患者の細胞においては顆粒球マクロファージコロニー刺激因子に対する感受性が亢進しており顆粒球マクロファージコロニー刺激因子に依存的にSTAT5が活性化されることがNSGSマウスを選択したおもな理由である.また,患者の試料に含まれる正常な細胞の生着を可能なかぎりふせぐため,CD34をマーカーとして未分化な画分を分取し,また,生着の効率を高めるため細胞は骨髄へ直接に注射した.その結果,レシピエントのマウスは中央値38日で慢性骨髄単球性白血病を発症して死亡した.死亡時の骨髄にはヒトCD45が25~96%も存在し,また,白血病細胞の浸潤によると思われる重度の貧血および血小板の減少を呈していた.この異種移植モデルにおいて,白血病細胞は細胞の表面にヒトCD33,ヒトCD14,ヒトCD16のいずれか,あるいは,その複数を発現しており,慢性骨髄単球性白血病に矛盾しない骨髄単球系への分化の傾向をもつ細胞であった.また,ヒトCD45に陽性の細胞を分取してターゲットシークエンスを実施したところ,患者の試料にみられる遺伝子の変異およびそれらのバリアントのアリル頻度が異種移植モデルにおいても忠実に再現されていることが確認された9).
これらの結果から,この慢性骨髄単球性白血病の異種移植モデルは,in vivoにおいて薬効を評価するには最適なロバストなモデルであると考えられたため,慢性骨髄単球性白血病の6人の患者の試料(うち,3人がSRSF2遺伝子に変異をもつ)をNSGSマウスに骨髄移植し,H3B-8800の治療の効果について検討した.その結果,SF3B1遺伝子に変異をもつ急性骨髄性白血病の異種移植モデルと同様に,H3B-8800はSRSF2遺伝子に変異をもつ慢性骨髄単球性白血病の異種移植モデルに対し選択的にすぐれた効果を示した.また,一般的に治療抵抗性といわれる白血病幹細胞とされる画分に対しても,H3B-8800は細胞死をひき起こす効果を示した.したがって,H3B-8800はin vivoにおいてスプライシング因子をコードする遺伝子に変異をもつ白血病に対し特異的に細胞死をひき起こす効果をもつと考えられた.
4.H3B-8800は短いGCリッチなイントロンを標的とする
スプライシング因子をコードする遺伝子に変異をもつ細胞に対するH3B-8800の特異的な効果の機序について検討するため,H3B-8800により治療した,Lys700がGluに置換したSF3B1をもつK562細胞のRNAシークエンスを実施した.その結果,H3B-8800はおもにイントロンリテンションおよびエキソンスキッピングをひき起こし,これらのスプライシングの異常をもつ遺伝子の多くはその発現が低下していた.一方で,野生型のK562細胞およびLys700がGluに置換したSF3B1をもつK562細胞において,H3B-8800による治療によりひき起こされるスプライシングの変化はほぼ同様であった. スプライシングの変化をより詳細に検証したところ,治療によりイントロンリテンションの起こったイントロンは,その27%が短くかつGCリッチであり,スプライシングされたイントロン(イントロンリテンションが起こらなかったイントロン)とは有意な差が認められた(図1).同様の効果は,Lys700がGluに置換した変異をもつ急性リンパ芽球性白血病細胞株においても認められた.また,H3B-8800のアナログであるE7107ではこのような効果はみられなかったことから,短くGCリッチなイントロンにイントロンリテンションを起こすのはH3B-8800に特異的な効果であることがわかった.
H3B-8800によりひき起こされた短くGCリッチなイントロンをもつ遺伝子の欠失が,H3B-8800によるスプライシング因子をコードする遺伝子に変異をもつ細胞に対する感受性の亢進に寄与する機序を説明するため,これらの遺伝子のエンリッチメント解析を実施した.その結果,これらの遺伝子にはスプライシングそのものにかかわる遺伝子が濃縮されていることがわかった.そのなかには,スプライシングに必須なU2AF2をコードする遺伝子も含まれており,実際に,H3B-8800の用量に依存してU2AF2遺伝子においてイントロンリテンションが起こり,U2AF2の発現量は低下した.しかしながら,U2AF2遺伝子の全長cDNAの過剰発現ではH3B-8800による細胞死からレスキューされず,H3B-8800はほかの多数のスプライシング因子の発現量に影響をおよぼして細胞死をひき起こす可能性が示唆された.実際に,スプライシング因子の制御に寄与することが知られているSRPK1キナーゼも,H3B-8800の用量に依存して発現量が低下した.スプライシング因子をコードする遺伝子に変異をもつ細胞は野生型のスプライシング因子に依存して生存することから,野生型の細胞と比較した際に,H3B-8800による治療によりひき起こされるさらなるスプライソソームの阻害に対しより脆弱で,治療の感受性が亢進するものと考えられた(図1).
おわりに
この研究において,H3B-8800がスプライシング因子をコードする遺伝子に変異をもつ細胞に対し選択的に細胞死をひき起こる小分子スプライソソーム阻害剤であることが示された.また,H3B-8800は従来のスプライソソーム阻害剤と比較して,より短くGCリッチな配列をもつイントロンを標的とすることにより,SF3b複合体に対する直接的な阻害だけでなく,ほかのスプライソソームの構成タンパク質の発現を抑制しスプライシングを効率的に阻害することが明らかにされた.このことは,野生型のスプライシング因子に依存して生存するスプライシング因子をコードする遺伝子に変異をもつ細胞に対し,H3B-8800が細胞死をひき起こす高い効果をもつことの理論的な裏づけになると考えられた.異なるスプライシング因子をコードするSF3B1遺伝子,SRSF2遺伝子,U2AF1遺伝子の変異はそれぞれ異なるスプライシングの異常をきたすことが知られているが,さきに述べたことから,いずれのスプライシング因子をコードする遺伝子に変異をもつ細胞に対してもH3B-8800が有効である可能性が示唆された.また,この研究において新たに開発された慢性骨髄単球性白血病の異種移植モデルは,さまざまな薬剤の薬効の評価に適すると同時に,慢性骨髄単球性白血病における白血病幹細胞の研究をはじめとする,これまでアプローチが困難であった病態の研究に有用かつ汎用性の高いモデルとなりうる.現在,H3B-8800の骨髄異形成症候群,慢性骨髄単球性白血病,急性骨髄性白血病に対する第1相試験が進行中であり,造血器腫瘍および固形腫瘍の治療を一変させる薬剤として,今後の安全性および有効性の評価が期待される.
文 献
- Papaemmanuil, E. Cazzola, M., Boultwood, J. et al.: Somatic SF3B1 mutation in myelodysplasia with ring sideroblasts. N. Engl. J. Med., 365, 1384-1395 (2011)[PubMed]
- Yoshida, K., Sanada, M., Shiraishi, Y. et al.: Frequent pathway mutations of splicing machinery in myelodysplasia. Nature, 478, 64-69 (2011)[PubMed] [新着論文レビュー]
- Dvinge, H., Kim, E., Abdel-Wahab, O. et al.: RNA splicing factors as oncoproteins and tumour suppressors. Nat. Rev. Cancer, 16, 413-430 (2016)[PubMed]
- Lee, S. C., Dvinge, H., Kim, E. et al.: Modulation of splicing catalysis for therapeutic targeting of leukemia with mutations in genes encoding spliceosomal proteins. Nat. Med., 22, 672-678 (2016)[PubMed]
- Obeng, E. A., Chappell, R. J., Seiler, M. et al.: Physiologic expression of Sf3b1K700E causes impaired erythropoiesis, aberrant splicing, and sensitivity to therapeutic spliceosome modulation. Cancer Cell, 30, 404-417 (2016)[PubMed]
- Shirai, C. L., Ley, J. N., White, B. S. et al.: Mutant U2AF1 expression alters hematopoiesis and pre-mRNA splicing in vivo. Cancer Cell, 27, 631-643 (2015)[PubMed]
- Kotake, Y., Sagane, K., Owa, T. et al.: Splicing factor SF3b as a target of the antitumor natural product pladienolide. Nat. Chem. Biol., 3, 570-575 (2007)[PubMed]
- Teng, T., Tsai, J. H., Puyang, X. et al.: Splicing modulators act at the branch point adenosine binding pocket defined by the PHF5A-SF3b complex. Nat. Commun., 8, 15522 (2017)[PubMed]
- Yoshimi, A., Balasis, M. E., Vedder, A. et al.: Robust patient-derived xenografts of MDS/MPN overlap syndromes capture the unique characteristics of CMML and JMML. Blood, 130, 397-407 (2017)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2011年 東京大学大学院医学系研究科博士課程 修了,同 特任助教を経て,2015年より米国Memorial Sloan Kettering Cancer Center客員研究員.
研究テーマ:造血器腫瘍の生物学的な解析および新規の治療法の開発.
関心事:スプライシングの異常による病態の解明.スプライシングを起点にしたがんの新しい治療.
© 2018 吉見 昭秀 Licensed under CC 表示 2.1 日本