単純ヘルペスウイルス1型のコードするVP22はAIM2インフラマソームを阻害し生体における増殖に貢献する
丸鶴雄平・川口 寧
(東京大学医科学研究所 ウイルス病態制御分野)
email:丸鶴雄平,川口 寧
DOI: 10.7875/first.author.2018.023
Herpes simplex virus 1 VP22 inhibits AIM2-dependent inflammasome activation to enable efficient viral replication.
Yuhei Maruzuru, Takeshi Ichinohe, Ryota Sato, Kensuke Miyake, Tokuju Okano, Toshihiko Suzuki, Takumi Koshiba, Naoto Koyanagi, Shumpei Tsuda, Mizuki Watanabe, Jun Arii, Akihisa Kato, Yasushi Kawaguchi
Cell Host & Microbe, 23, 254-265.e7 (2018)
AIM2は細菌やウイルスなどの病原体に由来する2本鎖DNAを認識するDNAセンサータンパク質である.AIM2が病原体に由来する2本鎖DNAを認識するとAIM2インフラマソームとよばれる巨大なタンパク質複合体が形成される.AIM2インフラマソームが形成されるとその構成タンパク質であるカスパーゼ1が未成熟型のインターロイキン1βおよびインターロイキン18を切断し,これらの炎症性サイトカインが細胞外へと放出されることにより病原体に対する免疫応答が活性化する.その一方で,病原体は免疫を回避するさまざまな機構をもつことが知られている.先行報告により,単純ヘルペスウイルス1型はAIM2インフラマソームを回避する機構をもつことが示唆されていたが,その詳細な機構および生体における役割については不明であった.この研究において,筆者らは,単純ヘルペスウイルス1型のコードするVP22がAIM2のHINドメインと結合し,AIM2のオリゴマー化を阻害することによりAIM2インフラマソームに依存的なインターロイキン1βの放出を阻害することを解明した.さらに,野生型のマウスの脳におけるVP22を欠損した単純ヘルペスウイルス1型の増殖の低下はAIM2ノックアウトマウスにおいて回復したことから,VP22によるAIM2インフラマソームの阻害は生体における単純ヘルペスウイルス1型の増殖に大きく貢献することが明らかにされた.
単純ヘルペスウイルスはヒトに脳炎,口唇ヘルペス,性器ヘルペス,皮膚疾患,眼疾患などといった多様な病態をひき起こす.また,多くの病態において潜伏と再発をくり返すことから,単純ヘルペスウイルスは宿主の免疫を回避する多様な機構を保持することがうかがえる.したがって,これらの免疫を回避する機構の解明は単純ヘルペスウイルスの病態が発現する機構の理解につながり,単純ヘルペスウイルスの感染を制御するうえで非常に重要な知見となる.
炎症性サイトカインであるインターロイキン1βおよびインターロイキン18はおもにマクロファージや樹状細胞から放出され,さまざまな病原体に対する免疫応答において重要なメディエーターとして機能する.インターロイキン1βおよびインターロイキン18の細胞外への放出はNF-κBやp38 MAPKによる転写レベル,および,インフラマソームによる翻訳後レベルの2つの段階において厳密に制御される.インフラマソームはセンサータンパク質,アダプタータンパク質であるASC,エフェクタータンパク質であるカスパーゼ1からなる巨大なタンパク質複合体である.インフラマソームの形成および活性化は,1)センサータンパク質による病原体の構成成分などの認識,2)センサータンパク質のオリゴマー化,3)ASCおよびカスパーゼ1前駆体のセンサータンパク質へのリクルート,4)カスパーゼ1前駆体の自己切断による活性化,5)活性化したカスパーゼ1によるインターロイキン1βおよびインターロイキン18の切断,の流れをたどる.センサータンパク質により認識する刺激の種類は異なり,たとえば,NLRP3はウイルスの感染による細胞質におけるイオン濃度の変化を認識してNLRP3インフラマソームを形成する1).AIM2は2本鎖DNAを認識することによりAIM2インフラマソームを形成し,インターロイキン1βおよびインターロイキン18の細胞外への放出をひき起こす2,3).
DNAウイルスであるワクシニアウイルスあるいはマウスサイトメガロウイルスの感染によるインターロイキン1βの放出はAIM2インフラマソームに依存的である一方,同じDNAウイルスである単純ヘルペスウイルス1型の感染によるインターロイキン1βの放出はAIM2インフラマソーム非依存的であることが報告されていた4).これらの知見から,単純ヘルペスウイルス1型がAIM2インフラマソームを回避する機構をもつことが示唆され,この研究においては,この機構の解明を目的とした.
単純ヘルペスウイルス1型はAIM2インフラマソームを阻害するタンパク質をコードする,という作業仮説のもと,単純ヘルペスウイルス1型にコードされるAIM2インフラマソームの阻害能をもつタンパク質を探索した.AIM2インフラマソームの構成タンパク質であるAIM2,ASC,カスパーゼ1前駆体,インターロイキン1β前駆体を発現するプラスミドを293FT細胞にトランスフェクションすると,細胞においてAIM2インフラマソームが再構成され,切断されたインターロイキン1βが培養上清に放出される.このとき,同時に単純ヘルペスウイルス1型にコードされる72種類のタンパク質それぞれをトランスフェクションし,培養上清のインターロイキン1βをELISA法にて定量することにより,単純ヘルペスウイルス1型にコードされるタンパク質のAIM2インフラマソームの活性化に対する影響について評価した.さらに,単純ヘルペスウイルス1型にコードされるAIM2インフラマソームを特異的に阻害するタンパク質を同定するため,対照としてNLRP3インフラマソームの再構成の系においても同様に実験した.これらのスクリーニングの結果,AIM2インフラマソームによるインターロイキン1βの放出をもっとも特異的に阻害する単純ヘルペスウイルス1型にコードされるタンパク質としてVP22が同定された.ところで,AIM2およびASCを発現するプラスミドを細胞にトランスフェクションするとAIM2とASCとの凝集体が観察される.そこで,AIM2,ASC,VP22を同時に発現させたところ,VP22はAIM2とASCとの凝集体の形成を阻害した.したがって,VP22はAIM2のオリゴマー化,あるいは,ASCのAIM2へのリクルートを阻害することが示唆された.
293T細胞にAIM2を単独で発現させると自己凝集しフィラメント様の構造をとることが報告されていた5).もし,VP22がAIM2の自己凝集を阻害するのであれば,VP22はAIM2のオリゴマー化を阻害することが考えらえる.そこで,293FT細胞にAIM2とVP22を共発現させて顕微鏡によりAIM2の構造を観察したところ,VP22と共発現させたときのみAIM2の自己凝集は阻害された.さらに,AIM2とVP22を共発現させた細胞の溶解液を密度勾配遠心分離法により分画したところ,VP22の非存在下と比較して,VP22の存在下においては低密度の画分にAIM2が検出された.これらの結果から,VP22はAIM2のオリゴマー化を阻害することが明らかにされた.
AIM2はN末端側にASCとの結合に必要なpyrinドメイン,C末端側に2本鎖DNAとの結合に必要なHINドメインをもつ.GSTプルダウンアッセイにより,VP22はAIM2のHINドメインと結合することが示された.また,293FT細胞において,VP22はAIM2のpyrinドメインの自己凝集は阻害せずHINドメインの自己凝集のみ阻害したこと,および,HINドメインとの結合能を欠失させた変異VP22はAIM2インフラマソームの阻害能を消失したことから,VP22はAIM2のHINドメインと結合することによりAIM2のオリゴマー化を阻害することが示唆された.
単純ヘルペスウイルス1型の感染した細胞においてVP22がAIM2インフラマソームの阻害能をもつことを確かめるため,VP22を欠損した単純ヘルペスウイルス1型あるいは野生型の単純ヘルペスウイルス1型を,野生型のマウスあるいはAIM2ノックアウトマウスに由来する骨髄由来マクロファージに感染させ,インフラマソームの活性化の指標であるカスパーゼ1の切断およびインターロイキン1βの放出について解析した.その結果,野生型の単純ヘルペスウイルス1型の感染においてはどちらのマウスに由来する骨髄由来マクロファージにおいてもカスパーゼ1の切断およびインターロイキン1βの放出はほとんど認められなかったのに対し,VP22を欠損した単純ヘルペスウイルス1型の感染においては野生型のマウスに由来する骨髄由来マクロファージでのみカスパーゼ1の切断およびインターロイキン1βの放出が確認された.これらの結果から,VP22を欠損した単純ヘルペスウイルス1型の感染においてはAIM2に依存的なインフラマソームの活性化およびそれにともなうインターロイキン1βの放出が認められたが,野生型の単純ヘルペスウイルス1型の感染においてはそのどちらも阻害されることが示された.したがって,VP22の非存在下においては単純ヘルペスウイルス1型の感染によりAIM2インフラマソームは活性化されるが,VP22は感染細胞においてAIM2インフラマソームを非常に効率的に阻害することが明らかにされた.
単純ヘルペスウイルス1型においてVP22はウイルス粒子を構成するテグメントタンパク質として知られている.単純ヘルペスウイルス1型は宿主の細胞に侵入した際,テグメントタンパク質を細胞質に放出することにより細胞を迅速にウイルスの増殖に有利な環境に変える.たとえば,同じくテグメントタンパク質であるUL41はNF-κB経路を阻害してインターロイキン6やTNFαなどの炎症性サイトカインの発現を抑制する6).そこで,単純ヘルペスウイルス1型のウイルス粒子においてVP22がインフラマソームを阻害できるかどうかについて検討した.VP22を欠損した単純ヘルペスウイルス1型をVP22を恒常的に発現するVero細胞において増殖させることにより,ウイルス粒子にVP22を含むが感染細胞においてはVP22を新規に合成できない単純ヘルペスウイルス1型を調製し,骨髄由来マクロファージに感染させカスパーゼ1の切断およびインターロイキン1βの放出について解析した.その結果,対照と比較して,カスパーゼ1の切断およびインターロイキン1βの放出が阻害されたことから,単純ヘルペスウイルス1型のウイルス粒子に含まれるVP22はインフラマソームの阻害能をもつことが明らかにされた.
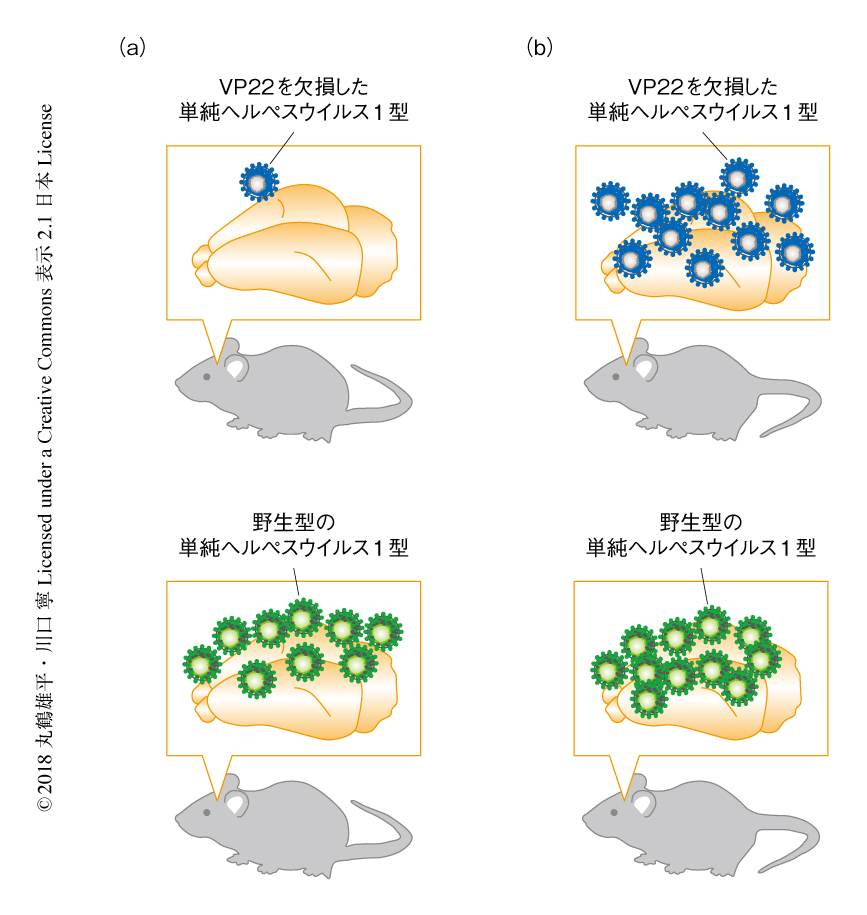
これまでに,筆者らの研究グループは,VP22はマウスの脳における単純ヘルペスウイルス1型の増殖に必要なタンパク質であることを報告していた7).そこで,VP22によるAIM2インフラマソームの阻害がマウスの脳における単純ヘルペスウイルス1型の増殖にどのように影響をおよぼすのかについて検討するため,野生型のマウスあるいはAIM2ノックアウトマウスの脳に,VP22を欠損した単純ヘルペスウイルス1型あるいは野生型の単純ヘルペスウイルス1型を感染させ,感染から4日後の脳におけるウイルス力価を測定した.これまでの報告のとおり,野生型のマウスの脳においてVP22を欠損した単純ヘルペスウイルス1型は野生型の単純ヘルペスウイルス1型から約14倍のウイルス力価の減少が認められた(図1a).一方,AIM2ノックアウトマウスの脳においてはVP22を欠損した単純ヘルペスウイルス1型と野生型の単純ヘルペスウイルス1型のウイルス力価はほぼ同じであった(図1b).これらの結果から,VP22を欠損した単純ヘルペスウイルス1型の脳におけるウイルス力価の減少はAIM2インフラマソームのかかわる免疫応答が原因であることが考えられ,VP22がAIM2インフラマソームを阻害することにより単純ヘルペスウイルス1型の生体における効率的な増殖に貢献することが示唆された.
病原体は免疫を回避するさまざまな機構により宿主の免疫応答からのがれ,宿主の体内における効率的な増殖を達成する.インフラマソームについても例外ではなく,2002年にはじめてインフラマソームの存在が報告されて以来,さまざまな病原体においてインフラマソームを回避する機構について報告されてきた8).たとえば,同じヘルペスウイルス科に属するカポジ肉腫関連ヘルペスウイルスがコードするORF63は,NLRP1のオリゴマー化をふせぐことにより,そののちのNLRP1インフラマソームの活性化および細胞外へのインターロイキン1βの放出を阻害する9).しかし,これまで,病原体によるインフラマソームの回避の機構が生体における増殖にどのくらい寄与するのかについてはまったく不明であった.また,ほかの病原体を含め,AIM2インフラマソームの阻害タンパク質は同定されていなかった.この研究においては,VP22を欠損した単純ヘルペスウイルス1型とAIM2ノックアウトマウスを組み合わせた感染実験により,病原体のもつAIM2インフラマソームの阻害タンパク質をはじめて同定しただけでなく,VP22によるAIM2インフラマソームの阻害が単純ヘルペスウイルス1型の生体レベルにおける増殖に大きく貢献することを明らかにした.これらの知見は,単純ヘルペスウイルスによる病態がくり返し再発するしくみの理解に大きく貢献し,その分子機構を標的とした単純ヘルペスウイルスの感染の新しい治療法や予防法の開発につながることが期待される.
宿主と病原体は進化的な軍拡競争により,免疫機構とそれに対する回避機構をともに獲得してきたと考えられる.VP22は単純ヘルペスウイルス1型が所属するαヘルペスウイルス亜科において保存されており,筆者らによる解析により,同じ亜科に属する単純ヘルペスウイルス2型およびブタヘルペスウイルス1型においてAIM2インフラマソームの阻害能は保存されていることが明らかにされた.これらの結果から,AIM2インフラマソームからの回避はさまざまなヘルペスウイルスの感染において重要であることが示唆された.この仮説を支持するように,インフラマソームの下流においてはたらくタンパク質の多型とさまざまなヘルペスウイルスの感受性とが相関するとの報告がある10).
略歴:東京大学医科学研究所 研究員.
研究テーマ:単純ヘルペスウイルスの増殖の機構.
川口 寧(Yasushi Kawaguchi)
東京大学医科学研究所 教授.
研究室URL:http://www.ims.u-tokyo.ac.jp/kawaguchi-lab/KawaguchiLabTop.html
© 2018 丸鶴雄平・川口 寧 Licensed under CC 表示 2.1 日本
(東京大学医科学研究所 ウイルス病態制御分野)
email:丸鶴雄平,川口 寧
DOI: 10.7875/first.author.2018.023
Herpes simplex virus 1 VP22 inhibits AIM2-dependent inflammasome activation to enable efficient viral replication.
Yuhei Maruzuru, Takeshi Ichinohe, Ryota Sato, Kensuke Miyake, Tokuju Okano, Toshihiko Suzuki, Takumi Koshiba, Naoto Koyanagi, Shumpei Tsuda, Mizuki Watanabe, Jun Arii, Akihisa Kato, Yasushi Kawaguchi
Cell Host & Microbe, 23, 254-265.e7 (2018)
要 約
AIM2は細菌やウイルスなどの病原体に由来する2本鎖DNAを認識するDNAセンサータンパク質である.AIM2が病原体に由来する2本鎖DNAを認識するとAIM2インフラマソームとよばれる巨大なタンパク質複合体が形成される.AIM2インフラマソームが形成されるとその構成タンパク質であるカスパーゼ1が未成熟型のインターロイキン1βおよびインターロイキン18を切断し,これらの炎症性サイトカインが細胞外へと放出されることにより病原体に対する免疫応答が活性化する.その一方で,病原体は免疫を回避するさまざまな機構をもつことが知られている.先行報告により,単純ヘルペスウイルス1型はAIM2インフラマソームを回避する機構をもつことが示唆されていたが,その詳細な機構および生体における役割については不明であった.この研究において,筆者らは,単純ヘルペスウイルス1型のコードするVP22がAIM2のHINドメインと結合し,AIM2のオリゴマー化を阻害することによりAIM2インフラマソームに依存的なインターロイキン1βの放出を阻害することを解明した.さらに,野生型のマウスの脳におけるVP22を欠損した単純ヘルペスウイルス1型の増殖の低下はAIM2ノックアウトマウスにおいて回復したことから,VP22によるAIM2インフラマソームの阻害は生体における単純ヘルペスウイルス1型の増殖に大きく貢献することが明らかにされた.
はじめに
単純ヘルペスウイルスはヒトに脳炎,口唇ヘルペス,性器ヘルペス,皮膚疾患,眼疾患などといった多様な病態をひき起こす.また,多くの病態において潜伏と再発をくり返すことから,単純ヘルペスウイルスは宿主の免疫を回避する多様な機構を保持することがうかがえる.したがって,これらの免疫を回避する機構の解明は単純ヘルペスウイルスの病態が発現する機構の理解につながり,単純ヘルペスウイルスの感染を制御するうえで非常に重要な知見となる.
炎症性サイトカインであるインターロイキン1βおよびインターロイキン18はおもにマクロファージや樹状細胞から放出され,さまざまな病原体に対する免疫応答において重要なメディエーターとして機能する.インターロイキン1βおよびインターロイキン18の細胞外への放出はNF-κBやp38 MAPKによる転写レベル,および,インフラマソームによる翻訳後レベルの2つの段階において厳密に制御される.インフラマソームはセンサータンパク質,アダプタータンパク質であるASC,エフェクタータンパク質であるカスパーゼ1からなる巨大なタンパク質複合体である.インフラマソームの形成および活性化は,1)センサータンパク質による病原体の構成成分などの認識,2)センサータンパク質のオリゴマー化,3)ASCおよびカスパーゼ1前駆体のセンサータンパク質へのリクルート,4)カスパーゼ1前駆体の自己切断による活性化,5)活性化したカスパーゼ1によるインターロイキン1βおよびインターロイキン18の切断,の流れをたどる.センサータンパク質により認識する刺激の種類は異なり,たとえば,NLRP3はウイルスの感染による細胞質におけるイオン濃度の変化を認識してNLRP3インフラマソームを形成する1).AIM2は2本鎖DNAを認識することによりAIM2インフラマソームを形成し,インターロイキン1βおよびインターロイキン18の細胞外への放出をひき起こす2,3).
DNAウイルスであるワクシニアウイルスあるいはマウスサイトメガロウイルスの感染によるインターロイキン1βの放出はAIM2インフラマソームに依存的である一方,同じDNAウイルスである単純ヘルペスウイルス1型の感染によるインターロイキン1βの放出はAIM2インフラマソーム非依存的であることが報告されていた4).これらの知見から,単純ヘルペスウイルス1型がAIM2インフラマソームを回避する機構をもつことが示唆され,この研究においては,この機構の解明を目的とした.
1.単純ヘルペスウイルス1型がコードするAIM2インフラマソームの阻害タンパク質の探索
単純ヘルペスウイルス1型はAIM2インフラマソームを阻害するタンパク質をコードする,という作業仮説のもと,単純ヘルペスウイルス1型にコードされるAIM2インフラマソームの阻害能をもつタンパク質を探索した.AIM2インフラマソームの構成タンパク質であるAIM2,ASC,カスパーゼ1前駆体,インターロイキン1β前駆体を発現するプラスミドを293FT細胞にトランスフェクションすると,細胞においてAIM2インフラマソームが再構成され,切断されたインターロイキン1βが培養上清に放出される.このとき,同時に単純ヘルペスウイルス1型にコードされる72種類のタンパク質それぞれをトランスフェクションし,培養上清のインターロイキン1βをELISA法にて定量することにより,単純ヘルペスウイルス1型にコードされるタンパク質のAIM2インフラマソームの活性化に対する影響について評価した.さらに,単純ヘルペスウイルス1型にコードされるAIM2インフラマソームを特異的に阻害するタンパク質を同定するため,対照としてNLRP3インフラマソームの再構成の系においても同様に実験した.これらのスクリーニングの結果,AIM2インフラマソームによるインターロイキン1βの放出をもっとも特異的に阻害する単純ヘルペスウイルス1型にコードされるタンパク質としてVP22が同定された.ところで,AIM2およびASCを発現するプラスミドを細胞にトランスフェクションするとAIM2とASCとの凝集体が観察される.そこで,AIM2,ASC,VP22を同時に発現させたところ,VP22はAIM2とASCとの凝集体の形成を阻害した.したがって,VP22はAIM2のオリゴマー化,あるいは,ASCのAIM2へのリクルートを阻害することが示唆された.
2.VP22はAIM2のHINドメインと結合しオリゴマー化を阻害する
293T細胞にAIM2を単独で発現させると自己凝集しフィラメント様の構造をとることが報告されていた5).もし,VP22がAIM2の自己凝集を阻害するのであれば,VP22はAIM2のオリゴマー化を阻害することが考えらえる.そこで,293FT細胞にAIM2とVP22を共発現させて顕微鏡によりAIM2の構造を観察したところ,VP22と共発現させたときのみAIM2の自己凝集は阻害された.さらに,AIM2とVP22を共発現させた細胞の溶解液を密度勾配遠心分離法により分画したところ,VP22の非存在下と比較して,VP22の存在下においては低密度の画分にAIM2が検出された.これらの結果から,VP22はAIM2のオリゴマー化を阻害することが明らかにされた.
AIM2はN末端側にASCとの結合に必要なpyrinドメイン,C末端側に2本鎖DNAとの結合に必要なHINドメインをもつ.GSTプルダウンアッセイにより,VP22はAIM2のHINドメインと結合することが示された.また,293FT細胞において,VP22はAIM2のpyrinドメインの自己凝集は阻害せずHINドメインの自己凝集のみ阻害したこと,および,HINドメインとの結合能を欠失させた変異VP22はAIM2インフラマソームの阻害能を消失したことから,VP22はAIM2のHINドメインと結合することによりAIM2のオリゴマー化を阻害することが示唆された.
3.VP22を欠損した単純ヘルペスウイルス1型は感染細胞においてAIM2インフラマソームの活性化を増強する
単純ヘルペスウイルス1型の感染した細胞においてVP22がAIM2インフラマソームの阻害能をもつことを確かめるため,VP22を欠損した単純ヘルペスウイルス1型あるいは野生型の単純ヘルペスウイルス1型を,野生型のマウスあるいはAIM2ノックアウトマウスに由来する骨髄由来マクロファージに感染させ,インフラマソームの活性化の指標であるカスパーゼ1の切断およびインターロイキン1βの放出について解析した.その結果,野生型の単純ヘルペスウイルス1型の感染においてはどちらのマウスに由来する骨髄由来マクロファージにおいてもカスパーゼ1の切断およびインターロイキン1βの放出はほとんど認められなかったのに対し,VP22を欠損した単純ヘルペスウイルス1型の感染においては野生型のマウスに由来する骨髄由来マクロファージでのみカスパーゼ1の切断およびインターロイキン1βの放出が確認された.これらの結果から,VP22を欠損した単純ヘルペスウイルス1型の感染においてはAIM2に依存的なインフラマソームの活性化およびそれにともなうインターロイキン1βの放出が認められたが,野生型の単純ヘルペスウイルス1型の感染においてはそのどちらも阻害されることが示された.したがって,VP22の非存在下においては単純ヘルペスウイルス1型の感染によりAIM2インフラマソームは活性化されるが,VP22は感染細胞においてAIM2インフラマソームを非常に効率的に阻害することが明らかにされた.
4.単純ヘルペスウイルス1型のウイルス粒子に含まれるVP22はAIM2インフラマソームの活性化を阻害する
単純ヘルペスウイルス1型においてVP22はウイルス粒子を構成するテグメントタンパク質として知られている.単純ヘルペスウイルス1型は宿主の細胞に侵入した際,テグメントタンパク質を細胞質に放出することにより細胞を迅速にウイルスの増殖に有利な環境に変える.たとえば,同じくテグメントタンパク質であるUL41はNF-κB経路を阻害してインターロイキン6やTNFαなどの炎症性サイトカインの発現を抑制する6).そこで,単純ヘルペスウイルス1型のウイルス粒子においてVP22がインフラマソームを阻害できるかどうかについて検討した.VP22を欠損した単純ヘルペスウイルス1型をVP22を恒常的に発現するVero細胞において増殖させることにより,ウイルス粒子にVP22を含むが感染細胞においてはVP22を新規に合成できない単純ヘルペスウイルス1型を調製し,骨髄由来マクロファージに感染させカスパーゼ1の切断およびインターロイキン1βの放出について解析した.その結果,対照と比較して,カスパーゼ1の切断およびインターロイキン1βの放出が阻害されたことから,単純ヘルペスウイルス1型のウイルス粒子に含まれるVP22はインフラマソームの阻害能をもつことが明らかにされた.
5.VP22を欠損した単純ヘルペスウイルス1型の生体における増殖の低下はAIM2に依存的である
これまでに,筆者らの研究グループは,VP22はマウスの脳における単純ヘルペスウイルス1型の増殖に必要なタンパク質であることを報告していた7).そこで,VP22によるAIM2インフラマソームの阻害がマウスの脳における単純ヘルペスウイルス1型の増殖にどのように影響をおよぼすのかについて検討するため,野生型のマウスあるいはAIM2ノックアウトマウスの脳に,VP22を欠損した単純ヘルペスウイルス1型あるいは野生型の単純ヘルペスウイルス1型を感染させ,感染から4日後の脳におけるウイルス力価を測定した.これまでの報告のとおり,野生型のマウスの脳においてVP22を欠損した単純ヘルペスウイルス1型は野生型の単純ヘルペスウイルス1型から約14倍のウイルス力価の減少が認められた(図1a).一方,AIM2ノックアウトマウスの脳においてはVP22を欠損した単純ヘルペスウイルス1型と野生型の単純ヘルペスウイルス1型のウイルス力価はほぼ同じであった(図1b).これらの結果から,VP22を欠損した単純ヘルペスウイルス1型の脳におけるウイルス力価の減少はAIM2インフラマソームのかかわる免疫応答が原因であることが考えられ,VP22がAIM2インフラマソームを阻害することにより単純ヘルペスウイルス1型の生体における効率的な増殖に貢献することが示唆された.
おわりに
病原体は免疫を回避するさまざまな機構により宿主の免疫応答からのがれ,宿主の体内における効率的な増殖を達成する.インフラマソームについても例外ではなく,2002年にはじめてインフラマソームの存在が報告されて以来,さまざまな病原体においてインフラマソームを回避する機構について報告されてきた8).たとえば,同じヘルペスウイルス科に属するカポジ肉腫関連ヘルペスウイルスがコードするORF63は,NLRP1のオリゴマー化をふせぐことにより,そののちのNLRP1インフラマソームの活性化および細胞外へのインターロイキン1βの放出を阻害する9).しかし,これまで,病原体によるインフラマソームの回避の機構が生体における増殖にどのくらい寄与するのかについてはまったく不明であった.また,ほかの病原体を含め,AIM2インフラマソームの阻害タンパク質は同定されていなかった.この研究においては,VP22を欠損した単純ヘルペスウイルス1型とAIM2ノックアウトマウスを組み合わせた感染実験により,病原体のもつAIM2インフラマソームの阻害タンパク質をはじめて同定しただけでなく,VP22によるAIM2インフラマソームの阻害が単純ヘルペスウイルス1型の生体レベルにおける増殖に大きく貢献することを明らかにした.これらの知見は,単純ヘルペスウイルスによる病態がくり返し再発するしくみの理解に大きく貢献し,その分子機構を標的とした単純ヘルペスウイルスの感染の新しい治療法や予防法の開発につながることが期待される.
宿主と病原体は進化的な軍拡競争により,免疫機構とそれに対する回避機構をともに獲得してきたと考えられる.VP22は単純ヘルペスウイルス1型が所属するαヘルペスウイルス亜科において保存されており,筆者らによる解析により,同じ亜科に属する単純ヘルペスウイルス2型およびブタヘルペスウイルス1型においてAIM2インフラマソームの阻害能は保存されていることが明らかにされた.これらの結果から,AIM2インフラマソームからの回避はさまざまなヘルペスウイルスの感染において重要であることが示唆された.この仮説を支持するように,インフラマソームの下流においてはたらくタンパク質の多型とさまざまなヘルペスウイルスの感受性とが相関するとの報告がある10).
文 献
- Ichinohe, T., Pang, I. K. & Iwasaki, A.: Influenza virus activates inflammasomes via its intracellular M2 ion channel. Nat. Immunol., 11, 404-410 (2010)[PubMed]
- Fernandes-Alnemri, T., Yu, J. W., Datta, P. et al.: AIM2 activates the inflammasome and cell death in response to cytoplasmic DNA. Nature, 458, 509-513 (2009)[PubMed]
- Hornung, V., Ablasser, A., Charrel-Dennis, M. et al.: AIM2 recognizes cytosolic dsDNA and forms a caspase-1-activating inflammasome with ASC. Nature, 458, 514-518 (2009)[PubMed]
- Rathinam, V. A., Jiang, Z., Waggoner, S. N. et al.: The AIM2 inflammasome is essential for host defense against cytosolic bacteria and DNA viruses. Nat. Immunol., 11, 395-402 (2010)[PubMed]
- Lu, A., Kabaleeswaran, V., Fu, T. et al.: Crystal structure of the F27G AIM2 PYD mutant and similarities of its self-association to DED/DED interactions. J. Mol. Biol., 426, 1420-1427 (2014)[PubMed]
- Cotter, C. R., Kim, W. K., Nguyen, M. L. et al.: The virion host shutoff protein of herpes simplex virus 1 blocks the replication-independent activation of NF-κB in dendritic cells in the absence of type I interferon signaling. J. Virol., 85, 12662-12672 (2011)[PubMed]
- Tanaka, M., Kato, A., Satoh, Y. et al.: Herpes simplex virus 1 VP22 regulates translocation of multiple viral and cellular proteins and promotes neurovirulence. J. Virol., 86, 5264-5277 (2012)[PubMed]
- Gram, A. M., Frenkel, J. & Ressing, M. E.: Inflammasomes and viruses: cellular defence versus viral offence. J. Gen. Virol., 93, 2063-2075 (2012)[PubMed]
- Gregory, S. M., Davis, B. K., West, J. A. et al.: Discovery of a viral NLR homolog that inhibits the inflammasome. Science, 331, 330-334 (2011)[PubMed]
- Shirts, B. H., Wood, J., Yolken, R. H. et al.: Comprehensive evaluation of positional candidates in the IL-18 pathway reveals suggestive associations with schizophrenia and herpes virus seropositivity. Am. J. Med. Genet. B Neuropsychiatr. Genet., 147, 343-350 (2008)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:東京大学医科学研究所 研究員.
研究テーマ:単純ヘルペスウイルスの増殖の機構.
川口 寧(Yasushi Kawaguchi)
東京大学医科学研究所 教授.
研究室URL:http://www.ims.u-tokyo.ac.jp/kawaguchi-lab/KawaguchiLabTop.html
© 2018 丸鶴雄平・川口 寧 Licensed under CC 表示 2.1 日本