グルココルチコイドはインターロイキン7受容体およびCXCR4の発現を誘導することによりT細胞の体内分布および免疫応答の日内変動を制御する
榛葉旭恒・生田宏一
(京都大学ウイルス・再生医科学研究所 免疫制御分野)
email:榛葉旭恒
DOI: 10.7875/first.author.2018.018
Glucocorticoids drive diurnal oscillations in T cell distribution and responses by inducing interleukin-7 receptor and CXCR4.
Akihiro Shimba, Guangwei Cui, Shizue Tani-ichi, Makoto Ogawa, Shinya Abe, Fumie Okazaki, Satsuki Kitano, Hitoshi Miyachi, Hisakata Yamada, Takahiro Hara, Yasunobu Yoshikai, Takashi Nagasawa, Günther Schütz, Koichi Ikuta
Immunity, 48, 286-298.e6 (2018)
グルココルチコイドは強い抗炎症作用および免疫抑制作用をもつ,免疫系との関係の深いステロイドホルモンである.生体におけるグルココルチコイドの産生は日内変動を示すが,この日内変動が免疫系を制御する詳細な機構は不明であった.この研究において,筆者らは,T細胞において特異的にグルココルチコイド受容体をノックアウトしたマウス,および,グルココルチコイド受容体によるインターロイキン7受容体の発現の誘導能を失わせたマウスを作製しグルココルチコイドの生理作用を探求した.グルココルチコイドによりインターロイキン7受容体の発現を夜間に上げ昼間に下げる日内変動がひき起こされた.そして,インターロイキン7受容体からのシグナルによりT細胞においてケモカイン受容体CXCR4の発現が誘導されることにより,T細胞が夜間に脾臓やリンパ節などのリンパ組織に集積し昼間に血中にもどるという体内分布の日内変動がひき起こされた.さらに,T細胞がリンパ組織により集積する夜間においては,細菌の感染や抗原による刺激に対する免疫応答がより強く起こった.以上の結果から,グルココルチコイドによるT細胞のリンパ組織への集積により,より強い免疫応答がひき起こされることが明らかにされた.
グルココルチコイドは副腎皮質から分泌され,代謝や神経系などに対する多岐にわたる機能をもつ.免疫系に対しては強い抗炎症作用と免疫抑制作用をもつため,アレルギーや自己免疫疾患などさまざまな疾患の治療に用いられる1).生体においては,血中のグルココルチコイドの濃度は早朝にピークになり,昼間は高く,夜間は低値となるという,日内変動を示すことが知られている(マウスにおいては,夜行性のためこれが逆転する).われわれの生活リズムが昼夜のサイクルを軸にするように,近年,免疫系も日内変動を示すことが明らかにされてきた2-4).しかし,なぜ昼夜で免疫応答に違いが生じるのか,これまで,その詳細な機構は不明であった.
これまで,筆者らの研究グループは,グルココルチコイドはT細胞の生存を促進するインターロイキン7受容体の発現を誘導するという,免疫抑制作用とは矛盾する機能をあわせもつことを見い出してきた5,6).しかし,日内変動を示すグルココルチコイドが生体においてT細胞の機能をどのように制御するのか,その全容はいまだ明らかにされていない.この問題にアプローチするため,T細胞において特異的にグルココルチコイド受容体をノックアウトしたマウス,および,グルココルチコイド応答配列に点変異を導入することによりグルココルチコイド受容体によるインターロイキン7受容体の発現の誘導能を失わせたマウスを作製した.
1日の時間経過とともにT細胞におけるインターロイキン7受容体の発現について調べたところ,野生型のマウスにおいて夜間に高く昼間に低いという日内変動を示した.一方,T細胞に特異的なグルココルチコイド受容体ノックアウトマウスにおいてインターロイキン7受容体の発現の日内変動は消失した.以上の結果から,グルココルチコイドによりT細胞におけるインターロイキン7受容体の発現の日内変動がひき起こされることがわかった.
1日の時間経過とともに末梢血およびリンパ組織におけるT細胞の数を調べたところ,野生型のマウスの末梢血において昼間に多く夜間に少ないという日内変動を示した.また,リンパ節,脾臓,パイエル板などのリンパ組織においては,夜間に多く昼間に少ないという末梢血と反対の日内変動を示した.一方,T細胞に特異的なグルココルチコイド受容体ノックアウトマウスにおいてT細胞の数の日内変動は消失した.以上の結果から,昼間は多くのT細胞が血中を循環し夜間はリンパ組織に集積するという,T細胞の体内分布の日内変動が示され,グルココルチコイドによりその日内変動は制御されることが明らかにされた.
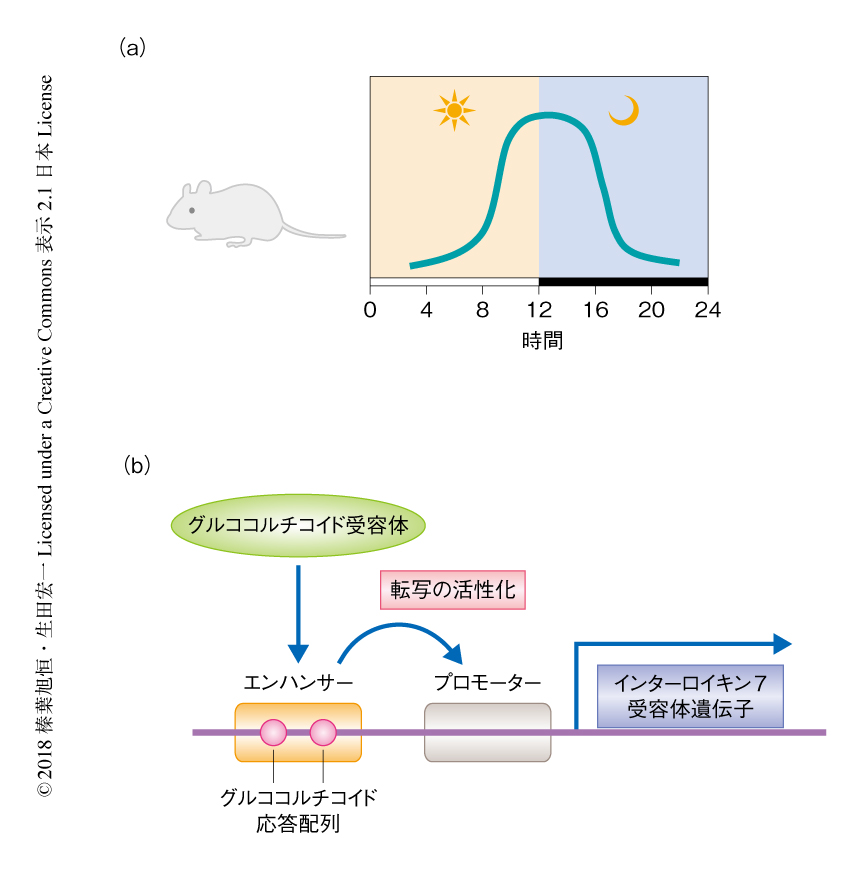
これまで,筆者らの研究グループは,培養細胞を用いて,インターロイキン7受容体遺伝子のエンハンサー領域は2つのグルココルチコイド応答配列をもち,グルココルチコイド受容体が結合することによりインターロイキン7受容体遺伝子の転写を活性化することを明らかにしてきた5,6)(図1).そこで,グルココルチコイド受容体によるインターロイキン7受容体の発現の誘導を阻害するため,2つのグルココルチコイド応答配列に点変異を導入したマウスを作製した.野生型のマウスのT細胞において,グルココルチコイド受容体は夜間にインターロイキン7受容体遺伝子のエンハンサー領域に結合し昼間は結合していないこと,グルココルチコイド応答配列に点変異を導入したマウスにおいてこの夜間の結合はみられないことが確認された.グルココルチコイド応答配列に点変異を導入したマウスは,T細胞に特異的なグルココルチコイド受容体ノックアウトマウスと同様に,T細胞におけるインターロイキン7受容体の発現の日内変動,および,末梢血およびリンパ組織におけるT細胞の数の日内変動が消失した.以上の結果から,グルココルチコイド受容体により発現が誘導されるインターロイキン7受容体の日内変動により,T細胞の体内分布の日内変動は制御されることが明らかにされた.
さらに,T細胞に特異的なグルココルチコイド受容体ノックアウトマウス,あるいは,グルココルチコイド応答配列に点変異を導入したマウスのT細胞を正常なマウスに移入したところ,野生型のマウスに比べ,残存するT細胞の数が少なかったことから,T細胞の生存も低下すると考えられた.したがって,この生存の低下が,T細胞に特異的なグルココルチコイド受容体ノックアウトマウス,および,グルココルチコイド応答配列に点変異を導入したマウスの末梢血およびリンパ組織においてT細胞の数が減少した一因と考えられた.
グルココルチコイド受容体とインターロイキン7受容体によるT細胞の体内分布の日内変動を調べるにあたり,ケモカイン受容体であるCCR7およびCXCR4に着目した.T細胞においてCCR7の発現に変化はなかった.一方,CXCR4の発現は,野生型のマウスにおいて夜間に高く昼間に低い日内変動を示したが,T細胞に特異的なグルココルチコイド受容体ノックアウトマウス,および,グルココルチコイド応答配列に点変異を導入したマウスにおいて日内変動は消失した.CXCR4の日内変動によりT細胞の体内分布の日内変動がひき起こされるかどうかを確認するため,T細胞において特異的にCXCR4をノックアウトしたマウスを作製したところ,末梢血およびリンパ組織においてT細胞の数の日内変動は消失し,血中にはつねに多くのT細胞が存在した.以上の結果から,グルココルチコイド受容体により発現が誘導されるインターロイキン7受容体の日内変動によりCXCR4の発現の日内変動がひき起こされ,T細胞の体内分布の日内変動が制御されることが明らかにされた.
インターロイキン7のレポーターマウスおよびCXCR4のリガンドであるCXCL12のレポーターマウスを用い,免疫組織染色法により移入されたT細胞の局在について調べた.その結果,CXCL12は脾髄の血管内皮細胞に発現し,インターロイキン7はT細胞領域のCXCL12陽性の血管内皮細胞をとりかこむ細胞に発現していた.移入されたT細胞は,赤脾髄にくわえ,T細胞領域のCXCL12陽性の血管内皮細胞およびそれをとりかこむインターロイキン7陽性の細胞の周辺に多く集積していた.また,T細胞に特異的なグルココルチコイド受容体ノックアウトマウスのT細胞においては移入されたT細胞の集積は少なかった.以上の結果から,CXCL12およびCXCR4によりT細胞の脾臓への移入がひき起こされることが示された.
昼間と夜間のT細胞の体内分布の変化が免疫応答の違いをひき起こすかどうかを調べた.オボアルブミンを発現するリステリア菌を昼間あるいは夜間にマウスに感染させ,脾臓においてオボアルブミンに特異的な活性化CD8陽性T細胞について解析した.その結果,夜間に細菌を感染させた野生型のマウスにおいては,オボアルブミンに特異的なCD8陽性T細胞の割合および数が昼間に感染させた場合より高いという,免疫応答の日内変動を示した.一方で,T細胞に特異的なグルココルチコイド受容体ノックアウトマウス,および,グルココルチコイド応答配列に点変異を導入したマウスにおいては,昼間に感染させたときと夜間に感染させたときとで免疫応答に差はなかった.以上の結果から,グルココルチコイドおよびインターロイキン7受容体によりひき起こされるT細胞のリンパ組織への集積により,夜間において強い免疫応答をひき起こされることが明らかにされた.
グルココルチコイドは1型ヘルパーT細胞の分化を抑制し2型ヘルパーT細胞の分化を促進することが報告されている7).そこで,T細胞に特異的なグルココルチコイド受容体ノックアウトマウスを用いヘルパーT細胞の分化について解析した.その結果,1型ヘルパーT細胞が分化する条件においてインターフェロンγ陽性の1型ヘルパーT細胞の割合が上昇し,逆に,2型ヘルパーT細胞が分化する条件においてインターロイキン4陽性あるいはインターロイキン13陽性の2型ヘルパーT細胞の割合が低下した.以上の結果から,グルココルチコイドは1型ヘルパーT細胞の分化を抑制し,2型ヘルパーT細胞の分化を促進することが確認された.
ヘルパーT細胞から産生されるインターロイキン4はB細胞の応答を補助し抗体の産生を促進する.マウスをオボアルブミンで免疫し抗体を産生させたところ,野生型のマウスにおいては夜間に免疫すると昼間に免疫したときに比べ,濾胞性ヘルパーT細胞,胚中心B細胞,クラススイッチを起こしたB細胞の数がより多く存在した.また,インターロイキン4に依存して産生される免疫グロブリンG1および免疫グロブリンG2bの血清中の量は夜間に免疫したほうが多く昼間に免疫したほうが少なかったことから,抗体の産生能も日内変動することがわかった.一方,T細胞に特異的なグルココルチコイド受容体ノックアウトマウスにおいては,夜間に免疫したときと昼間に免疫したときとで免疫応答に差はなかった.以上の結果から,グルココルチコイド受容体およびインターロイキン7受容体によりひき起こされる脾臓へのT細胞の集積により,夜間における強い抗体の産生がひき起こされることが明らかにされた.
パイエル板においては腸内細菌の刺激により恒常的に胚中心が形成されており,濾胞性ヘルパーT細胞および胚中心B細胞が検出される.一方,T細胞に特異的なグルココルチコイド受容体ノックアウトマウスにおいてはこれらの細胞の数が減少していた.この結果から,グルココルチコイドはパイエル板における抗体の産生を促進し,腸管における感染防御に関与すると考えられた.
インターロイキン7受容体はメモリーT細胞の維持にも重要なはたらきをする8,9).グルココルチコイド受容体により発現が誘導されるインターロイキン7受容体がメモリーT細胞の生存にも寄与するかどうかを確かめるため,試験管内で分化させた2型ヘルパーT細胞をマウスに移入しメモリー2型ヘルパーT細胞に分化させた.野生型のマウスのメモリー2型ヘルパーT細胞は,インターロイキン7受容体の発現が夜間に高く昼間に低いという日内変動を示した.一方,T細胞に特異的なグルココルチコイド受容体ノックアウトマウス,および,グルココルチコイド応答配列に点変異を導入したマウスのメモリー2型ヘルパーT細胞においては,インターロイキン7受容体の発現は低下し日内変動も消失した.さらに,メモリー2型ヘルパーT細胞の数も減少し,インターロイキン7受容体の発現の低下のため生存が障害されたと考えられた.以上の結果から,グルココルチコイドはインターロイキン7受容体の発現の誘導を介してメモリーT細胞の維持を促進することが明らかにされた.
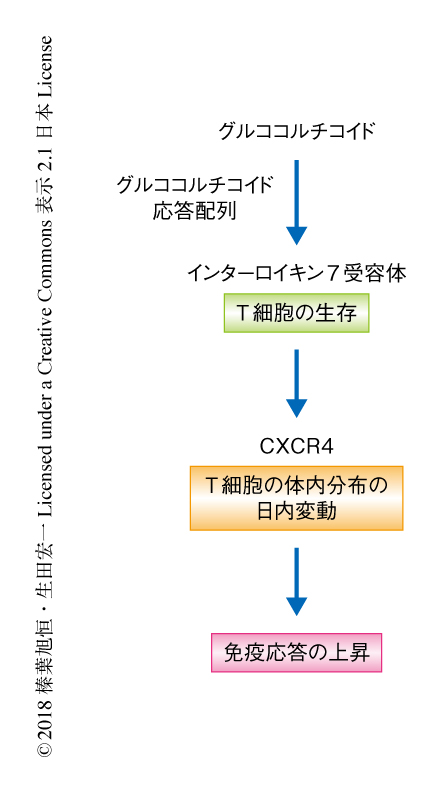
今回の研究により,生体において生理的な濃度のグルココルチコイドはT細胞におけるインターロイキン7受容体およびCXCR4の発現を誘導することによりT細胞の生存を促進し,T細胞の体内分布および免疫応答の日内変動をひき起こすことにより免疫応答を高めるはたらきをもつことが明らかにされた(図2).ヒトにおいては昼間,マウスにおいては夜間という,活動期の時間帯に免疫応答能が高まることになり,外界からの感染のリスクに備えるものと考えられる.このことから,規則的な生活によるグルココルチコイドの周期的な分泌は効率的な免疫応答をひき起こし,逆に,不規則な生活によるグルココルチコイドの分泌の乱れは免疫力の低下をもたらし,細菌やウイルスの感染のリスクが上昇する可能性が示唆される.今後は,気管支喘息などのアレルギーや関節リウマチなどの自己免疫疾患の症状と日内変動の関係性について,さらなる研究に発展することが期待される.
略歴:京都大学ウイルス・再生医科学研究所 研究員.
研究テーマ:内分泌系と免疫系との相互作用.
生田 宏一(Koichi Ikuta)
京都大学ウイルス・再生医科学研究所 教授.
研究室URL:http://www.infront.kyoto-u.ac.jp/ex_ivr/Lab/Ikuta-Lab/
© 2018 榛葉旭恒・生田宏一 Licensed under CC 表示 2.1 日本
(京都大学ウイルス・再生医科学研究所 免疫制御分野)
email:榛葉旭恒
DOI: 10.7875/first.author.2018.018
Glucocorticoids drive diurnal oscillations in T cell distribution and responses by inducing interleukin-7 receptor and CXCR4.
Akihiro Shimba, Guangwei Cui, Shizue Tani-ichi, Makoto Ogawa, Shinya Abe, Fumie Okazaki, Satsuki Kitano, Hitoshi Miyachi, Hisakata Yamada, Takahiro Hara, Yasunobu Yoshikai, Takashi Nagasawa, Günther Schütz, Koichi Ikuta
Immunity, 48, 286-298.e6 (2018)
要 約
グルココルチコイドは強い抗炎症作用および免疫抑制作用をもつ,免疫系との関係の深いステロイドホルモンである.生体におけるグルココルチコイドの産生は日内変動を示すが,この日内変動が免疫系を制御する詳細な機構は不明であった.この研究において,筆者らは,T細胞において特異的にグルココルチコイド受容体をノックアウトしたマウス,および,グルココルチコイド受容体によるインターロイキン7受容体の発現の誘導能を失わせたマウスを作製しグルココルチコイドの生理作用を探求した.グルココルチコイドによりインターロイキン7受容体の発現を夜間に上げ昼間に下げる日内変動がひき起こされた.そして,インターロイキン7受容体からのシグナルによりT細胞においてケモカイン受容体CXCR4の発現が誘導されることにより,T細胞が夜間に脾臓やリンパ節などのリンパ組織に集積し昼間に血中にもどるという体内分布の日内変動がひき起こされた.さらに,T細胞がリンパ組織により集積する夜間においては,細菌の感染や抗原による刺激に対する免疫応答がより強く起こった.以上の結果から,グルココルチコイドによるT細胞のリンパ組織への集積により,より強い免疫応答がひき起こされることが明らかにされた.
はじめに
グルココルチコイドは副腎皮質から分泌され,代謝や神経系などに対する多岐にわたる機能をもつ.免疫系に対しては強い抗炎症作用と免疫抑制作用をもつため,アレルギーや自己免疫疾患などさまざまな疾患の治療に用いられる1).生体においては,血中のグルココルチコイドの濃度は早朝にピークになり,昼間は高く,夜間は低値となるという,日内変動を示すことが知られている(マウスにおいては,夜行性のためこれが逆転する).われわれの生活リズムが昼夜のサイクルを軸にするように,近年,免疫系も日内変動を示すことが明らかにされてきた2-4).しかし,なぜ昼夜で免疫応答に違いが生じるのか,これまで,その詳細な機構は不明であった.
これまで,筆者らの研究グループは,グルココルチコイドはT細胞の生存を促進するインターロイキン7受容体の発現を誘導するという,免疫抑制作用とは矛盾する機能をあわせもつことを見い出してきた5,6).しかし,日内変動を示すグルココルチコイドが生体においてT細胞の機能をどのように制御するのか,その全容はいまだ明らかにされていない.この問題にアプローチするため,T細胞において特異的にグルココルチコイド受容体をノックアウトしたマウス,および,グルココルチコイド応答配列に点変異を導入することによりグルココルチコイド受容体によるインターロイキン7受容体の発現の誘導能を失わせたマウスを作製した.
1.グルココルチコイドはT細胞においてインターロイキン7受容体の発現の日内変動を制御する
1日の時間経過とともにT細胞におけるインターロイキン7受容体の発現について調べたところ,野生型のマウスにおいて夜間に高く昼間に低いという日内変動を示した.一方,T細胞に特異的なグルココルチコイド受容体ノックアウトマウスにおいてインターロイキン7受容体の発現の日内変動は消失した.以上の結果から,グルココルチコイドによりT細胞におけるインターロイキン7受容体の発現の日内変動がひき起こされることがわかった.
1日の時間経過とともに末梢血およびリンパ組織におけるT細胞の数を調べたところ,野生型のマウスの末梢血において昼間に多く夜間に少ないという日内変動を示した.また,リンパ節,脾臓,パイエル板などのリンパ組織においては,夜間に多く昼間に少ないという末梢血と反対の日内変動を示した.一方,T細胞に特異的なグルココルチコイド受容体ノックアウトマウスにおいてT細胞の数の日内変動は消失した.以上の結果から,昼間は多くのT細胞が血中を循環し夜間はリンパ組織に集積するという,T細胞の体内分布の日内変動が示され,グルココルチコイドによりその日内変動は制御されることが明らかにされた.
2.グルココルチコイドによるインターロイキン7受容体の発現の誘導はT細胞の体内分布の日内変動および生存を制御する
これまで,筆者らの研究グループは,培養細胞を用いて,インターロイキン7受容体遺伝子のエンハンサー領域は2つのグルココルチコイド応答配列をもち,グルココルチコイド受容体が結合することによりインターロイキン7受容体遺伝子の転写を活性化することを明らかにしてきた5,6)(図1).そこで,グルココルチコイド受容体によるインターロイキン7受容体の発現の誘導を阻害するため,2つのグルココルチコイド応答配列に点変異を導入したマウスを作製した.野生型のマウスのT細胞において,グルココルチコイド受容体は夜間にインターロイキン7受容体遺伝子のエンハンサー領域に結合し昼間は結合していないこと,グルココルチコイド応答配列に点変異を導入したマウスにおいてこの夜間の結合はみられないことが確認された.グルココルチコイド応答配列に点変異を導入したマウスは,T細胞に特異的なグルココルチコイド受容体ノックアウトマウスと同様に,T細胞におけるインターロイキン7受容体の発現の日内変動,および,末梢血およびリンパ組織におけるT細胞の数の日内変動が消失した.以上の結果から,グルココルチコイド受容体により発現が誘導されるインターロイキン7受容体の日内変動により,T細胞の体内分布の日内変動は制御されることが明らかにされた.
さらに,T細胞に特異的なグルココルチコイド受容体ノックアウトマウス,あるいは,グルココルチコイド応答配列に点変異を導入したマウスのT細胞を正常なマウスに移入したところ,野生型のマウスに比べ,残存するT細胞の数が少なかったことから,T細胞の生存も低下すると考えられた.したがって,この生存の低下が,T細胞に特異的なグルココルチコイド受容体ノックアウトマウス,および,グルココルチコイド応答配列に点変異を導入したマウスの末梢血およびリンパ組織においてT細胞の数が減少した一因と考えられた.
3.グルココルチコイドとインターロイキン7受容体はCXCR4の発現を誘導しT細胞の体内分布の日内変動をひき起こす
グルココルチコイド受容体とインターロイキン7受容体によるT細胞の体内分布の日内変動を調べるにあたり,ケモカイン受容体であるCCR7およびCXCR4に着目した.T細胞においてCCR7の発現に変化はなかった.一方,CXCR4の発現は,野生型のマウスにおいて夜間に高く昼間に低い日内変動を示したが,T細胞に特異的なグルココルチコイド受容体ノックアウトマウス,および,グルココルチコイド応答配列に点変異を導入したマウスにおいて日内変動は消失した.CXCR4の日内変動によりT細胞の体内分布の日内変動がひき起こされるかどうかを確認するため,T細胞において特異的にCXCR4をノックアウトしたマウスを作製したところ,末梢血およびリンパ組織においてT細胞の数の日内変動は消失し,血中にはつねに多くのT細胞が存在した.以上の結果から,グルココルチコイド受容体により発現が誘導されるインターロイキン7受容体の日内変動によりCXCR4の発現の日内変動がひき起こされ,T細胞の体内分布の日内変動が制御されることが明らかにされた.
インターロイキン7のレポーターマウスおよびCXCR4のリガンドであるCXCL12のレポーターマウスを用い,免疫組織染色法により移入されたT細胞の局在について調べた.その結果,CXCL12は脾髄の血管内皮細胞に発現し,インターロイキン7はT細胞領域のCXCL12陽性の血管内皮細胞をとりかこむ細胞に発現していた.移入されたT細胞は,赤脾髄にくわえ,T細胞領域のCXCL12陽性の血管内皮細胞およびそれをとりかこむインターロイキン7陽性の細胞の周辺に多く集積していた.また,T細胞に特異的なグルココルチコイド受容体ノックアウトマウスのT細胞においては移入されたT細胞の集積は少なかった.以上の結果から,CXCL12およびCXCR4によりT細胞の脾臓への移入がひき起こされることが示された.
4.グルココルチコイドによるT細胞の体内分布の日内変動により細菌の感染に対する昼夜の免疫応答に違いが生じる
昼間と夜間のT細胞の体内分布の変化が免疫応答の違いをひき起こすかどうかを調べた.オボアルブミンを発現するリステリア菌を昼間あるいは夜間にマウスに感染させ,脾臓においてオボアルブミンに特異的な活性化CD8陽性T細胞について解析した.その結果,夜間に細菌を感染させた野生型のマウスにおいては,オボアルブミンに特異的なCD8陽性T細胞の割合および数が昼間に感染させた場合より高いという,免疫応答の日内変動を示した.一方で,T細胞に特異的なグルココルチコイド受容体ノックアウトマウス,および,グルココルチコイド応答配列に点変異を導入したマウスにおいては,昼間に感染させたときと夜間に感染させたときとで免疫応答に差はなかった.以上の結果から,グルココルチコイドおよびインターロイキン7受容体によりひき起こされるT細胞のリンパ組織への集積により,夜間において強い免疫応答をひき起こされることが明らかにされた.
5.グルココルチコイドは2型ヘルパーT細胞の分化を促進し抗体産生能の日内変動をひき起こす
グルココルチコイドは1型ヘルパーT細胞の分化を抑制し2型ヘルパーT細胞の分化を促進することが報告されている7).そこで,T細胞に特異的なグルココルチコイド受容体ノックアウトマウスを用いヘルパーT細胞の分化について解析した.その結果,1型ヘルパーT細胞が分化する条件においてインターフェロンγ陽性の1型ヘルパーT細胞の割合が上昇し,逆に,2型ヘルパーT細胞が分化する条件においてインターロイキン4陽性あるいはインターロイキン13陽性の2型ヘルパーT細胞の割合が低下した.以上の結果から,グルココルチコイドは1型ヘルパーT細胞の分化を抑制し,2型ヘルパーT細胞の分化を促進することが確認された.
ヘルパーT細胞から産生されるインターロイキン4はB細胞の応答を補助し抗体の産生を促進する.マウスをオボアルブミンで免疫し抗体を産生させたところ,野生型のマウスにおいては夜間に免疫すると昼間に免疫したときに比べ,濾胞性ヘルパーT細胞,胚中心B細胞,クラススイッチを起こしたB細胞の数がより多く存在した.また,インターロイキン4に依存して産生される免疫グロブリンG1および免疫グロブリンG2bの血清中の量は夜間に免疫したほうが多く昼間に免疫したほうが少なかったことから,抗体の産生能も日内変動することがわかった.一方,T細胞に特異的なグルココルチコイド受容体ノックアウトマウスにおいては,夜間に免疫したときと昼間に免疫したときとで免疫応答に差はなかった.以上の結果から,グルココルチコイド受容体およびインターロイキン7受容体によりひき起こされる脾臓へのT細胞の集積により,夜間における強い抗体の産生がひき起こされることが明らかにされた.
パイエル板においては腸内細菌の刺激により恒常的に胚中心が形成されており,濾胞性ヘルパーT細胞および胚中心B細胞が検出される.一方,T細胞に特異的なグルココルチコイド受容体ノックアウトマウスにおいてはこれらの細胞の数が減少していた.この結果から,グルココルチコイドはパイエル板における抗体の産生を促進し,腸管における感染防御に関与すると考えられた.
インターロイキン7受容体はメモリーT細胞の維持にも重要なはたらきをする8,9).グルココルチコイド受容体により発現が誘導されるインターロイキン7受容体がメモリーT細胞の生存にも寄与するかどうかを確かめるため,試験管内で分化させた2型ヘルパーT細胞をマウスに移入しメモリー2型ヘルパーT細胞に分化させた.野生型のマウスのメモリー2型ヘルパーT細胞は,インターロイキン7受容体の発現が夜間に高く昼間に低いという日内変動を示した.一方,T細胞に特異的なグルココルチコイド受容体ノックアウトマウス,および,グルココルチコイド応答配列に点変異を導入したマウスのメモリー2型ヘルパーT細胞においては,インターロイキン7受容体の発現は低下し日内変動も消失した.さらに,メモリー2型ヘルパーT細胞の数も減少し,インターロイキン7受容体の発現の低下のため生存が障害されたと考えられた.以上の結果から,グルココルチコイドはインターロイキン7受容体の発現の誘導を介してメモリーT細胞の維持を促進することが明らかにされた.
おわりに
今回の研究により,生体において生理的な濃度のグルココルチコイドはT細胞におけるインターロイキン7受容体およびCXCR4の発現を誘導することによりT細胞の生存を促進し,T細胞の体内分布および免疫応答の日内変動をひき起こすことにより免疫応答を高めるはたらきをもつことが明らかにされた(図2).ヒトにおいては昼間,マウスにおいては夜間という,活動期の時間帯に免疫応答能が高まることになり,外界からの感染のリスクに備えるものと考えられる.このことから,規則的な生活によるグルココルチコイドの周期的な分泌は効率的な免疫応答をひき起こし,逆に,不規則な生活によるグルココルチコイドの分泌の乱れは免疫力の低下をもたらし,細菌やウイルスの感染のリスクが上昇する可能性が示唆される.今後は,気管支喘息などのアレルギーや関節リウマチなどの自己免疫疾患の症状と日内変動の関係性について,さらなる研究に発展することが期待される.
文 献
- Ashwell, J. D., Lu, F. W. M. & Vacchio, M. S.: Glucocorticoids in T cell development and function. Annu. Rev. Immunol., 18, 309-345 (2000)[PubMed]
- Curtis, A. M., Bellet, M. M., Sassone-Corsi, P. et al.: Circadian clock proteins and immunity. Immunity, 40, 178-186 (2014)[PubMed]
- Druzd, D., Matveeva, O., Ince, L. et al.: Lymphocyte circadian clocks control lymph node trafficking and adaptive immune responses. Immunity, 46, 120-132 (2017)[PubMed]
- Suzuki, K., Hayano, Y., Nakai, A. et al.: Adrenergic control of the adaptive immune response by diurnal lymphocyte recirculation through lymph nodes. J. Exp. Med., 213, 2567-2574 (2016)[PubMed]
- Lee, H. C., Shibata, H., Ogawa, S. et al.: Transcriptional regulation of the mouse IL-7 receptor α promoter by glucocorticoid receptor. J. Immunol., 174, 7800-7806 (2005)[PubMed]
- Abe, A., Tani-ichi, S., Shitara, S. et al.: An enhancer of the IL-7 receptor αchain locus controls IL-7 receptor expression and maintenance of peripheral T cells. J. Immunol., 195, 3129-3138 (2015)[PubMed]
- Elenkov, I. J.: Glucocorticoids and the Th1/Th2 balance. Ann. N. Y. Acad. Sci., 1024, 138-146 (2004)[PubMed]
- Kondrack, R. M., Harbertson, J., Tan, J. T. et al.: Interleukin 7 regulates the survival and generation of memory CD4 cells. J. Exp. Med., 198, 1797-1806 (2003)[PubMed]
- Schluns, K. S., Kieper, W. C., Jameson, S. C. et al.: Interleukin-7 mediates the homeostasis of naive and memory CD8 T cells in vivo. Nat. Immunol., 1, 426-432 (2000)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:京都大学ウイルス・再生医科学研究所 研究員.
研究テーマ:内分泌系と免疫系との相互作用.
生田 宏一(Koichi Ikuta)
京都大学ウイルス・再生医科学研究所 教授.
研究室URL:http://www.infront.kyoto-u.ac.jp/ex_ivr/Lab/Ikuta-Lab/
© 2018 榛葉旭恒・生田宏一 Licensed under CC 表示 2.1 日本