凸凹戦略によりデザインした人工オーキシンと受容体のペアにより植物のオーキシンシグナル伝達経路をハイジャックする
打田直行・高橋宏二・萩原伸也・鳥居啓子
(名古屋大学トランスフォーマティブ生命分子研究所)
email:打田直行,高橋宏二,萩原伸也,鳥居啓子
DOI: 10.7875/first.author.2018.016
Chemical hijacking of auxin signaling with an engineered auxin-TIR1 pair.
Naoyuki Uchida, Koji Takahashi, Rie Iwasaki, Ryotaro Yamada, Masahiko Yoshimura, Takaho A. Endo, Seisuke Kimura, Hua Zhang, Mika Nomoto, Yasuomi Tada, Toshinori Kinoshita, Kenichiro Itami, Shinya Hagihara, Keiko U. Torii
Nature Chemical Biology, 14, 299-305 (2018)
オーキシンはこれまでもっとも研究されてきた植物ホルモンであるが,その作用の多彩さのため,ひとつひとつの作用を厳密に区別して解析することは困難である.ねらった作用のみを解析するには,その作用の発揮に必要となる細胞種のみでオーキシンのシグナルを操作することが望ましいが,これまで,それを実現するツールは開発されていなかった.この研究において,筆者らは,植物に対する生理作用をもたない人工オーキシンと,その人工オーキシンを認識してシグナルを惹起する改変型のオーキシン受容体との組合せを,オーキシン受容体のオーキシン結合ポケットにおける凸凹を再構成する方法論により開発した.さらに,この人工オーキシンと受容体のペアを活用することにより,オーキシンの研究において長年の論争になってきた,酸成長とよばれるオーキシンによりひき起こされる植物組織の急速な成長を仲介するオーキシン受容体を同定した.
主要な植物ホルモンのひとつであるオーキシンは,これまでもっとも多く研究されてきた植物ホルモンであるのと同時に,その生理作用の多彩さから扱いのむずかしい植物ホルモンでもある1,2).植物のどの現象を対象として研究していてもオーキシンがかかわってくるといわれるなど,オーキシンはあらゆる組織あるいは細胞種において作用を発揮するといっても過言ではなく,そのため,従来の解析法によりオーキシンの作用のひとつひとつを個別に解析することには限界が生じている.たとえば,オーキシンの作用を遺伝学的に解析するにはオーキシン受容体をノックアウトしてその表現型を解析することが重要になるが,オーキシン受容体は冗長性が高く,たとえば,双子葉類のモデル植物であるシロイヌナズナには類似した6個の遺伝子が存在し核において機能する受容体ファミリーを構成するなど3),ひとつの遺伝子のノックアウトでは明確な表現型が現われない.逆に,多重変異体は植物体に多面的な異常が生じるので,目的とする現象にだけ特化して厳密に解析するのは困難である.また,オーキシンを添加する実験においても,ただ添加するだけではさまざまな組織の多様な応答が同時にひき起こされるため,目的とする応答だけを解析することはむずかしい.この状況を打破するには,オーキシンにより惹起されるシグナル伝達経路を従来の手法にはないかたちで自在に操作する新しい技術の開発が必要である.この研究において,筆者らは,そもそも植物にはなんの応答もひき起こさない人工オーキシンと,その人工オーキシンを認識してシグナルを惹起する改変型オーキシン受容体のペアの創成した.
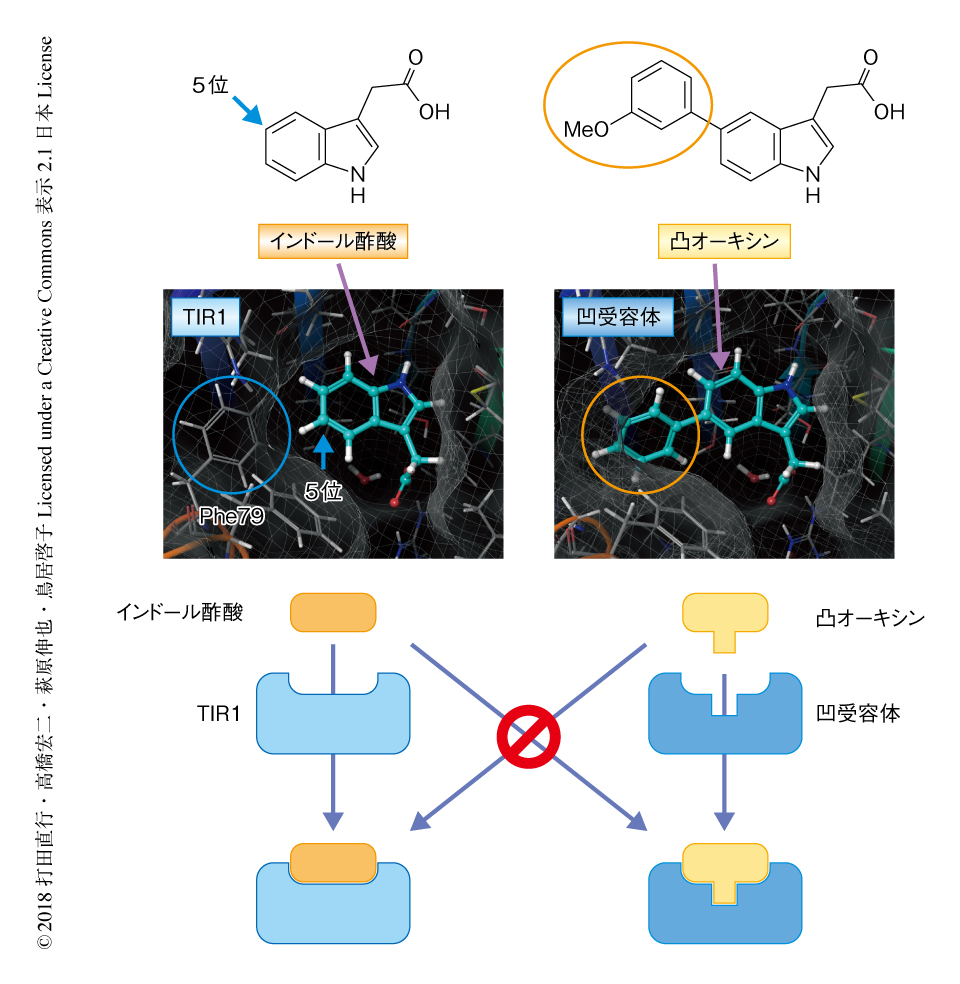
以前に,シロイヌナズナのオーキシン受容体ファミリーのひとつであるTIR1と,内在性のオーキシンであるインドール酢酸との複合体のX線結晶構造が報告されている4).そこで,このTIR1のオーキシン結合ポケットの構造情報をもとに,TIR1とは結合しない人工オーキシンと,インドール酢酸とは結合しないがその人工オーキシンとは結合する改変型のTIR1のデザインを試みた(図1).まず,野生型のTIR1のPhe79の芳香環がインドール酢酸のインドール環のすぐ横に位置することに注目した.この側鎖に芳香環をもつPhe79を側鎖をもたないGlyに置換すると,オーキシン結合ポケットが大きくなりインドール酢酸が結合しなくなると考えた.すなわち,Phe79をGlyに置換したTIR1(凹受容体)は内因性のインドール酢酸には応答しないと推測された.つぎに,この凹受容体と結合する人工オーキシンをデザインした.この際,インドール酢酸のインドール環の5位の位置に芳香環を導入すれば,凹受容体のオーキシン結合ポケットに結合する人工オーキシンになると考えた.この芳香環を付加したインドール酢酸(凸オーキシン)は,芳香環が野生型のTIR1のPhe79と立体的に干渉しオーキシン結合ポケットには収まらないと考えた.すなわち,凸オーキシンは野生型の植物に対しオーキシン活性を発揮しないことが期待された.
このデザインにもとづき,少しずつ違いのある芳香環を付加した7種類のインドール酢酸を合成し,そのなかから期待どおりのはたらきをする凸オーキシンを選抜することにした.野生型のTIR1および凹受容体に対する結合活性を,酵母ツーハイブリッド法,および,組換えタンパク質を用いたin vitro結合アッセイにより検定した結果,5-(3-メトキシフェニル)-インドール酢酸がもっとも理想的なはたらきを示した.すなわち,この凸オーキシンは,内因性のTIR1との結合活性は劇的に低下していたが凹受容体とは相互作用した.一方で,凹受容体は内因性のインドール酢酸とは結合活性を示さなかった.これらの結果から,この凹受容体と凸オーキシンのペアは,内因性のインドール酢酸とTIR1のペアに干渉することなく,オーキシンのシグナルを惹起させるツールになりうると考えられた(図1).
この凹受容体と凸オーキシンのペアが植物体においても想定どおりに作動するかどうかを調べるため,全身において凹受容体を発現する形質転換シロイヌナズナを用いた.野生型のシロイヌナズナを凸オーキシンにより処理してもオーキシン応答はひき起こされなかった.しかし,凹受容体を発現するシロイヌナズナを凸オーキシンにより処理したところ,根の伸長の阻害,植物の矮小化,側根の発生(根の枝分かれ)の促進など,野生型のシロイヌナズナをオーキシンにより処理した場合とまったく同じ影響が現われた.また,オーキシンがTIR1に作用するとその下流において転写活性が制御されることによりその作用が発揮されることがわかっていたことから5,6),RNA-seq法により遺伝子発現の変動を網羅的に解析した.その結果,凸オーキシンは凹受容体を発現するシロイヌナズナに対してのみ,オーキシンにより発現の誘導される遺伝子の発現をひき起こした.以上のことから,凹受容体と凸オーキシンのペアは,植物体においても想定どおりに内因性のオーキシンと同様のシグナル伝達経路を惹起すると結論された.
この凹受容体と凸オーキシンのペアを活用することにより,過去のオーキシンの研究において長年の論争になってきた謎に明確な答えをだすことに挑戦した.古くから,植物体をオーキシンにより処理すると数分以内に組織が急激に伸長を開始する現象が知られており,この現象は細胞外のpHの低下をともなうことから酸成長とよばれている7,8).この酸成長においては,その反応のすばやさから転写を介さない経路が中心的な役割をはたすという可能性が示唆されていたものの,明確な結論は得られていなかった.とくに,この現象をつかさどるオーキシン受容体に関しては,今回,この研究において扱った核に局在性のTIR1であるのか,それとも,細胞膜に存在する未同定のオーキシン受容体であるのか,議論の中心となってきた.そこで,凹受容体を発現するシロイヌナズナの芽生えの胚軸を凸オーキシンにより処理したところ,野生型のシロイヌナズナをオーキシンにより処理した場合と同様の,すばやい組織の伸長が起こった.この際には,従来から酸成長において観察されてきたような,細胞内から細胞外へとプロトンを排出する細胞膜結合型のプロトンポンプのすばやい活性化7) もともなっていた.これらの結果から,酸成長にはオーキシンがTIR1を介した経路を作動させることで十分であることが示され,酸成長をつかさどるオーキシン受容体の正体に関する議論にひとつの答えがだされた.
オーキシンはその作用の多彩さのためひとつひとつの作用を厳密に区別して解析することは困難であった.しかし,今回,開発された凹受容体をオーキシン応答の現場となる細胞種に特異的なプロモーターを用いて発現させれば,その植物体を凸オーキシンにより処理することで,着目した細胞において起こるおのおののオーキシン応答のみを解析することが可能になるだろう.また,オーキシンは着果の促進作用など農業において有用な効果ももつ.しかし,植物の全体を従来のオーキシン剤により処理すると,多様な効果が同時にひき起こされることにより生育への悪影響が生じてしまう.この悪影響を回避して有用な効果のみを発揮させるには,オーキシン剤を慎重かつていねいに該当する部位にだけ噴霧する作業が必要で,農業の現場において非常に大きな手間がかかっている.この問題に関しても,該当する部位あるいは細胞だけに凹受容体を発現させておけば,凸オーキシンを植物の全体に噴霧しても有用な効果だけを発揮させることができるだろう.今回,着目したTIR1のオーキシン結合ポケットのPhe(シロイヌナズナにおいては,Phe79)は,陸上植物の基部に位置するコケ類から単子葉類および双子葉類にいたるまで進化をつうじて保存されている.したがって,今回の方法論は植物種を問わずに適応が可能であると考えられ,今後はさまざまな植物種においてこの手法が活用されていくだろう.
この研究において扱ったTIR1はユビキチン化の制御を仲介するSCF複合体のサブユニットであり,オーキシンと結合したTIR1は特定のアミノ酸配列(植物に特有の短い配列で,デグロン配列とよばれる)をもつタンパク質と相互作用しその分解を促進することが知られている6).そこで,TIR1とデグロン配列を付加した目的のタンパク質を動物細胞に共発現させておき,そこにオーキシンを添加することにより目的のタンパク質の分解をひき起こして消失させるAID系(auxin-inducible degradation system)が報告されている9).今回の凹受容体と凸オーキシンのペアは,このAID系のひとつとして活用することも可能であろう.
以上のように,今回,開発に成功したツールは,今後,基礎科学および応用への展開の両面において大きく活用されることが期待される.
略歴:東京大学大学院薬学系研究科博士課程 修了,米国California大学Davis校 博士研究員,奈良先端科学技術大学院大学バイオサイエンス研究科 博士研究員,同 助教を経て,2013年より名古屋大学トランスフォーマティブ生命分子研究所 特任准教授.
研究テーマ:植物の成長および発生にかかわる分泌型の情報分子の解析および創成.
高橋 宏二(Koji Takahashi)
名古屋大学大学院理学研究科 助教.
萩原 伸也(Shinya Hagihara)
名古屋大学大学院理学研究科 准教授.
鳥居 啓子(Keiko U. Torii)
名古屋大学トランスフォーマティブ生命分子研究所 海外主任研究者,米国Washington大学 教授.
研究室URL:http://www.itbm.nagoya-u.ac.jp/ja/members/k-torii/
© 2018 打田直行・高橋宏二・萩原伸也・鳥居啓子 Licensed under CC 表示 2.1 日本
(名古屋大学トランスフォーマティブ生命分子研究所)
email:打田直行,高橋宏二,萩原伸也,鳥居啓子
DOI: 10.7875/first.author.2018.016
Chemical hijacking of auxin signaling with an engineered auxin-TIR1 pair.
Naoyuki Uchida, Koji Takahashi, Rie Iwasaki, Ryotaro Yamada, Masahiko Yoshimura, Takaho A. Endo, Seisuke Kimura, Hua Zhang, Mika Nomoto, Yasuomi Tada, Toshinori Kinoshita, Kenichiro Itami, Shinya Hagihara, Keiko U. Torii
Nature Chemical Biology, 14, 299-305 (2018)
要 約
オーキシンはこれまでもっとも研究されてきた植物ホルモンであるが,その作用の多彩さのため,ひとつひとつの作用を厳密に区別して解析することは困難である.ねらった作用のみを解析するには,その作用の発揮に必要となる細胞種のみでオーキシンのシグナルを操作することが望ましいが,これまで,それを実現するツールは開発されていなかった.この研究において,筆者らは,植物に対する生理作用をもたない人工オーキシンと,その人工オーキシンを認識してシグナルを惹起する改変型のオーキシン受容体との組合せを,オーキシン受容体のオーキシン結合ポケットにおける凸凹を再構成する方法論により開発した.さらに,この人工オーキシンと受容体のペアを活用することにより,オーキシンの研究において長年の論争になってきた,酸成長とよばれるオーキシンによりひき起こされる植物組織の急速な成長を仲介するオーキシン受容体を同定した.
はじめに
主要な植物ホルモンのひとつであるオーキシンは,これまでもっとも多く研究されてきた植物ホルモンであるのと同時に,その生理作用の多彩さから扱いのむずかしい植物ホルモンでもある1,2).植物のどの現象を対象として研究していてもオーキシンがかかわってくるといわれるなど,オーキシンはあらゆる組織あるいは細胞種において作用を発揮するといっても過言ではなく,そのため,従来の解析法によりオーキシンの作用のひとつひとつを個別に解析することには限界が生じている.たとえば,オーキシンの作用を遺伝学的に解析するにはオーキシン受容体をノックアウトしてその表現型を解析することが重要になるが,オーキシン受容体は冗長性が高く,たとえば,双子葉類のモデル植物であるシロイヌナズナには類似した6個の遺伝子が存在し核において機能する受容体ファミリーを構成するなど3),ひとつの遺伝子のノックアウトでは明確な表現型が現われない.逆に,多重変異体は植物体に多面的な異常が生じるので,目的とする現象にだけ特化して厳密に解析するのは困難である.また,オーキシンを添加する実験においても,ただ添加するだけではさまざまな組織の多様な応答が同時にひき起こされるため,目的とする応答だけを解析することはむずかしい.この状況を打破するには,オーキシンにより惹起されるシグナル伝達経路を従来の手法にはないかたちで自在に操作する新しい技術の開発が必要である.この研究において,筆者らは,そもそも植物にはなんの応答もひき起こさない人工オーキシンと,その人工オーキシンを認識してシグナルを惹起する改変型オーキシン受容体のペアの創成した.
1.凸凹戦略による人工オーキシンと受容体のペアのデザインおよび創成
以前に,シロイヌナズナのオーキシン受容体ファミリーのひとつであるTIR1と,内在性のオーキシンであるインドール酢酸との複合体のX線結晶構造が報告されている4).そこで,このTIR1のオーキシン結合ポケットの構造情報をもとに,TIR1とは結合しない人工オーキシンと,インドール酢酸とは結合しないがその人工オーキシンとは結合する改変型のTIR1のデザインを試みた(図1).まず,野生型のTIR1のPhe79の芳香環がインドール酢酸のインドール環のすぐ横に位置することに注目した.この側鎖に芳香環をもつPhe79を側鎖をもたないGlyに置換すると,オーキシン結合ポケットが大きくなりインドール酢酸が結合しなくなると考えた.すなわち,Phe79をGlyに置換したTIR1(凹受容体)は内因性のインドール酢酸には応答しないと推測された.つぎに,この凹受容体と結合する人工オーキシンをデザインした.この際,インドール酢酸のインドール環の5位の位置に芳香環を導入すれば,凹受容体のオーキシン結合ポケットに結合する人工オーキシンになると考えた.この芳香環を付加したインドール酢酸(凸オーキシン)は,芳香環が野生型のTIR1のPhe79と立体的に干渉しオーキシン結合ポケットには収まらないと考えた.すなわち,凸オーキシンは野生型の植物に対しオーキシン活性を発揮しないことが期待された.
このデザインにもとづき,少しずつ違いのある芳香環を付加した7種類のインドール酢酸を合成し,そのなかから期待どおりのはたらきをする凸オーキシンを選抜することにした.野生型のTIR1および凹受容体に対する結合活性を,酵母ツーハイブリッド法,および,組換えタンパク質を用いたin vitro結合アッセイにより検定した結果,5-(3-メトキシフェニル)-インドール酢酸がもっとも理想的なはたらきを示した.すなわち,この凸オーキシンは,内因性のTIR1との結合活性は劇的に低下していたが凹受容体とは相互作用した.一方で,凹受容体は内因性のインドール酢酸とは結合活性を示さなかった.これらの結果から,この凹受容体と凸オーキシンのペアは,内因性のインドール酢酸とTIR1のペアに干渉することなく,オーキシンのシグナルを惹起させるツールになりうると考えられた(図1).
2.人工オーキシンと受容体のペアの植物体における検証
この凹受容体と凸オーキシンのペアが植物体においても想定どおりに作動するかどうかを調べるため,全身において凹受容体を発現する形質転換シロイヌナズナを用いた.野生型のシロイヌナズナを凸オーキシンにより処理してもオーキシン応答はひき起こされなかった.しかし,凹受容体を発現するシロイヌナズナを凸オーキシンにより処理したところ,根の伸長の阻害,植物の矮小化,側根の発生(根の枝分かれ)の促進など,野生型のシロイヌナズナをオーキシンにより処理した場合とまったく同じ影響が現われた.また,オーキシンがTIR1に作用するとその下流において転写活性が制御されることによりその作用が発揮されることがわかっていたことから5,6),RNA-seq法により遺伝子発現の変動を網羅的に解析した.その結果,凸オーキシンは凹受容体を発現するシロイヌナズナに対してのみ,オーキシンにより発現の誘導される遺伝子の発現をひき起こした.以上のことから,凹受容体と凸オーキシンのペアは,植物体においても想定どおりに内因性のオーキシンと同様のシグナル伝達経路を惹起すると結論された.
3.酸成長を仲介するオーキシン受容体がTIR1であることの実証
この凹受容体と凸オーキシンのペアを活用することにより,過去のオーキシンの研究において長年の論争になってきた謎に明確な答えをだすことに挑戦した.古くから,植物体をオーキシンにより処理すると数分以内に組織が急激に伸長を開始する現象が知られており,この現象は細胞外のpHの低下をともなうことから酸成長とよばれている7,8).この酸成長においては,その反応のすばやさから転写を介さない経路が中心的な役割をはたすという可能性が示唆されていたものの,明確な結論は得られていなかった.とくに,この現象をつかさどるオーキシン受容体に関しては,今回,この研究において扱った核に局在性のTIR1であるのか,それとも,細胞膜に存在する未同定のオーキシン受容体であるのか,議論の中心となってきた.そこで,凹受容体を発現するシロイヌナズナの芽生えの胚軸を凸オーキシンにより処理したところ,野生型のシロイヌナズナをオーキシンにより処理した場合と同様の,すばやい組織の伸長が起こった.この際には,従来から酸成長において観察されてきたような,細胞内から細胞外へとプロトンを排出する細胞膜結合型のプロトンポンプのすばやい活性化7) もともなっていた.これらの結果から,酸成長にはオーキシンがTIR1を介した経路を作動させることで十分であることが示され,酸成長をつかさどるオーキシン受容体の正体に関する議論にひとつの答えがだされた.
おわりに
オーキシンはその作用の多彩さのためひとつひとつの作用を厳密に区別して解析することは困難であった.しかし,今回,開発された凹受容体をオーキシン応答の現場となる細胞種に特異的なプロモーターを用いて発現させれば,その植物体を凸オーキシンにより処理することで,着目した細胞において起こるおのおののオーキシン応答のみを解析することが可能になるだろう.また,オーキシンは着果の促進作用など農業において有用な効果ももつ.しかし,植物の全体を従来のオーキシン剤により処理すると,多様な効果が同時にひき起こされることにより生育への悪影響が生じてしまう.この悪影響を回避して有用な効果のみを発揮させるには,オーキシン剤を慎重かつていねいに該当する部位にだけ噴霧する作業が必要で,農業の現場において非常に大きな手間がかかっている.この問題に関しても,該当する部位あるいは細胞だけに凹受容体を発現させておけば,凸オーキシンを植物の全体に噴霧しても有用な効果だけを発揮させることができるだろう.今回,着目したTIR1のオーキシン結合ポケットのPhe(シロイヌナズナにおいては,Phe79)は,陸上植物の基部に位置するコケ類から単子葉類および双子葉類にいたるまで進化をつうじて保存されている.したがって,今回の方法論は植物種を問わずに適応が可能であると考えられ,今後はさまざまな植物種においてこの手法が活用されていくだろう.
この研究において扱ったTIR1はユビキチン化の制御を仲介するSCF複合体のサブユニットであり,オーキシンと結合したTIR1は特定のアミノ酸配列(植物に特有の短い配列で,デグロン配列とよばれる)をもつタンパク質と相互作用しその分解を促進することが知られている6).そこで,TIR1とデグロン配列を付加した目的のタンパク質を動物細胞に共発現させておき,そこにオーキシンを添加することにより目的のタンパク質の分解をひき起こして消失させるAID系(auxin-inducible degradation system)が報告されている9).今回の凹受容体と凸オーキシンのペアは,このAID系のひとつとして活用することも可能であろう.
以上のように,今回,開発に成功したツールは,今後,基礎科学および応用への展開の両面において大きく活用されることが期待される.
文 献
- Woodward, A. W. & Bartel, B.: Auxin: regulation, action, and interaction. Ann. Bot., 95, 707-735 (2005)[PubMed]
- Teale, W. D., Paponov, I. A. & Palme, K.: Auxin in action: signalling, transport and the control of plant growth and development. Nat. Rev. Mol. Cell Biol., 7, 847-859 (2006)[PubMed]
- Dharmasiri, N., Dharmasiri, S., Weijers, D. et al.: Plant development is regulated by a family of auxin receptor F box proteins. Dev. Cell, 9, 109-119 (2005)[PubMed]
- Tan, X., Calderon-Villalobos, L. I., Sharon, M. et al.: Mechanism of auxin perception by the TIR1 ubiquitin ligase. Nature, 446, 640-645 (2007)[PubMed]
- Abel, S. & Theologis, A.: Early genes and auxin action. Plant Physiol., 111, 9-17 (1996)[PubMed]
- Gray, W. M., Kepinski S., Rouse, D. et al.: Auxin regulates SCFTIR1-dependent degradation of Aux/IAA proteins. Nature, 414, 271-276 (2001)[PubMed]
- Takahashi, K., Hayashi, K. & Kinoshita, T.: Auxin activates the plasma membrane H+-ATPase by phosphorylation during hypocotyl elongation in Arabidopsis. Plant Physiol., 159, 632-641 (2012)[PubMed]
- Hager, A.: Role of the plasma membrane H+-ATPase in auxin-induced elongation growth: historical and new aspects. J. Plant Res., 116, 483-505 (2003)[PubMed]
- Nishimura, K., Fukagawa, T., Takisawa, H. et al.: An auxin-based degron system for the rapid depletion of proteins in nonplant cells. Nat. Methods, 6, 917-922 (2009)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:東京大学大学院薬学系研究科博士課程 修了,米国California大学Davis校 博士研究員,奈良先端科学技術大学院大学バイオサイエンス研究科 博士研究員,同 助教を経て,2013年より名古屋大学トランスフォーマティブ生命分子研究所 特任准教授.
研究テーマ:植物の成長および発生にかかわる分泌型の情報分子の解析および創成.
高橋 宏二(Koji Takahashi)
名古屋大学大学院理学研究科 助教.
萩原 伸也(Shinya Hagihara)
名古屋大学大学院理学研究科 准教授.
鳥居 啓子(Keiko U. Torii)
名古屋大学トランスフォーマティブ生命分子研究所 海外主任研究者,米国Washington大学 教授.
研究室URL:http://www.itbm.nagoya-u.ac.jp/ja/members/k-torii/
© 2018 打田直行・高橋宏二・萩原伸也・鳥居啓子 Licensed under CC 表示 2.1 日本