HP1との結合により形成される構成的なヘテロクロマチンの基盤となる構造
町田晋一1・滝沢由政2・Matthias Wolf 2・胡桃坂仁志1
(1早稲田大学大学院先進理工学研究科 電気・情報生命専攻構造生物学研究室,2沖縄科学技術大学院大学 生体分子電子顕微鏡解析ユニット)
email:胡桃坂仁志
DOI: 10.7875/first.author.2018.014
Structural basis of heterochromatin formation by human HP1.
Shinichi Machida, Yoshimasa Takizawa, Masakazu Ishimaru, Yukihiko Sugita, Satoshi Sekine, Jun-ichi Nakayama, Matthias Wolf, Hitoshi Kurumizaka
Molecular Cell, 69, 385-397.e8 (2018)
染色体において不活性化した領域であるヘテロクロマチンは,セントロメアやテロメアなど染色体の機能ドメインの形成など,染色体の機能の制御において重要な役割をはたす.ヒストンH3のLys9のトリメチル化は構成的なヘテロクロマチンのエピジェネティックなマークとして知られ,構成的なヘテロクロマチンの主要な構成タンパク質であるHP1の集積をひき起こす.HP1がLys9のトリメチル化したヒストンH3を含むクロマチンと複合体を形成することにより構成的なヘテロクロマチンは形成されると考えられているが,その基盤となる構造は明らかにされていない.この研究において,筆者らは,HP1とLys9のトリメチル化したヒストンH3を含むジヌクレオソームとの複合体を試験管内において再構成し,クライオ電子顕微鏡を用いた単粒子解析法によりその立体構造を解明した.HP1とジヌクレオソームとの複合体において,二量体を形成したHP1はリンカーDNAにより連結された2つのヌクレオソームをブリッジするかたちで結合していた.また,リンカーDNAはHP1とは直接に結合しておらず,ほかのヘテロクロマチン構成タンパク質の結合が可能な状態になっていた.このような構造的な特徴はHP1のアイソフォームのあいだで共通していた.この研究により,HP1とLys9のトリメチル化したヒストンH3により形成される構成的なヘテロクロマチンの基盤となる構造が明らかにされた.
真核生物のゲノムDNAはクロマチンを形成することにより高度に折りたたまれて核に収納される.クロマチンの基本単位はヌクレオソームとよばれる構造であり,ヒストンH2A,ヒストンH2B,ヒストンH3,ヒストンH4からなるヒストン八量体にDNAが巻きつき形成される1).ヒストンはさまざまな化学修飾をうけることにより多様な構造をもつクロマチンの形成に寄与する.ヒストンH3のLys9トリメチル化は,細胞の種類や分化の状態に依存しない,構成的なヘテロクロマチンにおける主要なエピジェネティックなマークとして知られている.構成的なヘテロクロマチンの主要な構成タンパク質であるHP1は,Lys9がトリメチル化されたヒストンH3を含むヌクレオソームと結合することにより構成的なヘテロクロマチンの基盤となる構造を形成する2-5).HP1はクロモシャドウドメインを介して二量体を形成し,クロモドメインを介してヒストンH3のLys9のトリメチル化を認識してヌクレオソームと結合する4,5).現在まで,ヘテロクロマチンにおけるHP1のヌクレオソームへの結合のモデルがいくつか提唱されている.代表的なモデルとして,HP1二量体がひとつのヌクレオソームの2つのヒストンH3のLys9のトリメチル化と結合するモデル,HP1二量体がとなりあったヌクレオソームのそれぞれのヒストンH3のLys9のトリメチル化と2つのヌクレオソームをブリッジするかたちで結合するモデル,HP1二量体がクロモシャドウドメインを介してヌクレオソームのヒストンH3のN末端ヘリックスと結合するモデル,などがあげられる4,5).しかし,決定的な証拠が得られていないため,ヘテロクロマチンにおけるHP1のヌクレオソームへの結合様式は不明であった.この研究において,筆者らは,HP1とヒストンH3のLys9のトリメチル化を含むジヌクレオソームとの複合体を試験管内に再構成し,クライオ電子顕微鏡を用いた単粒子解析法によりその立体構造を明らかにした.
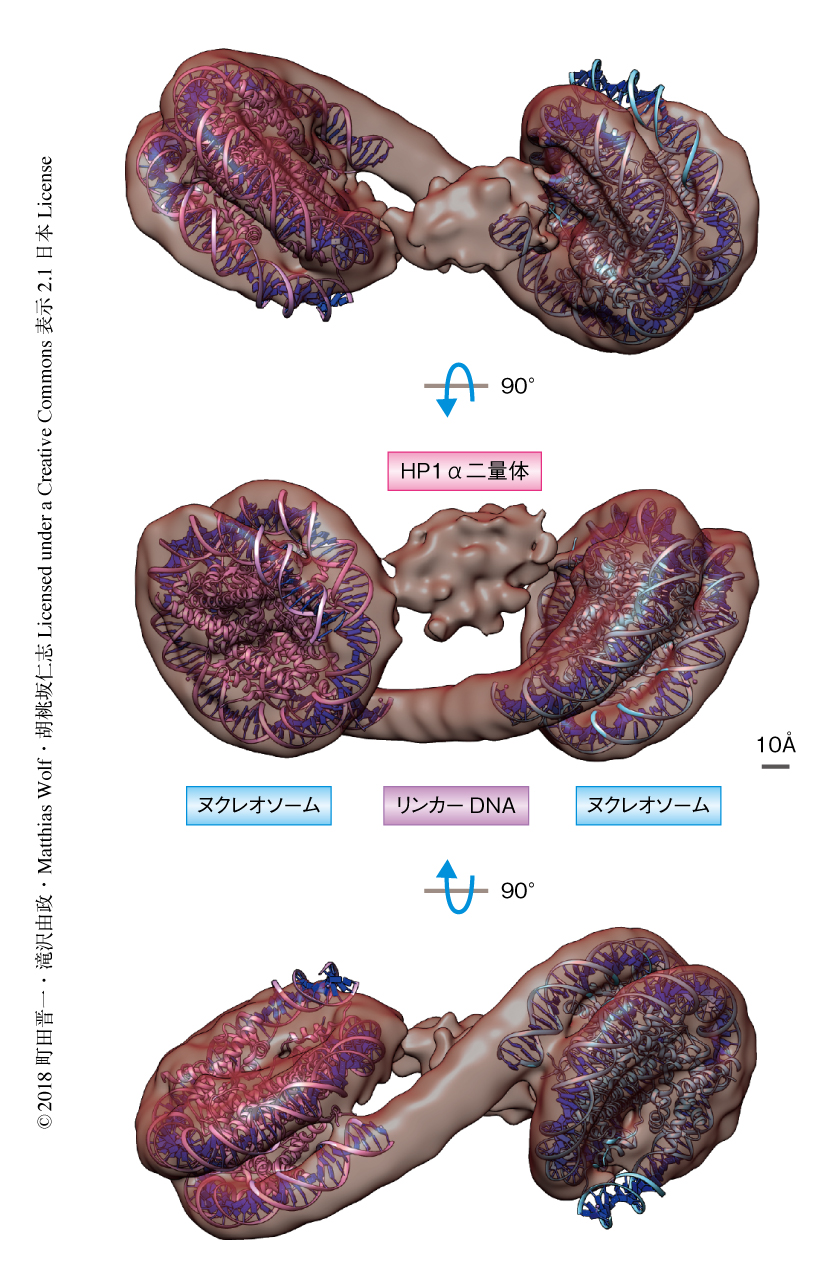
ヒトのヒストンH3.2においてLys9をCysに置換およびCys110をAlaに置換した変異体を組換えタンパク質として高純度に精製したのち,Cys9を化学的に修飾することによりヒストンH3のLys9のトリメチル化を模倣したヒストンH3を調製した.それにくわえ,組換えタンパク質として精製したヒトに由来するヒストンH2A,ヒストンH2B,ヒストンH4を用いてヒストン八量体を再構成した.さらに,ヌクレオソームポジショニング配列である601配列を15 bpのリンカーDNAにより連結したDNAを用いて,ヒストン八量体の存在下において塩透析法によりジヌクレオソームを再構成した.このジヌクレオソームを,HP1のアイソフォームのうちヘテロクロマチンにもっとも豊富に局在するHP1αと混合し複合体を調製した.HP1αとジヌクレオソームとの複合体は,スクロース密度勾配遠心法とグルタルアルデヒドによる化学架橋を組み合わせたGraFix法6) により精製した.精製されたHP1αとジヌクレオソームとの複合体をクライオ電子顕微鏡法により撮影し,得られた画像の単粒子解析によりその立体構造を決定した(図1).
決定されたHP1αとジヌクレオソームとの複合体の立体構造から,HP1二量体は2つのヌクレオソームをブリッジするかたちで結合することが明らかにされた.また,複合体においてヌクレオソームどうしに相互作用はみられず,HP1αは2つのヌクレオソームのあいだに存在した.さらに,HP1αはDNAと相互作用することが知られているが,ヌクレオソームのあいだのリンカーDNAとは相互作用していなかった.複合体の立体構造において,HP1およびリンカーDNAは外側に露出していた.多くのヘテロクロマチン構成タンパク質がHP1やリンカーDNAと結合することが報告されているが2,3,7),このようなHP1およびリンカーDNAの立体構造における配置により,ヘテロクロマチン構成タンパク質の結合が可能になっていると考えられた.
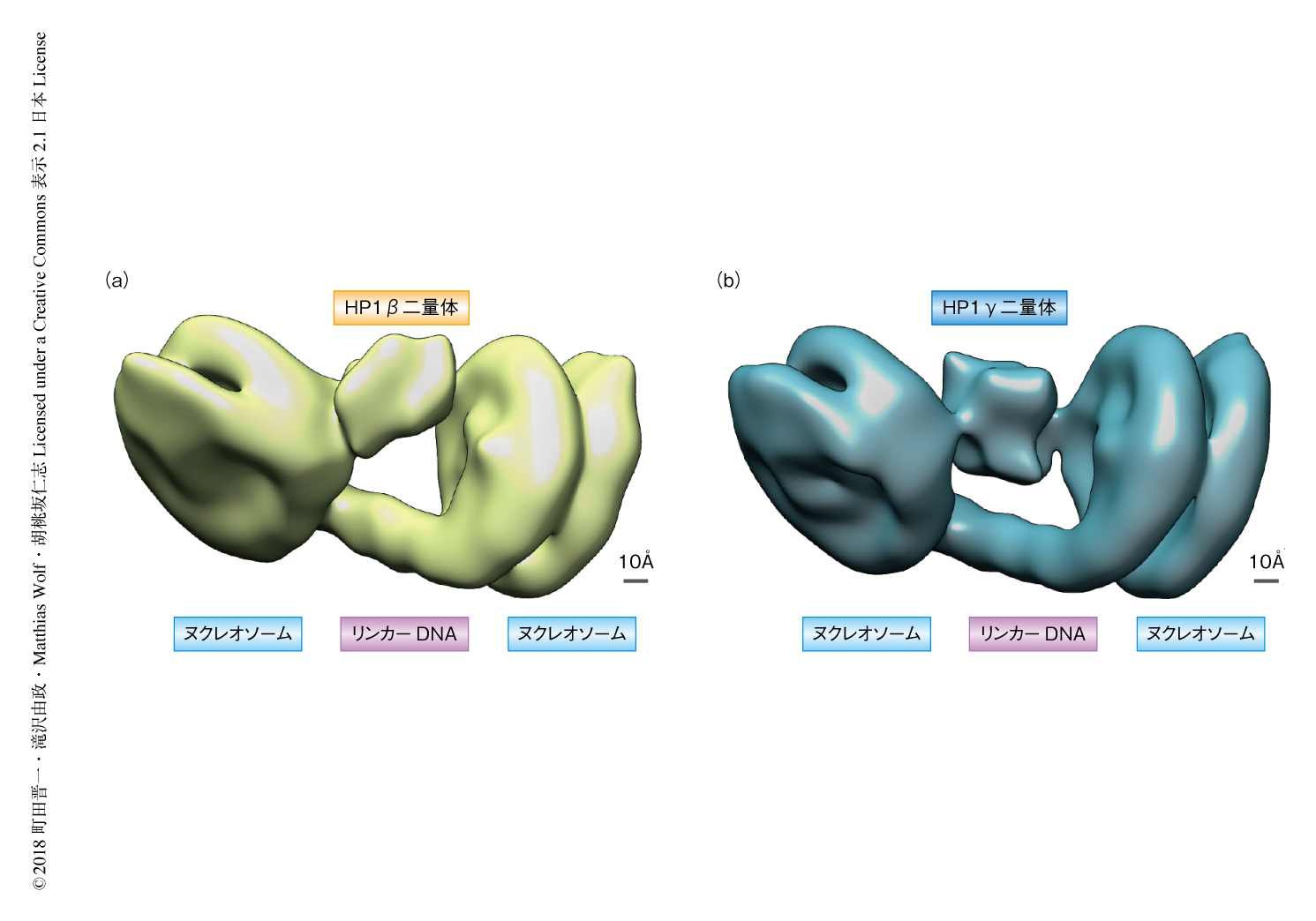
哺乳類のHP1にはクロモドメインおよびクロモシャドウドメインを共通にもつ3種類のアイソフォームとしてHP1α,HP1β,HP1γが存在する.そこで,HP1βあるいはHP1γとジヌクレオソームとの複合体をHP1αの場合と同様にGraFix法により調製し,それらの複合体の立体構造をクライオ電子顕微鏡による単粒子解析法により解析した(図2).その結果,HP1βおよびHP1γは,HP1αと同様に,2つのヌクレオソームをブリッジするかたちで結合することが明らかにされた.
HP1αとジヌクレオソームとの複合体の立体構造から,HP1αとリンカーDNAとは直接に相互作用していないことが見い出された.精製に用いたグルタルアルデヒドによりHP1αとリンカーDNAとの結合が阻害された可能性を排除するため,グルタルアルデヒドの非存在下において再構成したHP1αとジヌクレオソームとの複合体を用いて,DNA分解酵素に対するリンカーDNAの感受性について調べた.その結果,グルタルアルデヒドの非存在下においても,HP1αとリンカーDNAとは直接に相互作用していないことが示唆された.
リンカーDNAの長さがHP1αとリンカーDNAとの相互作用におよぼす影響について解析するため,48 bpあるいは58 bpのリンカーDNAをもつジヌクレオソームを再構成し,HP1αとジヌクレオソームとの複合体をGraFix法により調製した.クライオ電子顕微鏡像から,HP1αと48 bpあるいは58 bpのリンカーDNAをもつジヌクレオソームとの複合体においても,HP1αはリンカーDNAとは直接に相互作用していないことが示された.これらのリンカーDNAの長さは,ヒトのヘテロクロマチンにおけるリンカーDNAの長さに対応している8).これらの結果から,生理的な長さのリンカーDNAであっても,HP1αとジヌクレオソームとの複合体の構造の特徴は保持されると結論づけた.
クロマチンの構造を変換するタンパク質としてヌクレオソームリモデリングタンパク質が知られている.ヘテロクロマチンにおいても特異的にはたらくヌクレオソームリモデリングタンパク質が存在する.なかでも,ACFはヘテロクロマチンにおけるDNA複製に重要な役割をはたすことが報告されている9).そこで,試験管内において再構成したHP1αとジヌクレオソームとの複合体を用いて,ACFに依存的なヌクレオソームリモデリングについて生化学的に解析した.その結果,ACFはHP1αとジヌクレオソームとの複合体においてヌクレオソームを効率よくリモデリングすることがわかった.この結果は,これまでの報告とも矛盾せず,この研究において立体構造が解析されたHP1αとジヌクレオソームとの複合体は機能的な構造であることが支持された.
構成的なヘテロクロマチンはHP1とLys9のトリメチル化されたヒストンH3を含むヌクレオソームを基盤として形成されるが,その立体構造は不明であった.この研究においては,HP1とLys9のトリメチル化されたヒストンH3を含むクロマチンの立体構造をジヌクレオソームのレベルで解明することに成功した.HP1とジヌクレオソームとの複合体において,HP1二量体は2つのヌクレオソームをブリッジするかたちで結合することが明らかにされた.さらに,複合体においてHP1およびリンカーDNAはヘテロクロマチン構成タンパク質やリンカーヒストンであるヒストンH1の結合の足場となることが可能な状態であることがわかった.今後,この研究において明らかにされた構成的なヘテロクロマチンの立体構造をもとに,ヘテロクロマチンの形成および維持の機構が詳細に明らかにされ,ヘテロクロマチンによる染色体の機能の制御機構が解明されることが期待される.
略歴:2014年 早稲田大学大学院先進理工学研究科博士後期課程 修了,早稲田大学理工学術院 助教を経て,2017年よりフランスInstitute of Human Genetics博士研究員.
研究テーマ:クロマチンの構造解析.
滝沢 由政(Yoshimasa Takizawa)
沖縄科学技術大学院大学 グループリーダー.
Matthias Wolf
沖縄科学技術大学院大学 准教授.
胡桃坂 仁志(Hitoshi Kurumizaka)
早稲田大学理工学術院 教授.
研究室URL:http://www.eb.waseda.ac.jp/kurumizaka/
© 2018 町田晋一・滝沢由政・Matthias Wolf ・胡桃坂仁志 Licensed under CC 表示 2.1 日本
(1早稲田大学大学院先進理工学研究科 電気・情報生命専攻構造生物学研究室,2沖縄科学技術大学院大学 生体分子電子顕微鏡解析ユニット)
email:胡桃坂仁志
DOI: 10.7875/first.author.2018.014
Structural basis of heterochromatin formation by human HP1.
Shinichi Machida, Yoshimasa Takizawa, Masakazu Ishimaru, Yukihiko Sugita, Satoshi Sekine, Jun-ichi Nakayama, Matthias Wolf, Hitoshi Kurumizaka
Molecular Cell, 69, 385-397.e8 (2018)
要 約
染色体において不活性化した領域であるヘテロクロマチンは,セントロメアやテロメアなど染色体の機能ドメインの形成など,染色体の機能の制御において重要な役割をはたす.ヒストンH3のLys9のトリメチル化は構成的なヘテロクロマチンのエピジェネティックなマークとして知られ,構成的なヘテロクロマチンの主要な構成タンパク質であるHP1の集積をひき起こす.HP1がLys9のトリメチル化したヒストンH3を含むクロマチンと複合体を形成することにより構成的なヘテロクロマチンは形成されると考えられているが,その基盤となる構造は明らかにされていない.この研究において,筆者らは,HP1とLys9のトリメチル化したヒストンH3を含むジヌクレオソームとの複合体を試験管内において再構成し,クライオ電子顕微鏡を用いた単粒子解析法によりその立体構造を解明した.HP1とジヌクレオソームとの複合体において,二量体を形成したHP1はリンカーDNAにより連結された2つのヌクレオソームをブリッジするかたちで結合していた.また,リンカーDNAはHP1とは直接に結合しておらず,ほかのヘテロクロマチン構成タンパク質の結合が可能な状態になっていた.このような構造的な特徴はHP1のアイソフォームのあいだで共通していた.この研究により,HP1とLys9のトリメチル化したヒストンH3により形成される構成的なヘテロクロマチンの基盤となる構造が明らかにされた.
はじめに
真核生物のゲノムDNAはクロマチンを形成することにより高度に折りたたまれて核に収納される.クロマチンの基本単位はヌクレオソームとよばれる構造であり,ヒストンH2A,ヒストンH2B,ヒストンH3,ヒストンH4からなるヒストン八量体にDNAが巻きつき形成される1).ヒストンはさまざまな化学修飾をうけることにより多様な構造をもつクロマチンの形成に寄与する.ヒストンH3のLys9トリメチル化は,細胞の種類や分化の状態に依存しない,構成的なヘテロクロマチンにおける主要なエピジェネティックなマークとして知られている.構成的なヘテロクロマチンの主要な構成タンパク質であるHP1は,Lys9がトリメチル化されたヒストンH3を含むヌクレオソームと結合することにより構成的なヘテロクロマチンの基盤となる構造を形成する2-5).HP1はクロモシャドウドメインを介して二量体を形成し,クロモドメインを介してヒストンH3のLys9のトリメチル化を認識してヌクレオソームと結合する4,5).現在まで,ヘテロクロマチンにおけるHP1のヌクレオソームへの結合のモデルがいくつか提唱されている.代表的なモデルとして,HP1二量体がひとつのヌクレオソームの2つのヒストンH3のLys9のトリメチル化と結合するモデル,HP1二量体がとなりあったヌクレオソームのそれぞれのヒストンH3のLys9のトリメチル化と2つのヌクレオソームをブリッジするかたちで結合するモデル,HP1二量体がクロモシャドウドメインを介してヌクレオソームのヒストンH3のN末端ヘリックスと結合するモデル,などがあげられる4,5).しかし,決定的な証拠が得られていないため,ヘテロクロマチンにおけるHP1のヌクレオソームへの結合様式は不明であった.この研究において,筆者らは,HP1とヒストンH3のLys9のトリメチル化を含むジヌクレオソームとの複合体を試験管内に再構成し,クライオ電子顕微鏡を用いた単粒子解析法によりその立体構造を明らかにした.
1.HP1αとジヌクレオソームとの複合体の立体構造の決定
ヒトのヒストンH3.2においてLys9をCysに置換およびCys110をAlaに置換した変異体を組換えタンパク質として高純度に精製したのち,Cys9を化学的に修飾することによりヒストンH3のLys9のトリメチル化を模倣したヒストンH3を調製した.それにくわえ,組換えタンパク質として精製したヒトに由来するヒストンH2A,ヒストンH2B,ヒストンH4を用いてヒストン八量体を再構成した.さらに,ヌクレオソームポジショニング配列である601配列を15 bpのリンカーDNAにより連結したDNAを用いて,ヒストン八量体の存在下において塩透析法によりジヌクレオソームを再構成した.このジヌクレオソームを,HP1のアイソフォームのうちヘテロクロマチンにもっとも豊富に局在するHP1αと混合し複合体を調製した.HP1αとジヌクレオソームとの複合体は,スクロース密度勾配遠心法とグルタルアルデヒドによる化学架橋を組み合わせたGraFix法6) により精製した.精製されたHP1αとジヌクレオソームとの複合体をクライオ電子顕微鏡法により撮影し,得られた画像の単粒子解析によりその立体構造を決定した(図1).
2.HP1αとジヌクレオソームとの複合体の立体構造の特徴
決定されたHP1αとジヌクレオソームとの複合体の立体構造から,HP1二量体は2つのヌクレオソームをブリッジするかたちで結合することが明らかにされた.また,複合体においてヌクレオソームどうしに相互作用はみられず,HP1αは2つのヌクレオソームのあいだに存在した.さらに,HP1αはDNAと相互作用することが知られているが,ヌクレオソームのあいだのリンカーDNAとは相互作用していなかった.複合体の立体構造において,HP1およびリンカーDNAは外側に露出していた.多くのヘテロクロマチン構成タンパク質がHP1やリンカーDNAと結合することが報告されているが2,3,7),このようなHP1およびリンカーDNAの立体構造における配置により,ヘテロクロマチン構成タンパク質の結合が可能になっていると考えられた.
3.HP1βあるいはHP1γとジヌクレオソームとの複合体の立体構造
哺乳類のHP1にはクロモドメインおよびクロモシャドウドメインを共通にもつ3種類のアイソフォームとしてHP1α,HP1β,HP1γが存在する.そこで,HP1βあるいはHP1γとジヌクレオソームとの複合体をHP1αの場合と同様にGraFix法により調製し,それらの複合体の立体構造をクライオ電子顕微鏡による単粒子解析法により解析した(図2).その結果,HP1βおよびHP1γは,HP1αと同様に,2つのヌクレオソームをブリッジするかたちで結合することが明らかにされた.
4.HP1αとジヌクレオソームとの複合体においてリンカーDNAは溶媒に露出する
HP1αとジヌクレオソームとの複合体の立体構造から,HP1αとリンカーDNAとは直接に相互作用していないことが見い出された.精製に用いたグルタルアルデヒドによりHP1αとリンカーDNAとの結合が阻害された可能性を排除するため,グルタルアルデヒドの非存在下において再構成したHP1αとジヌクレオソームとの複合体を用いて,DNA分解酵素に対するリンカーDNAの感受性について調べた.その結果,グルタルアルデヒドの非存在下においても,HP1αとリンカーDNAとは直接に相互作用していないことが示唆された.
リンカーDNAの長さがHP1αとリンカーDNAとの相互作用におよぼす影響について解析するため,48 bpあるいは58 bpのリンカーDNAをもつジヌクレオソームを再構成し,HP1αとジヌクレオソームとの複合体をGraFix法により調製した.クライオ電子顕微鏡像から,HP1αと48 bpあるいは58 bpのリンカーDNAをもつジヌクレオソームとの複合体においても,HP1αはリンカーDNAとは直接に相互作用していないことが示された.これらのリンカーDNAの長さは,ヒトのヘテロクロマチンにおけるリンカーDNAの長さに対応している8).これらの結果から,生理的な長さのリンカーDNAであっても,HP1αとジヌクレオソームとの複合体の構造の特徴は保持されると結論づけた.
5.HP1とジヌクレオソームとの複合体はヌクレオソームリモデリングタンパク質により再編成される
クロマチンの構造を変換するタンパク質としてヌクレオソームリモデリングタンパク質が知られている.ヘテロクロマチンにおいても特異的にはたらくヌクレオソームリモデリングタンパク質が存在する.なかでも,ACFはヘテロクロマチンにおけるDNA複製に重要な役割をはたすことが報告されている9).そこで,試験管内において再構成したHP1αとジヌクレオソームとの複合体を用いて,ACFに依存的なヌクレオソームリモデリングについて生化学的に解析した.その結果,ACFはHP1αとジヌクレオソームとの複合体においてヌクレオソームを効率よくリモデリングすることがわかった.この結果は,これまでの報告とも矛盾せず,この研究において立体構造が解析されたHP1αとジヌクレオソームとの複合体は機能的な構造であることが支持された.
おわりに
構成的なヘテロクロマチンはHP1とLys9のトリメチル化されたヒストンH3を含むヌクレオソームを基盤として形成されるが,その立体構造は不明であった.この研究においては,HP1とLys9のトリメチル化されたヒストンH3を含むクロマチンの立体構造をジヌクレオソームのレベルで解明することに成功した.HP1とジヌクレオソームとの複合体において,HP1二量体は2つのヌクレオソームをブリッジするかたちで結合することが明らかにされた.さらに,複合体においてHP1およびリンカーDNAはヘテロクロマチン構成タンパク質やリンカーヒストンであるヒストンH1の結合の足場となることが可能な状態であることがわかった.今後,この研究において明らかにされた構成的なヘテロクロマチンの立体構造をもとに,ヘテロクロマチンの形成および維持の機構が詳細に明らかにされ,ヘテロクロマチンによる染色体の機能の制御機構が解明されることが期待される.
文 献
- Luger, K., Mader, A. W., Richmond, R. K. et al.: Crystal structure of the nucleosome core particle at 2.8Å resolution. Nature, 389, 251-260 (1997)[PubMed]
- Maison, C. & Almouzni, G.: HP1 and the dynamics of heterochromatin maintenance. Nat. Rev. Mol. Cell Biol., 5, 296-304 (2004)[PubMed]
- Grewal, S. I. & Jia, S.: Heterochromatin revisited. Nat. Rev. Genet., 8, 35-46 (2007)[PubMed]
- Canzio, D., Larson, A. & Narlikar, G. J.: Mechanisms of functional promiscuity by HP1 proteins. Trends Cell Biol., 24, 377-386 (2014)[PubMed]
- Nishibuchi, G. & Nakayama, J.: Biochemical and structural properties of heterochromatin protein 1: understanding its role in chromatin assembly. J. Biochem., 156, 11-20 (2014)[PubMed]
- Kastner, B., Fischer, N., Golas, M. M. et al.: GraFix: sample preparation for single-particle electron cryomicroscopy. Nat. Methods, 5, 53-55 (2008)[PubMed]
- Saksouk, N., Simboeck, E. & Dejardin, J.: Constitutive heterochromatin formation and transcription in mammals. Epigenetics Chromatin, 8, 3 (2015)[PubMed]
- Valouev, A., Johnson, S. M., Boyd, S. D. et al.: Determinants of nucleosome organization in primary human cells. Nature, 474, 516-520 (2011)[PubMed]
- Collins, N., Poot, R. A., Kukimoto, I. et al.: An ACF1-ISWI chromatin-remodeling complex is required for DNA replication through heterochromatin. Nat. Genet., 32, 627-632 (2002)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2014年 早稲田大学大学院先進理工学研究科博士後期課程 修了,早稲田大学理工学術院 助教を経て,2017年よりフランスInstitute of Human Genetics博士研究員.
研究テーマ:クロマチンの構造解析.
滝沢 由政(Yoshimasa Takizawa)
沖縄科学技術大学院大学 グループリーダー.
Matthias Wolf
沖縄科学技術大学院大学 准教授.
胡桃坂 仁志(Hitoshi Kurumizaka)
早稲田大学理工学術院 教授.
研究室URL:http://www.eb.waseda.ac.jp/kurumizaka/
© 2018 町田晋一・滝沢由政・Matthias Wolf ・胡桃坂仁志 Licensed under CC 表示 2.1 日本