オートファジー受容体ALLO-1とTBK1ファミリーキナーゼIKKE-1による父性オルガネラの選択的な分解
佐藤美由紀1・佐藤 健2
(群馬大学生体調節研究所 1生体情報シグナル研究センター生体膜機能分野,2細胞構造分野)
email:佐藤美由紀
DOI: 10.7875/first.author.2018.009
The autophagy receptor ALLO-1 and the IKKE-1 kinase control clearance of paternal mitochondria in Caenorhabditis elegans.
Miyuki Sato, Katsuya Sato, Kotone Tomura, Hidetaka Kosako, Ken Sato
Nature Cell Biology, 20, 81-91 (2018)
線虫Caenorhabditis elegansの受精卵においては,精子に由来するミトコンドリアなど父性オルガネラがオートファジーにより選択的に分解される.この現象はアロファジーとよばれ,線虫においてはミトコンドリアDNAが母性遺伝するためのしくみにもなる.この研究において,筆者らは,アロファジーを制御する2つのタンパク質,ALLO-1およびIKKE-1を見い出した.allo-1変異体あるいはikke-1変異体においてアロファジーは起こらず,父性オルガネラの分解は強く阻害された.ALLO-1はオートファジー受容体に共通するLIR配列をもつ新規のタンパク質で,オートファゴソームの形成にさきだち父性オルガネラに局在したこと,また,LIR配列を介してLC3のホモログであるLGG-1と直接に結合したことから,アロファジーにおいて基質に対する選択性を規定するオートファジー受容体としてはたらくと考えられた.また,IKKE-1は哺乳類のTBK1やIKKεと相同性を示すTBK1ファミリーキナーゼであり,そのキナーゼ活性はアロファジーに必須であった.IKKE-1はALLO-1と結合し,また,ALLO-1のThr74はIKKE-1に依存的なリン酸化部位のひとつであった.この研究により,アロファジーにおける基質に特異的な分解のしくみがみえてきた.
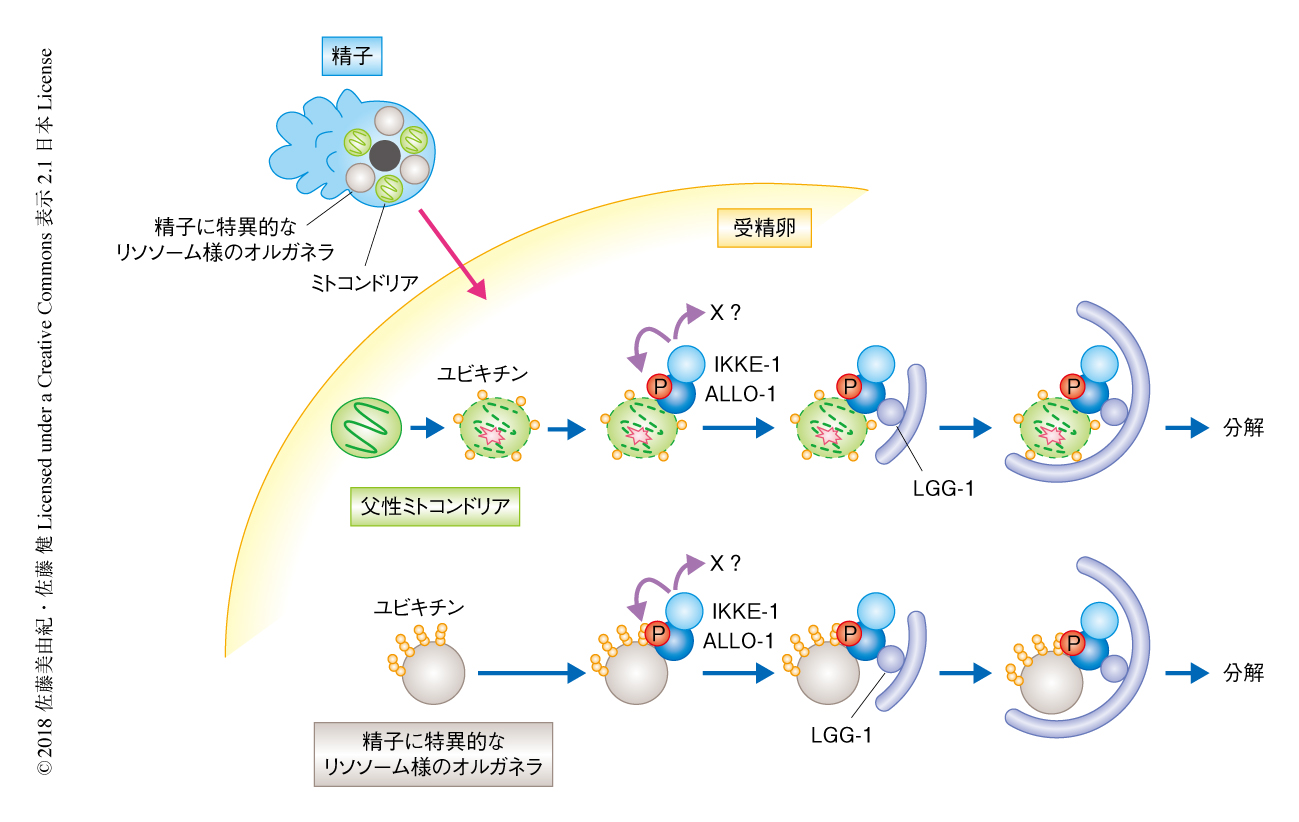
ミトコンドリアは細菌の共生を起源とするオルガネラであり,内部に独自のDNAをもつ.このミトコンドリアDNAには呼吸鎖を構成するタンパク質などミトコンドリアの機能に必須な遺伝子がコードされており,ヒトにおけるミトコンドリアDNAの変異は脳の機能や筋力の低下など深刻な症状をひき起こすミトコンドリア病などの原因になることが知られている.ミトコンドリアDNAは多くの生物において母性遺伝するが,そのくわしいしくみは長いあいだ不明であった1).筆者らは,線虫Caenorhabditis elegansを用いてこの問題の解明を試みてきた.その結果,精子から受精卵にもち込まれた父性ミトコンドリアがオートファジーにより選択的に分解されることが明らかにされ,この分解がミトコンドリアDNAの母性遺伝のしくみであることが示された2,3).そののち,父性ミトコンドリアのオートファジーによる分解はショウジョウバエやマウスにおいても保存されていることが示唆された4).線虫の受精卵においては,精子に特異的なリソソーム様のオルガネラ(membranous organelles:MOs)も父性ミトコンドリアとともにオートファジーにより分解されることから,筆者らは,この現象をアロファジー(allogeneic organelle autophagy:allophagy)と命名した.さらにこの研究において,筆者らは,アロファジーにおいて基質に対する選択性を規定するタンパク質を同定した.
選択的なオートファジーにおいては,オートファジー受容体(アダプター)とよばれるタンパク質が標的を認識し,その周囲にオートファゴソーム膜を形成させると考えられている5,6).代表的なオートファジー受容体であるp62/SQSTM1の線虫におけるホモログの変異体において,アロファジーへの影響は認められなかったことから,新たな因子の存在が考えられた.
一部の選択的なオートファジーにおいては,キナーゼによるオートファジー受容体のリン酸化が重要であると報告されている6).そこで,GFPとオートファゴソーム膜に局在するLC3のホモログであるLGG-1との融合タンパク質により標識された,父性オルガネラを含むオートファゴソーム(アロファゴソーム)の形成の異常を指標として,線虫のもつキナーゼに対し網羅的なRNAiスクリーニングを実施し,関連するキナーゼの同定を試みた.その結果,ikke-1遺伝子の発現を阻害することによりアロファゴソームの形成が強く阻害されることを見い出した.さらに,同様の表現型はikke-1変異体の受精卵においても確認された.ikke-1遺伝子がコードするIKKE-1は,哺乳類のIKKファミリーに属するTBK1やIKKεに相同性を示すTBK1ファミリーキナーゼである.TBK1やIKKεは哺乳類の自然免疫において重要な役割をはたすキナーゼであるが,それにくわえ,TBK1はサルモネラ菌の選択的なオートファジー(ゼノファジー)や不良なミトコンドリアのオートファジー(マイトファジー)においても機能しており,optineurinやNDP52といったオートファジー受容体をリン酸化することが報告されていた7-9).自然免疫のシグナル伝達経路は哺乳類と線虫とで保存性が低く,これまで,線虫におけるIKKE-1の機能についてはよくわかっていなかったが,IKKE-1は選択的なオートファジーにおいてはたらくことが明らかにされた.しかし,線虫においてoptineurinやNDP52はゲノム配列に保存されておらず,未知のオートファジー受容体の存在が予想された.そこで,IKKE-1と相互作用するタンパク質を酵母ツーハイブリッド法により探索し,さらに,アロファゴソームの形成を指標にした2次スクリーニングを実施したところ,新規のタンパク質が同定され,これをALLO-1と命名した.ALLO-1はゲノム配列において線虫類にのみ保存される,機能が未知のタンパク質であったが,唯一の機能ドメインとして,オートファジー受容体に共通しLC3と結合するするLIR(LC3-interatcing region)配列をもっていた.
ikke-1変異体とallo-1変異体はよく似た表現型を示し,1細胞期の胚においてアロファジーが起こらず,結果として,父性ミトコンドリアおよび精子に特異的なリソソーム様のオルガネラの分解が強く阻害された.さらに,ikke-1変異体およびallo-1変異体においては父方のミトコンドリアDNAが子世代にも検出されたことから,ミトコンドリアDNAの母性遺伝においても必要であることが確認された.さらに,IKKE-1とALLO-1との結合は受精卵を用いた免疫沈降によっても確認された.これらの結果から,IKKE-1とALLO-1は同じ経路においてパートナーとしてはたらくことが示唆された.一方で,64細胞期の胚において起こるオートファジーはikke-1変異体およびallo-1変異体においても起こったことから,IKKE-1およびALLO-1はアロファジーなど特定の経路においてはたらくと考えられた.
IKKE-1あるいはALLO-1を発現する組織について調べたところ,ともに卵母細胞において発現しており,変異体への入れ戻し実験においても卵母細胞における発現がアロファジーに十分であった.受精卵においては,IKKE-1およびALLO-1は受精ののちの非常に早いタイミングにおいてほぼ同時に父性オルガネラの周囲に集積し,IKKE-1およびALLO-1が集積したのちLGG-1が局在するようすが観察された.また,IKKE-1およびALLO-1の局在はunc-51/atg-1変異体においても起こったことから,IKKE-1およびALLO-1はオートファゴソーム膜の形成とは独立に標的となるオルガネラに局在化できることが確認された.
さらに,ALLO-1がオートファジー受容体として機能するかどうかを検証するため,そのLIR配列について解析した.まず,精製タンパク質を用いた結合実験から,ALLO-1はLIR配列に依存的にLGG-1と直接に結合することが明らかにされた.また,LIR配列に変異を導入した変異型ALLO-1は,父性オルガネラに局在するもののLGG-1をリクルートせず,アロファジーをひき起こす活性を失っていた.これらの結果から,ALLO-1はアロファジーにおけるオートファジー受容体であると結論した.
IKKE-1によるリン酸化の役割についても検討した.キナーゼ活性を失わせた変異型IKKE-1はアロファジーを起こさなくなったことから,IKKE-1のキナーゼ活性が必須であることが判明した.そこで,ALLO-1がIKKE-1の標的である可能性を考えた.受精卵の抽出液を用いたウェスタンブロット解析により,ALLO-1はリン酸化タンパク質であることが見い出された.さらに,質量分析により1カ所のリン酸化部位Thr74が同定され,そのリン酸化の率はikke-1変異体において部分的に低下していた.また,ALLO-1のThr74をAlaに置換したところそのリン酸化は減少し,allo-1変異体の相補活性も低下したことから,Thr74のリン酸化がALLO-1の機能に重要であることが示唆された.しかし一方で,Thr74をAlaに置換した変異体においてもこれらの表現型は部分的であったことから,Thr74にくわえ,ALLO-1あるいは別のタンパク質にさらにリン酸化の標的が存在すると考えられた.アロファジーのリン酸化による制御の全体像を明らかにするには,さらなる解析が必要である.
ALLO-1はどのように父性オルガネラを認識しているのであろうか? p62やoptineurinなど哺乳類の多くのオートファジー受容体は標的のユビキチン化を認識して局在する.アロファジーにおいても,精子に特異的なリソソーム様のオルガネラにはユビキチン鎖の集積が観察されていたことから,ユビキチン化の関与について検証した.ユビキチン化を制御する線虫における唯一のユビキチン活性化酵素であるUBA-1の機能を阻害したところ,ALLO-1の父性オルガネラへの局在は顕著に阻害された.それとは逆に,Hrs/Vps27のホモログであるHGRS-1の機能を阻害することにより人為的にユビキチン鎖をエンドソームの表面に蓄積させたところ,一部のエンドソームにALLO-1が局在し,さらに,そこにLGG-1も局在するようになった.このLGG-1の異所的な局在はALLO-1に依存しており,allo-1変異体においてエンドソームの表面にユビキチン鎖を蓄積させてもLGG-1の局在は起こらなかった.これらの結果から,ALLO-1はユビキチン化に依存的に標的に局在し,そこにLGG-1をリクルートする能力があると考えられた.また,精子に特異的なリソソーム様のオルガネラに比べると非常に少ないながらも,父性ミトコンドリアにもユビキチン鎖の集積が観察されたことから,父性オルガネラの認識にもユビキチン化が関与すると考えられた.しかし,精子に特異的なリソソーム様のオルガネラと父性ミトコンドリアのユビキチン化の程度には大きな差があったことから,父性ミトコンドリアについては,ユビキチン化にくわえALLO-1の局在を促進あるいは安定化させるための付加的な機構の存在する可能性もある.
この研究においては,アロファジーにおいてオートファジー受容体としてはたらくALLO-1が同定された.ALLO-1はLIR配列を除き既知のオートファジー受容体と配列における相同性を示さなかったものの,その機能はよく保存されていた.また,キナーゼによるオートファジー受容体の制御という点においても,アロファジーと哺乳類や酵母の選択的なオートファジーとは共通性のあることが明らかにされた.TBK1は自然免疫における重要なシグナルタンパク質であるが,ゼノファジーやマイトファジーなど選択的なオートファジーにおいても機能する.自然免疫のシグナル伝達経路は線虫と哺乳類とで保存性が低く,これまで,なぜ線虫にIKKE-1が存在するのかよくわかっていなかったが,選択的なオートファジーにおける役割はTBK1とIKKE-1とで共通しており,進化的にはこちらの機能がさきに生じたのではないかと推測された.
2017年,線虫の父性ミトコンドリアは受精ののち自発的に膜の構造が変性することが報告された10).今回の筆者らの結果をあわせると,そのような父性ミトコンドリアや不要になった精子に特異的なリソソーム様のオルガネラはユビキチン化により標識され,それをALLO-1が認識してオートファジーをひき起こす,というモデルが有力だと思われる(図1).不良なミトコンドリアのマイトファジーにおいてはPINK-1-Parkin経路を介したユビキチン化の制御が知られているが,PINK-1やParkinの線虫におけるホモログの変異体においてもアロファジーは起こる.父性ミトコンドリアおよび精子に特異的なリソソーム様のオルガネラとも,受精ののちのユビキチン化のしくみはいまだ不明であり,その解明は今後の大きな課題である.
略歴:東京大学大学院理学系研究科博士課程 修了,理化学研究所 博士研究員,米国Rutgers大学 博士研究員,群馬大学生体調節研究所 博士研究員などを経て,2013年より同 准教授.
研究テーマ:線虫の受精卵におけるオルガネラのバイオロジー.
研究室URL:http://makukinou.showa.gunma-u.ac.jp/index.html
佐藤 健(Ken Sato)
群馬大学生体調節研究所 教授.
研究室URL:http://traffic.dept.med.gunma-u.ac.jp/
© 2018 佐藤美由紀・佐藤 健 Licensed under CC 表示 2.1 日本
(群馬大学生体調節研究所 1生体情報シグナル研究センター生体膜機能分野,2細胞構造分野)
email:佐藤美由紀
DOI: 10.7875/first.author.2018.009
The autophagy receptor ALLO-1 and the IKKE-1 kinase control clearance of paternal mitochondria in Caenorhabditis elegans.
Miyuki Sato, Katsuya Sato, Kotone Tomura, Hidetaka Kosako, Ken Sato
Nature Cell Biology, 20, 81-91 (2018)
要 約
線虫Caenorhabditis elegansの受精卵においては,精子に由来するミトコンドリアなど父性オルガネラがオートファジーにより選択的に分解される.この現象はアロファジーとよばれ,線虫においてはミトコンドリアDNAが母性遺伝するためのしくみにもなる.この研究において,筆者らは,アロファジーを制御する2つのタンパク質,ALLO-1およびIKKE-1を見い出した.allo-1変異体あるいはikke-1変異体においてアロファジーは起こらず,父性オルガネラの分解は強く阻害された.ALLO-1はオートファジー受容体に共通するLIR配列をもつ新規のタンパク質で,オートファゴソームの形成にさきだち父性オルガネラに局在したこと,また,LIR配列を介してLC3のホモログであるLGG-1と直接に結合したことから,アロファジーにおいて基質に対する選択性を規定するオートファジー受容体としてはたらくと考えられた.また,IKKE-1は哺乳類のTBK1やIKKεと相同性を示すTBK1ファミリーキナーゼであり,そのキナーゼ活性はアロファジーに必須であった.IKKE-1はALLO-1と結合し,また,ALLO-1のThr74はIKKE-1に依存的なリン酸化部位のひとつであった.この研究により,アロファジーにおける基質に特異的な分解のしくみがみえてきた.
はじめに
ミトコンドリアは細菌の共生を起源とするオルガネラであり,内部に独自のDNAをもつ.このミトコンドリアDNAには呼吸鎖を構成するタンパク質などミトコンドリアの機能に必須な遺伝子がコードされており,ヒトにおけるミトコンドリアDNAの変異は脳の機能や筋力の低下など深刻な症状をひき起こすミトコンドリア病などの原因になることが知られている.ミトコンドリアDNAは多くの生物において母性遺伝するが,そのくわしいしくみは長いあいだ不明であった1).筆者らは,線虫Caenorhabditis elegansを用いてこの問題の解明を試みてきた.その結果,精子から受精卵にもち込まれた父性ミトコンドリアがオートファジーにより選択的に分解されることが明らかにされ,この分解がミトコンドリアDNAの母性遺伝のしくみであることが示された2,3).そののち,父性ミトコンドリアのオートファジーによる分解はショウジョウバエやマウスにおいても保存されていることが示唆された4).線虫の受精卵においては,精子に特異的なリソソーム様のオルガネラ(membranous organelles:MOs)も父性ミトコンドリアとともにオートファジーにより分解されることから,筆者らは,この現象をアロファジー(allogeneic organelle autophagy:allophagy)と命名した.さらにこの研究において,筆者らは,アロファジーにおいて基質に対する選択性を規定するタンパク質を同定した.
1.アロファジーを制御するIKKE-1およびALLO-1の同定
選択的なオートファジーにおいては,オートファジー受容体(アダプター)とよばれるタンパク質が標的を認識し,その周囲にオートファゴソーム膜を形成させると考えられている5,6).代表的なオートファジー受容体であるp62/SQSTM1の線虫におけるホモログの変異体において,アロファジーへの影響は認められなかったことから,新たな因子の存在が考えられた.
一部の選択的なオートファジーにおいては,キナーゼによるオートファジー受容体のリン酸化が重要であると報告されている6).そこで,GFPとオートファゴソーム膜に局在するLC3のホモログであるLGG-1との融合タンパク質により標識された,父性オルガネラを含むオートファゴソーム(アロファゴソーム)の形成の異常を指標として,線虫のもつキナーゼに対し網羅的なRNAiスクリーニングを実施し,関連するキナーゼの同定を試みた.その結果,ikke-1遺伝子の発現を阻害することによりアロファゴソームの形成が強く阻害されることを見い出した.さらに,同様の表現型はikke-1変異体の受精卵においても確認された.ikke-1遺伝子がコードするIKKE-1は,哺乳類のIKKファミリーに属するTBK1やIKKεに相同性を示すTBK1ファミリーキナーゼである.TBK1やIKKεは哺乳類の自然免疫において重要な役割をはたすキナーゼであるが,それにくわえ,TBK1はサルモネラ菌の選択的なオートファジー(ゼノファジー)や不良なミトコンドリアのオートファジー(マイトファジー)においても機能しており,optineurinやNDP52といったオートファジー受容体をリン酸化することが報告されていた7-9).自然免疫のシグナル伝達経路は哺乳類と線虫とで保存性が低く,これまで,線虫におけるIKKE-1の機能についてはよくわかっていなかったが,IKKE-1は選択的なオートファジーにおいてはたらくことが明らかにされた.しかし,線虫においてoptineurinやNDP52はゲノム配列に保存されておらず,未知のオートファジー受容体の存在が予想された.そこで,IKKE-1と相互作用するタンパク質を酵母ツーハイブリッド法により探索し,さらに,アロファゴソームの形成を指標にした2次スクリーニングを実施したところ,新規のタンパク質が同定され,これをALLO-1と命名した.ALLO-1はゲノム配列において線虫類にのみ保存される,機能が未知のタンパク質であったが,唯一の機能ドメインとして,オートファジー受容体に共通しLC3と結合するするLIR(LC3-interatcing region)配列をもっていた.
ikke-1変異体とallo-1変異体はよく似た表現型を示し,1細胞期の胚においてアロファジーが起こらず,結果として,父性ミトコンドリアおよび精子に特異的なリソソーム様のオルガネラの分解が強く阻害された.さらに,ikke-1変異体およびallo-1変異体においては父方のミトコンドリアDNAが子世代にも検出されたことから,ミトコンドリアDNAの母性遺伝においても必要であることが確認された.さらに,IKKE-1とALLO-1との結合は受精卵を用いた免疫沈降によっても確認された.これらの結果から,IKKE-1とALLO-1は同じ経路においてパートナーとしてはたらくことが示唆された.一方で,64細胞期の胚において起こるオートファジーはikke-1変異体およびallo-1変異体においても起こったことから,IKKE-1およびALLO-1はアロファジーなど特定の経路においてはたらくと考えられた.
2.IKKE-1およびALLO-1によるアロファジーの制御の機構
IKKE-1あるいはALLO-1を発現する組織について調べたところ,ともに卵母細胞において発現しており,変異体への入れ戻し実験においても卵母細胞における発現がアロファジーに十分であった.受精卵においては,IKKE-1およびALLO-1は受精ののちの非常に早いタイミングにおいてほぼ同時に父性オルガネラの周囲に集積し,IKKE-1およびALLO-1が集積したのちLGG-1が局在するようすが観察された.また,IKKE-1およびALLO-1の局在はunc-51/atg-1変異体においても起こったことから,IKKE-1およびALLO-1はオートファゴソーム膜の形成とは独立に標的となるオルガネラに局在化できることが確認された.
さらに,ALLO-1がオートファジー受容体として機能するかどうかを検証するため,そのLIR配列について解析した.まず,精製タンパク質を用いた結合実験から,ALLO-1はLIR配列に依存的にLGG-1と直接に結合することが明らかにされた.また,LIR配列に変異を導入した変異型ALLO-1は,父性オルガネラに局在するもののLGG-1をリクルートせず,アロファジーをひき起こす活性を失っていた.これらの結果から,ALLO-1はアロファジーにおけるオートファジー受容体であると結論した.
IKKE-1によるリン酸化の役割についても検討した.キナーゼ活性を失わせた変異型IKKE-1はアロファジーを起こさなくなったことから,IKKE-1のキナーゼ活性が必須であることが判明した.そこで,ALLO-1がIKKE-1の標的である可能性を考えた.受精卵の抽出液を用いたウェスタンブロット解析により,ALLO-1はリン酸化タンパク質であることが見い出された.さらに,質量分析により1カ所のリン酸化部位Thr74が同定され,そのリン酸化の率はikke-1変異体において部分的に低下していた.また,ALLO-1のThr74をAlaに置換したところそのリン酸化は減少し,allo-1変異体の相補活性も低下したことから,Thr74のリン酸化がALLO-1の機能に重要であることが示唆された.しかし一方で,Thr74をAlaに置換した変異体においてもこれらの表現型は部分的であったことから,Thr74にくわえ,ALLO-1あるいは別のタンパク質にさらにリン酸化の標的が存在すると考えられた.アロファジーのリン酸化による制御の全体像を明らかにするには,さらなる解析が必要である.
3.アロファジーにおけるユビキチン化の関与
ALLO-1はどのように父性オルガネラを認識しているのであろうか? p62やoptineurinなど哺乳類の多くのオートファジー受容体は標的のユビキチン化を認識して局在する.アロファジーにおいても,精子に特異的なリソソーム様のオルガネラにはユビキチン鎖の集積が観察されていたことから,ユビキチン化の関与について検証した.ユビキチン化を制御する線虫における唯一のユビキチン活性化酵素であるUBA-1の機能を阻害したところ,ALLO-1の父性オルガネラへの局在は顕著に阻害された.それとは逆に,Hrs/Vps27のホモログであるHGRS-1の機能を阻害することにより人為的にユビキチン鎖をエンドソームの表面に蓄積させたところ,一部のエンドソームにALLO-1が局在し,さらに,そこにLGG-1も局在するようになった.このLGG-1の異所的な局在はALLO-1に依存しており,allo-1変異体においてエンドソームの表面にユビキチン鎖を蓄積させてもLGG-1の局在は起こらなかった.これらの結果から,ALLO-1はユビキチン化に依存的に標的に局在し,そこにLGG-1をリクルートする能力があると考えられた.また,精子に特異的なリソソーム様のオルガネラに比べると非常に少ないながらも,父性ミトコンドリアにもユビキチン鎖の集積が観察されたことから,父性オルガネラの認識にもユビキチン化が関与すると考えられた.しかし,精子に特異的なリソソーム様のオルガネラと父性ミトコンドリアのユビキチン化の程度には大きな差があったことから,父性ミトコンドリアについては,ユビキチン化にくわえALLO-1の局在を促進あるいは安定化させるための付加的な機構の存在する可能性もある.
おわりに
この研究においては,アロファジーにおいてオートファジー受容体としてはたらくALLO-1が同定された.ALLO-1はLIR配列を除き既知のオートファジー受容体と配列における相同性を示さなかったものの,その機能はよく保存されていた.また,キナーゼによるオートファジー受容体の制御という点においても,アロファジーと哺乳類や酵母の選択的なオートファジーとは共通性のあることが明らかにされた.TBK1は自然免疫における重要なシグナルタンパク質であるが,ゼノファジーやマイトファジーなど選択的なオートファジーにおいても機能する.自然免疫のシグナル伝達経路は線虫と哺乳類とで保存性が低く,これまで,なぜ線虫にIKKE-1が存在するのかよくわかっていなかったが,選択的なオートファジーにおける役割はTBK1とIKKE-1とで共通しており,進化的にはこちらの機能がさきに生じたのではないかと推測された.
2017年,線虫の父性ミトコンドリアは受精ののち自発的に膜の構造が変性することが報告された10).今回の筆者らの結果をあわせると,そのような父性ミトコンドリアや不要になった精子に特異的なリソソーム様のオルガネラはユビキチン化により標識され,それをALLO-1が認識してオートファジーをひき起こす,というモデルが有力だと思われる(図1).不良なミトコンドリアのマイトファジーにおいてはPINK-1-Parkin経路を介したユビキチン化の制御が知られているが,PINK-1やParkinの線虫におけるホモログの変異体においてもアロファジーは起こる.父性ミトコンドリアおよび精子に特異的なリソソーム様のオルガネラとも,受精ののちのユビキチン化のしくみはいまだ不明であり,その解明は今後の大きな課題である.
文 献
- Sato, M. & Sato, K.: Maternal inheritance of mitochondrial DNA by diverse mechanisms to eliminate paternal mitochondrial DNA. Biochim. Biophys. Acta, 1833, 1979-1984 (2013)[PubMed]
- Sato, M. & Sato, K.: Degradation of paternal mitochondria by fertilization-triggered autophagy in C. elegans embryos. Science, 334, 1141-1144 (2011)[PubMed]
- Al Rawi, S., Louvet-Vallee, S., Djeddi, A. et al.: Postfertilization autophagy of sperm organelles prevents paternal mitochondrial DNA transmission. Science, 334, 1144-1147 (2011)[PubMed]
- Sato, K. & Sato, M.: Multiple ways to prevent transmission of paternal mitochondrial DNA for maternal iheritance in animals. J. Biochem., 162, 247-253 (2017)[PubMed]
- Mizushima, N. & Komatsu, M.: Autophagy: renovation of cells and tissues. Cell, 147, 728-741 (2011)[PubMed]
- Okamoto, K.: Organellophagy: eliminating cellular building blocks via selective autophagy. J. Cell Biol., 205, 435-445 (2014)[PubMed]
- Thurston, T. L., Ryzhakov, G., Bloor, S. et al.: The TBK1 adaptor and autophagy receptor NDP52 restricts the proliferation of ubiquitin-coated bacteria. Nat. Immunol., 10, 1215-1221 (2009)[PubMed]
- Wild, P., Farhan, H., McEwan, D. G. et al.: Phosphorylation of the autophagy receptor optineurin restricts Salmonella growth. Science, 333, 228-233 (2011)[PubMed]
- Lazarou, M., Sliter, D. A., Kane, L. A. et al.: The ubiquitin kinase PINK1 recruits autophagy receptors to induce mitophagy. Nature, 524, 309-314 (2015)[PubMed]
- Zhou, Q., Li, H., Li, H. et al.: Mitochondrial endonuclease G mediates breakdown of paternal mitochondria upon fertilization. Science, 353, 394-399 (2016)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:東京大学大学院理学系研究科博士課程 修了,理化学研究所 博士研究員,米国Rutgers大学 博士研究員,群馬大学生体調節研究所 博士研究員などを経て,2013年より同 准教授.
研究テーマ:線虫の受精卵におけるオルガネラのバイオロジー.
研究室URL:http://makukinou.showa.gunma-u.ac.jp/index.html
佐藤 健(Ken Sato)
群馬大学生体調節研究所 教授.
研究室URL:http://traffic.dept.med.gunma-u.ac.jp/
© 2018 佐藤美由紀・佐藤 健 Licensed under CC 表示 2.1 日本