放射状グリアは新生仔における脳の障害ののちの新生ニューロンの移動および神経学的な機能の回復を促進する
神農英雄・澤本和延
(名古屋市立大学大学院医学研究科 再生医学分野)
email:神農英雄,澤本和延
DOI: 10.7875/first.author.2018.008
Radial glial fibers promote neuronal migration and functional recovery after neonatal brain injury.
Hideo Jinnou, Masato Sawada, Koya Kawase, Naoko Kaneko, Vicente Herranz-Pérez, Takuya Miyamoto, Takumi Kawaue, Takaki Miyata, Yasuhiko Tabata, Toshihiro Akaike, José Manuel García-Verdugo, Itsuki Ajioka, Shinji Saitoh, Kazunobu Sawamoto
Cell Stem Cell, 22, 128-137.e9 (2018)
放射状グリアは脳の発生期に神経幹細胞として新生ニューロンを産生し,さらに,新生ニューロンが移動する足場として機能する.マウスにおいて放射状グリアは生後すぐに消失するが,この研究において,筆者らは,新生仔においては脳の傷害ののち放射状グリアが一時的に維持され,脳室下帯の神経幹細胞において産生された新生ニューロンが放射状グリアを足場として傷害部へと移動することを発見した.このとき,新生ニューロンと放射状グリアはNカドヘリンによる接着構造を形成し,新生ニューロンにおいてRhoAが活性化されることによりその移動が促進された.さらに,放射状グリアを模倣してNカドヘリンの結合したスポンジを作製し,新生仔の傷害をうけた脳に移植したところ,傷害部への新生ニューロンの移動および成熟が促進され,歩行が回復した.この研究により,放射状グリアが新生仔における脳の傷害ののちの新生ニューロンの移動を基盤とした再生において重要であることが示された.
新生児における脳の傷害は重篤な後遺症のおもな要因であるが,傷害により失われた脳の組織を再生させる治療法はない.生後の脳においても脳室下帯には神経幹細胞が存在し,たえずニューロンが産生される.ヒトの脳室下帯は新生児期においてニューロンの高い産生能をもつことから1),新生児における脳の傷害ののちの神経の再生の治療戦略として期待されている.げっ歯類において,脳室下帯に由来する新生ニューロンは脳の傷害部へと移動する際に血管などの足場を用いる2).成体と比べ,新生仔の脳においては,多数の新生ニューロンが脳室下帯から傷害部へと移動するが,新生仔に特異的なニューロンの移動の足場については不明であった.放射状グリアは脳室帯に位置し軟膜の表面に細い突起を伸ばしており,胎生期には神経幹細胞として機能する3).産生された新生ニューロンは放射状グリアを足場として移動するが,このとき,放射状グリアは新生ニューロンと接着構造を形成し4),新生ニューロンが適切な場所へ効率よく移動するのを助ける5)(新着論文レビュー でも掲載).しかし,放射状グリアは生後まもなく消失するため,新生仔における脳の傷害ののちの新生ニューロンの移動がどのように制御されるのかは不明であった.この研究において,筆者らは,マウスの新生仔における脳の傷害ののちの内在性のニューロンの再生における放射状グリアの重要性について明らかにした.
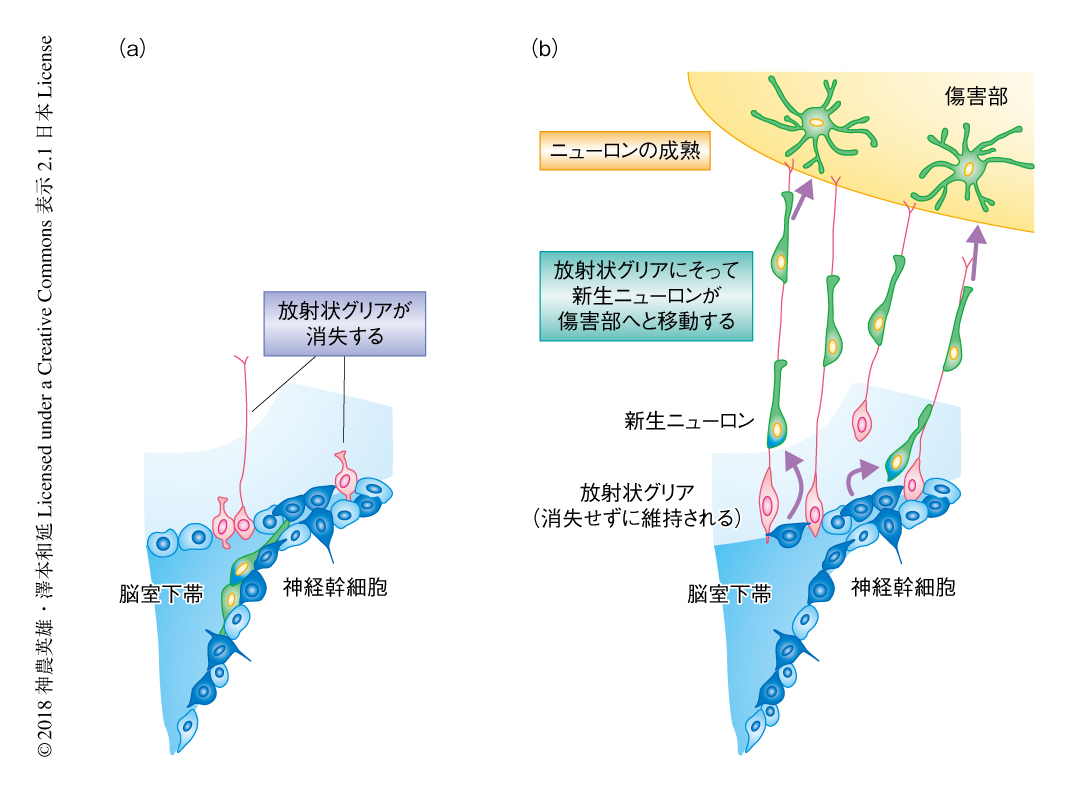
2日齢(新生仔期)のマウスの大脳皮質を凍結により傷害し放射状グリアを観察したところ,傷害の側においては健常な側よりも放射状グリアの密度が有意に高かった.この現象は傷害の7日後においてもっとも顕著で,そののち,放射状グリアの密度は低下した.傷害をうけた脳においては放射状グリアの長さも長かった.これらの結果から,新生仔における脳の傷害により放射状グリアは一時的に維持されることが示唆された.
新生仔期よりあとの脳の傷害による放射状グリアの変化について検討するため,4日齢,14日齢,8週齢(成体)のマウスの脳を同様に傷害し,7日後に放射状グリアを観察した.4日齢にて傷害したマウスにおいては,放射状グリアのマーカーに陽性の突起が,2日齢にて傷害したマウスより少ないものの維持されていた.一方,14日齢よりあとに傷害したマウスにおいて放射状グリアは確認されなかった.このことから,脳の傷害ののち放射状グリアが維持される能力は新生仔期のみに備わることが示唆された.この現象は,脳を凍結により傷害したマウスのみならず,低酸素虚血を起こさせたマウスにおいても確認された.以上より,新生仔の脳は傷害ののちに放射状グリアを維持する能力をもつことが示された(図1).
2日齢のマウスの脳を傷害し7日後に観察したところ,新生ニューロンのマーカーに陽性の移動形態をしたニューロンが傷害部に多く観察された.電気穿孔法を用いた解析により,これらの新生ニューロンの少なくとも一部は脳室下帯に由来することが確認された.これらの新生ニューロンの約56%は傷害部の方向をむいており,放射状グリアを特異的に標識6) して観察したところ,傷害部の方向をむいた新生ニューロンの約96%は放射状グリアにそっていた.なお,約35%の新生ニューロンは細胞体の全体が放射状グリアにそっていた.以上から,新生仔期に脳の傷害部へと移動する脳室下帯に由来する新生ニューロンは放射状グリアにそっていることが示唆された(図1).
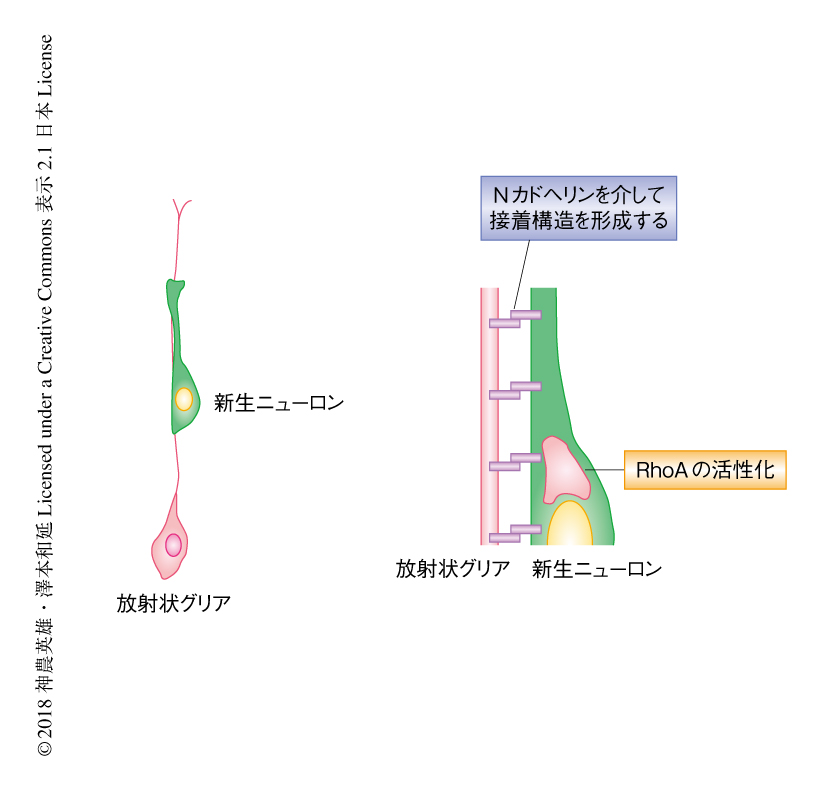
Nカドヘリンは細胞間の接着を制御するタンパク質であり,胎生期の脳における放射状グリアを足場とした新生ニューロンの移動に関与するが5),新生仔の傷害をうけた脳においては,新生ニューロンおよび放射状グリアはともにNカドヘリンを発現していた.Nカドヘリンのドミナントネガティブ体を発現させることにより放射状グリアにおいてNカドヘリンを不活性化したところ,新生仔における脳の傷害ののち放射状グリアの形態や密度は変化しなかったが,放射状グリアにそった新生ニューロンの割合は対照と比較して有意に低下し,脳における新生ニューロンの密度も有意に低下していた.このことから,新生ニューロンは移動する際にはNカドヘリンを発現する放射状グリアを足場とすることが示唆された.放射状グリアにおいて特異的にNカドヘリンをノックダウンした解析においても,放射状グリアにそった新生ニューロンの割合および脳における新生ニューロンの密度が低下したことから,脳の傷害ののちにみられる放射状グリアにそった新生ニューロンの移動には放射状グリアに発現するNカドヘリンが関連することが示唆された.さらに,透過型電子顕微鏡を用いた解析により,新生ニューロンと放射状グリアの突起が接着構造を形成し直接的に接している像が観察されたが(図2),放射状グリアのNカドヘリンを不活性化させると接着構造の密度が低下し,新生ニューロンと放射状グリアとの接触面が不規則になる割合が上昇した.以上より,マウスの新生仔における脳の傷害ののち,放射状グリアは傷害部へと移動する脳室下帯に由来する新生ニューロンと密接にかかわることが示された.
新生ニューロンが放射状グリアにそって移動するようすを直接的に観察するため,放射状グリアを特異的に標識した2日齢のマウスの脳を傷害し,4~5日後に脳の切片を培養下において経時的にイメージングした.その結果,新生ニューロンは放射状グリアにそって跳躍運動の様式で移動していた.Nカドヘリンを不活性化させた放射状グリアにそった新生ニューロンは移動の速度が有意に低下し,放射状グリアから頻繁にはなれた.免疫組織学的な解析と同様に,放射状グリアにそっていない新生ニューロンの割合は放射状グリアにおいてNカドヘリンを不活性化させることにより有意に上昇した.このことから,放射状グリアにおいてNカドヘリンは,放射状グリアにそった新生ニューロンの持続的かつ効率のよい傷害部への移動に関与することが示唆された.新生ニューロンの移動の速度は,細胞体の歩幅,跳躍運動1サイクルの時間(移動の頻度),停止時間により決定されるが7),放射状グリアにおいてNカドヘリンを不活性化させると,細胞体の歩幅が減少し,跳躍運動1サイクルの時間および停止時間が増加した.以上より,新生仔の傷害をうけた脳における放射状グリアにそった新生ニューロンの移動は,Nカドヘリンを介した接着に依存しており,新生ニューロンの跳躍運動における細胞体の歩幅の増加,跳躍運動1サイクルの時間および停止時間の減少に関連することが示された.
新生ニューロンの先導突起の腫脹部分におけるRhoAシグナルは跳躍運動を促進することが知られている7).Nカドヘリンをストライプ状にコートした基質のうえを新生ニューロンが移動する際のRhoA活性の変化を蛍光共鳴エネルギー移動(fluorescence resonance energy transfer:FRET)を用いたイメージングにより解析したところ,新生ニューロンの先導突起の腫脹部分のRhoA活性はNカドヘリンのストライプのうえを移動するとき上昇することが見い出された(図2).
新生ニューロンがNカドヘリンの足場のうえを移動する際に,新生ニューロンの側のNカドヘリンも移動の制御に関与するのかどうか検討するため,培養下において新生ニューロンのNカドヘリンをノックダウンし,Nカドヘリンのストライプのうえにおける移動様式を解析した.その結果,新生ニューロンがNカドヘリンのストライプにさしかかると移動の速度は有意に上昇した.この速度の上昇は,細胞体の歩幅の増加,跳躍運動1サイクルの時間および停止時間の減少によると考えられ,放射状グリアにおいてNカドヘリンを不活性化させたときと同様であった.また,新生ニューロンがNカドヘリンのストライプの境界線に近づくと,対照においてはほとんどの新生ニューロンは先導突起の方向を変えてNカドヘリンのストライプにとどまろうとしたが,Nカドヘリンをノックダウンした新生ニューロンにおいてはこの移動様式は有意に減少したことから,新生ニューロンのNカドヘリンは,Nカドヘリンの足場のうえを移動する際に方向の維持に寄与することが示唆された.以上より,Nカドヘリンは放射状グリアにそって移動する新生ニューロンにおいて,RhoAの活性化および跳躍運動を促進することが明らかにされた.
放射状グリアを模倣した人工的な足場として,Nカドヘリンを結合させたゼラチンスポンジを作製し,新生仔における脳の傷害ののちの脳室下帯に由来する新生ニューロンの移動がこれにより促進されるかどうか検討した.in vitroにおいて,脳室下帯に由来する新生ニューロンの移動の速度は,新生ニューロンがNカドヘリンの結合したスポンジに接したときに上昇した.Nカドヘリンの結合したスポンジを傷害部に移植したところ,傷害部において新生ニューロンの密度が有意に上昇したことから,Nカドヘリンの結合したスポンジはin vivoにおいても効率よく新生ニューロンの移動を促進することが示唆された.放射状グリアが消失した年長のマウスの脳においてもNカドヘリンの結合したスポンジが新生ニューロンの移動を促進するかどうか検討するため,14日齢あるいは8週齢のマウスの脳を傷害したうえでNカドヘリンの結合したスポンジを移植した.その結果,傷害部へと移動した新生ニューロンの数は2日齢において傷害したマウスにてもっとも多かったが,年長のマウスにおいても増加が確認された.結果として,Nカドヘリンの結合したスポンジによる新生ニューロンの移動の促進の効果は,年長のマウスにおいてより顕著であった.さらに,Nカドヘリンの結合したスポンジを移植する最適な時期を検討するため,脳への傷害の3日後および10日後にNカドヘリンの結合したスポンジを移植した.その結果,傷害部における新生ニューロンの密度は傷害の3日後に移植したマウスにおいて有意に高値であったことから,早期の移植が新生仔における脳の傷害ののちの新生ニューロンの移動に有効であることが示唆された.
Nカドヘリンの結合したスポンジの移植のニューロンの成熟に対する効果について検討するため,新生仔において脳を傷害し28日後に観察したところ,Nカドヘリンの結合したスポンジの移植により,傷害部において脳室下帯に由来する成熟したニューロンの数が有意に増加し,大脳皮質の上層における成熟したニューロンの割合も有意に増加した.以上より,Nカドヘリンの結合したスポンジは新生仔における脳の傷害ののちの脳室下帯に由来するニューロンの再生を促進することが示唆された.
脳への傷害の28日後における機能の回復について検討した.自然歩行を解析したところ,新生仔における脳の傷害により前肢の接地面積が減少し左右の前肢のあいだの幅が増加したが,Nカドヘリンの結合したスポンジの移植によりこれらが改善されたことから,Nカドヘリンの結合したスポンジは新生仔における脳の傷害ののちの機能の回復を促進することが示唆された.行動解析において,新生仔における脳の傷害により左右差が出現したが,Nカドヘリンの結合したスポンジの移植により回復した.Nカドヘリンの結合したスポンジの移植は14日齢において傷害したマウスにおいても神経学的なスコアの改善をもたらしたが,8週齢において傷害したマウスにおいては改善されなかった.このことから,成体の脳においてもNカドヘリンの結合したスポンジの移植により新生ニューロンの移動は促進されるが,機能の回復には限定的な時期が存在することが示唆された.さらに,傷害部における脳室下帯に由来するニューロンの再生が機能の回復に寄与するかどうかを評価するため,0日齢のマウスにおいて遺伝子操作により脳室下帯にて産生されるニューロンを除去したところ,行動解析において,脳の傷害ののちのNカドヘリンの結合したスポンジの移植により改善は認められなかった.以上より,Nカドヘリンの結合したスポンジは新生仔における脳の傷害ののちの脳室下帯に由来するニューロンの再生をつうじ神経学的な機能の回復を促進することが示された.
この研究において,筆者らは,マウスの新生仔の傷害をうけた脳を用いた研究から,1)新生ニューロンが傷害部へと移動する際に放射状グリアが移動の足場を提供すること,2)放射状グリアにそった新生ニューロンの移動を維持する適切な接着構造を形成するうえでNカドヘリンが重要な役割をはたすこと,3)Nカドヘリンが結合する足場を傷害部に移植することにより新生ニューロンの移動および神経学的な機能の回復が促進されること,を示した.ヒトの新生児の傷害をうけた脳においても,放射状グリアを模倣した足場を移植することや,放射状グリアの維持を起こすことができれば,内在性の神経幹細胞を利用した再生戦略となることが期待される.
略歴:2016年 名古屋市立大学大学院医学研究科博士課程 修了,同年より同 研究員.
研究テーマ:新生児脳障害の再生医療.
抱負:未来あるこどもたちのため,臨床と研究の両方の視点から貢献できるようがんばります.
澤本 和延(Kazunobu Sawamoto)
名古屋市立大学大学院医学研究科 教授.
研究室URL:http://k-sawamoto.com/
© 2018 神農英雄・澤本和延 Licensed under CC 表示 2.1 日本
(名古屋市立大学大学院医学研究科 再生医学分野)
email:神農英雄,澤本和延
DOI: 10.7875/first.author.2018.008
Radial glial fibers promote neuronal migration and functional recovery after neonatal brain injury.
Hideo Jinnou, Masato Sawada, Koya Kawase, Naoko Kaneko, Vicente Herranz-Pérez, Takuya Miyamoto, Takumi Kawaue, Takaki Miyata, Yasuhiko Tabata, Toshihiro Akaike, José Manuel García-Verdugo, Itsuki Ajioka, Shinji Saitoh, Kazunobu Sawamoto
Cell Stem Cell, 22, 128-137.e9 (2018)
要 約
放射状グリアは脳の発生期に神経幹細胞として新生ニューロンを産生し,さらに,新生ニューロンが移動する足場として機能する.マウスにおいて放射状グリアは生後すぐに消失するが,この研究において,筆者らは,新生仔においては脳の傷害ののち放射状グリアが一時的に維持され,脳室下帯の神経幹細胞において産生された新生ニューロンが放射状グリアを足場として傷害部へと移動することを発見した.このとき,新生ニューロンと放射状グリアはNカドヘリンによる接着構造を形成し,新生ニューロンにおいてRhoAが活性化されることによりその移動が促進された.さらに,放射状グリアを模倣してNカドヘリンの結合したスポンジを作製し,新生仔の傷害をうけた脳に移植したところ,傷害部への新生ニューロンの移動および成熟が促進され,歩行が回復した.この研究により,放射状グリアが新生仔における脳の傷害ののちの新生ニューロンの移動を基盤とした再生において重要であることが示された.
はじめに
新生児における脳の傷害は重篤な後遺症のおもな要因であるが,傷害により失われた脳の組織を再生させる治療法はない.生後の脳においても脳室下帯には神経幹細胞が存在し,たえずニューロンが産生される.ヒトの脳室下帯は新生児期においてニューロンの高い産生能をもつことから1),新生児における脳の傷害ののちの神経の再生の治療戦略として期待されている.げっ歯類において,脳室下帯に由来する新生ニューロンは脳の傷害部へと移動する際に血管などの足場を用いる2).成体と比べ,新生仔の脳においては,多数の新生ニューロンが脳室下帯から傷害部へと移動するが,新生仔に特異的なニューロンの移動の足場については不明であった.放射状グリアは脳室帯に位置し軟膜の表面に細い突起を伸ばしており,胎生期には神経幹細胞として機能する3).産生された新生ニューロンは放射状グリアを足場として移動するが,このとき,放射状グリアは新生ニューロンと接着構造を形成し4),新生ニューロンが適切な場所へ効率よく移動するのを助ける5)(新着論文レビュー でも掲載).しかし,放射状グリアは生後まもなく消失するため,新生仔における脳の傷害ののちの新生ニューロンの移動がどのように制御されるのかは不明であった.この研究において,筆者らは,マウスの新生仔における脳の傷害ののちの内在性のニューロンの再生における放射状グリアの重要性について明らかにした.
1.新生仔においては脳の傷害ののちにも放射状グリアが維持される
2日齢(新生仔期)のマウスの大脳皮質を凍結により傷害し放射状グリアを観察したところ,傷害の側においては健常な側よりも放射状グリアの密度が有意に高かった.この現象は傷害の7日後においてもっとも顕著で,そののち,放射状グリアの密度は低下した.傷害をうけた脳においては放射状グリアの長さも長かった.これらの結果から,新生仔における脳の傷害により放射状グリアは一時的に維持されることが示唆された.
新生仔期よりあとの脳の傷害による放射状グリアの変化について検討するため,4日齢,14日齢,8週齢(成体)のマウスの脳を同様に傷害し,7日後に放射状グリアを観察した.4日齢にて傷害したマウスにおいては,放射状グリアのマーカーに陽性の突起が,2日齢にて傷害したマウスより少ないものの維持されていた.一方,14日齢よりあとに傷害したマウスにおいて放射状グリアは確認されなかった.このことから,脳の傷害ののち放射状グリアが維持される能力は新生仔期のみに備わることが示唆された.この現象は,脳を凍結により傷害したマウスのみならず,低酸素虚血を起こさせたマウスにおいても確認された.以上より,新生仔の脳は傷害ののちに放射状グリアを維持する能力をもつことが示された(図1).
2.新生仔における脳の傷害ののちに放射状グリアは新生ニューロンの移動の足場としてはたらく
2日齢のマウスの脳を傷害し7日後に観察したところ,新生ニューロンのマーカーに陽性の移動形態をしたニューロンが傷害部に多く観察された.電気穿孔法を用いた解析により,これらの新生ニューロンの少なくとも一部は脳室下帯に由来することが確認された.これらの新生ニューロンの約56%は傷害部の方向をむいており,放射状グリアを特異的に標識6) して観察したところ,傷害部の方向をむいた新生ニューロンの約96%は放射状グリアにそっていた.なお,約35%の新生ニューロンは細胞体の全体が放射状グリアにそっていた.以上から,新生仔期に脳の傷害部へと移動する脳室下帯に由来する新生ニューロンは放射状グリアにそっていることが示唆された(図1).
Nカドヘリンは細胞間の接着を制御するタンパク質であり,胎生期の脳における放射状グリアを足場とした新生ニューロンの移動に関与するが5),新生仔の傷害をうけた脳においては,新生ニューロンおよび放射状グリアはともにNカドヘリンを発現していた.Nカドヘリンのドミナントネガティブ体を発現させることにより放射状グリアにおいてNカドヘリンを不活性化したところ,新生仔における脳の傷害ののち放射状グリアの形態や密度は変化しなかったが,放射状グリアにそった新生ニューロンの割合は対照と比較して有意に低下し,脳における新生ニューロンの密度も有意に低下していた.このことから,新生ニューロンは移動する際にはNカドヘリンを発現する放射状グリアを足場とすることが示唆された.放射状グリアにおいて特異的にNカドヘリンをノックダウンした解析においても,放射状グリアにそった新生ニューロンの割合および脳における新生ニューロンの密度が低下したことから,脳の傷害ののちにみられる放射状グリアにそった新生ニューロンの移動には放射状グリアに発現するNカドヘリンが関連することが示唆された.さらに,透過型電子顕微鏡を用いた解析により,新生ニューロンと放射状グリアの突起が接着構造を形成し直接的に接している像が観察されたが(図2),放射状グリアのNカドヘリンを不活性化させると接着構造の密度が低下し,新生ニューロンと放射状グリアとの接触面が不規則になる割合が上昇した.以上より,マウスの新生仔における脳の傷害ののち,放射状グリアは傷害部へと移動する脳室下帯に由来する新生ニューロンと密接にかかわることが示された.
3.Nカドヘリンは新生ニューロンにおいてRhoAを活性化し放射状グリアにそった移動を促進する
新生ニューロンが放射状グリアにそって移動するようすを直接的に観察するため,放射状グリアを特異的に標識した2日齢のマウスの脳を傷害し,4~5日後に脳の切片を培養下において経時的にイメージングした.その結果,新生ニューロンは放射状グリアにそって跳躍運動の様式で移動していた.Nカドヘリンを不活性化させた放射状グリアにそった新生ニューロンは移動の速度が有意に低下し,放射状グリアから頻繁にはなれた.免疫組織学的な解析と同様に,放射状グリアにそっていない新生ニューロンの割合は放射状グリアにおいてNカドヘリンを不活性化させることにより有意に上昇した.このことから,放射状グリアにおいてNカドヘリンは,放射状グリアにそった新生ニューロンの持続的かつ効率のよい傷害部への移動に関与することが示唆された.新生ニューロンの移動の速度は,細胞体の歩幅,跳躍運動1サイクルの時間(移動の頻度),停止時間により決定されるが7),放射状グリアにおいてNカドヘリンを不活性化させると,細胞体の歩幅が減少し,跳躍運動1サイクルの時間および停止時間が増加した.以上より,新生仔の傷害をうけた脳における放射状グリアにそった新生ニューロンの移動は,Nカドヘリンを介した接着に依存しており,新生ニューロンの跳躍運動における細胞体の歩幅の増加,跳躍運動1サイクルの時間および停止時間の減少に関連することが示された.
新生ニューロンの先導突起の腫脹部分におけるRhoAシグナルは跳躍運動を促進することが知られている7).Nカドヘリンをストライプ状にコートした基質のうえを新生ニューロンが移動する際のRhoA活性の変化を蛍光共鳴エネルギー移動(fluorescence resonance energy transfer:FRET)を用いたイメージングにより解析したところ,新生ニューロンの先導突起の腫脹部分のRhoA活性はNカドヘリンのストライプのうえを移動するとき上昇することが見い出された(図2).
新生ニューロンがNカドヘリンの足場のうえを移動する際に,新生ニューロンの側のNカドヘリンも移動の制御に関与するのかどうか検討するため,培養下において新生ニューロンのNカドヘリンをノックダウンし,Nカドヘリンのストライプのうえにおける移動様式を解析した.その結果,新生ニューロンがNカドヘリンのストライプにさしかかると移動の速度は有意に上昇した.この速度の上昇は,細胞体の歩幅の増加,跳躍運動1サイクルの時間および停止時間の減少によると考えられ,放射状グリアにおいてNカドヘリンを不活性化させたときと同様であった.また,新生ニューロンがNカドヘリンのストライプの境界線に近づくと,対照においてはほとんどの新生ニューロンは先導突起の方向を変えてNカドヘリンのストライプにとどまろうとしたが,Nカドヘリンをノックダウンした新生ニューロンにおいてはこの移動様式は有意に減少したことから,新生ニューロンのNカドヘリンは,Nカドヘリンの足場のうえを移動する際に方向の維持に寄与することが示唆された.以上より,Nカドヘリンは放射状グリアにそって移動する新生ニューロンにおいて,RhoAの活性化および跳躍運動を促進することが明らかにされた.
4.Nカドヘリンの結合したスポンジの移植により新生仔における脳の傷害ののちのニューロンの再生および神経学的な機能の回復が促進される
放射状グリアを模倣した人工的な足場として,Nカドヘリンを結合させたゼラチンスポンジを作製し,新生仔における脳の傷害ののちの脳室下帯に由来する新生ニューロンの移動がこれにより促進されるかどうか検討した.in vitroにおいて,脳室下帯に由来する新生ニューロンの移動の速度は,新生ニューロンがNカドヘリンの結合したスポンジに接したときに上昇した.Nカドヘリンの結合したスポンジを傷害部に移植したところ,傷害部において新生ニューロンの密度が有意に上昇したことから,Nカドヘリンの結合したスポンジはin vivoにおいても効率よく新生ニューロンの移動を促進することが示唆された.放射状グリアが消失した年長のマウスの脳においてもNカドヘリンの結合したスポンジが新生ニューロンの移動を促進するかどうか検討するため,14日齢あるいは8週齢のマウスの脳を傷害したうえでNカドヘリンの結合したスポンジを移植した.その結果,傷害部へと移動した新生ニューロンの数は2日齢において傷害したマウスにてもっとも多かったが,年長のマウスにおいても増加が確認された.結果として,Nカドヘリンの結合したスポンジによる新生ニューロンの移動の促進の効果は,年長のマウスにおいてより顕著であった.さらに,Nカドヘリンの結合したスポンジを移植する最適な時期を検討するため,脳への傷害の3日後および10日後にNカドヘリンの結合したスポンジを移植した.その結果,傷害部における新生ニューロンの密度は傷害の3日後に移植したマウスにおいて有意に高値であったことから,早期の移植が新生仔における脳の傷害ののちの新生ニューロンの移動に有効であることが示唆された.
Nカドヘリンの結合したスポンジの移植のニューロンの成熟に対する効果について検討するため,新生仔において脳を傷害し28日後に観察したところ,Nカドヘリンの結合したスポンジの移植により,傷害部において脳室下帯に由来する成熟したニューロンの数が有意に増加し,大脳皮質の上層における成熟したニューロンの割合も有意に増加した.以上より,Nカドヘリンの結合したスポンジは新生仔における脳の傷害ののちの脳室下帯に由来するニューロンの再生を促進することが示唆された.
脳への傷害の28日後における機能の回復について検討した.自然歩行を解析したところ,新生仔における脳の傷害により前肢の接地面積が減少し左右の前肢のあいだの幅が増加したが,Nカドヘリンの結合したスポンジの移植によりこれらが改善されたことから,Nカドヘリンの結合したスポンジは新生仔における脳の傷害ののちの機能の回復を促進することが示唆された.行動解析において,新生仔における脳の傷害により左右差が出現したが,Nカドヘリンの結合したスポンジの移植により回復した.Nカドヘリンの結合したスポンジの移植は14日齢において傷害したマウスにおいても神経学的なスコアの改善をもたらしたが,8週齢において傷害したマウスにおいては改善されなかった.このことから,成体の脳においてもNカドヘリンの結合したスポンジの移植により新生ニューロンの移動は促進されるが,機能の回復には限定的な時期が存在することが示唆された.さらに,傷害部における脳室下帯に由来するニューロンの再生が機能の回復に寄与するかどうかを評価するため,0日齢のマウスにおいて遺伝子操作により脳室下帯にて産生されるニューロンを除去したところ,行動解析において,脳の傷害ののちのNカドヘリンの結合したスポンジの移植により改善は認められなかった.以上より,Nカドヘリンの結合したスポンジは新生仔における脳の傷害ののちの脳室下帯に由来するニューロンの再生をつうじ神経学的な機能の回復を促進することが示された.
おわりに
この研究において,筆者らは,マウスの新生仔の傷害をうけた脳を用いた研究から,1)新生ニューロンが傷害部へと移動する際に放射状グリアが移動の足場を提供すること,2)放射状グリアにそった新生ニューロンの移動を維持する適切な接着構造を形成するうえでNカドヘリンが重要な役割をはたすこと,3)Nカドヘリンが結合する足場を傷害部に移植することにより新生ニューロンの移動および神経学的な機能の回復が促進されること,を示した.ヒトの新生児の傷害をうけた脳においても,放射状グリアを模倣した足場を移植することや,放射状グリアの維持を起こすことができれば,内在性の神経幹細胞を利用した再生戦略となることが期待される.
文 献
- Sanai, N., Nguyen, T., Ihrie, R. A. et al.: Corridors of migrating neurons in the human brain and their decline during infancy. Nature, 478, 382-386 (2011)[PubMed]
- Yamashita, T., Ninomiya, M., Hernandez Acosta, P. et al.: Subventricular zone-derived neuroblasts migrate and differentiate into mature neurons in the post-stroke adult striatum. J. Neurosci., 26, 6627-6636 (2006)[PubMed]
- Rakic, P.: Mode of cell migration to the superficial layers of fetal monkey neocortex. J. Comp. Neurol., 145, 61-83 (1972)[PubMed]
- Franco, S. J., Martinez-Garay, I., Gil-Sanz, C. et al.: Reelin regulates cadherin function via Dab1/Rap1 to control neuronal migration and lamination in the neocortex. Neuron, 69, 482-497 (2011)[PubMed]
- Kawauchi, T., Sekine, K., Shikanai, M. et al.: Rab GTPases-dependent endocytic pathways regulate neuronal migration and maturation through N-cadherin trafficking. Neuron, 67, 588-602 (2010)[PubMed] [新着論文レビュー]
- Merkle, F. T., Mirzadeh, Z. & Alvarez-Buylla, A.: Mosaic organization of neural stem cells in the adult brain. Science, 317, 381-384 (2007)[PubMed]
- Ota, H., Hikita, T., Sawada, M. et al.: Speed control for neuronal migration in the postnatal brain by Gmip-mediated local inactivation of RhoA. Nat. Commun., 5, 4532 (2014)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2016年 名古屋市立大学大学院医学研究科博士課程 修了,同年より同 研究員.
研究テーマ:新生児脳障害の再生医療.
抱負:未来あるこどもたちのため,臨床と研究の両方の視点から貢献できるようがんばります.
澤本 和延(Kazunobu Sawamoto)
名古屋市立大学大学院医学研究科 教授.
研究室URL:http://k-sawamoto.com/
© 2018 神農英雄・澤本和延 Licensed under CC 表示 2.1 日本