アドレナリンβ2受容体と神経栄養因子とのフィードフォワードループによる膵臓がんの進展
高橋良太・Bernhard W. Renz・Timothy C. Wang
(米国Columbia大学Medical Center,Department of Digestive and Liver Diseases)
email:高橋良太
DOI: 10.7875/first.author.2018.007
β2 adrenergic-neurotrophin feedforward loop promotes pancreatic cancer.
Bernhard W. Renz, Ryota Takahashi, Takayuki Tanaka, Marina Macchini, Yoku Hayakawa, Zahra Dantes, H. Carlo Maurer, Xiaowei Chen, Zhengyu Jiang, C. Benedikt Westphalen, Matthias Ilmer, Giovanni Valenti, Sarajo K. Mohanta, Andreas J.R. Habenicht, Moritz Middelhoff, Timothy Chu, Karan Nagar, Yagnesh Tailor, Riccardo Casadei, Mariacristina Di Marco, Axel Kleespies, Richard A. Friedman, Helen Remotti, Maximilian Reichert, Daniel L. Worthley, Jens Neumann, Jens Werner, Alina C. Iuga, Kenneth P. Olive, Timothy C. Wang
Cancer Cell, 33, 75-90.e7 (2018)
これまで,膵臓がんにおいて交感神経のはたす役割については明らかにされていない.この研究において,筆者らは,マウスにおいて膵臓がんはストレスにより進展しやすくなることを示した.さらに,これが膵臓がん細胞におけるカテコールアミンによるアドレナリンβ2受容体シグナル伝達経路を介すること,神経栄養因子NGFの分泌を促進し膵臓がん組織において神経を増生させていることが示された.膵臓がんの発がんモデルマウスにNGFを発現させることにより膵臓がんが進展した.膵臓がんのモデルマウスにおいては,抗がん剤であるゲムシタビンによる治療にくわえ,アドレナリンβ2受容体のアンタゴニストやTrkの阻害剤を併用した治療により生存期間が延長した.膵臓がんの患者のデータにおいては,非選択的β阻害剤の使用と神経栄養因子BDNFの発現量,神経の密度,生存期間とのあいだに関連が認められた.これらの結果から,カテコールアミンはアドレナリンβ2受容体-神経栄養因子-交感神経というフィードフォワードループにより膵臓がんを進展させるという機構が示された.
膵臓がんは生存期間の中央値が約6カ月と非常に予後が不良の悪性疾患として知られており,また,症例の数も増加の傾向にある.その多くは診断のときすでに遠隔転移をともなっており根治は困難である.外科的な手術もしくは化学療法が治療の主流であるが,いまだその効果は十分でなく,病態については未解明な部分が多い.
膵臓がんは豊富な間質の変化により特徴づけられる.間質には免疫細胞,血管内皮細胞,ニューロンといったさまざまな細胞が含まれ,相互作用をもちつつがんの微小環境を構成する.近年,がんと交感神経あるいは副交感神経とのかかわりが明らかにされてきており,前立腺がんや胃がんなどにおいて報告がある1,2).膵臓にも交感神経および副交感神経があるが,これらと膵臓がんとのかかわりについて十分には検証されていない.膵臓がん組織においては神経の増生が認められ3),神経の浸潤と予後との相関が報告されていることから4),膵臓がんの進展において神経が大きな役割をはたすことが推測される.
交感神経における神経伝達物質としてアドレナリンおよびノルアドレナリンを含むカテコールアミンが知られており,これらはアドレナリンα受容体およびアドレナリンβ受容体と結合して作用する.これらの受容体はがん細胞にも発現することが知られており,アドレナリンβ受容体への刺激は膵臓がんを進展させることが示唆されている5,6).一方,カテコールアミンは生体においてストレス応答を伝達するが,ストレスによりがんが悪化することも示唆されている7).また,さまざまな種類のがんにおいて,降圧剤であるβ阻害剤の使用は予後を改善させることが示唆されている.これらの背景から,筆者らは,膵臓がんの発がんの過程においてストレスやアドレナリンβ受容体シグナル伝達経路が深くかかわるという仮定をたてた.
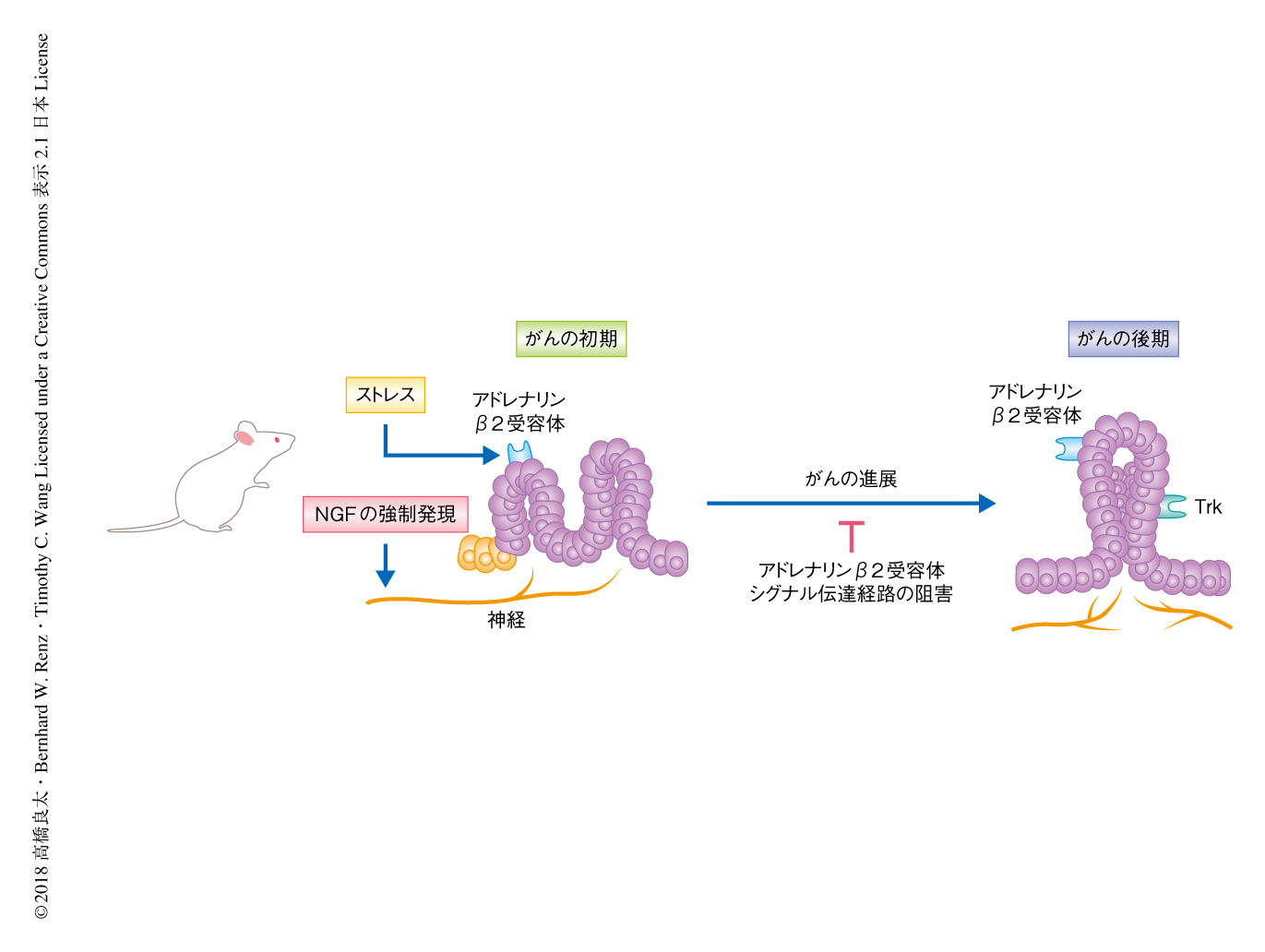
膵臓の上皮細胞に特異的に変異型のKras遺伝子を発現させたマウスは膵臓に前がん病変を発達させることが知られるが8),ほとんどの場合において,がんに進展するにはほかの遺伝子の異常が必要である.この膵臓がんの前がん病変のモデルマウスに拘束によるストレスをあたえ,膵臓における病変の変化を調べた.その結果,ストレスをあたえたマウスにおいて血液中のアドレナリンが増加し,20週齢において比較すると,ストレスをあたえなかったマウスにおいて膵臓がんは発生しなかったのに対し,ストレスをあたえたマウスの38%において膵臓がんが発生した.膵臓がんの前がん病変のモデルマウスの膵臓において,アドレナリンβ受容体のうちアドレナリンβ2受容体の発現がもっとも高値であったため,ストレスをあたえたマウスに対しアドレナリンβ2受容体のアンタゴニストを投与したところ膵臓がんの発生率は低下した.また,アドレナリンβ受容体のアゴニストを投与したところ,膵臓がんの発生率は77%に上昇した.一方,アドレナリンβ2受容体をノックアウトしたところ,ストレスをあたえた際の膵臓がんの発生率は12%まで低下し,副腎を切除する手術をうけたマウスにおいても,ストレスによる膵臓がんの発生率はアドレナリンβ2受容体のアンタゴニストを投与したマウスと同じ程度にまで低下した.また,ストレスをあたえたときあるいはアドレナリンβ受容体のアゴニストを投与したときには前がん病変の周囲に神経が増生し,アドレナリンβ2受容体のアンタゴニストの投与や副腎の切除によりこの神経の増生は抑制された.これらの結果から,長期にわたるストレスおよびカテコールアミンの増加により,膵臓がんの発がんおよびがん組織における神経の増生がもたらされることが示唆された(図1).
膵臓の上皮細胞に特異的な変異型のKras遺伝子の発現にくわえてp53遺伝子を変異させたマウスは膵管がんを発生することが知られている9).このマウスに発生した膵臓がんはヒトの膵臓がんと病理学的に類似しているため,膵臓がんのモデルマウスとして使用される.このマウスの膵臓がん細胞においては正常な膵臓と比較してアドレナリンβ2受容体の発現が上昇しており,交感神経の増生も正常な膵臓と比較して顕著であった.この膵臓がんのモデルマウスに発生した膵臓がんの体積が20~60 mm3になった時点で,抗がん剤であるゲムシタビンの単剤あるいはゲムシタビンとアドレナリンβ2受容体のアンタゴニストによる併用療法を開始し生存期間を比較した.その結果,生存期間はゲムシタビンの単剤による治療では18日であったのに対し,併用療法では31日に延長された.また,交感神経を外科的に切除したマウスにおいてはゲムシタビンの単剤での治療による生存期間は36日であった.がん組織における神経の密度を比較すると,ゲムシタビンの単剤による治療と比較して,併用療法あるいはゲムシタビンを投与した交感神経を切除したマウスのゲムシタビンの単剤による治療において,がん組織における神経組織の減少が認められた.
アドレナリンシグナル伝達経路が膵臓がんを進展させる機構について明らかにするため,膵臓の腺房細胞を用いた3次元培養により,膵臓がんの前段階である腺房-導管異形成とよばれる過程を再現して解析した.変異型のKras遺伝子をもつ膵臓の腺房細胞の培養系をアドレナリンβ受容体のアゴニストにより刺激したところ,腺房-導管異形成により形成されるスフェロイドの数が増加した.この増加は非選択的β阻害剤やアドレナリンβ2受容体のアンタゴニストにより抑制された一方,アドレナリンβ1受容体に特異的な阻害剤の投与により抑制されなかった.また,変異型のKras遺伝子をもちアドレナリンβ2受容体をノックアウトした膵臓の腺房細胞を用いると,アドレナリンβ受容体のアゴニストによりスフェロイドの形成は促進されなかった.また,アドレナリンβ2受容体シグナル伝達経路を構成することが知られるプロテインキナーゼAの阻害剤を投与するとスフェロイドの形成が阻害されたことから,アドレナリンβ2受容体シグナル伝達経路の関与が示唆された.このスフェロイド培養系をマウスの胎仔に由来する後根神経節と共培養したところ,スフェロイドの形成が増加した.後根神経節と共培養するまえにスフェロイドにアドレナリンβ2受容体のアンタゴニストを投与したところ,スフェロイドの形成の増加は抑制された.これらの結果から,カテコールアミンによるアドレナリンβ2受容体への刺激が膵臓がんの発生に寄与することが示唆された.
ヒトおよびマウスの膵臓がん細胞株においても,アドレナリンβ受容体のアゴニストの投与により増殖が促進され,アドレナリンβ2受容体のアンタゴニストの投与により増殖は阻害された.また,アドレナリンβ受容体のアゴニストの投与によりリン酸化ERKやリン酸化CREBが増加し,これらのかかわるシグナル伝達経路の関与が示唆された.
これまでの結果から,カテコールアミンが神経栄養因子の分泌を介して神経とがんとの相互作用を促進すると仮定した.膵臓がんのモデルマウスのがん組織における神経栄養因子の発現を調べたところ,NGFの発現がもっとも高値であった.また,NGFの発現は,膵臓がんの前がん病変のモデルマウスにおける前がん病変を含む膵臓において上昇しはじめており,膵臓がんのモデルマウスのがん組織においてより顕著に上昇していた.膵臓がんのモデルマウスの膵臓がん組織から確立した細胞株に対しノルアドレナリンを投与したところNGFの発現が上昇し,これはアドレナリンβ2受容体のアンタゴニストの投与,プロテインキナーゼAの阻害剤の投与,MEKの阻害剤の投与により抑制された.
がんの発生のより早い段階におけるNGFの発現を調べるため,変異型のKras遺伝子をもつスフェロイドにノルアドレナリンを投与したところ,やはりNGFの発現が上昇し,これはアドレナリンβ2受容体のアンタゴニストの投与により抑制された.カテコールアミンによるNGFの分泌が実際に神経を増生することを確認するため,膵臓がん細胞株と後根神経節を共培養しアドレナリンβ受容体のアゴニストを投与したところ後根神経節から神経突起が伸長し,これはアドレナリンβ2受容体のアンタゴニストの前投与により抑制された.これらの結果から,アドレナリンβ2受容体シグナル伝達経路によるNGFの分泌の増加が神経を増生し,がんと神経との相互作用をもたらすことが示唆された.
膵臓がんの前がん病変のモデルマウスにNGFを発現させたところ,膵臓における交感神経の増生とともに,前がん病変が進展した.また,膵臓がんのモデルマウスにNGFを発現させたマウスにおいても,膵臓における神経の増生,膵臓がんの進展,生存期間の短縮が認められた.
ヒトの膵臓がん組織からレーザーマイクロダイセクション法により得た膵臓の上皮組織および間質の試料において,神経栄養因子の発現をRNA-seq法により調べたところ,膵臓の上皮組織においてBDNFがもっとも高い発現を示した.ヒトの膵臓がん細胞株であるPanc-1細胞においても,BDNFはもっとも発現の高い神経栄養因子であった.ノルアドレナリンの投与によりBDNFおよびNGFはともに発現が上昇し,アドレナリンβ2受容体のアンタゴニスト,プロテインキナーゼAの阻害剤,MEKの阻害剤により抑制された.これらの結果から,ヒトの膵臓がん細胞においてもアドレナリンβ2シグナル伝達経路が神経栄養因子の分泌を促進することが示された.
NGFの発現の上昇による膵臓がんの進展という現象についてさらに明らかにするため,神経栄養因子の受容体であるTrkの阻害剤を使用した.まず,in vitroにおいて膵臓がん細胞がTrkを発現していること,NGFの投与により膵臓がん細胞の増殖が促進され,それがTrkの阻害剤の投与により抑制されることが確認された.また,スフェロイド培養を用いて,NGFによる増殖の促進がアドレナリンβ2受容体シグナル伝達経路によるものではないことが示された.マウスの膵臓がん細胞と後根神経節の共培養系において,Trkの阻害剤を投与することにより神経突起の伸長が抑制された.したがって,膵臓がん細胞から分泌されたNGFは周囲の神経の増生を促進するとともに,オートクラインにより膵臓がん細胞それ自体の増殖を促進する可能性が示唆された.
膵臓がんの前がん病変のモデルマウスに対しセルレインを投与することにより発がんを促進し,Trkの阻害剤を投与しなかったマウスと投与したマウスとで24週齢における膵臓がんの発がん率を比較した.Trkの阻害剤を投与しなかったマウスでは発がん率は60%であったのに対し,Trkの阻害剤を投与したマウスでは発がん率は10%まで低下した.さらに,膵臓がんのモデルマウスを用いて,膵臓がんが直径3~6 mmになった時点でゲムシタビンの単剤あるいはゲムシタビンとTrkの阻害剤の併用療法を実施し生存期間を比較したところ,併用療法では生存期間の延長し,神経組織が減少した.これらの結果から,NGF-Trkシグナル伝達経路の阻害により膵臓がん組織における神経の増生および膵臓がんの進展が抑制されることが示された.NGFのオートクラインによる影響について評価するため,膵臓がんのモデルマウスの膵臓がんが20~60 mm3になった時点からゲムシタビン,アドレナリンβ2受容体のアンタゴニスト,Trkの阻害剤の3剤による併用療法を実施したところ,生存期間は47日であった.これは,ゲムシタビンとアドレナリンβ2受容体のアンタゴニストの併用療法をうけたマウスの生存期間と比較して延長していたことから,NGFによるオートクラインの影響が示唆されたものの,これらの実験は同時に実施されたものではないため直接の比較は困難であった.
ヒトの膵臓がんにおけるアドレナリンβ2シグナル伝達経路およびがんと神経とのあいだの相互作用の役割について明らかにするため,ヒトの膵臓がん組織から作製したオルガノイドを用いた.ゲムシタビン,非選択的β阻害剤,アドレナリンβ2受容体のアンタゴニストを投与するとオルガノイドが減少したが,アドレナリンβ1受容体の阻害剤の投与では減少しなかった.
アドレナリンβ2受容体の阻害と膵臓がんの患者の予後との相関について,外科的な切除をうけたステージIIおよびステージIIIの膵臓がんの患者のデータを後ろ向き解析した.β阻害剤を使用しなかった患者の生存期間が23カ月であったのに対し,すべてのβ阻害剤の使用例において生存期間は24カ月であり有意差は認められなかった.一方,非選択的β阻害剤の使用例に限定すると生存期間は40カ月に延長した.β阻害剤の使用例において心血管系のリスクが高いほかには,患者の背景に差はみられなかった.免疫染色においては,非選択的β阻害剤の使用例において神経マーカーであるS-100染色およびBDNF染色の減少が認められた.これらの結果から,外科的な切除をうけたステージIIおよびステージIIIの膵臓がんの患者において,非選択的β阻害剤の使用による神経組織の減少および予後の改善が示唆された.
この研究においては,膵臓がんやその前段階において,カテコールアミンによるアドレナリンβ2受容体シグナル伝達経路を介した神経栄養因子の分泌の亢進が起こり,がん組織における神経の増生をもたらす結果,さらに,カテコールアミンが増加するというがんと神経とのあいだの相互作用が示された(図2).アドレナリンβ2受容体の阻害もしくはTrkの阻害が治療の標的あるいは予防的な治療になりうると考えられた.
略歴:2012年 東京大学大学院医学系研究科博士課程 修了,2015年より米国Columbia大学 ポスドク研究員.
研究テーマ:膵臓がんの病態.
抱負:難治がんであり複雑な病態をもつ膵臓がんの治療の発展のために,新たな知見を見い出していきたい.
Bernhard W. Renz
ドイツMunich大学病院.
Timothy C. Wang
米国Columbia大学Medical CenterにてProfessor.
© 2018 高橋良太・Bernhard W. Renz・Timothy C. Wang Licensed under CC 表示 2.1 日本
(米国Columbia大学Medical Center,Department of Digestive and Liver Diseases)
email:高橋良太
DOI: 10.7875/first.author.2018.007
β2 adrenergic-neurotrophin feedforward loop promotes pancreatic cancer.
Bernhard W. Renz, Ryota Takahashi, Takayuki Tanaka, Marina Macchini, Yoku Hayakawa, Zahra Dantes, H. Carlo Maurer, Xiaowei Chen, Zhengyu Jiang, C. Benedikt Westphalen, Matthias Ilmer, Giovanni Valenti, Sarajo K. Mohanta, Andreas J.R. Habenicht, Moritz Middelhoff, Timothy Chu, Karan Nagar, Yagnesh Tailor, Riccardo Casadei, Mariacristina Di Marco, Axel Kleespies, Richard A. Friedman, Helen Remotti, Maximilian Reichert, Daniel L. Worthley, Jens Neumann, Jens Werner, Alina C. Iuga, Kenneth P. Olive, Timothy C. Wang
Cancer Cell, 33, 75-90.e7 (2018)
要 約
これまで,膵臓がんにおいて交感神経のはたす役割については明らかにされていない.この研究において,筆者らは,マウスにおいて膵臓がんはストレスにより進展しやすくなることを示した.さらに,これが膵臓がん細胞におけるカテコールアミンによるアドレナリンβ2受容体シグナル伝達経路を介すること,神経栄養因子NGFの分泌を促進し膵臓がん組織において神経を増生させていることが示された.膵臓がんの発がんモデルマウスにNGFを発現させることにより膵臓がんが進展した.膵臓がんのモデルマウスにおいては,抗がん剤であるゲムシタビンによる治療にくわえ,アドレナリンβ2受容体のアンタゴニストやTrkの阻害剤を併用した治療により生存期間が延長した.膵臓がんの患者のデータにおいては,非選択的β阻害剤の使用と神経栄養因子BDNFの発現量,神経の密度,生存期間とのあいだに関連が認められた.これらの結果から,カテコールアミンはアドレナリンβ2受容体-神経栄養因子-交感神経というフィードフォワードループにより膵臓がんを進展させるという機構が示された.
はじめに
膵臓がんは生存期間の中央値が約6カ月と非常に予後が不良の悪性疾患として知られており,また,症例の数も増加の傾向にある.その多くは診断のときすでに遠隔転移をともなっており根治は困難である.外科的な手術もしくは化学療法が治療の主流であるが,いまだその効果は十分でなく,病態については未解明な部分が多い.
膵臓がんは豊富な間質の変化により特徴づけられる.間質には免疫細胞,血管内皮細胞,ニューロンといったさまざまな細胞が含まれ,相互作用をもちつつがんの微小環境を構成する.近年,がんと交感神経あるいは副交感神経とのかかわりが明らかにされてきており,前立腺がんや胃がんなどにおいて報告がある1,2).膵臓にも交感神経および副交感神経があるが,これらと膵臓がんとのかかわりについて十分には検証されていない.膵臓がん組織においては神経の増生が認められ3),神経の浸潤と予後との相関が報告されていることから4),膵臓がんの進展において神経が大きな役割をはたすことが推測される.
交感神経における神経伝達物質としてアドレナリンおよびノルアドレナリンを含むカテコールアミンが知られており,これらはアドレナリンα受容体およびアドレナリンβ受容体と結合して作用する.これらの受容体はがん細胞にも発現することが知られており,アドレナリンβ受容体への刺激は膵臓がんを進展させることが示唆されている5,6).一方,カテコールアミンは生体においてストレス応答を伝達するが,ストレスによりがんが悪化することも示唆されている7).また,さまざまな種類のがんにおいて,降圧剤であるβ阻害剤の使用は予後を改善させることが示唆されている.これらの背景から,筆者らは,膵臓がんの発がんの過程においてストレスやアドレナリンβ受容体シグナル伝達経路が深くかかわるという仮定をたてた.
1.ストレスによる膵臓がんの発がんの促進
膵臓の上皮細胞に特異的に変異型のKras遺伝子を発現させたマウスは膵臓に前がん病変を発達させることが知られるが8),ほとんどの場合において,がんに進展するにはほかの遺伝子の異常が必要である.この膵臓がんの前がん病変のモデルマウスに拘束によるストレスをあたえ,膵臓における病変の変化を調べた.その結果,ストレスをあたえたマウスにおいて血液中のアドレナリンが増加し,20週齢において比較すると,ストレスをあたえなかったマウスにおいて膵臓がんは発生しなかったのに対し,ストレスをあたえたマウスの38%において膵臓がんが発生した.膵臓がんの前がん病変のモデルマウスの膵臓において,アドレナリンβ受容体のうちアドレナリンβ2受容体の発現がもっとも高値であったため,ストレスをあたえたマウスに対しアドレナリンβ2受容体のアンタゴニストを投与したところ膵臓がんの発生率は低下した.また,アドレナリンβ受容体のアゴニストを投与したところ,膵臓がんの発生率は77%に上昇した.一方,アドレナリンβ2受容体をノックアウトしたところ,ストレスをあたえた際の膵臓がんの発生率は12%まで低下し,副腎を切除する手術をうけたマウスにおいても,ストレスによる膵臓がんの発生率はアドレナリンβ2受容体のアンタゴニストを投与したマウスと同じ程度にまで低下した.また,ストレスをあたえたときあるいはアドレナリンβ受容体のアゴニストを投与したときには前がん病変の周囲に神経が増生し,アドレナリンβ2受容体のアンタゴニストの投与や副腎の切除によりこの神経の増生は抑制された.これらの結果から,長期にわたるストレスおよびカテコールアミンの増加により,膵臓がんの発がんおよびがん組織における神経の増生がもたらされることが示唆された(図1).
2.膵臓がんのモデルマウスにおけるアドレナリンβ2受容体の阻害による生存期間の延長
膵臓の上皮細胞に特異的な変異型のKras遺伝子の発現にくわえてp53遺伝子を変異させたマウスは膵管がんを発生することが知られている9).このマウスに発生した膵臓がんはヒトの膵臓がんと病理学的に類似しているため,膵臓がんのモデルマウスとして使用される.このマウスの膵臓がん細胞においては正常な膵臓と比較してアドレナリンβ2受容体の発現が上昇しており,交感神経の増生も正常な膵臓と比較して顕著であった.この膵臓がんのモデルマウスに発生した膵臓がんの体積が20~60 mm3になった時点で,抗がん剤であるゲムシタビンの単剤あるいはゲムシタビンとアドレナリンβ2受容体のアンタゴニストによる併用療法を開始し生存期間を比較した.その結果,生存期間はゲムシタビンの単剤による治療では18日であったのに対し,併用療法では31日に延長された.また,交感神経を外科的に切除したマウスにおいてはゲムシタビンの単剤での治療による生存期間は36日であった.がん組織における神経の密度を比較すると,ゲムシタビンの単剤による治療と比較して,併用療法あるいはゲムシタビンを投与した交感神経を切除したマウスのゲムシタビンの単剤による治療において,がん組織における神経組織の減少が認められた.
3.カテコールアミンによる腺房-導管異形成および増殖の促進
アドレナリンシグナル伝達経路が膵臓がんを進展させる機構について明らかにするため,膵臓の腺房細胞を用いた3次元培養により,膵臓がんの前段階である腺房-導管異形成とよばれる過程を再現して解析した.変異型のKras遺伝子をもつ膵臓の腺房細胞の培養系をアドレナリンβ受容体のアゴニストにより刺激したところ,腺房-導管異形成により形成されるスフェロイドの数が増加した.この増加は非選択的β阻害剤やアドレナリンβ2受容体のアンタゴニストにより抑制された一方,アドレナリンβ1受容体に特異的な阻害剤の投与により抑制されなかった.また,変異型のKras遺伝子をもちアドレナリンβ2受容体をノックアウトした膵臓の腺房細胞を用いると,アドレナリンβ受容体のアゴニストによりスフェロイドの形成は促進されなかった.また,アドレナリンβ2受容体シグナル伝達経路を構成することが知られるプロテインキナーゼAの阻害剤を投与するとスフェロイドの形成が阻害されたことから,アドレナリンβ2受容体シグナル伝達経路の関与が示唆された.このスフェロイド培養系をマウスの胎仔に由来する後根神経節と共培養したところ,スフェロイドの形成が増加した.後根神経節と共培養するまえにスフェロイドにアドレナリンβ2受容体のアンタゴニストを投与したところ,スフェロイドの形成の増加は抑制された.これらの結果から,カテコールアミンによるアドレナリンβ2受容体への刺激が膵臓がんの発生に寄与することが示唆された.
ヒトおよびマウスの膵臓がん細胞株においても,アドレナリンβ受容体のアゴニストの投与により増殖が促進され,アドレナリンβ2受容体のアンタゴニストの投与により増殖は阻害された.また,アドレナリンβ受容体のアゴニストの投与によりリン酸化ERKやリン酸化CREBが増加し,これらのかかわるシグナル伝達経路の関与が示唆された.
4.アドレナリンシグナル伝達経路による神経栄養因子の分泌の増加および神経の増生による膵臓がんの進展
これまでの結果から,カテコールアミンが神経栄養因子の分泌を介して神経とがんとの相互作用を促進すると仮定した.膵臓がんのモデルマウスのがん組織における神経栄養因子の発現を調べたところ,NGFの発現がもっとも高値であった.また,NGFの発現は,膵臓がんの前がん病変のモデルマウスにおける前がん病変を含む膵臓において上昇しはじめており,膵臓がんのモデルマウスのがん組織においてより顕著に上昇していた.膵臓がんのモデルマウスの膵臓がん組織から確立した細胞株に対しノルアドレナリンを投与したところNGFの発現が上昇し,これはアドレナリンβ2受容体のアンタゴニストの投与,プロテインキナーゼAの阻害剤の投与,MEKの阻害剤の投与により抑制された.
がんの発生のより早い段階におけるNGFの発現を調べるため,変異型のKras遺伝子をもつスフェロイドにノルアドレナリンを投与したところ,やはりNGFの発現が上昇し,これはアドレナリンβ2受容体のアンタゴニストの投与により抑制された.カテコールアミンによるNGFの分泌が実際に神経を増生することを確認するため,膵臓がん細胞株と後根神経節を共培養しアドレナリンβ受容体のアゴニストを投与したところ後根神経節から神経突起が伸長し,これはアドレナリンβ2受容体のアンタゴニストの前投与により抑制された.これらの結果から,アドレナリンβ2受容体シグナル伝達経路によるNGFの分泌の増加が神経を増生し,がんと神経との相互作用をもたらすことが示唆された.
膵臓がんの前がん病変のモデルマウスにNGFを発現させたところ,膵臓における交感神経の増生とともに,前がん病変が進展した.また,膵臓がんのモデルマウスにNGFを発現させたマウスにおいても,膵臓における神経の増生,膵臓がんの進展,生存期間の短縮が認められた.
ヒトの膵臓がん組織からレーザーマイクロダイセクション法により得た膵臓の上皮組織および間質の試料において,神経栄養因子の発現をRNA-seq法により調べたところ,膵臓の上皮組織においてBDNFがもっとも高い発現を示した.ヒトの膵臓がん細胞株であるPanc-1細胞においても,BDNFはもっとも発現の高い神経栄養因子であった.ノルアドレナリンの投与によりBDNFおよびNGFはともに発現が上昇し,アドレナリンβ2受容体のアンタゴニスト,プロテインキナーゼAの阻害剤,MEKの阻害剤により抑制された.これらの結果から,ヒトの膵臓がん細胞においてもアドレナリンβ2シグナル伝達経路が神経栄養因子の分泌を促進することが示された.
5.NGF-Trkシグナル伝達経路の阻害による膵臓がんの進展および神経の増生の抑制
NGFの発現の上昇による膵臓がんの進展という現象についてさらに明らかにするため,神経栄養因子の受容体であるTrkの阻害剤を使用した.まず,in vitroにおいて膵臓がん細胞がTrkを発現していること,NGFの投与により膵臓がん細胞の増殖が促進され,それがTrkの阻害剤の投与により抑制されることが確認された.また,スフェロイド培養を用いて,NGFによる増殖の促進がアドレナリンβ2受容体シグナル伝達経路によるものではないことが示された.マウスの膵臓がん細胞と後根神経節の共培養系において,Trkの阻害剤を投与することにより神経突起の伸長が抑制された.したがって,膵臓がん細胞から分泌されたNGFは周囲の神経の増生を促進するとともに,オートクラインにより膵臓がん細胞それ自体の増殖を促進する可能性が示唆された.
膵臓がんの前がん病変のモデルマウスに対しセルレインを投与することにより発がんを促進し,Trkの阻害剤を投与しなかったマウスと投与したマウスとで24週齢における膵臓がんの発がん率を比較した.Trkの阻害剤を投与しなかったマウスでは発がん率は60%であったのに対し,Trkの阻害剤を投与したマウスでは発がん率は10%まで低下した.さらに,膵臓がんのモデルマウスを用いて,膵臓がんが直径3~6 mmになった時点でゲムシタビンの単剤あるいはゲムシタビンとTrkの阻害剤の併用療法を実施し生存期間を比較したところ,併用療法では生存期間の延長し,神経組織が減少した.これらの結果から,NGF-Trkシグナル伝達経路の阻害により膵臓がん組織における神経の増生および膵臓がんの進展が抑制されることが示された.NGFのオートクラインによる影響について評価するため,膵臓がんのモデルマウスの膵臓がんが20~60 mm3になった時点からゲムシタビン,アドレナリンβ2受容体のアンタゴニスト,Trkの阻害剤の3剤による併用療法を実施したところ,生存期間は47日であった.これは,ゲムシタビンとアドレナリンβ2受容体のアンタゴニストの併用療法をうけたマウスの生存期間と比較して延長していたことから,NGFによるオートクラインの影響が示唆されたものの,これらの実験は同時に実施されたものではないため直接の比較は困難であった.
6.外科的な切除をうけた膵臓がんの患者に対する非選択的β阻害剤による生存期間の延長
ヒトの膵臓がんにおけるアドレナリンβ2シグナル伝達経路およびがんと神経とのあいだの相互作用の役割について明らかにするため,ヒトの膵臓がん組織から作製したオルガノイドを用いた.ゲムシタビン,非選択的β阻害剤,アドレナリンβ2受容体のアンタゴニストを投与するとオルガノイドが減少したが,アドレナリンβ1受容体の阻害剤の投与では減少しなかった.
アドレナリンβ2受容体の阻害と膵臓がんの患者の予後との相関について,外科的な切除をうけたステージIIおよびステージIIIの膵臓がんの患者のデータを後ろ向き解析した.β阻害剤を使用しなかった患者の生存期間が23カ月であったのに対し,すべてのβ阻害剤の使用例において生存期間は24カ月であり有意差は認められなかった.一方,非選択的β阻害剤の使用例に限定すると生存期間は40カ月に延長した.β阻害剤の使用例において心血管系のリスクが高いほかには,患者の背景に差はみられなかった.免疫染色においては,非選択的β阻害剤の使用例において神経マーカーであるS-100染色およびBDNF染色の減少が認められた.これらの結果から,外科的な切除をうけたステージIIおよびステージIIIの膵臓がんの患者において,非選択的β阻害剤の使用による神経組織の減少および予後の改善が示唆された.
おわりに
この研究においては,膵臓がんやその前段階において,カテコールアミンによるアドレナリンβ2受容体シグナル伝達経路を介した神経栄養因子の分泌の亢進が起こり,がん組織における神経の増生をもたらす結果,さらに,カテコールアミンが増加するというがんと神経とのあいだの相互作用が示された(図2).アドレナリンβ2受容体の阻害もしくはTrkの阻害が治療の標的あるいは予防的な治療になりうると考えられた.
文 献
- Magnon, C., Hall, S. J., Lin, J. et al.: Autonomic nerve development contributes to prostate cancer progression. Science, 341, 1236361 (2013)[PubMed]
- Hayakawa, Y., Sakitani, K., Konishi, M. et al.: Nerve growth factor promotes gastric tumorigenesis through aberrant cholinergic signaling. Cancer Cell, 31, 21-34 (2017)[PubMed]
- Ceyhan, G. O., Bergmann, F., Kadihasanoglu, M. et al.: Pancreatic neuropathy and neuropathic pain: a comprehensive pathomorphological study of 546 cases. Gastroenterology, 136, 177-186.e1 (2009)[PubMed]
- Liebl, F., Demir, I. E., Mayer, K. et al.: The impact of neural invasion severity in gastrointestinal malignancies: a clinicopathological study. Ann. Surg., 260, 900-907 (2014)[PubMed]
- Guo, K., Ma, Q., Li, J. et al.: Interaction of the sympathetic nerve with pancreatic cancer cells promotes perineural invasion through the activation of STAT3 signaling. Mol. Cancer Ther., 12, 264-273 (2013)[PubMed]
- Zhang, D., Ma, Q. -Y., Hu, H. -T. et al.: β2-adrenergic antagonists suppress pancreatic cancer cell invasion by inhibiting CREB, NFκB and AP-1. Cancer Biol. Ther., 10, 19-29 (2010)[PubMed]
- Jansen, L., Hoffmeister, M., Arndt, V. et al.: Stage-specific associations between beta blocker use and prognosis after colorectal cancer. Cancer, 120, 1178-1186 (2014)[PubMed]
- Hingorani, S. R., Petricoin, E. F., Maitra, A. et al.: Preinvasive and invasive ductal pancreatic cancer and its early detection in the mouse. Cancer Cell, 4, 437-450 (2003)[PubMed]
- Hingorani, S. R., Wang, L., Multani, A. S. et al.: Trp53R172H and KrasG12D cooperate to promote chromosomal instability and widely metastatic pancreatic ductal adenocarcinoma in mice. Cancer Cell, 7, 469-483 (2005)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2012年 東京大学大学院医学系研究科博士課程 修了,2015年より米国Columbia大学 ポスドク研究員.
研究テーマ:膵臓がんの病態.
抱負:難治がんであり複雑な病態をもつ膵臓がんの治療の発展のために,新たな知見を見い出していきたい.
Bernhard W. Renz
ドイツMunich大学病院.
Timothy C. Wang
米国Columbia大学Medical CenterにてProfessor.
© 2018 高橋良太・Bernhard W. Renz・Timothy C. Wang Licensed under CC 表示 2.1 日本