腸管においてT細胞に発現する多剤排出トランスポーターMDR1は胆汁酸がひき起こす炎症応答を抑制することにより回腸炎の発症をふせぐ
香山尚子1・竹田 潔1・Mark S. Sundrud 2
(1大阪大学大学院医学系研究科 免疫制御学,2米国Scripps Research Institute,Department of Immunology and Microbiology)
email:香山尚子
DOI: 10.7875/first.author.2018.003
The xenobiotic transporter Mdr1 enforces T cell homeostasis in the presence of intestinal bile acids.
Wei Cao, Hisako Kayama, Mei Lan Chen, Amber Delmas, Amy Sun, Sang Yong Kim, Erumbi S. Rangarajan, Kelly McKevitt, Amanda P. Beck, Cody B. Jackson, Gogce Crynen, Angelos Oikonomopoulos, Precious N. Lacey, Gustavo J. Martinez, Tina Izard, Robin G. Lorenz, Alex Rodriguez-Palacios, Fabio Cominelli, Maria T. Abreu, Daniel W. Hommes, Sergei B. Koralov, Kiyoshi Takeda, Mark S. Sundrud
Immunity, 47, 1182-1196.e10 (2017)
腸管に局在する獲得免疫細胞の一種であるエフェクターCD4陽性T細胞の活性の異常は,クローン病や潰瘍性大腸炎といった炎症性腸疾患の病態に深く関与する.そのため,CD4陽性T細胞の分化および活性化は腸内細菌およびその代謝産物により厳密に制御される.腸管は,腸内細菌のみならず,胆汁酸をはじめとする宿主が産生した代謝産物が豊富に存在する場である.しかし,宿主の代謝産物が腸管の免疫細胞におよぼす影響については明らかにされていない.この研究において,筆者らは,胆汁酸が豊富に存在する回腸の粘膜固有層に局在するCD4陽性T細胞に,多剤排出トランスポーターであるMDR1が高発現することを見い出した.MDR1ノックアウトマウスの脾臓から回収したナイーブCD4陽性T細胞を移入したRAG1ノックアウトマウスにおいてクローン病様の回腸炎が発症し,胆汁酸の除去によりMDR1の欠損にともなう回腸炎は抑制された.また,胆汁酸はMDR1欠損CD4陽性T細胞において酸化ストレスおよび炎症性サイトカインの産生を亢進することにより,クローン病様の回腸炎の病態に関与することが示された.さらに,回腸クローン病の患者の一部においてMDR1の機能が低下していた.これらの結果より,胆汁酸が豊富に存在する回腸においては,CD4陽性T細胞にMDR1が発現することにより正常なエフェクター応答が維持され,組織の破壊が抑制されることが明らかにされた.
病原体をはじめ外来の異物の侵入の場である腸管において,獲得免疫細胞の一種であるエフェクターCD4陽性T細胞による炎症応答は生体防御に必須である.しかし,エフェクターCD4陽性T細胞の過剰な活性化はクローン病や潰瘍性大腸炎といった炎症性腸疾患の病態に深く関与するため1),厳密に制御される必要がある.腸内細菌が産生するポリサッカライドAや短鎖脂肪酸は,Foxp3陽性の制御性T細胞の分化および機能の獲得をひき起こすことによりエフェクターCD4陽性T細胞の炎症応答を負に制御する2,3).また,腸内細菌によるToll様受容体シグナルの活性化は,CX3CR1を高発現するマクロファージの腸間膜リンパ節への移動を制限することによりT細胞のプライミングを抑制する4).腸内細菌と腸管免疫系との相互作用に関する多様な分子機構が明らかにされた一方,腸管免疫系の制御における宿主に由来する代謝産物の役割は明らかにされていない.
腸内細菌と同様に,胆汁酸も消化管の生理的な機能に重要な役割をはたす5).肝臓において合成される胆汁酸は,食物の摂取により十二指腸に分泌され,食物に含まれる脂質の成分を乳化し消化および吸収の促進に寄与する.そののち,胆汁酸は回腸の上皮細胞により再吸収され,粘膜固有層に蓄積されたのち門脈をとおり肝臓へともどる.哺乳類には5種類の胆汁酸が存在する.肝臓において合成される1次胆汁酸にはコール酸,ケノデオキシコール酸,βムリコール酸がある.1次胆汁酸は腸内細菌により2次胆汁酸であるデオキシコール酸およびリトコール酸に変換される.いずれの胆汁酸にも,遊離型,グリシン抱合型,タウリン抱合型が存在し,腸管においては抱合型の胆汁酸が主要である.2次胆汁酸の腸管免疫系への作用に関しては報告がある一方,1次胆汁酸の腸管免疫系へおよぼす影響については明らかにされていない.
MDR1はがん細胞に取り込まれた抗がん剤をATPに依存的に細胞の外へと排出する多剤排出トランスポーターである6).また,腸管の粘膜固有層にはMDR1を発現するエフェクターCD4陽性T細胞が集積すること7),MDR1ノックアウトマウスは腸炎を自然発症すること8),ABCB1遺伝子の多型が炎症性腸疾患に関与すること9) が報告されている.しかし,エフェクターCD4陽性T細胞に発現するMDR1の生理的な機能については未解明である.この研究においては,腸管の粘膜固有層に存在するCD4陽性T細胞に発現するMDR1による腸管における恒常性の維持の機構について解析した.
腸管におけるMDR1陽性CD4陽性T細胞の詳細な局在について明らかにするため,十二指腸,空腸,回腸,大腸の粘膜固有層より細胞を回収し,MDR1により特異的に排出される蛍光色素であるローダミン123を取り込ませたのち,その排出能を蛍光セルソーターを用いて解析した.その結果,十二指腸,空腸,大腸においてはエフェクターCD4陽性T細胞のうち約40%がMDR1を発現するのに対し,回腸においてはほぼすべてのエフェクターCD4陽性T細胞がMDR1を発現することが明らかにされた.小腸の粘膜固有層に局在する自然免疫細胞であるCD103陽性の樹状細胞あるいはCX3CR1陽性細胞とMDR1を発現していないCD4陽性T細胞とを共培養したところ,CD103陽性の樹状細胞と共培養したCD4陽性T細胞でのみMDR1が発現した.
野生型のマウスおよびMDR1ノックアウトマウスの脾臓から回収したナイーブCD4陽性T細胞をRAG1ノックアウトマウスに移入し,腸管炎症のモデルマウスを作製した.野生型のT細胞あるいはMDR1欠損T細胞を移入したマウスはともに大腸炎を発症し,組織学的な検査により炎症の程度に差はないことが示された.一方で,MDR1欠損T細胞を移入したマウスにおいてのみ重篤な回腸炎が生じた.16S rRNAメタゲノム解析により,野生型のT細胞あるいはMDR1欠損T細胞を移入したマウスにおいて腸内細菌叢に違いはないことが示された.また,MDR1欠損T細胞を移入したマウスに抗生剤を投与しても回腸炎は改善しなかったことより,MDR1欠損CD4陽性T細胞による回腸炎は腸内細菌に非依存的であることが示唆された.回腸炎と一致して,野生型のT細胞を移入したマウスに比べ,MDR1欠損T細胞を移入したマウスの回腸の粘膜固有層においては,炎症性サイトカインであるTNFα,インターロイキン17,インターフェロンγを産生するエフェクターCD4陽性T細胞が顕著に増加していた.これらの結果より,回腸に局在するエフェクターCD4陽性T細胞におけるMDR1の発現は,炎症性サイトカインの発現の抑制および腸管における恒常性の維持に必須であることが強く示唆された.
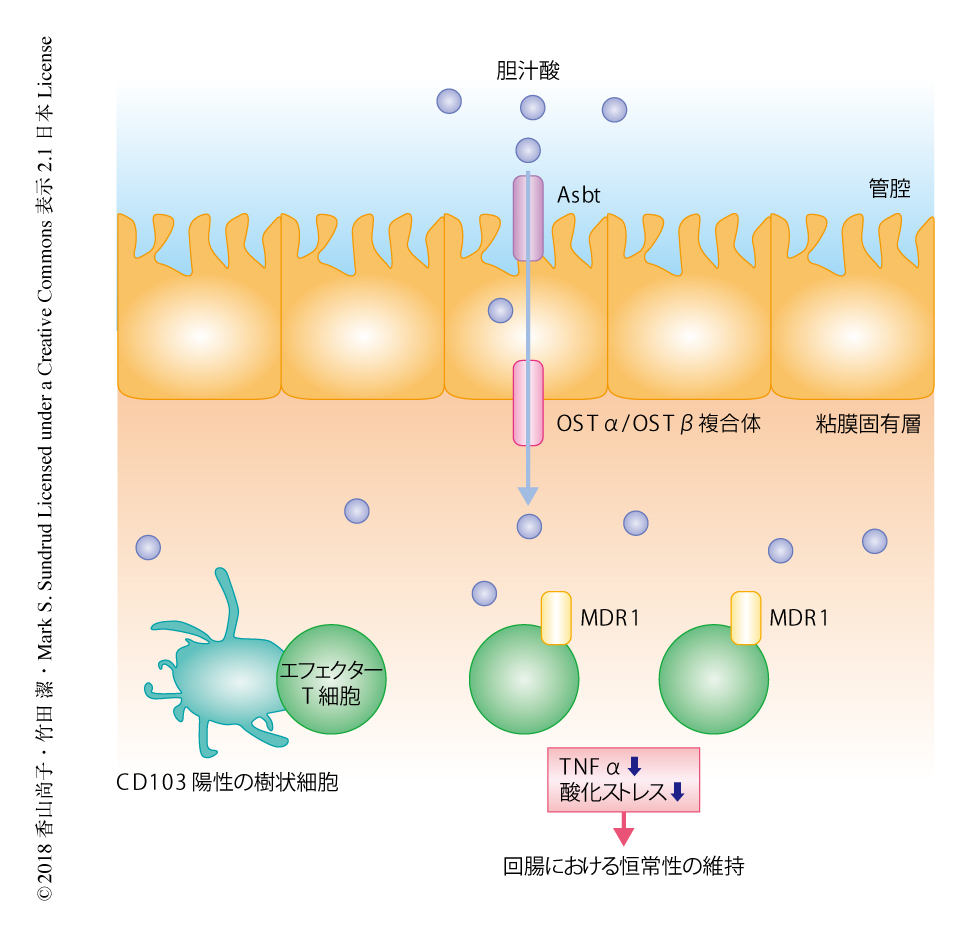
MDR1欠損CD4陽性T細胞を移入したRAG1ノックアウトマウスに対する抗生剤の投与が回腸炎の改善につながらなかったことから,エフェクターCD4陽性T細胞に発現するMDR1は腸内細菌ではなく宿主に由来する代謝産物と相互作用する可能性が示唆された.肝臓において合成され十二指腸に分泌された胆汁酸は,胆汁酸のトランスポーターであるAsbtにより回腸の上皮細胞に取り込まれ,OSTα-OSTβ複合体により粘膜固有層の側に排出されたのち,門脈をとおり肝臓へともどる.そのため,腸管のほかの組織とは異なり,回腸に局在する細胞はつねに胆汁酸にさらされている.高濃度の胆汁酸は細胞毒性が高く,胆汁うっ滞性の肝疾患においては胆汁酸が肝細胞の壊死をひき起こすことが報告されている10).
MDR1欠損CD4陽性T細胞を移入したRAG1ノックアウトマウスにおける腸内細菌に依存しない回腸炎に胆汁酸が関与する可能性を考え,腸内細菌をもたない無菌マウスおよびSPFマウスにおいて小腸の管腔における胆汁酸の濃度を測定した.その結果,無菌マウスにおける胆汁酸の濃度はSPFマウスと同等であった.shRNAによりMDR1をノックダウンしたナイーブCD4陽性T細胞あるいは対照となるナイーブCD4陽性T細胞を移入したRAG1ノックアウトマウスおよびRAG1 Asbtダブルノックアウトマウスの小腸の粘膜固有層からエフェクターCD4陽性T細胞を回収し,RNA-seq法によりトランスクリプトームを解析した.RAG1ノックアウトマウスから回収したMDR1をノックダウンしたエフェクターCD4陽性T細胞においては,対照となるエフェクターCD4陽性T細胞に比べ,TNFαの発現が亢進していた.また,MDR1をノックダウンしたエフェクターCD4陽性T細胞においては,酸化ストレス,DNA損傷,アポトーシスに関連する遺伝子の発現が顕著に上昇していた.一方,RAG1 Asbtダブルノックアウトマウスから回収したMDR1をノックダウンしたエフェクターCD4陽性T細胞においては,炎症性サイトカイン,酸化ストレス,DNA損傷,アポトーシスに関連する遺伝子の発現の上昇はみられなかった.
CD4陽性T細胞におけるMDR1の欠損が胆汁酸に依存的な回腸炎に関与するかどうか調べるため,野生型あるいはMDR1を欠損したナイーブCD4陽性T細胞を移入したRAG1ノックアウトマウスに胆汁酸の吸着剤であるコレスチラミンを投与し,回腸における胆汁酸の再吸収を阻害することにより粘膜固有層におけるエフェクターCD4陽性T細胞への胆汁酸の作用を阻害した.その結果,コレスチラミンの投与により,MDR1を欠損したナイーブCD4陽性T細胞を移入したRAG1ノックアウトマウスにおける回腸炎が劇的に改善した.その際,小腸の粘膜固有層に存在するMDR1を欠損したエフェクターCD4陽性T細胞におけるTNFαの産生が顕著に低下するとともに,アポトーシスおよびDNA損傷に関連する遺伝子の発現も顕著に低下した.これらの結果より,MDR1は胆汁酸の存在下におけるエフェクターCD4陽性T細胞のサイトカインの産生,酸化ストレス,細胞死の抑制に寄与することにより,回腸炎を抑制することが示された.
マウスを用いたMDR1の機能の解析の結果から,炎症性腸疾患の患者におけるMDR1の機能の低下が示唆された.そこで,健常者,潰瘍性大腸炎の患者,非回腸クローン病の患者,回腸クローン病の患者について,末梢血のエフェクターCD4陽性T細胞,ナイーブCD8陽性T細胞,CD45RO陽性エフェクターCD8陽性T細胞,CD45RO陰性エフェクターCD8陽性T細胞において,MDR1に依存的なローダミン123の排出を解析しランクづけをした.その結果,健常者に比べ,すべての炎症性腸疾患の患者においてMDR1の機能が低下していること,外科的な手術およびいずれの薬物療法もMDR1の機能の低下に関与しないことが示された.また,MDR1の機能が顕著に低い8名の患者においては,いずれのT細胞の集団においても同様にMDR1の機能がいちじるしく低下していた.さらに,潰瘍性大腸炎の患者および非回腸クローン病の患者に比べ,回腸クローン病の患者においては高い割合でMDR1の機能が低下していた.これらの結果より,ヒトの回腸においてもMDR1はエフェクター応答の制御を介して炎症の抑制に機能することが強く示唆された.
腸内細菌や食事の成分など多様な環境因子につねにさらされる腸管の粘膜固有層に存在する免疫細胞は,多様な分子機構により炎症応答が厳密に制御されている.宿主の代謝産物である胆汁酸の再吸収の場である回腸においては,自然免疫細胞であるCD103陽性の樹状細胞によるMDR1の発現の誘導がエフェクターT細胞の炎症応答の制御に必須であるとともに,回腸炎の抑制に機能することが明らかにされた(図1).また,炎症性腸疾患の一部の患者においてエフェクターT細胞におけるMDR1の機能の不全が顕著であることより,今後,MDR1および胆汁酸を標的としたクローン病の新規の治療法の開発が期待される.
略歴:2009年 大阪大学大学院医学系研究科博士課程 修了,同年より同 助教.
研究テーマ:粘膜免疫.
竹田 潔(Kiyoshi Takeda)
大阪大学大学院医学系研究科 教授.
Mark S. Sundrud
米国Scripps Research InstituteにてAssistant Professor.
© 2018 香山尚子・竹田 潔・Mark S. Sundrud Licensed under CC 表示 2.1 日本
(1大阪大学大学院医学系研究科 免疫制御学,2米国Scripps Research Institute,Department of Immunology and Microbiology)
email:香山尚子
DOI: 10.7875/first.author.2018.003
The xenobiotic transporter Mdr1 enforces T cell homeostasis in the presence of intestinal bile acids.
Wei Cao, Hisako Kayama, Mei Lan Chen, Amber Delmas, Amy Sun, Sang Yong Kim, Erumbi S. Rangarajan, Kelly McKevitt, Amanda P. Beck, Cody B. Jackson, Gogce Crynen, Angelos Oikonomopoulos, Precious N. Lacey, Gustavo J. Martinez, Tina Izard, Robin G. Lorenz, Alex Rodriguez-Palacios, Fabio Cominelli, Maria T. Abreu, Daniel W. Hommes, Sergei B. Koralov, Kiyoshi Takeda, Mark S. Sundrud
Immunity, 47, 1182-1196.e10 (2017)
要 約
腸管に局在する獲得免疫細胞の一種であるエフェクターCD4陽性T細胞の活性の異常は,クローン病や潰瘍性大腸炎といった炎症性腸疾患の病態に深く関与する.そのため,CD4陽性T細胞の分化および活性化は腸内細菌およびその代謝産物により厳密に制御される.腸管は,腸内細菌のみならず,胆汁酸をはじめとする宿主が産生した代謝産物が豊富に存在する場である.しかし,宿主の代謝産物が腸管の免疫細胞におよぼす影響については明らかにされていない.この研究において,筆者らは,胆汁酸が豊富に存在する回腸の粘膜固有層に局在するCD4陽性T細胞に,多剤排出トランスポーターであるMDR1が高発現することを見い出した.MDR1ノックアウトマウスの脾臓から回収したナイーブCD4陽性T細胞を移入したRAG1ノックアウトマウスにおいてクローン病様の回腸炎が発症し,胆汁酸の除去によりMDR1の欠損にともなう回腸炎は抑制された.また,胆汁酸はMDR1欠損CD4陽性T細胞において酸化ストレスおよび炎症性サイトカインの産生を亢進することにより,クローン病様の回腸炎の病態に関与することが示された.さらに,回腸クローン病の患者の一部においてMDR1の機能が低下していた.これらの結果より,胆汁酸が豊富に存在する回腸においては,CD4陽性T細胞にMDR1が発現することにより正常なエフェクター応答が維持され,組織の破壊が抑制されることが明らかにされた.
はじめに
病原体をはじめ外来の異物の侵入の場である腸管において,獲得免疫細胞の一種であるエフェクターCD4陽性T細胞による炎症応答は生体防御に必須である.しかし,エフェクターCD4陽性T細胞の過剰な活性化はクローン病や潰瘍性大腸炎といった炎症性腸疾患の病態に深く関与するため1),厳密に制御される必要がある.腸内細菌が産生するポリサッカライドAや短鎖脂肪酸は,Foxp3陽性の制御性T細胞の分化および機能の獲得をひき起こすことによりエフェクターCD4陽性T細胞の炎症応答を負に制御する2,3).また,腸内細菌によるToll様受容体シグナルの活性化は,CX3CR1を高発現するマクロファージの腸間膜リンパ節への移動を制限することによりT細胞のプライミングを抑制する4).腸内細菌と腸管免疫系との相互作用に関する多様な分子機構が明らかにされた一方,腸管免疫系の制御における宿主に由来する代謝産物の役割は明らかにされていない.
腸内細菌と同様に,胆汁酸も消化管の生理的な機能に重要な役割をはたす5).肝臓において合成される胆汁酸は,食物の摂取により十二指腸に分泌され,食物に含まれる脂質の成分を乳化し消化および吸収の促進に寄与する.そののち,胆汁酸は回腸の上皮細胞により再吸収され,粘膜固有層に蓄積されたのち門脈をとおり肝臓へともどる.哺乳類には5種類の胆汁酸が存在する.肝臓において合成される1次胆汁酸にはコール酸,ケノデオキシコール酸,βムリコール酸がある.1次胆汁酸は腸内細菌により2次胆汁酸であるデオキシコール酸およびリトコール酸に変換される.いずれの胆汁酸にも,遊離型,グリシン抱合型,タウリン抱合型が存在し,腸管においては抱合型の胆汁酸が主要である.2次胆汁酸の腸管免疫系への作用に関しては報告がある一方,1次胆汁酸の腸管免疫系へおよぼす影響については明らかにされていない.
MDR1はがん細胞に取り込まれた抗がん剤をATPに依存的に細胞の外へと排出する多剤排出トランスポーターである6).また,腸管の粘膜固有層にはMDR1を発現するエフェクターCD4陽性T細胞が集積すること7),MDR1ノックアウトマウスは腸炎を自然発症すること8),ABCB1遺伝子の多型が炎症性腸疾患に関与すること9) が報告されている.しかし,エフェクターCD4陽性T細胞に発現するMDR1の生理的な機能については未解明である.この研究においては,腸管の粘膜固有層に存在するCD4陽性T細胞に発現するMDR1による腸管における恒常性の維持の機構について解析した.
1.CD4陽性T細胞に発現するMDR1は回腸炎の抑制に機能する
腸管におけるMDR1陽性CD4陽性T細胞の詳細な局在について明らかにするため,十二指腸,空腸,回腸,大腸の粘膜固有層より細胞を回収し,MDR1により特異的に排出される蛍光色素であるローダミン123を取り込ませたのち,その排出能を蛍光セルソーターを用いて解析した.その結果,十二指腸,空腸,大腸においてはエフェクターCD4陽性T細胞のうち約40%がMDR1を発現するのに対し,回腸においてはほぼすべてのエフェクターCD4陽性T細胞がMDR1を発現することが明らかにされた.小腸の粘膜固有層に局在する自然免疫細胞であるCD103陽性の樹状細胞あるいはCX3CR1陽性細胞とMDR1を発現していないCD4陽性T細胞とを共培養したところ,CD103陽性の樹状細胞と共培養したCD4陽性T細胞でのみMDR1が発現した.
野生型のマウスおよびMDR1ノックアウトマウスの脾臓から回収したナイーブCD4陽性T細胞をRAG1ノックアウトマウスに移入し,腸管炎症のモデルマウスを作製した.野生型のT細胞あるいはMDR1欠損T細胞を移入したマウスはともに大腸炎を発症し,組織学的な検査により炎症の程度に差はないことが示された.一方で,MDR1欠損T細胞を移入したマウスにおいてのみ重篤な回腸炎が生じた.16S rRNAメタゲノム解析により,野生型のT細胞あるいはMDR1欠損T細胞を移入したマウスにおいて腸内細菌叢に違いはないことが示された.また,MDR1欠損T細胞を移入したマウスに抗生剤を投与しても回腸炎は改善しなかったことより,MDR1欠損CD4陽性T細胞による回腸炎は腸内細菌に非依存的であることが示唆された.回腸炎と一致して,野生型のT細胞を移入したマウスに比べ,MDR1欠損T細胞を移入したマウスの回腸の粘膜固有層においては,炎症性サイトカインであるTNFα,インターロイキン17,インターフェロンγを産生するエフェクターCD4陽性T細胞が顕著に増加していた.これらの結果より,回腸に局在するエフェクターCD4陽性T細胞におけるMDR1の発現は,炎症性サイトカインの発現の抑制および腸管における恒常性の維持に必須であることが強く示唆された.
2.MDR1は胆汁酸の存在下におけるCD4陽性T細胞の恒常性の維持に必須である
MDR1欠損CD4陽性T細胞を移入したRAG1ノックアウトマウスに対する抗生剤の投与が回腸炎の改善につながらなかったことから,エフェクターCD4陽性T細胞に発現するMDR1は腸内細菌ではなく宿主に由来する代謝産物と相互作用する可能性が示唆された.肝臓において合成され十二指腸に分泌された胆汁酸は,胆汁酸のトランスポーターであるAsbtにより回腸の上皮細胞に取り込まれ,OSTα-OSTβ複合体により粘膜固有層の側に排出されたのち,門脈をとおり肝臓へともどる.そのため,腸管のほかの組織とは異なり,回腸に局在する細胞はつねに胆汁酸にさらされている.高濃度の胆汁酸は細胞毒性が高く,胆汁うっ滞性の肝疾患においては胆汁酸が肝細胞の壊死をひき起こすことが報告されている10).
MDR1欠損CD4陽性T細胞を移入したRAG1ノックアウトマウスにおける腸内細菌に依存しない回腸炎に胆汁酸が関与する可能性を考え,腸内細菌をもたない無菌マウスおよびSPFマウスにおいて小腸の管腔における胆汁酸の濃度を測定した.その結果,無菌マウスにおける胆汁酸の濃度はSPFマウスと同等であった.shRNAによりMDR1をノックダウンしたナイーブCD4陽性T細胞あるいは対照となるナイーブCD4陽性T細胞を移入したRAG1ノックアウトマウスおよびRAG1 Asbtダブルノックアウトマウスの小腸の粘膜固有層からエフェクターCD4陽性T細胞を回収し,RNA-seq法によりトランスクリプトームを解析した.RAG1ノックアウトマウスから回収したMDR1をノックダウンしたエフェクターCD4陽性T細胞においては,対照となるエフェクターCD4陽性T細胞に比べ,TNFαの発現が亢進していた.また,MDR1をノックダウンしたエフェクターCD4陽性T細胞においては,酸化ストレス,DNA損傷,アポトーシスに関連する遺伝子の発現が顕著に上昇していた.一方,RAG1 Asbtダブルノックアウトマウスから回収したMDR1をノックダウンしたエフェクターCD4陽性T細胞においては,炎症性サイトカイン,酸化ストレス,DNA損傷,アポトーシスに関連する遺伝子の発現の上昇はみられなかった.
CD4陽性T細胞におけるMDR1の欠損が胆汁酸に依存的な回腸炎に関与するかどうか調べるため,野生型あるいはMDR1を欠損したナイーブCD4陽性T細胞を移入したRAG1ノックアウトマウスに胆汁酸の吸着剤であるコレスチラミンを投与し,回腸における胆汁酸の再吸収を阻害することにより粘膜固有層におけるエフェクターCD4陽性T細胞への胆汁酸の作用を阻害した.その結果,コレスチラミンの投与により,MDR1を欠損したナイーブCD4陽性T細胞を移入したRAG1ノックアウトマウスにおける回腸炎が劇的に改善した.その際,小腸の粘膜固有層に存在するMDR1を欠損したエフェクターCD4陽性T細胞におけるTNFαの産生が顕著に低下するとともに,アポトーシスおよびDNA損傷に関連する遺伝子の発現も顕著に低下した.これらの結果より,MDR1は胆汁酸の存在下におけるエフェクターCD4陽性T細胞のサイトカインの産生,酸化ストレス,細胞死の抑制に寄与することにより,回腸炎を抑制することが示された.
3.炎症性腸疾患の患者におけるMDR1の機能の低下
マウスを用いたMDR1の機能の解析の結果から,炎症性腸疾患の患者におけるMDR1の機能の低下が示唆された.そこで,健常者,潰瘍性大腸炎の患者,非回腸クローン病の患者,回腸クローン病の患者について,末梢血のエフェクターCD4陽性T細胞,ナイーブCD8陽性T細胞,CD45RO陽性エフェクターCD8陽性T細胞,CD45RO陰性エフェクターCD8陽性T細胞において,MDR1に依存的なローダミン123の排出を解析しランクづけをした.その結果,健常者に比べ,すべての炎症性腸疾患の患者においてMDR1の機能が低下していること,外科的な手術およびいずれの薬物療法もMDR1の機能の低下に関与しないことが示された.また,MDR1の機能が顕著に低い8名の患者においては,いずれのT細胞の集団においても同様にMDR1の機能がいちじるしく低下していた.さらに,潰瘍性大腸炎の患者および非回腸クローン病の患者に比べ,回腸クローン病の患者においては高い割合でMDR1の機能が低下していた.これらの結果より,ヒトの回腸においてもMDR1はエフェクター応答の制御を介して炎症の抑制に機能することが強く示唆された.
おわりに
腸内細菌や食事の成分など多様な環境因子につねにさらされる腸管の粘膜固有層に存在する免疫細胞は,多様な分子機構により炎症応答が厳密に制御されている.宿主の代謝産物である胆汁酸の再吸収の場である回腸においては,自然免疫細胞であるCD103陽性の樹状細胞によるMDR1の発現の誘導がエフェクターT細胞の炎症応答の制御に必須であるとともに,回腸炎の抑制に機能することが明らかにされた(図1).また,炎症性腸疾患の一部の患者においてエフェクターT細胞におけるMDR1の機能の不全が顕著であることより,今後,MDR1および胆汁酸を標的としたクローン病の新規の治療法の開発が期待される.
文 献
- Kaser, A., Zeissig, S. & Blumberg, R. S.: Inflammatory bowel disease. Annu. Rev. Immunol., 28, 573-621 (2010)[PubMed]
- Arpaia, N., Campbell, C., Fan, X. et al.: Metabolites produced by commensal bacteria promote peripheral regulatory T-cell generation. Nature, 504, 451-455 (2013)[PubMed]
- Mazmanian, S. K., Round, J. L. & Kasper, D. L.: A microbial symbiosis factor prevents intestinal inflammatory disease. Nature, 453, 620-625 (2008)[PubMed]
- Diehl, G. E., Longman, R. S., Zhang, J. X. et al.: Microbiota restricts trafficking of bacteria to mesenteric lymph nodes by CX3CR1hi cells. Nature, 494, 116-120 (2013)[PubMed]
- Hofmann, A. F. & Hagey, L. R.: Key discoveries in bile acid chemistry and biology and their clinical applications: history of the last eight decades. J. Lipid Res., 55, 1553-1595 (2014)[PubMed]
- Gottesman, M. M., Fojo, T. & Bates, S. E.: Multidrug resistance in cancer: role of ATP-dependent transporters. Nat. Rev. Cancer, 2, 48-58 (2002)[PubMed]
- Ramesh, R., Kozhaya, L., McKevitt, K. et al.: Pro-inflammatory human Th17 cells selectively express P-glycoprotein and are refractory to glucocorticoids. J. Exp. Med., 211, 89-104 (2014)[PubMed]
- Panwala, C. M., Jones, J. C. & Viney, J. L.: A novel model of inflammatory bowel disease: mice deficient for the multiple drug resistance gene, mdr1a, spontaneously develop colitis. J. Immunol., 161, 5733-5744 (1998)[PubMed]
- Annese, V., Valvano, M. R., Palmieri, O. et al.: Multidrug resistance 1 gene in inflammatory bowel disease: a meta-analysis. World J. Gastroenterol., 12, 3636-3644 (2006)[PubMed]
- Poupon, R., Chazouilleres, O. & Poupon, R. E.: Chronic cholestatic diseases. J. Hepatol., 32, 129-140 (2000)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2009年 大阪大学大学院医学系研究科博士課程 修了,同年より同 助教.
研究テーマ:粘膜免疫.
竹田 潔(Kiyoshi Takeda)
大阪大学大学院医学系研究科 教授.
Mark S. Sundrud
米国Scripps Research InstituteにてAssistant Professor.
© 2018 香山尚子・竹田 潔・Mark S. Sundrud Licensed under CC 表示 2.1 日本