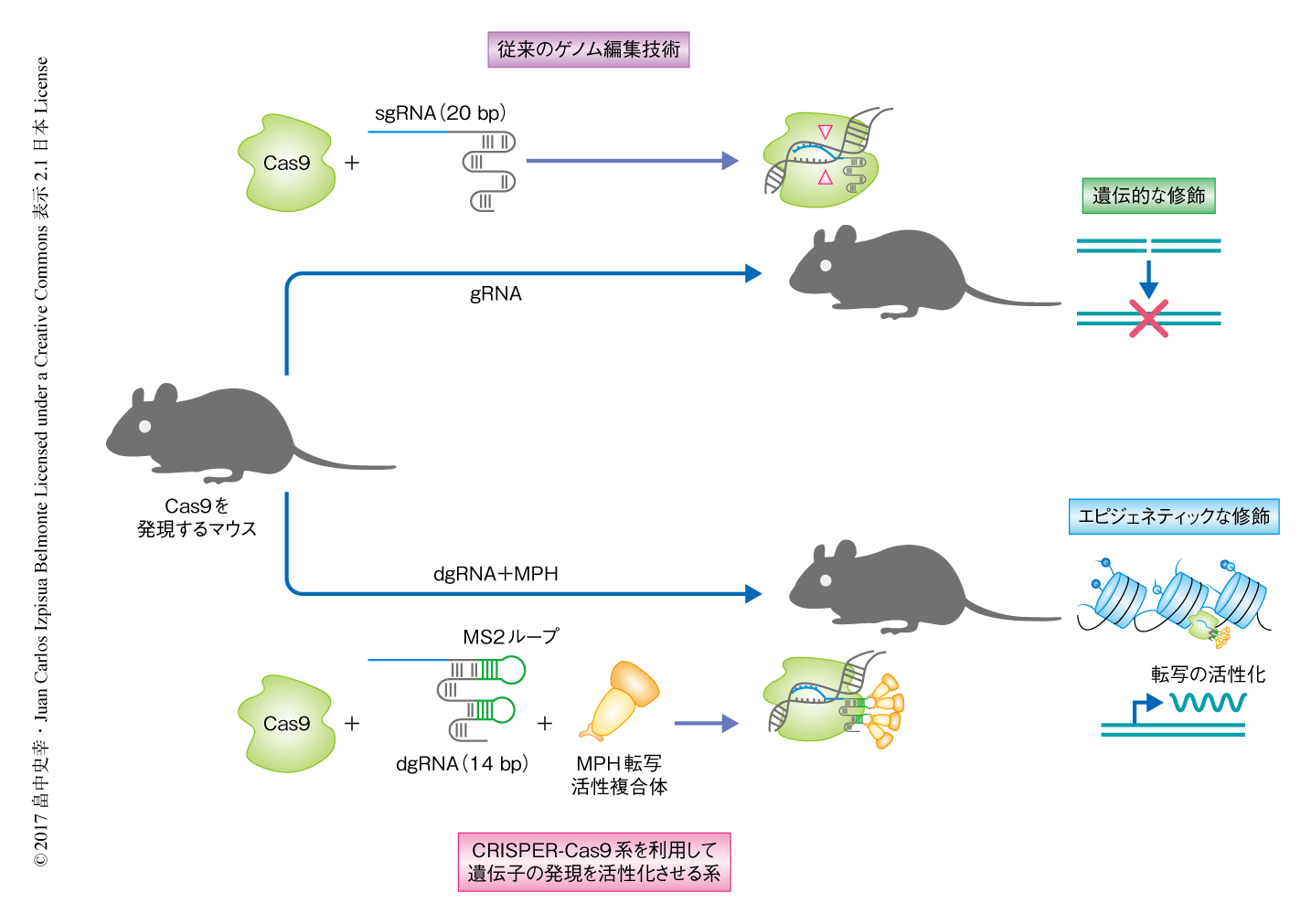
CRISPR-Cas9系を利用してin vivoにおいて内在性の遺伝子の発現をエピジェネティックに活性化させる
畠中史幸・Juan Carlos Izpisua Belmonte
(米国Salk Institute for Biological Studies,Gene Expression Laboratory)
email:畠中史幸
DOI: 10.7875/first.author.2017.145
In vivo target gene activation via CRISPR/Cas9-mediated trans-epigenetic modulation.
Hsin-Kai Liao, Fumiyuki Hatanaka, Toshikazu Araoka, Pradeep Reddy, Min-Zu Wu, Yinghui Sui, Takayoshi Yamauchi, Masahiro Sakurai, David D. O’Keefe, Estrella Núñez-Delicado, Pedro Guillen, Josep M. Campistol, Cheng-Jang Wu, Li-Fan Lu, Concepcion Rodriguez Esteban, Juan Carlos Izpisua Belmonte
Cell, 171, 1495-1507.e15 (2017)
近年,CRISPR-Cas9系を用いたゲノム編集技術は,次世代の遺伝子治療の実用化にむけ急速に進歩している.この研究において,筆者らは,CRISPR-Cas9系を利用して,in vivoにおいてDNA 2本鎖切断を起こすことなくエピジェネティックな修飾をともない標的となる内在性の遺伝子の発現を活性化させることに成功した.この系は,出生ののちのマウスにおいて生理学的な表現型をひき起こすのに十分であり,さらに,いくつかの病態モデルマウスにおいて症状の改善に有効であった.以上のことから,この技術は,さまざまな疾患に対するエピジェネティックな治療という,新たな精密医療の確立にむけた重要な基盤となりうるだろう.
近年,エピジェネティクスは世界中で活発に研究されており,実際に,がんや生活習慣病などさまざまな疾患に対する医療への応用も進められている.創薬においては,DNAメチル化酵素やヒストン脱アセチル化酵素を標的としたエピジェネティック薬の開発が進められている.しかしながら,これらの薬剤は非常に広範な遺伝子の発現を変化させるため,変化を必要としないオフターゲット遺伝子の起こすリスクが問題のひとつになっている1).このことから,特定の遺伝子のみを標的とするエピジェネティックな修飾の技術の確立が必要とされている.
一方で,CRISPR-Cas9系をはじめとするゲノム編集技術は,ここ数年で飛躍的に進展してきた.この技術は,標的となるゲノムの部位にDNA 2本鎖切断を起こすことをきっかけにさまざまな遺伝子を編集することが可能である.しかしながら,標的と近い配列をもつゲノムの部位にもおいても同様にDNA 2本鎖切断が起こるオフターゲット効果の可能性は否定できず,これらの技術をヒトへ応用する際のボトルネックのひとつになっている.
一方で,このCRISPR-Cas9系を利用しDNA 2本鎖切断を起こさずに特定の遺伝子の発現を制御する方法も開発されてきた2).第1世代として,ヌクレアーゼ活性を欠失させたdCas9と転写活性ドメインVP64とを組み合わせることによりDNA 2本鎖切断を起こさずに標的となる遺伝子の発現が活性化されることが示された3,4).そののち,標的となる遺伝子の発現の活性化の効率をさらに改善することを目的として,さまざまな転写活性ドメインを用いた方法がつぎつぎと報告された5-7).しかしながら,これらの方法はin vitroにおいては標的となる遺伝子の発現を効率よく活性化したが,in vivoにおける効率はまだまだ不完全であった.そのおもな理由として,in vivoにおけるCas9融合タンパク質の発現が不十分であること,また,dCas9-gRNA複合体および転写活性複合体の大きさがin vivoにおいて最適なウイルスベクターであるアデノ随伴ウイルスベクターの大きさの限度をこえてしまうことなどが考えられた.したがって,これまでの方法では出生ののちのマウスにおける生理学的な表現型を獲得することは困難であり,in vivoにおける汎用性は制限されるのが実情であった.この研究において,筆者らは,CRISPR-Cas9系を利用してin vivoにおいてDNA 2本鎖切断を起こさずに標的となる遺伝子の発現を活性化する効率的な系を確立することを目的とした.
in vivoにおいてCRISPR-Cas9系を利用して遺伝子の発現を活性化する系を検討するなかで,これまで利用されていたdCas9-VP64融合タンパク質はアデノ随伴ウイルスベクターの大きさの限度をこえるため,Cas9と20 bpのsgRNAではなく14~15 bpのsgRNAを使用した.このsgRNAはCas9によるDNA 2本鎖切断を起こさないdead sgRNAとして報告されている6,8).そこで,MPH(MS2-p65-HSF1)転写活性複合体を認識するMS2結合ループを含むdead sgRNAを使用した.最初のステップとして,プロモーターにdead sgRNAとの結合配列を含むルシフェラーゼレポーター遺伝子を設計し,in vitroにおいて,ルシフェラーゼの発現の活性化が効率よく起こるdead sgRNAをスクリーニングした.GC含量および反復配列を変更することにより高いルシフェラーゼ活性を示すdead sgRNAが同定され,その活性は従来のdCas9-VP64融合タンパク質とMPH転写活性複合体との組合せと同等であることが確認された.そのほかの転写活性化因子についても検討したが,MPH転写活性複合体がもっとも高い活性を示した.この系は,成体のマウスの筋肉に対しエレクトロポレーション法により遺伝子を導入した場合においても高いルシフェラーゼ活性を示した.
このCRISPR-Cas9系を利用して遺伝子の発現を活性化する系をin vivoにおいて検討するため,dead sgRNAおよびMPHをコードしたアデノ随伴ウイルスベクター,および,プロモーター領域にdead sgRNAとの結合配列を含むルシフェラーゼレポーター遺伝子を含むアデノ随伴ウイルスベクターを作製した.これらのベクターをさまざまな方法によりCas9ノックインマウスに投与し,ルシフェラーゼ活性を経時的に測定した.生後2.5日齢のマウスの前脛骨筋に局所的に投与したところ,約2週間後に投与部位において対照と比べ強いルシフェラーゼ活性が検出された.また,マウスの全身性に投与したところ,生後0.5日齢での投与により心臓,肝臓,筋肉,肺,腎臓においてルシフェラーゼ活性が検出され,成体への投与により約1カ月にわたりおもに肝臓においてルシフェラーゼ活性が検出された.これらの結果から,このCRISPR-Cas9系を利用して遺伝子の発現を活性化する系は,in vivoにおいてレポーター遺伝子の発現を活性化することが確認された.
この系がマウスにおいて生理学的な表現型を示すのに十分な内在性の遺伝子の発現を活性化できるかどうか検討した.表現型の判別がわかりやすい遺伝子として,筋肉の増量にかかわるFst遺伝子を標的として用いた.Cas9を恒常的に発現する細胞株を用いて,Fst遺伝子に対する最適なdead sgRNAの配列を選定した.これまでの報告と同様に,もっとも効率の高い配列は転写開始点の近傍であった9,10).選定されたdead sgRNAおよびMPHをコードするアデノ随伴ウイルスベクターをCas9ノックインマウスの前脛骨筋に局所的に投与したところ,投与ののち3週間目および3カ月目において,対照と比べ,Fst遺伝子の発現の顕著な上昇が確認された.また,対照と比べ,筋肉の増量,筋肉繊維の増大,握力測定試験における高い握力値を示した.以上のことから,このCRISPR-Cas9系を利用して遺伝子の発現を活性化する系は,生理学的な表現型を示すのに十分な内在性の遺伝子の発現を活性化することが確認された.
この系を用いて細胞運命の転換が可能であるかどうか検討した.Pdx1遺伝子は胎生期における膵臓の形成において重要であることが知られている.Cas9ノックインマウスに.Pdx1遺伝子の標的配列を含むdead sgRNAおよびMPHをコードするアデノ随伴ウイルスベクターを尾静脈より全身性に投与したところ,対照と比べ,肝臓において.Pdx1遺伝子の顕著な発現がみられた.また,インスリンの産生にかかわるInsulin1遺伝子,Insulin2遺伝子,Pcsk1遺伝子も発現していた.これらの肝臓の試料に対し,クロマチン免疫沈降-定量PCR法を用いてヒストンの修飾を解析した.その結果,Pdx1遺伝子座においてヒストンH3のLys27のアセチル化およびヒストンH3のLys4のトリメチル化が亢進していることが明らかにされた.さらに,ストレプトゾトシンにより誘発された糖尿病のモデルマウスにおいて,Pdx1遺伝子の標的配列を含むdead sgRNAおよびMPHをコードするアデノ随伴ウイルスベクターを投与したマウスは,対照と比べ,血清におけるインスリンの増加および血中におけるグルコースの濃度の低下を示した.以上のことから,このCRISPR-Cas9系を利用して遺伝子の発現を活性化する系は,in vivoにおいてエピジェネティックな修飾をともない内在性の遺伝子の発現を活性化し,細胞運命の転換が可能であることが示唆された.
この系の遺伝性疾患の治療に対する有効性について検討した.Duchenne型筋ジストロフィーはX染色体にコードされるDystrophin遺伝子が変異することにより起こる遺伝性の筋疾患であり,現在も根本的な治療法は確立されていない.そこで,Duchenne型筋ジストロフィーのモデルマウスであるmdxマウスおよびCas9ノックインマウスを用いて,この系により内在性のKlotho遺伝子,Fst遺伝子,Utrophin遺伝子の発現の誘導を試みた.なかでも,Utrophin遺伝子はDystrophin遺伝子のホモログであり成熟した筋肉において発現はみられない.また,Dystrophin遺伝子と同様に,Utrophin遺伝子は非常に大きいため,従来の方法では発現させることが困難であった.このCRISPR-Cas9系を利用して遺伝子の発現を活性化する系は内在性の遺伝子を標的とするため,遺伝子の大きさにかかわらず標的となる遺伝子の発現を活性化することが可能である.実際に,Utrophin遺伝子の標的配列を含むdead sgRNAおよびMPHをコードするアデノ随伴ウイルスベクターを投与したマウスは,対照と比べ,筋肉におけるUtrophin遺伝子の発現が上昇し,筋ジストロフィーの病態が改善された.さらに,実際のヒトにおける治療への応用の有効性を評価するため,Utrophin遺伝子の標的配列を含むdead sgRNAおよびMPHをコードするアデノ随伴ウイルスベクターとCas9をコードするアデノ随伴ウイルスベクターを併用したところ,mdxマウスの病態が改善された.
この研究において新たに開発されたCRISPR-Cas9系を利用して遺伝子の発現を活性化する系は,ゲノムの配列に影響をあたえることなく,内在性の遺伝子の発現をエピジェネティックに活性化することが可能であり(図1),in vivoにおいて生理学的な表現型の表出および病態の改善に対し有効であった.また,この系は,遺伝子の大きさに関係なく,さらに,2つ以上の内在性の遺伝子を同時に活性化することが可能であり,エピスタシスにかかわる遺伝子についての応用が可能である.以上のことから,このCRISPR-Cas9系を利用して遺伝子の発現を活性化する系は,基礎研究から臨床応用にいたるまで幅広く使用できる技術であると考えられた.
略歴:2010年 京都大学大学院医学研究科博士課程 修了,広島大学大学院医歯薬保健学研究院 助教,理化学研究所脳科学総合研究センター 研究員を経て,2015年より米国Salk Institute for Biological StudiesにてResearch Associate.
研究テーマ:老化が体におよぼす影響.
関心事:脳(体)を若返らせる方法.エレ片のコント太郎.
Juan Carlos Izpisua Belmonte
米国Salk Institute for Biological StudiesにてProfessor.
研究室URL:http://www.salk.edu/labs/belmonte/
© 2017 畠中史幸・Juan Carlos Izpisua Belmonte Licensed under CC 表示 2.1 日本
(米国Salk Institute for Biological Studies,Gene Expression Laboratory)
email:畠中史幸
DOI: 10.7875/first.author.2017.145
In vivo target gene activation via CRISPR/Cas9-mediated trans-epigenetic modulation.
Hsin-Kai Liao, Fumiyuki Hatanaka, Toshikazu Araoka, Pradeep Reddy, Min-Zu Wu, Yinghui Sui, Takayoshi Yamauchi, Masahiro Sakurai, David D. O’Keefe, Estrella Núñez-Delicado, Pedro Guillen, Josep M. Campistol, Cheng-Jang Wu, Li-Fan Lu, Concepcion Rodriguez Esteban, Juan Carlos Izpisua Belmonte
Cell, 171, 1495-1507.e15 (2017)
この論文に出現する遺伝子・タンパク質のUniprot ID
DNAメチル化酵素, ヒストン脱アセチル化酵素, p65(Q04207), HSF1(P38532), Fst(P47931), Pdx1(P52946), インスリン, Insulin1(P01325), Insulin2(P01326), Pcsk1(P63239), ヒストン, ヒストンH3, Dystrophin(P11531), Klotho(O35082), Utrophin(Q9WTN3)
要 約
近年,CRISPR-Cas9系を用いたゲノム編集技術は,次世代の遺伝子治療の実用化にむけ急速に進歩している.この研究において,筆者らは,CRISPR-Cas9系を利用して,in vivoにおいてDNA 2本鎖切断を起こすことなくエピジェネティックな修飾をともない標的となる内在性の遺伝子の発現を活性化させることに成功した.この系は,出生ののちのマウスにおいて生理学的な表現型をひき起こすのに十分であり,さらに,いくつかの病態モデルマウスにおいて症状の改善に有効であった.以上のことから,この技術は,さまざまな疾患に対するエピジェネティックな治療という,新たな精密医療の確立にむけた重要な基盤となりうるだろう.
はじめに
近年,エピジェネティクスは世界中で活発に研究されており,実際に,がんや生活習慣病などさまざまな疾患に対する医療への応用も進められている.創薬においては,DNAメチル化酵素やヒストン脱アセチル化酵素を標的としたエピジェネティック薬の開発が進められている.しかしながら,これらの薬剤は非常に広範な遺伝子の発現を変化させるため,変化を必要としないオフターゲット遺伝子の起こすリスクが問題のひとつになっている1).このことから,特定の遺伝子のみを標的とするエピジェネティックな修飾の技術の確立が必要とされている.
一方で,CRISPR-Cas9系をはじめとするゲノム編集技術は,ここ数年で飛躍的に進展してきた.この技術は,標的となるゲノムの部位にDNA 2本鎖切断を起こすことをきっかけにさまざまな遺伝子を編集することが可能である.しかしながら,標的と近い配列をもつゲノムの部位にもおいても同様にDNA 2本鎖切断が起こるオフターゲット効果の可能性は否定できず,これらの技術をヒトへ応用する際のボトルネックのひとつになっている.
一方で,このCRISPR-Cas9系を利用しDNA 2本鎖切断を起こさずに特定の遺伝子の発現を制御する方法も開発されてきた2).第1世代として,ヌクレアーゼ活性を欠失させたdCas9と転写活性ドメインVP64とを組み合わせることによりDNA 2本鎖切断を起こさずに標的となる遺伝子の発現が活性化されることが示された3,4).そののち,標的となる遺伝子の発現の活性化の効率をさらに改善することを目的として,さまざまな転写活性ドメインを用いた方法がつぎつぎと報告された5-7).しかしながら,これらの方法はin vitroにおいては標的となる遺伝子の発現を効率よく活性化したが,in vivoにおける効率はまだまだ不完全であった.そのおもな理由として,in vivoにおけるCas9融合タンパク質の発現が不十分であること,また,dCas9-gRNA複合体および転写活性複合体の大きさがin vivoにおいて最適なウイルスベクターであるアデノ随伴ウイルスベクターの大きさの限度をこえてしまうことなどが考えられた.したがって,これまでの方法では出生ののちのマウスにおける生理学的な表現型を獲得することは困難であり,in vivoにおける汎用性は制限されるのが実情であった.この研究において,筆者らは,CRISPR-Cas9系を利用してin vivoにおいてDNA 2本鎖切断を起こさずに標的となる遺伝子の発現を活性化する効率的な系を確立することを目的とした.
1.CRISPR-Cas9系を利用して遺伝子の発現を活性化する系の最適化
in vivoにおいてCRISPR-Cas9系を利用して遺伝子の発現を活性化する系を検討するなかで,これまで利用されていたdCas9-VP64融合タンパク質はアデノ随伴ウイルスベクターの大きさの限度をこえるため,Cas9と20 bpのsgRNAではなく14~15 bpのsgRNAを使用した.このsgRNAはCas9によるDNA 2本鎖切断を起こさないdead sgRNAとして報告されている6,8).そこで,MPH(MS2-p65-HSF1)転写活性複合体を認識するMS2結合ループを含むdead sgRNAを使用した.最初のステップとして,プロモーターにdead sgRNAとの結合配列を含むルシフェラーゼレポーター遺伝子を設計し,in vitroにおいて,ルシフェラーゼの発現の活性化が効率よく起こるdead sgRNAをスクリーニングした.GC含量および反復配列を変更することにより高いルシフェラーゼ活性を示すdead sgRNAが同定され,その活性は従来のdCas9-VP64融合タンパク質とMPH転写活性複合体との組合せと同等であることが確認された.そのほかの転写活性化因子についても検討したが,MPH転写活性複合体がもっとも高い活性を示した.この系は,成体のマウスの筋肉に対しエレクトロポレーション法により遺伝子を導入した場合においても高いルシフェラーゼ活性を示した.
2.Cas9ノックインマウスを用いた検討
このCRISPR-Cas9系を利用して遺伝子の発現を活性化する系をin vivoにおいて検討するため,dead sgRNAおよびMPHをコードしたアデノ随伴ウイルスベクター,および,プロモーター領域にdead sgRNAとの結合配列を含むルシフェラーゼレポーター遺伝子を含むアデノ随伴ウイルスベクターを作製した.これらのベクターをさまざまな方法によりCas9ノックインマウスに投与し,ルシフェラーゼ活性を経時的に測定した.生後2.5日齢のマウスの前脛骨筋に局所的に投与したところ,約2週間後に投与部位において対照と比べ強いルシフェラーゼ活性が検出された.また,マウスの全身性に投与したところ,生後0.5日齢での投与により心臓,肝臓,筋肉,肺,腎臓においてルシフェラーゼ活性が検出され,成体への投与により約1カ月にわたりおもに肝臓においてルシフェラーゼ活性が検出された.これらの結果から,このCRISPR-Cas9系を利用して遺伝子の発現を活性化する系は,in vivoにおいてレポーター遺伝子の発現を活性化することが確認された.
3.CRISPR-Cas9系を利用して遺伝子の発現を活性化する系を用いた生理学的な表現型の表出
この系がマウスにおいて生理学的な表現型を示すのに十分な内在性の遺伝子の発現を活性化できるかどうか検討した.表現型の判別がわかりやすい遺伝子として,筋肉の増量にかかわるFst遺伝子を標的として用いた.Cas9を恒常的に発現する細胞株を用いて,Fst遺伝子に対する最適なdead sgRNAの配列を選定した.これまでの報告と同様に,もっとも効率の高い配列は転写開始点の近傍であった9,10).選定されたdead sgRNAおよびMPHをコードするアデノ随伴ウイルスベクターをCas9ノックインマウスの前脛骨筋に局所的に投与したところ,投与ののち3週間目および3カ月目において,対照と比べ,Fst遺伝子の発現の顕著な上昇が確認された.また,対照と比べ,筋肉の増量,筋肉繊維の増大,握力測定試験における高い握力値を示した.以上のことから,このCRISPR-Cas9系を利用して遺伝子の発現を活性化する系は,生理学的な表現型を示すのに十分な内在性の遺伝子の発現を活性化することが確認された.
4.CRISPR-Cas9系を利用して遺伝子の発現を活性化する系を用いた細胞運命の転換
この系を用いて細胞運命の転換が可能であるかどうか検討した.Pdx1遺伝子は胎生期における膵臓の形成において重要であることが知られている.Cas9ノックインマウスに.Pdx1遺伝子の標的配列を含むdead sgRNAおよびMPHをコードするアデノ随伴ウイルスベクターを尾静脈より全身性に投与したところ,対照と比べ,肝臓において.Pdx1遺伝子の顕著な発現がみられた.また,インスリンの産生にかかわるInsulin1遺伝子,Insulin2遺伝子,Pcsk1遺伝子も発現していた.これらの肝臓の試料に対し,クロマチン免疫沈降-定量PCR法を用いてヒストンの修飾を解析した.その結果,Pdx1遺伝子座においてヒストンH3のLys27のアセチル化およびヒストンH3のLys4のトリメチル化が亢進していることが明らかにされた.さらに,ストレプトゾトシンにより誘発された糖尿病のモデルマウスにおいて,Pdx1遺伝子の標的配列を含むdead sgRNAおよびMPHをコードするアデノ随伴ウイルスベクターを投与したマウスは,対照と比べ,血清におけるインスリンの増加および血中におけるグルコースの濃度の低下を示した.以上のことから,このCRISPR-Cas9系を利用して遺伝子の発現を活性化する系は,in vivoにおいてエピジェネティックな修飾をともない内在性の遺伝子の発現を活性化し,細胞運命の転換が可能であることが示唆された.
5.CRISPR-Cas9系を利用して遺伝子の発現を活性化する系を用いた遺伝性疾患の治療
この系の遺伝性疾患の治療に対する有効性について検討した.Duchenne型筋ジストロフィーはX染色体にコードされるDystrophin遺伝子が変異することにより起こる遺伝性の筋疾患であり,現在も根本的な治療法は確立されていない.そこで,Duchenne型筋ジストロフィーのモデルマウスであるmdxマウスおよびCas9ノックインマウスを用いて,この系により内在性のKlotho遺伝子,Fst遺伝子,Utrophin遺伝子の発現の誘導を試みた.なかでも,Utrophin遺伝子はDystrophin遺伝子のホモログであり成熟した筋肉において発現はみられない.また,Dystrophin遺伝子と同様に,Utrophin遺伝子は非常に大きいため,従来の方法では発現させることが困難であった.このCRISPR-Cas9系を利用して遺伝子の発現を活性化する系は内在性の遺伝子を標的とするため,遺伝子の大きさにかかわらず標的となる遺伝子の発現を活性化することが可能である.実際に,Utrophin遺伝子の標的配列を含むdead sgRNAおよびMPHをコードするアデノ随伴ウイルスベクターを投与したマウスは,対照と比べ,筋肉におけるUtrophin遺伝子の発現が上昇し,筋ジストロフィーの病態が改善された.さらに,実際のヒトにおける治療への応用の有効性を評価するため,Utrophin遺伝子の標的配列を含むdead sgRNAおよびMPHをコードするアデノ随伴ウイルスベクターとCas9をコードするアデノ随伴ウイルスベクターを併用したところ,mdxマウスの病態が改善された.
おわりに
この研究において新たに開発されたCRISPR-Cas9系を利用して遺伝子の発現を活性化する系は,ゲノムの配列に影響をあたえることなく,内在性の遺伝子の発現をエピジェネティックに活性化することが可能であり(図1),in vivoにおいて生理学的な表現型の表出および病態の改善に対し有効であった.また,この系は,遺伝子の大きさに関係なく,さらに,2つ以上の内在性の遺伝子を同時に活性化することが可能であり,エピスタシスにかかわる遺伝子についての応用が可能である.以上のことから,このCRISPR-Cas9系を利用して遺伝子の発現を活性化する系は,基礎研究から臨床応用にいたるまで幅広く使用できる技術であると考えられた.
文 献
- Hunter, P.: The second coming of epigenetic drugs: a more strategic and broader research framework could boost the development of new drugs to modify epigenetic factors and gene expression. EMBO Rep., 16, 276-279 (2015)[PubMed]
- Qi, L. S., Larson, M. H., Gilbert, L. A. et al.: Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression. Cell, 152, 1173-1183 (2013)[PubMed]
- Gilbert, L. A., Larson, M. H., Morsut, L. et al.: CRISPR-mediated modular RNA-guided regulation of transcription in eukaryotes. Cell, 154, 442-451 (2013)[PubMed]
- Perez-Pinera, P., Kocak, D. D., Vockley, C. M. et al.: RNA-guided gene activation by CRISPR-Cas9-based transcription factors. Nat. Methods, 10, 973-976 (2013)[PubMed]
- Chavez, A., Scheiman, J., Vora, S. et al.: Highly efficient Cas9-mediated transcriptional programming. Nat. Methods, 12, 326-328 (2015)[PubMed]
- Dahlman, J. E., Abudayyeh, O. O., Joung, J. et al.: Orthogonal gene knockout and activation with a catalytically active Cas9 nuclease. Nat. Biotechnol., 33, 1159-1161 (2015)[PubMed]
- Tanenbaum, M. E., Gilbert, L. A., Qi, L. S. et al.: A protein-tagging system for signal amplification in gene expression and fluorescence imaging. Cell, 159, 635-646 (2014)[PubMed]
- Kiani, S., Chavez, A., Tuttle, M. et al.: Cas9 gRNA engineering for genome editing, activation and repression. Nat. Methods, 12, 1051-1054 (2015)[PubMed]
- Gilbert, L. A., Horlbeck, M. A., Adamson, B. et al.: Genome-scale CRISPR-mediated control of gene repression and activation. Cell, 159, 647-661 (2014)[PubMed]
- Kearns, N. A., Genga, R. M. J., Enuameh, M. S. et al.: Cas9 effector-mediated regulation of transcription and differentiation in human pluripotent stem cells. Development, 141, 219-223 (2014)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2010年 京都大学大学院医学研究科博士課程 修了,広島大学大学院医歯薬保健学研究院 助教,理化学研究所脳科学総合研究センター 研究員を経て,2015年より米国Salk Institute for Biological StudiesにてResearch Associate.
研究テーマ:老化が体におよぼす影響.
関心事:脳(体)を若返らせる方法.エレ片のコント太郎.
Juan Carlos Izpisua Belmonte
米国Salk Institute for Biological StudiesにてProfessor.
研究室URL:http://www.salk.edu/labs/belmonte/
© 2017 畠中史幸・Juan Carlos Izpisua Belmonte Licensed under CC 表示 2.1 日本