熱帯熱マラリア原虫のもつRIFINによる宿主の免疫抑制化受容体を介した免疫からの逃避の機構
齋藤史路・平安恒幸・荒瀬 尚
(大阪大学微生物病研究所 免疫化学分野)
email:齋藤史路,平安恒幸,荒瀬 尚
DOI: 10.7875/first.author.2017.142
Immune evasion of Plasmodium falciparum by RIFIN via inhibitory receptors.
Fumiji Saito, Kouyuki Hirayasu, Takeshi Satoh, Christian W. Wang, John Lusingu, Takao Arimori, Kyoko Shida, Nirianne Marie Q. Palacpac, Sawako Itagaki, Shiroh Iwanaga, Eizo Takashima, Takafumi Tsuboi, Masako Kohyama, Tadahiro Suenaga, Marco Colonna, Junichi Takagi, Thomas Lavstsen, Toshihiro Horii, Hisashi Arase
Nature, 552, 101-105 (2017)
マラリアはもっとも重大な感染症のひとつであり,年間の死亡者数は約50万人と推定されている.生命をおびやかすマラリアの原因は熱帯熱マラリア原虫の感染である.熱帯熱マラリア原虫にくり返し感染しても十分な獲得免疫は成立しないため,熱帯熱マラリア原虫は免疫からのがれるしくみをもつことが考えられるが,その免疫抑制の機構についてはほとんどわかっていない.この研究において,筆者らは,熱帯熱マラリア原虫は宿主の免疫抑制化受容体を利用した免疫から逃避する機構をもつことを発見した.熱帯熱マラリア原虫のもつRIFINは150~200種類の遺伝子にコードされる多重遺伝子ファミリータンパク質であり,熱帯熱マラリア原虫に感染した赤血球の表面に発現するが,その機能は明らかでなかった.筆者らは,多数のRIFINのうちの一部が宿主の免疫抑制化受容体LILRB1と結合し,LILRB1の発現するB細胞やナチュラルキラー細胞の活性を抑制することを明らかにした.さらに,マラリアの患者に由来する熱帯熱マラリア原虫に感染した赤血球とLILRB1との相互作用はマラリアの重症化と関連することが判明した.これらの結果から,熱帯熱マラリア原虫のもつRIFINは宿主の免疫抑制化受容体を介して免疫応答を抑制することにより,免疫から逃避する機構に関与することが明らかにされた.
熱帯熱マラリア原虫はさまざまな段階において免疫から逃避する手段を獲得している.たとえば,赤血球へと侵入しそこで増殖することにより外部の免疫細胞からのがれることができる.この赤血球期の原虫がマラリアの病態をひき起こし,細胞性免疫および液性免疫の主要な標的になる.熱帯熱マラリア原虫に感染した赤血球は表面にPfEMP1,RIFIN,STEVORという多型的なタンパク質を発現する1).PfEMP1は血管内皮細胞のもつ受容体と結合し赤血球を血管にとどめることにより脾臓において排除されないようにする2).RIFINおよびSTEVORの機能は不明だが,一部は感染していない赤血球と結合してロゼットを形成し免疫による認識からのがれることが報告されている.熱帯熱マラリア原虫にくり返し感染しても十分な獲得免疫は成立しないため,熱帯熱マラリア原虫にはたんに免疫から逃避するだけでなく,宿主の免疫応答を積極的に抑制する分子機構をもつことが考えられるが,その免疫抑制の機構についてはほとんどわかっていなかった.
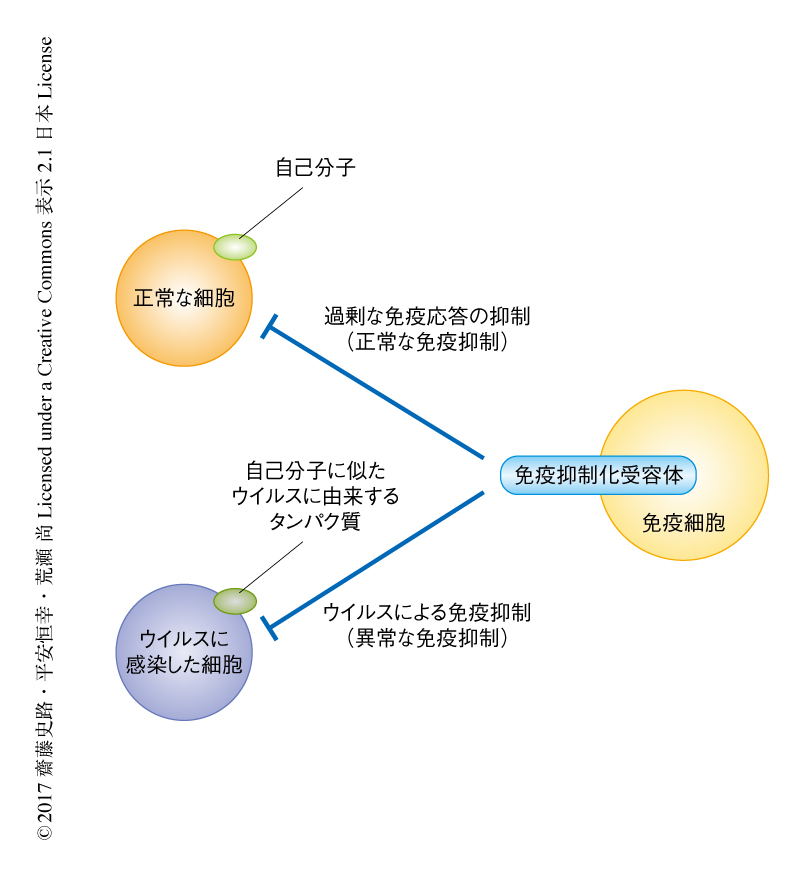
一方で,宿主の免疫細胞は過剰な免疫応答を抑制するため,自己分子に対するさまざまな免疫抑制化受容体を発現する.ところが,ある種のウイルスにおいては,免疫抑制化受容体のリガンドと似たタンパク質を発現させることにより,免疫からの逃避する機構をもつことが知られている3)(図1).そこで,筆者らは,熱帯熱マラリア原虫もウイルスと同様に,感染した赤血球に熱帯熱マラリア原虫に由来するタンパク質を発現させることにより,免疫抑制化受容体を利用し宿主の免疫からのがれているのではないかと考えた.
熱帯熱マラリア原虫に感染した赤血球と相互作用する免疫抑制化受容体を探索するため,さまざまなヒト免疫抑制化受容体と抗体のFc領域との融合タンパク質を作製し,タイにおけるマラリアの患者に由来する熱帯熱マラリア原虫を用いて融合タンパク質と熱帯熱マラリア原虫に感染した赤血球との結合をフローサイトメトリーにより解析した.このスクリーニングにおいて,LILRB1だけが熱帯熱マラリア原虫に感染した赤血球の一部と結合した.さらに,7名のマラリアの患者に由来する熱帯熱マラリア原虫を用いて,感染した赤血球に対するLILRB1の結合を調べた.その結果,マラリアの患者に由来する熱帯熱マラリア原虫のなかには,LILRB1が感染した赤血球の約77%と結合するもの,約15%と結合するもの,ほとんど結合しないものがあることが判明した.また,熱帯熱マラリア原虫に感染した赤血球はリング期,トロフォゾイト期,シゾント期とよばれる形態を示すが,LILRB1の結合はおもにトロフォゾイト期後期およびシゾント期において観察された.
免疫抑制化受容体LILRB1はさまざまな免疫細胞に発現するLILR多重遺伝子ファミリータンパク質のひとつであり,その遺伝子は白血球受容体複合体の領域にコードされている4).LILRB1は自己のタンパク質であるHLAクラスI分子を宿主のリガンドとして認識するが,赤血球にはHLAクラスI分子は発現していないことから,熱帯熱マラリア原虫に由来するなんらかのタンパク質がLILRB1のリガンドであると考えられた.
熱帯熱マラリア原虫のゲノムにはHLAクラスI分子に類似したタンパク質はコードされていない.そこで,LILRB1のリガンドを実験的に同定するため,全ゲノム配列が既知である実験室株として3D7株とよばれる熱帯熱マラリア原虫株を用いた.LILRB1は3D7株に感染した赤血球の一部としか結合しなかったため,セルソーターを用いてLILRB1と結合した赤血球を濃縮し,さらに限界希釈することにより,LILRB1が結合するクローンおよび結合しないクローンを得た.3D7株が感染した赤血球に発現するLILRB1のリガンドを同定するため,免疫沈降法によりLILRB1と抗体のFc領域との融合タンパク質と共沈するタンパク質を質量分析法により解析した.2回の独立した実験において,RIFINと一致するペプチド配列のみがLILRB1と共沈したタンパク質から同定された.
RIFINは熱帯熱マラリア原虫のひとつのゲノムあたり150~200種類がコードされる多重遺伝子ファミリータンパク質である5).同定されたペプチド配列は熱帯熱マラリア原虫3D7株がコードするRIFINのうち36種類に共通していた.そこで,これら36種類のRIFINとLILRB1との結合を調べるため遺伝子クローニングを試みたところ,同定されたペプチド配列をコードする25種類のRIFIN遺伝子およびこのペプチド配列をもたない6種類のRIFIN遺伝子がクローニングされた.実際に,RIFINとLILRB1との相互作用について調べるため,クローニングされたRIFIN遺伝子を3D7株に導入し,感染させた赤血球とLILRB1との結合をスクリーニングした.その結果,3D7株に発現させると感染した赤血球が強くLILRB1と結合するRIFINが2種類,感染した赤血球はLILRB1と結合しないRIFINが3種類,同定された.同定されたペプチド配列の有無はLILRB1の結合とは関連しなかった.これらの結果から,RIFINの一部がLILRB1のリガンドであることが確認された.
RIFINの細胞外ドメインは同定されたペプチド配列を含む定常領域および可変領域から構成される.LILRB1は293T細胞に発現させたLILRB1と結合するRIFINの組換えタンパク質に対し,可変領域と結合し定常領域とは結合しなかった.さらに,LILRB1と結合するRIFINの組換えタンパク質は293T細胞に発現させたLILRB1と結合し,LILRB1と結合しないRIFINの組換えタンパク質はLILRB1と結合しなかった.これらの結果から,LILRB1はRIFINの可変領域に存在する特定のアミノ酸配列もしくはコンフォメーションと直接に結合することが考えられた.
LILR多重遺伝子ファミリータンパク質は5種類の免疫活性化受容体,5種類の免疫抑制化受容体,1種類の分泌型タンパク質から構成される.免疫抑制化受容体LILRB1は,免疫活性化受容体LILRA2とアミノ酸配列で80%以上の相同性があるが,LILRA2のリガンド6) とは結合しなかった.これとは逆に,LILRA2は,LILRB1のリガンドとなるRIFINとは結合しなかった.これらの結果から,特定のRIFINがLILRB1と特異的に相互作用するように進化したことが考えられた.LILRB1の宿主におけるリガンドはHLAクラスI分子である.しかしながら,LILRB1と結合するRIFINはHLAクラスI分子とアミノ酸配列および構造予測レベルにおける類似性はなかった.さらに,LILRB1と結合するRIFINの特徴を示すアミノ酸配列のモチーフを同定することもできなかった.今後,LILRB1およびRIFINの立体構造が解析されれば,RIFINの機能的な制約や受容体との結合の特異性および多様性について明らかにされるだろう.
RIFINがLILRB1を介して細胞にシグナルを伝達するかどうかを調べるため,NFAT-GFPレポーターシステムを用いた7).LILRB1レポーター細胞はリガンドを認識すると細胞にシグナルを伝達しGFPを発現する.RIFINを発現させた熱帯熱マラリア原虫3D7株に感染した赤血球とLILRB1レポーター細胞を共培養したところ,レポーター細胞はLILRB1と結合するRIFINを発現させた3D7株に感染した赤血球により活性化されたが,LILRB1と結合しないRIFINを発現させた3D7株に感染した赤血球により活性化されなかった.この結果から,LILRB1はRIFINにより細胞へとシグナルを伝達することが明らかにされた.
LILRB1はヒトのプライマリーB細胞に発現しており,B細胞の活性を抑制することが知られている8).そこで,LILRB1を発現するB細胞に対するRIFINの影響について調べた.末梢血単核球を3D7株に感染した赤血球と共培養すると,LILRB1と結合するRIFINを発現させた3D7株に感染した赤血球は,LILRB1と結合しないRIFINを発現させた3D7株に感染した赤血球と比べて,活性化したB細胞の機能を抑制し免疫グロブリンMの産生を減少させた.さらに,LILRB1を発現するナチュラルキラー細胞に対するRIFINの影響について調べたところ,ナチュラルキラー細胞の標的細胞であるK562細胞はLILRB1と結合するRIFINを発現させるとナチュラルキラー細胞による細胞傷害に抵抗性を示した.これらの結果から,熱帯熱マラリア原虫はRIFINを利用して宿主の免疫を抑制することが考えられた.
LILRB1と熱帯熱マラリア原虫に感染した赤血球との相互作用は免疫抑制を示したことから,マラリアの重症化に影響するのではないかと仮説をたてた.この仮説を検証するため,タンザニアにおけるマラリアの患者に由来する熱帯熱マラリア原虫に感染した赤血球へのLILRB1の結合量を測定した.その結果,軽症の患者と比べて,脳性マラリアおよび重い貧血を示す重症の患者に由来する赤血球は,有意にLILRB1と結合しやすいことが明らかにされた.この結果から,重症の患者の赤血球にはLILRB1と結合するRIFINが高く発現しているため,LILRB1と赤血球との相互作用が重症マラリアの病態に関与することが示唆された.標本の数を増やしてさらに重症マラリアの病態との関連を解析する必要があるだろう.
熱帯熱マラリア原虫に感染した赤血球における抗原の発現は宿主免疫の状態により変動する9).マラリアが高度に流行している地域においては,重症マラリアに対する免疫は臨床免疫を獲得するまえの幼児期に成立する.したがって,重症マラリアと関連のあるRIFINに対する抗体はほかのRIFINに対する抗体よりも早く獲得される可能性が考えられた.そこで,LILRB1と結合するRIFINおよび結合しないRIFINの可変領域に対する抗体の反応性をタンザニア人222名の血漿を用いて調べた.その結果,2種類のRIFINに対し,同じ程度の免疫グロブリンGの獲得が1歳において急速に認められた.このように,2種類のRIFINに対して同じ程度の抗体の獲得がみられたが,早期に抗体が獲得されるということはRIFINが感染の初期において活動的であり,防御免疫の重要な標的として役だつことが考えられた.
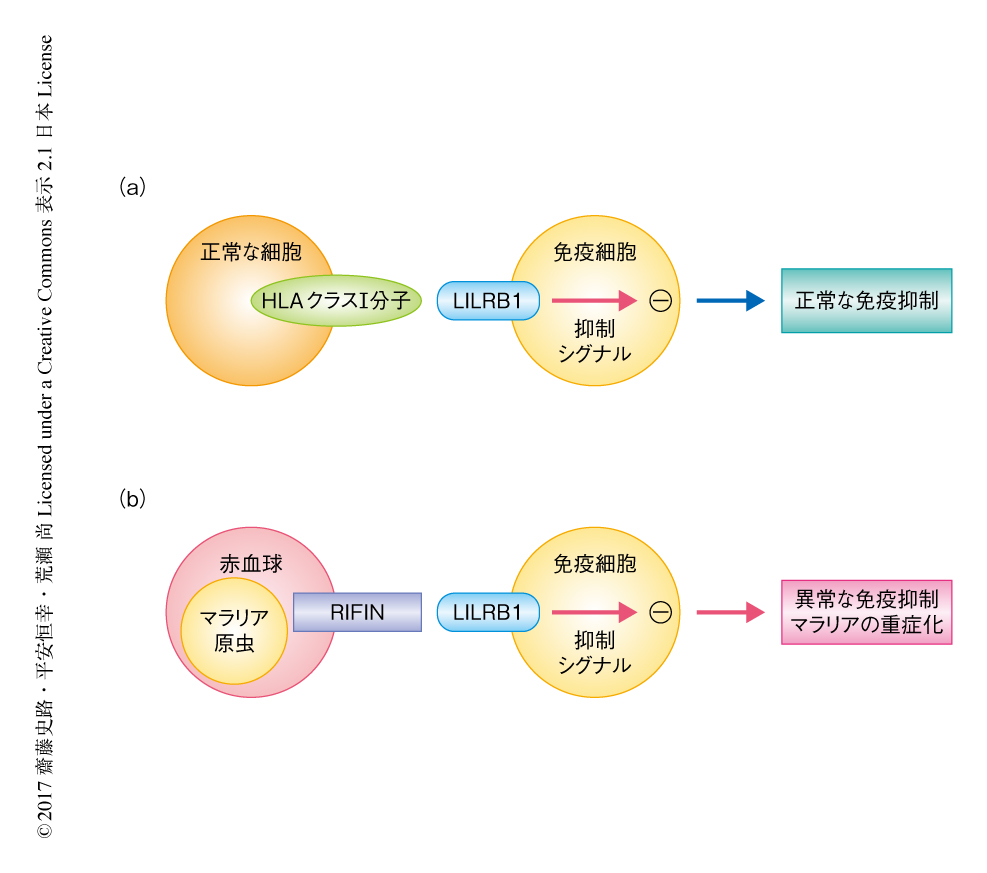
以上の結果から,熱帯熱マラリア原虫は宿主の免疫からのがれるため,宿主のもつ免疫抑制化受容体を標的として多様なRIFINを獲得し進化してきたことが示唆された(図2).RIFINは熱帯熱マラリア原虫にユニークなタンパク質であるが,マウスのマラリア原虫にも存在するPIRスーパーファミリーに属している10).PIRスーパーファミリーと免疫抑制化受容体との相互作用を解析することにより,さらにマラリアへの感染の制御機構が明らかにされることが期待される.さらに,LILRB1が認識するRIFINのエピトープが明らかにされればLILRB1とRIFINとの相互作用の阻害法の開発が可能になると考えられ,マラリアの重症化をふせぐワクチンや治療薬の開発に大きく貢献することが期待される.
略歴:2006年 高知医科大学大学院医学系研究科博士課程 早期修了,同年 九州大学生体防御医学研究所 特任助手を経て,2009年より大阪大学微生物病研究所 特任研究員.
研究テーマ:免疫学.感染症学.
抱負:感染症の研究をとおして社会に役だつ研究がしたい.
平安 恒幸(Kouyuki Hirayasu)
大阪大学免疫学フロンティア研究センター 特任助教.
荒瀬 尚(Hisashi Arase)
大阪大学微生物病研究所 教授.
研究室URL:http://immchem.biken.osaka-u.ac.jp/
© 2017 齋藤史路・平安恒幸・荒瀬 尚 Licensed under CC 表示 2.1 日本
(大阪大学微生物病研究所 免疫化学分野)
email:齋藤史路,平安恒幸,荒瀬 尚
DOI: 10.7875/first.author.2017.142
Immune evasion of Plasmodium falciparum by RIFIN via inhibitory receptors.
Fumiji Saito, Kouyuki Hirayasu, Takeshi Satoh, Christian W. Wang, John Lusingu, Takao Arimori, Kyoko Shida, Nirianne Marie Q. Palacpac, Sawako Itagaki, Shiroh Iwanaga, Eizo Takashima, Takafumi Tsuboi, Masako Kohyama, Tadahiro Suenaga, Marco Colonna, Junichi Takagi, Thomas Lavstsen, Toshihiro Horii, Hisashi Arase
Nature, 552, 101-105 (2017)
要 約
マラリアはもっとも重大な感染症のひとつであり,年間の死亡者数は約50万人と推定されている.生命をおびやかすマラリアの原因は熱帯熱マラリア原虫の感染である.熱帯熱マラリア原虫にくり返し感染しても十分な獲得免疫は成立しないため,熱帯熱マラリア原虫は免疫からのがれるしくみをもつことが考えられるが,その免疫抑制の機構についてはほとんどわかっていない.この研究において,筆者らは,熱帯熱マラリア原虫は宿主の免疫抑制化受容体を利用した免疫から逃避する機構をもつことを発見した.熱帯熱マラリア原虫のもつRIFINは150~200種類の遺伝子にコードされる多重遺伝子ファミリータンパク質であり,熱帯熱マラリア原虫に感染した赤血球の表面に発現するが,その機能は明らかでなかった.筆者らは,多数のRIFINのうちの一部が宿主の免疫抑制化受容体LILRB1と結合し,LILRB1の発現するB細胞やナチュラルキラー細胞の活性を抑制することを明らかにした.さらに,マラリアの患者に由来する熱帯熱マラリア原虫に感染した赤血球とLILRB1との相互作用はマラリアの重症化と関連することが判明した.これらの結果から,熱帯熱マラリア原虫のもつRIFINは宿主の免疫抑制化受容体を介して免疫応答を抑制することにより,免疫から逃避する機構に関与することが明らかにされた.
はじめに
熱帯熱マラリア原虫はさまざまな段階において免疫から逃避する手段を獲得している.たとえば,赤血球へと侵入しそこで増殖することにより外部の免疫細胞からのがれることができる.この赤血球期の原虫がマラリアの病態をひき起こし,細胞性免疫および液性免疫の主要な標的になる.熱帯熱マラリア原虫に感染した赤血球は表面にPfEMP1,RIFIN,STEVORという多型的なタンパク質を発現する1).PfEMP1は血管内皮細胞のもつ受容体と結合し赤血球を血管にとどめることにより脾臓において排除されないようにする2).RIFINおよびSTEVORの機能は不明だが,一部は感染していない赤血球と結合してロゼットを形成し免疫による認識からのがれることが報告されている.熱帯熱マラリア原虫にくり返し感染しても十分な獲得免疫は成立しないため,熱帯熱マラリア原虫にはたんに免疫から逃避するだけでなく,宿主の免疫応答を積極的に抑制する分子機構をもつことが考えられるが,その免疫抑制の機構についてはほとんどわかっていなかった.
一方で,宿主の免疫細胞は過剰な免疫応答を抑制するため,自己分子に対するさまざまな免疫抑制化受容体を発現する.ところが,ある種のウイルスにおいては,免疫抑制化受容体のリガンドと似たタンパク質を発現させることにより,免疫からの逃避する機構をもつことが知られている3)(図1).そこで,筆者らは,熱帯熱マラリア原虫もウイルスと同様に,感染した赤血球に熱帯熱マラリア原虫に由来するタンパク質を発現させることにより,免疫抑制化受容体を利用し宿主の免疫からのがれているのではないかと考えた.
1.熱帯熱マラリア原虫に感染した赤血球と相互作用する免疫抑制化受容体の同定
熱帯熱マラリア原虫に感染した赤血球と相互作用する免疫抑制化受容体を探索するため,さまざまなヒト免疫抑制化受容体と抗体のFc領域との融合タンパク質を作製し,タイにおけるマラリアの患者に由来する熱帯熱マラリア原虫を用いて融合タンパク質と熱帯熱マラリア原虫に感染した赤血球との結合をフローサイトメトリーにより解析した.このスクリーニングにおいて,LILRB1だけが熱帯熱マラリア原虫に感染した赤血球の一部と結合した.さらに,7名のマラリアの患者に由来する熱帯熱マラリア原虫を用いて,感染した赤血球に対するLILRB1の結合を調べた.その結果,マラリアの患者に由来する熱帯熱マラリア原虫のなかには,LILRB1が感染した赤血球の約77%と結合するもの,約15%と結合するもの,ほとんど結合しないものがあることが判明した.また,熱帯熱マラリア原虫に感染した赤血球はリング期,トロフォゾイト期,シゾント期とよばれる形態を示すが,LILRB1の結合はおもにトロフォゾイト期後期およびシゾント期において観察された.
免疫抑制化受容体LILRB1はさまざまな免疫細胞に発現するLILR多重遺伝子ファミリータンパク質のひとつであり,その遺伝子は白血球受容体複合体の領域にコードされている4).LILRB1は自己のタンパク質であるHLAクラスI分子を宿主のリガンドとして認識するが,赤血球にはHLAクラスI分子は発現していないことから,熱帯熱マラリア原虫に由来するなんらかのタンパク質がLILRB1のリガンドであると考えられた.
2.LILRB1のリガンドとしてのRIFINの同定
熱帯熱マラリア原虫のゲノムにはHLAクラスI分子に類似したタンパク質はコードされていない.そこで,LILRB1のリガンドを実験的に同定するため,全ゲノム配列が既知である実験室株として3D7株とよばれる熱帯熱マラリア原虫株を用いた.LILRB1は3D7株に感染した赤血球の一部としか結合しなかったため,セルソーターを用いてLILRB1と結合した赤血球を濃縮し,さらに限界希釈することにより,LILRB1が結合するクローンおよび結合しないクローンを得た.3D7株が感染した赤血球に発現するLILRB1のリガンドを同定するため,免疫沈降法によりLILRB1と抗体のFc領域との融合タンパク質と共沈するタンパク質を質量分析法により解析した.2回の独立した実験において,RIFINと一致するペプチド配列のみがLILRB1と共沈したタンパク質から同定された.
RIFINは熱帯熱マラリア原虫のひとつのゲノムあたり150~200種類がコードされる多重遺伝子ファミリータンパク質である5).同定されたペプチド配列は熱帯熱マラリア原虫3D7株がコードするRIFINのうち36種類に共通していた.そこで,これら36種類のRIFINとLILRB1との結合を調べるため遺伝子クローニングを試みたところ,同定されたペプチド配列をコードする25種類のRIFIN遺伝子およびこのペプチド配列をもたない6種類のRIFIN遺伝子がクローニングされた.実際に,RIFINとLILRB1との相互作用について調べるため,クローニングされたRIFIN遺伝子を3D7株に導入し,感染させた赤血球とLILRB1との結合をスクリーニングした.その結果,3D7株に発現させると感染した赤血球が強くLILRB1と結合するRIFINが2種類,感染した赤血球はLILRB1と結合しないRIFINが3種類,同定された.同定されたペプチド配列の有無はLILRB1の結合とは関連しなかった.これらの結果から,RIFINの一部がLILRB1のリガンドであることが確認された.
RIFINの細胞外ドメインは同定されたペプチド配列を含む定常領域および可変領域から構成される.LILRB1は293T細胞に発現させたLILRB1と結合するRIFINの組換えタンパク質に対し,可変領域と結合し定常領域とは結合しなかった.さらに,LILRB1と結合するRIFINの組換えタンパク質は293T細胞に発現させたLILRB1と結合し,LILRB1と結合しないRIFINの組換えタンパク質はLILRB1と結合しなかった.これらの結果から,LILRB1はRIFINの可変領域に存在する特定のアミノ酸配列もしくはコンフォメーションと直接に結合することが考えられた.
LILR多重遺伝子ファミリータンパク質は5種類の免疫活性化受容体,5種類の免疫抑制化受容体,1種類の分泌型タンパク質から構成される.免疫抑制化受容体LILRB1は,免疫活性化受容体LILRA2とアミノ酸配列で80%以上の相同性があるが,LILRA2のリガンド6) とは結合しなかった.これとは逆に,LILRA2は,LILRB1のリガンドとなるRIFINとは結合しなかった.これらの結果から,特定のRIFINがLILRB1と特異的に相互作用するように進化したことが考えられた.LILRB1の宿主におけるリガンドはHLAクラスI分子である.しかしながら,LILRB1と結合するRIFINはHLAクラスI分子とアミノ酸配列および構造予測レベルにおける類似性はなかった.さらに,LILRB1と結合するRIFINの特徴を示すアミノ酸配列のモチーフを同定することもできなかった.今後,LILRB1およびRIFINの立体構造が解析されれば,RIFINの機能的な制約や受容体との結合の特異性および多様性について明らかにされるだろう.
3.RIFINは宿主の免疫応答を抑制する
RIFINがLILRB1を介して細胞にシグナルを伝達するかどうかを調べるため,NFAT-GFPレポーターシステムを用いた7).LILRB1レポーター細胞はリガンドを認識すると細胞にシグナルを伝達しGFPを発現する.RIFINを発現させた熱帯熱マラリア原虫3D7株に感染した赤血球とLILRB1レポーター細胞を共培養したところ,レポーター細胞はLILRB1と結合するRIFINを発現させた3D7株に感染した赤血球により活性化されたが,LILRB1と結合しないRIFINを発現させた3D7株に感染した赤血球により活性化されなかった.この結果から,LILRB1はRIFINにより細胞へとシグナルを伝達することが明らかにされた.
LILRB1はヒトのプライマリーB細胞に発現しており,B細胞の活性を抑制することが知られている8).そこで,LILRB1を発現するB細胞に対するRIFINの影響について調べた.末梢血単核球を3D7株に感染した赤血球と共培養すると,LILRB1と結合するRIFINを発現させた3D7株に感染した赤血球は,LILRB1と結合しないRIFINを発現させた3D7株に感染した赤血球と比べて,活性化したB細胞の機能を抑制し免疫グロブリンMの産生を減少させた.さらに,LILRB1を発現するナチュラルキラー細胞に対するRIFINの影響について調べたところ,ナチュラルキラー細胞の標的細胞であるK562細胞はLILRB1と結合するRIFINを発現させるとナチュラルキラー細胞による細胞傷害に抵抗性を示した.これらの結果から,熱帯熱マラリア原虫はRIFINを利用して宿主の免疫を抑制することが考えられた.
4.LILRB1とマラリアの重症化との関連
LILRB1と熱帯熱マラリア原虫に感染した赤血球との相互作用は免疫抑制を示したことから,マラリアの重症化に影響するのではないかと仮説をたてた.この仮説を検証するため,タンザニアにおけるマラリアの患者に由来する熱帯熱マラリア原虫に感染した赤血球へのLILRB1の結合量を測定した.その結果,軽症の患者と比べて,脳性マラリアおよび重い貧血を示す重症の患者に由来する赤血球は,有意にLILRB1と結合しやすいことが明らかにされた.この結果から,重症の患者の赤血球にはLILRB1と結合するRIFINが高く発現しているため,LILRB1と赤血球との相互作用が重症マラリアの病態に関与することが示唆された.標本の数を増やしてさらに重症マラリアの病態との関連を解析する必要があるだろう.
熱帯熱マラリア原虫に感染した赤血球における抗原の発現は宿主免疫の状態により変動する9).マラリアが高度に流行している地域においては,重症マラリアに対する免疫は臨床免疫を獲得するまえの幼児期に成立する.したがって,重症マラリアと関連のあるRIFINに対する抗体はほかのRIFINに対する抗体よりも早く獲得される可能性が考えられた.そこで,LILRB1と結合するRIFINおよび結合しないRIFINの可変領域に対する抗体の反応性をタンザニア人222名の血漿を用いて調べた.その結果,2種類のRIFINに対し,同じ程度の免疫グロブリンGの獲得が1歳において急速に認められた.このように,2種類のRIFINに対して同じ程度の抗体の獲得がみられたが,早期に抗体が獲得されるということはRIFINが感染の初期において活動的であり,防御免疫の重要な標的として役だつことが考えられた.
おわりに
以上の結果から,熱帯熱マラリア原虫は宿主の免疫からのがれるため,宿主のもつ免疫抑制化受容体を標的として多様なRIFINを獲得し進化してきたことが示唆された(図2).RIFINは熱帯熱マラリア原虫にユニークなタンパク質であるが,マウスのマラリア原虫にも存在するPIRスーパーファミリーに属している10).PIRスーパーファミリーと免疫抑制化受容体との相互作用を解析することにより,さらにマラリアへの感染の制御機構が明らかにされることが期待される.さらに,LILRB1が認識するRIFINのエピトープが明らかにされればLILRB1とRIFINとの相互作用の阻害法の開発が可能になると考えられ,マラリアの重症化をふせぐワクチンや治療薬の開発に大きく貢献することが期待される.
文 献
- Kyes, S., Horrocks, P. & Newbold, C.: Antigenic variation at the infected red cell surface in malaria. Annu. Rev. Microbiol., 55, 673-707 (2001)[PubMed]
- Miller, L. H., Baruch, D. I., Marsh, K. et al.: The pathogenic basis of malaria. Nature, 415, 673-679 (2002)[PubMed]
- Arase, H. & Lanier, L. L.: Specific recognition of virus-infected cells by paired NK receptors. Rev. Med. Virol., 14, 83-93 (2004)[PubMed]
- Hirayasu, K. & Arase, H.: Functional and genetic diversity of leukocyte immunoglobulin-like receptor and implication for disease associations. J. Hum. Genet., 60, 703-708 (2015)[PubMed]
- Joannin, N., Abhiman, S., Sonnhammer, E. L. et al.: Sub-grouping and sub-functionalization of the RIFIN multi-copy protein family. BMC Genomics, 9, 19 (2008)[PubMed]
- Hirayasu, K., Saito, F., Suenaga, T. et al.: Microbially cleaved immunoglobulins are sensed by the innate immune receptor LILRA2. Nat. Microbiol., 1, 16054 (2016)[PubMed]
- Arase, H., Mocarski, E. S., Campbell, A. E. et al.: Direct recognition of cytomegalovirus by activating and inhibitory NK cell receptors. Science, 296, 1323-1326 (2002)[PubMed]
- Naji, A., Menier, C., Morandi, F. et al.: Binding of HLA-G to ITIM-bearing Ig-like transcript 2 receptor suppresses B cell responses. J. Immunol., 192, 1536-1546 (2014)[PubMed]
- Lavstsen, T., Turner, L., Saguti, F. et al.: Plasmodium falciparum erythrocyte membrane protein 1 domain cassettes 8 and 13 are associated with severe malaria in children. Proc. Natl. Acad. Sci. USA, 109, E1791-E1800 (2012)[PubMed]
- Janssen, C. S., Phillips, R. S., Turner, C. M. et al.: Plasmodium interspersed repeats: the major multigene superfamily of malaria parasites. Nucleic Acids Res., 32, 5712-5720 (2004)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2006年 高知医科大学大学院医学系研究科博士課程 早期修了,同年 九州大学生体防御医学研究所 特任助手を経て,2009年より大阪大学微生物病研究所 特任研究員.
研究テーマ:免疫学.感染症学.
抱負:感染症の研究をとおして社会に役だつ研究がしたい.
平安 恒幸(Kouyuki Hirayasu)
大阪大学免疫学フロンティア研究センター 特任助教.
荒瀬 尚(Hisashi Arase)
大阪大学微生物病研究所 教授.
研究室URL:http://immchem.biken.osaka-u.ac.jp/
© 2017 齋藤史路・平安恒幸・荒瀬 尚 Licensed under CC 表示 2.1 日本