成体の視覚皮質における可塑性はコリン作動性のブレーキであるLynx1によって制限される
森下博文・ヘンシュ貴雄
(米国Harvard Medical School, Children’s Hospital Boston,FM Kirby Neurobiology Center)
email:森下博文,ヘンシュ貴雄
DOI: 10.7875/first.author.2010.073
Lynx1, a cholinergic brake, limits plasticity in adult visual cortex.
Hirofumi Morishita, Julie M. Miwa, Nathaniel Heintz, Takao K. Hensch
Science, 330, 1238-1240 (2010)
経験に依存する脳の可塑性は神経回路の形成される発達の“臨界期”とよばれる時期を過ぎると低下する.この臨界期の終了にともなう可塑性の減弱の結果,成体においては機能の改善が制限されてしまう.しかし,脳の可塑性のレベルを制御する分子機構には依然として不明な点が多い.筆者らは,成体マウスにおいてLynx1の発現の増加が1次視覚野の可塑性をさまたげていることを明らかにした.この分子ブレーキを除くことでニコチン性アセチルコリン受容体を介するシグナルが増強することから,成体におけるLynx1の発現はコリン作動性ニューロンの存在下における皮質の安定性の維持に寄与しているものと考えられた.さらにこの実験結果は,興奮性と抑制性の神経回路のバランスの変化により視覚皮質の可塑性の再活性化の起こることを示唆しており,今後の治療開発のターゲットとなりうる.
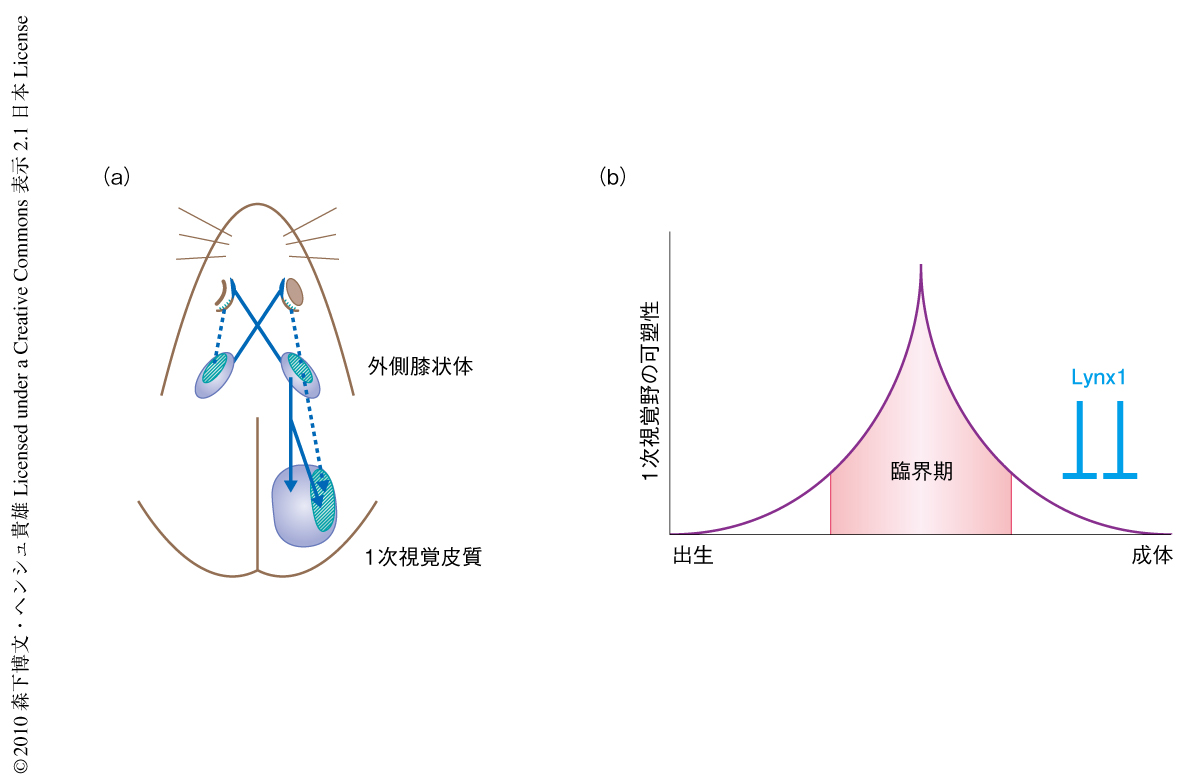
生後の発達の“臨界期”における大脳皮質の可塑性の亢進とそれにひきつづく減弱は神経回路と行動の確立に重要な役割をはたしている1).しかし,成体では臨界期が終了することで脳の可塑性は失われ障害に対する回復が困難となる2).たとえば,幼若期の異常な視覚経験は大脳皮質の1次視覚野において神経回路の形成異常を起こし,弱視とよばれる視覚機能の低下をひき起こす(図1).人口のうち2~4%の割合で弱視の患者がいると推計されており,弱視になるとその影響は一生涯つづき成体での回復は困難である.この成体での脳の可塑性を制限する生物学的な機構を明らかにすることで新規の弱視の治療法の開発につながることが期待される.
筆者らは,成体になると“分子ブレーキ”とでもよぶべき分子の発現が増加することで成体における可塑性を積極的に抑えているのではないかとの仮説をたてた.これまでの研究で臨界期の終了にかかわることの報告されている分子には,細胞外マトリックスの一部であるコンドロイチン硫酸プロテオグリカンやミエリンに由来するシグナルを受容するNgRやPirBがあるが,これらはすべて神経軸索の伸長の抑制にかかわるものである3-5).筆者らは,新規の候補分子の探索のためマウスの1次視覚野において臨界期に比べ成体で発現の増加する分子のトランスクリプトーム解析を行った.この研究では,その候補分子のひとつであるLynx1の解析を行った.Lynx1は内因性のプロトキシン(毒前駆体)のひとつで,ニコチン性アセチルコリン受容体の拮抗的な阻害薬であるαブンガロトキシン(ヘビ毒の一種)と似た構造をもちニコチン性アセチルコリン受容体に結合することが知られている6).
Lynx1はmRNAレベルおよびタンパク質レベルで弱視の臨界期の終了ののち視覚皮質において発現の増加を認めた.また,視覚皮質への中継視床核である外側膝状体でもそのmRNAの発現を認めた.一方,LynxファミリーのひとつであるLynx2は,Lynx1とは逆に,臨界期をへるとともにmRNAの発現の減弱を認めた.
これらの発現解析の結果にもとづき,Lynx1ノックアウトマウスを用いて7),電気生理学的な機能解析を行った.対照となる成体の野生型マウス(生後60日以上)では臨界期の終了した成体の片目を閉じて視覚経験を短時間(4日間)だけ遮断しても可塑性を生じることはなく,1次視覚野における反応に変化はみられなかった.しかし,成体のLnyx1ノックアウトマウスでは片眼の遮蔽により可塑性が生じていた.この可塑性の亢進は成体に限局しており,通常は可塑性の認められる臨界期ではLynx1ノックアウトマウスは野生型マウスと同じレベルの可塑性を認めた.
Lynx1は中枢神経系の主要なニコチン性アセチルコリン受容体(α4β2ヘテロマーやα7ホモマー)に直接に結合してアセチルコリンへの感受性を抑えることが知られている6,7).Lynx1ノックアウトマウスの1次視覚野におけるニコチン投与への反応性を麻酔下の視覚に誘発される電位の測定により評価した結果,Lynx1ノックアウトマウスのみにおいてニコチンによる視覚反応の亢進が認められた.つぎに,Lynx1ノックアウトマウスにおける成体の可塑性がこの亢進したニコチン性アセチルコリン受容体シグナルを介しているかどうかを確認するため,片眼を遮蔽したLynx1ノックアウトマウスに同時にニコチン性アセチルコリン受容体阻害剤を投与して可塑性への影響を確認した.その結果,全身への投与,あるいは,ミニポンプによる1次視覚野への限局した投与のいずれにおいても可塑性が阻害された.
これらの知見の臨床的な意義を明らかにするため,弱視の回復の可塑性を検討した.野生型マウスでは臨界期に長期にわたって片眼の遮蔽を行うと,1次視覚野における視覚に誘発される電位の測定により顕著な視力の低下(弱視)が認められる.興味深いことに,遮蔽した側の目を臨界期の終了ののち再び1ヶ月以上にわたって開いても成体まで視力の低下が持続する.しかし,Lynx1ノックアウトマウスで視力の測定を行った結果,遮蔽した目を開きつづけるだけで成体における視力が自然に回復することが明らかになった.さらに,Lynx1ノックアウトマウスの可塑性はコリン作動性シグナルを介することから,野生型マウスにおいて内因性のアセチルコリンのシグナルを増強することで同様に回復が可能かどうかを検討した.アセチルコリンエステラーゼ阻害剤であるフィゾスチグミンを長期にわたる片眼の遮蔽ののちの開眼期に投与つづけたところ,当初は弱視であった野生型マウスでも同様に弱視の回復が認められた.
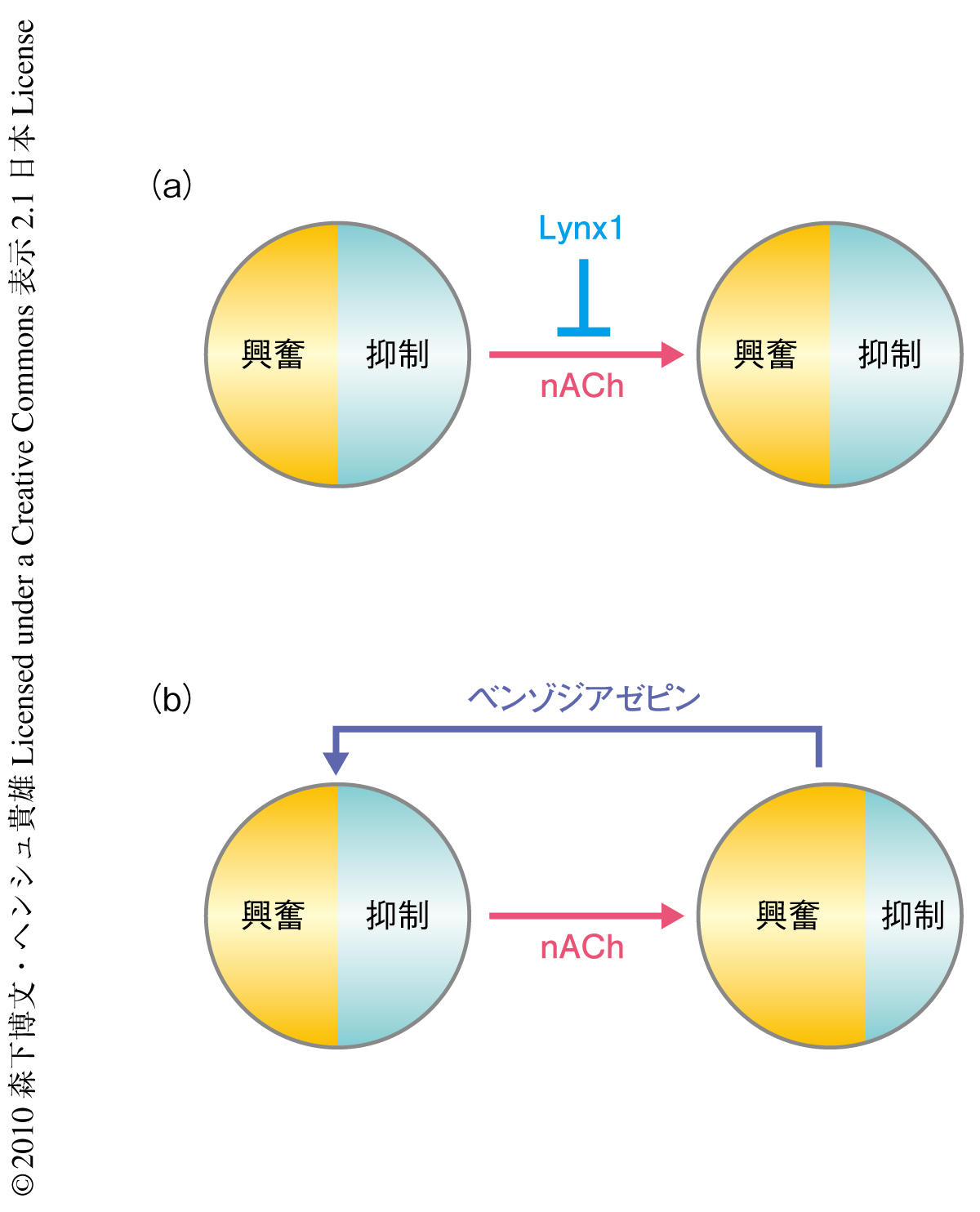
Lynx1ノックアウトマウスで認められた弱視の回復はどのような分子機構で起こっているのであろうか.成体において可塑性を制限することが知られているペリニューロナルネット(細胞外マトリックスの一種)やミエリンの発現に関してはLynx1ノックアウトマウスでは変化は認められなかったことから,局所の神経回路における興奮と抑制のバランスの変化がその分子機構として考えられた2).これまでの報告により,ニコチン性アセチルコリン受容体は1次視覚野に入力する視床-視覚皮質神経軸索のシナプス前終末に発現することで1次視覚野における興奮性を促進することが知られている.また,一部のニコチン性アセチルコリン受容体の遺伝子の先天性変異により抑制性の神経活動に異常をきたすことが知られているが,特定の抑制性ニューロンに発現するニコチン性アセチルコリン受容体の活性化は興奮と抑制のバランスを変化させ脱抑制をひき起こす.実際,Lynx1とニコチン性アセチルコリン受容体のmRNAは外側膝状体のみならず一部の抑制性ニューロン(とくに,parvalbumin陽性細胞)で共発現していた.Lynx1ノックアウトマウスで興奮と抑制のバランスの変化が可塑性に寄与している可能性を検討するため,ミニポンプを用いて1次視覚野に局所的にGABA受容体の機能を促進するベンゾジアセピンを注入し抑制を増強したところ,ニコチン性アセチルコリン受容体阻害剤と同様に可塑性を阻害することが明らかになった.このことから,Lynx1は,コリン作動性シグナルを介して興奮と抑制のバランスを制御することで可塑性を抑えていることが示唆された(図2).
以上の結果は,Lynx1が臨界期の終了に対応する有用な内因性の指標となることを示唆したのと同時に,新規の治療ならびに概念的な視点を提供した.これまで,臨界期における可塑性についてはムスカリン作動性のアセチルコリン受容体の寄与が知られていたが,筆者らの研究結果は,成体での可塑性の制御にはニコチン作動性の受容体が重要であることを示唆した.この結果は成体でのムスカリン性受容体の寄与を否定するものではないが,Lynx1の除去のみで弱視の回復を起こすことができたことは注目に値する.Lynx1とニコチン性アセチルコリン受容体との相互作用をターゲットとした薬物療法と,認知学習やビデオゲームなどの内因性のアセチルコリンの放出を刺激するような注意機能にかかわる行動療法を併用することは8),弱視の治療法として有効かもしれない.また,すでに臨床で利用されているコリンエステラーゼ阻害薬は視覚皮質への入力を増強することも知られており一部の弱視の治療に有効かもしれない.さらに,弱視の有無自体がタバコへの受動喫煙や統合失調症などのニコチン作動性の障害の示唆されている疾患の診断の一助にもなる可能性がある.これまで,臨界期においてはアセチルコリンの可塑性への寄与は知られていたが9),なぜコリン作動性ニューロンの入力の多く存在する成体の1次視覚野において可塑性が制限されているのか,この20年以上も不明であった.Lynx1の発現により,成体における神経回路の安定性を全体レベルでは維持しつつも,局所的にはアセチルコリンによる可塑性を許容するようなシステムが存在するのかもしれない.実際に最近,視覚注意課題により1次視覚野の抑制性ニューロンがより修飾をうけるとの報告があり10),注意などのトップダウンな影響は最終的には1次視覚野の局所的な興奮と抑制のバランスの制御にかかわっている可能性がある.
略歴:2000年 九州大学医学部 卒業,同年 国立精神神経センター病院 精神科,2005年 大阪大学大学院医学系研究科博士課程 修了,2006年より米国Harvard Medical Schoolポストドクトラルフェロー.
研究テーマ:脳の発達期における臨界期の分子機構の解明
関心事:これまでの研究で得られた脳発達の基礎的な知見を,今後,統合失調症などの精神疾患の解明につなげたいと考えています.
ヘンシュ 貴雄(Takao Hensch)
米国Harvard Medical School教授.
© 2010 森下博文・ヘンシュ貴雄 Licensed under CC 表示 2.1 日本
(米国Harvard Medical School, Children’s Hospital Boston,FM Kirby Neurobiology Center)
email:森下博文,ヘンシュ貴雄
DOI: 10.7875/first.author.2010.073
Lynx1, a cholinergic brake, limits plasticity in adult visual cortex.
Hirofumi Morishita, Julie M. Miwa, Nathaniel Heintz, Takao K. Hensch
Science, 330, 1238-1240 (2010)
要 約
経験に依存する脳の可塑性は神経回路の形成される発達の“臨界期”とよばれる時期を過ぎると低下する.この臨界期の終了にともなう可塑性の減弱の結果,成体においては機能の改善が制限されてしまう.しかし,脳の可塑性のレベルを制御する分子機構には依然として不明な点が多い.筆者らは,成体マウスにおいてLynx1の発現の増加が1次視覚野の可塑性をさまたげていることを明らかにした.この分子ブレーキを除くことでニコチン性アセチルコリン受容体を介するシグナルが増強することから,成体におけるLynx1の発現はコリン作動性ニューロンの存在下における皮質の安定性の維持に寄与しているものと考えられた.さらにこの実験結果は,興奮性と抑制性の神経回路のバランスの変化により視覚皮質の可塑性の再活性化の起こることを示唆しており,今後の治療開発のターゲットとなりうる.
はじめに
生後の発達の“臨界期”における大脳皮質の可塑性の亢進とそれにひきつづく減弱は神経回路と行動の確立に重要な役割をはたしている1).しかし,成体では臨界期が終了することで脳の可塑性は失われ障害に対する回復が困難となる2).たとえば,幼若期の異常な視覚経験は大脳皮質の1次視覚野において神経回路の形成異常を起こし,弱視とよばれる視覚機能の低下をひき起こす(図1).人口のうち2~4%の割合で弱視の患者がいると推計されており,弱視になるとその影響は一生涯つづき成体での回復は困難である.この成体での脳の可塑性を制限する生物学的な機構を明らかにすることで新規の弱視の治療法の開発につながることが期待される.
筆者らは,成体になると“分子ブレーキ”とでもよぶべき分子の発現が増加することで成体における可塑性を積極的に抑えているのではないかとの仮説をたてた.これまでの研究で臨界期の終了にかかわることの報告されている分子には,細胞外マトリックスの一部であるコンドロイチン硫酸プロテオグリカンやミエリンに由来するシグナルを受容するNgRやPirBがあるが,これらはすべて神経軸索の伸長の抑制にかかわるものである3-5).筆者らは,新規の候補分子の探索のためマウスの1次視覚野において臨界期に比べ成体で発現の増加する分子のトランスクリプトーム解析を行った.この研究では,その候補分子のひとつであるLynx1の解析を行った.Lynx1は内因性のプロトキシン(毒前駆体)のひとつで,ニコチン性アセチルコリン受容体の拮抗的な阻害薬であるαブンガロトキシン(ヘビ毒の一種)と似た構造をもちニコチン性アセチルコリン受容体に結合することが知られている6).
1.Lynx1は臨界期の終了ののち発現が増加し成体での可塑性を抑える
Lynx1はmRNAレベルおよびタンパク質レベルで弱視の臨界期の終了ののち視覚皮質において発現の増加を認めた.また,視覚皮質への中継視床核である外側膝状体でもそのmRNAの発現を認めた.一方,LynxファミリーのひとつであるLynx2は,Lynx1とは逆に,臨界期をへるとともにmRNAの発現の減弱を認めた.
これらの発現解析の結果にもとづき,Lynx1ノックアウトマウスを用いて7),電気生理学的な機能解析を行った.対照となる成体の野生型マウス(生後60日以上)では臨界期の終了した成体の片目を閉じて視覚経験を短時間(4日間)だけ遮断しても可塑性を生じることはなく,1次視覚野における反応に変化はみられなかった.しかし,成体のLnyx1ノックアウトマウスでは片眼の遮蔽により可塑性が生じていた.この可塑性の亢進は成体に限局しており,通常は可塑性の認められる臨界期ではLynx1ノックアウトマウスは野生型マウスと同じレベルの可塑性を認めた.
2.成体のLynx1ノックアウトマウスでみられる可塑性はニコチン性アセチルコリン受容体シグナルを介している
Lynx1は中枢神経系の主要なニコチン性アセチルコリン受容体(α4β2ヘテロマーやα7ホモマー)に直接に結合してアセチルコリンへの感受性を抑えることが知られている6,7).Lynx1ノックアウトマウスの1次視覚野におけるニコチン投与への反応性を麻酔下の視覚に誘発される電位の測定により評価した結果,Lynx1ノックアウトマウスのみにおいてニコチンによる視覚反応の亢進が認められた.つぎに,Lynx1ノックアウトマウスにおける成体の可塑性がこの亢進したニコチン性アセチルコリン受容体シグナルを介しているかどうかを確認するため,片眼を遮蔽したLynx1ノックアウトマウスに同時にニコチン性アセチルコリン受容体阻害剤を投与して可塑性への影響を確認した.その結果,全身への投与,あるいは,ミニポンプによる1次視覚野への限局した投与のいずれにおいても可塑性が阻害された.
3.成体のLynx1ノックアウトマウスでは弱視が回復する
これらの知見の臨床的な意義を明らかにするため,弱視の回復の可塑性を検討した.野生型マウスでは臨界期に長期にわたって片眼の遮蔽を行うと,1次視覚野における視覚に誘発される電位の測定により顕著な視力の低下(弱視)が認められる.興味深いことに,遮蔽した側の目を臨界期の終了ののち再び1ヶ月以上にわたって開いても成体まで視力の低下が持続する.しかし,Lynx1ノックアウトマウスで視力の測定を行った結果,遮蔽した目を開きつづけるだけで成体における視力が自然に回復することが明らかになった.さらに,Lynx1ノックアウトマウスの可塑性はコリン作動性シグナルを介することから,野生型マウスにおいて内因性のアセチルコリンのシグナルを増強することで同様に回復が可能かどうかを検討した.アセチルコリンエステラーゼ阻害剤であるフィゾスチグミンを長期にわたる片眼の遮蔽ののちの開眼期に投与つづけたところ,当初は弱視であった野生型マウスでも同様に弱視の回復が認められた.
4.Lynx1は大脳皮質における興奮と抑制のバランスを制御することで成体における可塑性を抑える
Lynx1ノックアウトマウスで認められた弱視の回復はどのような分子機構で起こっているのであろうか.成体において可塑性を制限することが知られているペリニューロナルネット(細胞外マトリックスの一種)やミエリンの発現に関してはLynx1ノックアウトマウスでは変化は認められなかったことから,局所の神経回路における興奮と抑制のバランスの変化がその分子機構として考えられた2).これまでの報告により,ニコチン性アセチルコリン受容体は1次視覚野に入力する視床-視覚皮質神経軸索のシナプス前終末に発現することで1次視覚野における興奮性を促進することが知られている.また,一部のニコチン性アセチルコリン受容体の遺伝子の先天性変異により抑制性の神経活動に異常をきたすことが知られているが,特定の抑制性ニューロンに発現するニコチン性アセチルコリン受容体の活性化は興奮と抑制のバランスを変化させ脱抑制をひき起こす.実際,Lynx1とニコチン性アセチルコリン受容体のmRNAは外側膝状体のみならず一部の抑制性ニューロン(とくに,parvalbumin陽性細胞)で共発現していた.Lynx1ノックアウトマウスで興奮と抑制のバランスの変化が可塑性に寄与している可能性を検討するため,ミニポンプを用いて1次視覚野に局所的にGABA受容体の機能を促進するベンゾジアセピンを注入し抑制を増強したところ,ニコチン性アセチルコリン受容体阻害剤と同様に可塑性を阻害することが明らかになった.このことから,Lynx1は,コリン作動性シグナルを介して興奮と抑制のバランスを制御することで可塑性を抑えていることが示唆された(図2).
おわりに
以上の結果は,Lynx1が臨界期の終了に対応する有用な内因性の指標となることを示唆したのと同時に,新規の治療ならびに概念的な視点を提供した.これまで,臨界期における可塑性についてはムスカリン作動性のアセチルコリン受容体の寄与が知られていたが,筆者らの研究結果は,成体での可塑性の制御にはニコチン作動性の受容体が重要であることを示唆した.この結果は成体でのムスカリン性受容体の寄与を否定するものではないが,Lynx1の除去のみで弱視の回復を起こすことができたことは注目に値する.Lynx1とニコチン性アセチルコリン受容体との相互作用をターゲットとした薬物療法と,認知学習やビデオゲームなどの内因性のアセチルコリンの放出を刺激するような注意機能にかかわる行動療法を併用することは8),弱視の治療法として有効かもしれない.また,すでに臨床で利用されているコリンエステラーゼ阻害薬は視覚皮質への入力を増強することも知られており一部の弱視の治療に有効かもしれない.さらに,弱視の有無自体がタバコへの受動喫煙や統合失調症などのニコチン作動性の障害の示唆されている疾患の診断の一助にもなる可能性がある.これまで,臨界期においてはアセチルコリンの可塑性への寄与は知られていたが9),なぜコリン作動性ニューロンの入力の多く存在する成体の1次視覚野において可塑性が制限されているのか,この20年以上も不明であった.Lynx1の発現により,成体における神経回路の安定性を全体レベルでは維持しつつも,局所的にはアセチルコリンによる可塑性を許容するようなシステムが存在するのかもしれない.実際に最近,視覚注意課題により1次視覚野の抑制性ニューロンがより修飾をうけるとの報告があり10),注意などのトップダウンな影響は最終的には1次視覚野の局所的な興奮と抑制のバランスの制御にかかわっている可能性がある.
文 献
- Hensch, T. K.: Critical period regulation. Annu. Rev. Neurosci., 27, 549-579 (2004)[PubMed]
- Morishita, H., Hensch, T. K.: Critical period revisited: impact on vision. Curr. Opin. Neurobiol., 18, 101-107 (2008)[PubMed]
- Pizzorusso, T., Medini, P., Berardi, N. et al.: Reactivation of ocular dominance plasticity in the adult visual cortex. Science, 298, 1248-1251 (2002)[PubMed]
- McGee, A. W., Yang, Y., Fischer, Q. S. et al.: Experience-driven plasticity of visual cortex limited by myelin and Nogo receptor. Science, 309, 2222-2226 (2005)[PubMed]
- Syken, J., Grandpre, T., Kanold, P. O. et al.: PirB restricts ocular-dominance plasticity in visual cortex. Science, 313, 1795-1800 (2006)[PubMed]
- Miwa, J. M., Ibanez-Tallon, I., Crabtree, G. W. et al.: lynx1, an endogenous toxin-like modulator of nicotinic acetylcholine receptors in the mammalian CNS. Neuron, 23, 105-114 (1999)[PubMed]
- Miwa, J. M., Stevens, T. R., King, S. L. et al.: The prototoxin lynx1 acts on nicotinic acetylcholine receptors to balance neuronal activity and survival in vivo. Neuron, 51, 587-600 (2006)[PubMed]
- Bavelier, D., Levi, D. M., Li, R. W. et al.: Removing brakes on adult brain plasticity: from molecular to behavioral interventions. J. Neurosci., 30, 14964-14971 (2010)[PubMed]
- Bear, M. F., Singer, W.: Modulation of visual cortical plasticity by acetylcholine and noradrenaline. Nature, 320, 172-176 (1986)[PubMed]
- Chen, Y., Martinez-Conde, S., Macknik, S. L. et al.: Task difficulty modulates the activity of specific neuronal populations in primary visual cortex. Nat. Neurosci., 11, 974-982 (2008)[PubMed]
著者プロフィール
略歴:2000年 九州大学医学部 卒業,同年 国立精神神経センター病院 精神科,2005年 大阪大学大学院医学系研究科博士課程 修了,2006年より米国Harvard Medical Schoolポストドクトラルフェロー.
研究テーマ:脳の発達期における臨界期の分子機構の解明
関心事:これまでの研究で得られた脳発達の基礎的な知見を,今後,統合失調症などの精神疾患の解明につなげたいと考えています.
ヘンシュ 貴雄(Takao Hensch)
米国Harvard Medical School教授.
© 2010 森下博文・ヘンシュ貴雄 Licensed under CC 表示 2.1 日本