電位依存性Ca2+チャネル,リアノジン受容体,電位/Ca2+活性化型K+チャネルからなる二重のCa2+ナノドメインはニューロンにおいてバースト発火を制御する
入江智彦1・Laurence O. Trussell 2
(1国立医薬品食品衛生研究所 安全性生物試験研究センター薬理部,2米国Oregon Health and Science大学Oregon Hearing Research Center)
email:入江智彦
DOI: 10.7875/first.author.2017.141
Double-nanodomain coupling of calcium channels, ryanodine receptors, and BK channels controls the generation of burst firing.
Tomohiko Irie, Laurence O. Trussell
Neuron, 96, 856-870.e4 (2017)
複数の活動電位がまとまり高頻度で発火する現象はバースト発火とよばれ,ニューロンにおける情報処理において重要な役割をはたす.しかしながら,バースト発火の持続時間および頻度を制御する電流についてはほとんど解明されていない.この研究において,筆者らは,マウスの背側蝸牛神経核のcartwheelインターニューロンにおいて,バースト発火の頻度は二重のCa2+ナノドメインにおけるCa2+シグナル伝達により制御されることを見い出した.この二重のCa2+ナノドメインは,細胞膜の電位依存性Ca2+チャネルと小胞体膜のリアノジン受容体とのあいだ,および,リアノジン受容体と細胞膜の電位/Ca2+活性化型K+チャネルのあいだに形成されていた.活動電位にともなう脱分極により電位依存性Ca2+チャネルが活性化し,これにより流入するCa2+がリアノジン受容体に作用してCa2+誘発性Ca2+放出を起こすことがわかったが,このCa2+誘発性Ca2+放出は細胞体膜の近傍でのみ起こり,樹状突起あるいは神経軸索の初節においては起こらなかった.さらに,蛍光免疫染色法によりリアノジン受容体および電位/Ca2+活性化型K+チャネルは細胞体膜に共局在することが示された.このように,細胞体膜と細胞体膜の直下の小胞体とのあいだに形成される二重のCa2+ナノドメインは,ミリ秒単位の時間スケールで発生する活動電位の急激な制御を可能にしていた.
ニューロンにおいて複数の活動電位が高頻度でまとまり発生する現象はバースト発火とよばれる.バースト発火は脳において普遍的な現象であり,シナプスの可塑性,睡眠および覚醒,報酬に関連した行動,運動学習などにおいて重要な役割をはたす.バースト発火はシナプス前終末において神経伝達物質の放出を増加させ,樹状突起においてはスパインの内部においてCa2+を増幅する.バースト発火は細胞膜が持続的な内向き電流により脱分極することにより誘発される.一方,バースト発火が消失するときには,バースト発火をひき起こした内向き電流が外向き電流により打ち消される必要があり,この外向き電流がバースト発火の持続時間や頻度などを決定すると考えられる.
バースト発火の誘発には電位依存性Ca2+チャネルの活性化が重要な場合が多く,この場合,Ca2+活性化型K+チャネルがバースト発火の発生に重要な役割を担うことが予想される.たとえば,背側蝸牛神経核に存在するcartwheelインターニューロンは自発的にあるいはシナプス入力をうけてバースト発火を起こす.このバースト発火は電位/Ca2+活性化型K+チャネルに強く依存しており,電位/Ca2+活性化型K+チャネルを阻害するとバースト発火の持続時間および頻度が顕著に上昇する1).このようなバースト発火において電位/Ca2+活性化型K+チャネルが活性化されるには,細胞におけるCa2+の濃度が急激かつ電位/Ca2+活性化型K+チャネルの近傍において上昇する必要がある.
細胞においてCa2+の濃度が急激かつ正確に時空間的な制御をうける場合には,Ca2+チャネルとCa2+との結合部位をもつタンパク質との距離が数十nm~数百nmであるCa2+ドメインにおいて制御がなされる2).このようなCa2+ドメインは,たとえば,シナプス前終末の神経伝達物質の放出にかかわる部位に存在する.一方,シナプス後細胞においてバースト発火の制御に関与するCa2+ドメインの候補として,細胞膜とCa2+ストアとしてはたらく小胞体とのあいだがあげられる.小胞体はさまざまな形態および機能を示す3).細胞膜の直下の小胞体は“subsurface ER cistern”とよばれ4),これは細胞膜に対しその内側からごく近接した形態を示し,Ca2+ストアとしてはたらく.Ca2+誘発性Ca2+放出においてはリアノジン受容体を介して小胞体からCa2+が放出されるが5),このCa2+が細胞膜に存在するCa2+依存性K+チャネルに作用してバースト発火を制御する可能性が考えられる.cartwheelインターニューロンは細胞膜の直下の小胞体を豊富にもつことが知られている6).そこで,cartwheelインターニューロンをバースト発火を起こすニューロンのモデルとし,Ca2+誘発性Ca2+放出がどのようにバースト発火の発生の頻度およびひとつのバースト発火における活動電位のあいだの頻度に関与するかを調べた.
16日齢~26日齢のマウスから背側蝸牛神経核を含む新鮮な脳の切片を作製し,ルーズセルパッチクランプ法により細胞体からcartwheelインターニューロンの自発発火を記録した.約60%のニューロンはバーストをともなわない発火を示したが,残りはバースト発火とバーストをともなわない発火の2種類が混在していた.リアノジン受容体の阻害剤であるリアノジンを投与してCa2+誘発性Ca2+放出を抑制したところ,バーストをともなわない発火を示すニューロンにおいて発火のパターンがバースト発火へと変化した.バースト発火を示すニューロンにおいてはCa2+誘発性Ca2+放出の阻害によりバースト発火の頻度が顕著に上昇した.また,Ca2+誘発性Ca2+放出の阻害は,ひとつのバースト発火に含まれる活動電位の数には影響しなかったが,1発目と2発目の活動電位の間隔を短縮した.このように,Ca2+誘発性Ca2+放出はバースト発火の頻度およびひとつのバーストにおける活動電位の間隔に関係することがわかった.
Ca2+誘発性Ca2+放出を阻害して増加したバースト発火が抑制性シナプス後電流の波型にどのように影響するかを検討するため,cartwheelインターニューロンのシナプス後細胞からシナプス前細胞の自発発火により誘発される抑制性シナプス後電流を記録した.リアノジンの投与のまえは抑制性シナプス後電流の波型はほとんどが1峰性であり,ときおり複数のピークをもつ波型が記録された.これは,それぞれ,バーストをともなわない発火により誘発されたシナプス後電流およびバースト発火により誘発されたシナプス後電流と考えられた.Ca2+誘発性Ca2+放出を阻害したのちには複数のピークをもつ波型の出現する頻度が顕著に上昇した.ピークのあいだの時間から計算した頻度は,ひとつのバースト発火における活動電位の頻度と一致した.このように,Ca2+誘発性Ca2+放出は発火にともない機能することにより,バースト発火を抑制してシナプス後細胞の過剰な抑制をふせぐ役割をもつことがわかった.
Ca2+誘発性Ca2+放出がどのように膜電位に影響をあたえて発火を制御するかを明らかにするため,穿孔パッチクランプ法により膜電位を記録した.cartwheelインターニューロンは小さな脱分極刺激によりひとつの活動電位を示し,大きな脱分極刺激によりバースト発火を示すことが知られている.Ca2+誘発性Ca2+放出を阻害したところ,小さな脱分極刺激の場合はバースト発火の発生の頻度が上昇し,大きな脱分極刺激の場合はバースト発火において1発目の活動電位のあとに起こる速い後過分極が浅くなった.これらをまとめると,Ca2+誘発性Ca2+放出は活動電位が発生したときに急速に再分極するのを助け,バースト発火を誘発する内向き電流に対抗する役割をもつことがわかった.
Ca2+誘発性Ca2+放出は急速な再分極に関与することがわかったことから,電位/Ca2+活性化型K+チャネルはCa2+誘発性Ca2+放出により活性化され後過分極を強めるはたらきをもつかのどうか検討した.活動電位を誘発した条件において電位/Ca2+活性化型K+チャネルの阻害剤を投与すると活動電位の波型の幅が広くなったが,この状況でさらにリアノジンを投与しCa2+誘発性Ca2+放出を阻害しても波型は変化しなかった.このことより,活動電位により誘発されたCa2+誘発性Ca2+放出は電位/Ca2+活性化型K+チャネルの活性化をひき起こすことがわかった.
Na+チャネルやAMPA受容体などのリガンド作動性チャネルを阻害した条件において電位固定法により細胞膜を脱分極させると,一過性の外向き電流が発生した.これは,電位/Ca2+活性化型K+チャネルの阻害により消失し,Ca2+誘発性Ca2+放出の阻害により減弱した.また,この一過性の外向き電流はサブタイプに非特異的な電位依存性Ca2+チャネルの阻害剤により消失した.これらのことより,電位依存性Ca2+チャネルが脱分極により開口し,これを介したCa2+の流入がCa2+誘発性Ca2+放出を誘発し,その結果,電位/Ca2+活性化型K+チャネルが活性化されたことにより一過性の外向き電流が誘発されたことがわかった.cartwheelインターニューロンはP/Q型,L型,T型の電位依存性Ca2+チャネルをもつ1).そこで,電位/Ca2+活性化型K+チャネルによる一過性の外向き電流を指標にしてそれぞれのサブタイプに特異的な阻害剤による影響について検討したところ,P/Q型Ca2+チャネルの阻害剤により一過性の外向き電流は顕著に減弱した.これらのことから,P/Q型Ca2+チャネルはCa2+誘発性Ca2+放出とそれにつづく電位/Ca2+活性化型K+チャネルの活性化に関与するおもな電位依存性Ca2+チャネルであることがわかった.
Ca2+誘発性Ca2+放出により誘発される一過性の外向き電流はひとつの活動電位が発生するあいだに発生したことから,リアノジンにより阻害される細胞におけるCa2+の上昇は非常に時間経過が早く,したがって,細胞膜に近接した部位において発生することが予想された.そこで,パッチクランプ法と2光子励起顕微鏡によるCa2+イメージング法を組み合わせ,cartwheelインターニューロンのどの部位の細胞膜の直下において活動電位に依存的なCa2+誘発性Ca2+放出が誘発されるかを調べた.活動電位を誘発して細胞においてCa2+を上昇させ,この上昇がCa2+誘発性Ca2+放出の阻害によりどのくらい減弱するかを細胞体,樹状突起,神経軸索の初節の3箇所において測定した.その結果,細胞体膜の直下において観察されたCa2+の上昇はリアノジンによるCa2+誘発性Ca2+放出の阻害により27%ほど減少した.この減少は小胞体においてCa2+ストアを枯渇させる薬剤であるシクロピアゾン酸の投与により再現された.一方,樹状突起および神経軸索の初節においてはリアノジンの投与により変化は観察されなかった.したがって,神経軸索の初節において発火によりCa2+が流入し7),また,樹状突起へは発火が逆向性に伝播するにもかかわらず8),活動電位に依存的なCa2+誘発性Ca2+放出は細胞体膜の近傍においてのみ誘発されることがわかった.
大きな脱分極はCa2+誘発性Ca2+放出による一過性の外向き電流を誘発することが明らかにされた.一方,Na+チャネルやAMPA受容体などのリガンド作動性チャネルを阻害した条件においてより小さい脱分極をあたえた場合,自発的な微小外向き電流が発生した9).これは,電位/Ca2+活性化型K+チャネルの阻害剤,Ca2+誘発性Ca2+放出の阻害剤,P/Q型Ca2+チャネルの阻害剤により消失したことから,この微小外向き電流もP/Q型Ca2+チャネル,リアノジン受容体,電位/Ca2+活性化型K+チャネルが協調してはたらくことにより発生することがわかった.
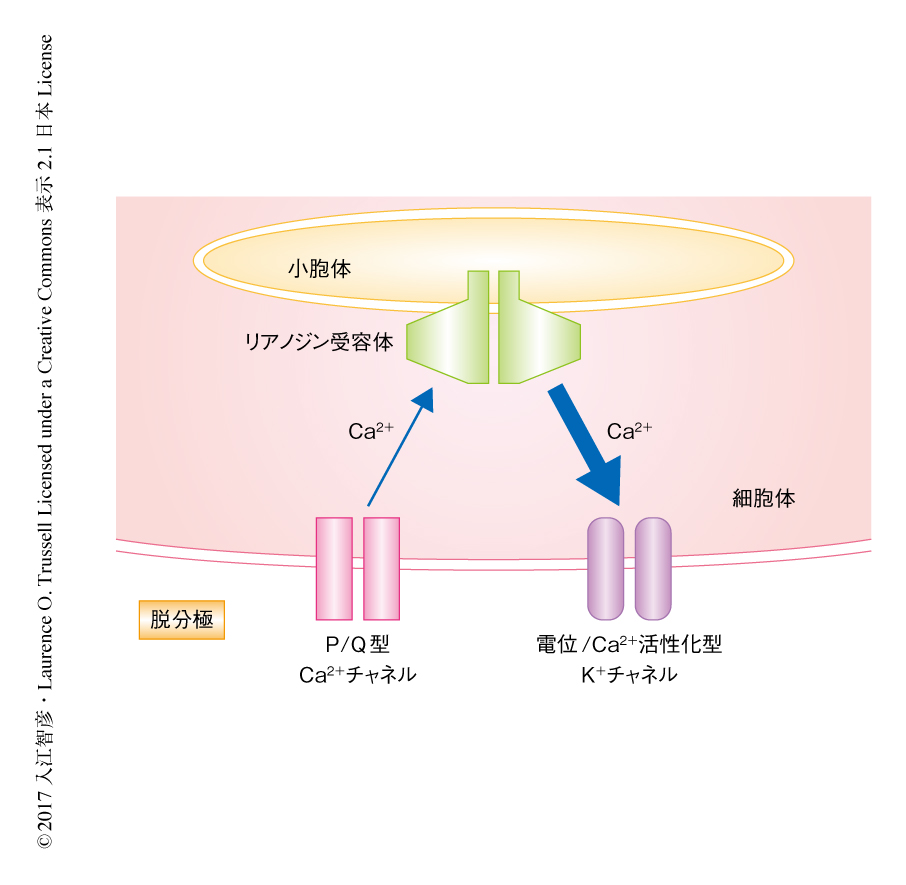
自発的な微小外向き電流はP/Q型Ca2+チャネル,リアノジン受容体,電位/Ca2+活性化型K+チャネルの協調したはたらきにより発生したことから,これら3つのチャネルがCa2+ドメインを形成している可能性があり,このドメインにおける三者の距離が自発的な微小外向き電流の発生に重要であると考えられた.実験的に,Ca2+シグナル伝達の距離の推定にはBAPTAおよびEGTAというCa2+キレート剤を利用する方法が知られている2).Ca2+チャネルとエフェクターのCa2+センサーとの距離がナノドメインの範囲の場合には,Ca2+と結合する速度の速いBAPTAはCa2+をキレートしてCa2+シグナル伝達を阻害するが,Ca2+と結合する速度の遅いEGTAは効果を示さない.一方,距離がより遠いマイクロドメインの範囲の場合には,Ca2+シグナル伝達はEGTAにより阻害される.BAPTAあるいはEGTAを含むパッチ電極内液を用いて自発的な微小外向き電流に対する影響を検討したところ,EGTAは自発的な微小外向き電流の発生する頻度や大きさに影響しなかったが,BATPAは時間の経過とともに頻度を低下させ,10分後には自発的な微小外向き電流の発生は消失した.このことから,Ca2+の供給源およびその標的は異なる膜に存在するにもかかわらず,P/Q型Ca2+チャネル,リアノジン受容体,電位/Ca2+活性化型K+チャネルの三者はCa2+ナノドメインの範囲に位置することがわかった(図1).同じ方法を用いて,Ca2+誘発性Ca2+放出による一過性の外向き電流におけるCa2+シグナル伝達について調べたところ,自発的な微小外向き電流と同様にCa2+ナノドメインの範囲で起こることが明らかにされた.
リアノジン受容体と電位/Ca2+活性化型K+チャネルの機能的な共役がcartwheelインターニューロンのどの部位で起こるかを形態学的に確認するため,抗リアノジン受容体および抗電位/Ca2+活性化型K+チャネル抗体を用いて蛍光免疫染色法および共焦点顕微鏡により観察した.その結果,電位/Ca2+活性化型K+チャネルのシグナルは細胞体膜においてもっとも強く点状に存在し,細胞体の内部および樹状突起の全体にも弱いながらもシグナルが認められた.リアノジン受容体のシグナルも細胞体膜の付近においてもっとも強く点状に認められたが,中程度のシグナルが細胞体の内部および樹状突起の全体にも存在した.それぞれのシグナルの共局在を定量したところ,細胞体膜において多くの共局在がみられた一方,樹状突起の膜において共局在はほとんど観察されなかった.リアノジン受容体は小胞体に存在するチャネルであるが,強いシグナルは共焦点顕微鏡の解像度の関係から細胞体膜の付近に局在して観察された.このことから,リアノジン受容体が存在する小胞体と細胞膜は非常に近接しており,Ca2+誘発性Ca2+放出は電子顕微鏡を用いた研究において存在が発見された細胞膜の直下の小胞体“subsurface ER cistern”6) において起こることが強く示唆された.
この研究において,筆者らは,P/Q型Ca2+チャネル,リアノジン受容体,電位/Ca2+活性化型K+チャネルの3種類のチャネルが細胞膜と細胞膜の直下の小胞体とのあいだに形成された二重のCa2+ナノドメインにおいてCa2+シグナルを介し相互作用することを示した(図1).P/Q型Ca2+チャネルを介して流入したCa2+はCa2+ナノドメインをこえて小胞体のリアノジン受容体に作用し,リアノジン受容体をとおり放出されたCa2+は同様の距離をこえて電位/Ca2+活性化型K+チャネルに作用する.あわせて考察すると,これらのチャネルおよび膜はバースト発火の頻度やひとつのバースト発火における活動電位の間隔を制御する“小器官”のように機能するといえるだろう.この研究において発見された二重のCa2+ナノドメインを構成する個々の要素,チャネルの種類,細胞膜の直下の小胞体,バースト発火,自発的な微小外向き電流は,中枢神経系において広く知られるものであり,発見された分子機構はバースト発火が発生する脳のほかの部位のニューロンにおいても使われているのかもしれない.また,活動電位より誘発される時間経過の早いCa2+誘発性Ca2+放出は細胞体に限局した一方,Ca2+誘発性Ca2+放出はシナプスの可塑性において重要な役割をはたすことが広く知られている.実際に,cartwheelインターニューロンにおけるシナプスの可塑性にはCa2+誘発性Ca2+放出が関与することが報告されている10).それゆえ,Ca2+誘発性Ca2+放出の機能は,リアノジン受容体と機能的に共役するチャネルなどの細胞における位置に依存して変わるといえるかもしれない.
略歴:2008年 京都大学大学院医学研究科博士課程 修了,同年 小野薬品工業 研究員,2009年 群馬大学大学院医学研究科 助教,2011年 国立医薬品食品衛生研究所 主任研究官,2015年 米国Oregon Health and Science大学Postdoctoral researcherを経て,2017年より国立医薬品食品衛生研究所 主任研究官.
研究テーマ:聴覚系のニューロンを対象とした神経生理学的な現象.危険ドラッグが中枢神経系に作用する分子機構.
Laurence O. Trussell
米国Oregon Health and Science大学Professor.
© 2017 入江智彦・Laurence O. Trussell Licensed under CC 表示 2.1 日本
(1国立医薬品食品衛生研究所 安全性生物試験研究センター薬理部,2米国Oregon Health and Science大学Oregon Hearing Research Center)
email:入江智彦
DOI: 10.7875/first.author.2017.141
Double-nanodomain coupling of calcium channels, ryanodine receptors, and BK channels controls the generation of burst firing.
Tomohiko Irie, Laurence O. Trussell
Neuron, 96, 856-870.e4 (2017)
要 約
複数の活動電位がまとまり高頻度で発火する現象はバースト発火とよばれ,ニューロンにおける情報処理において重要な役割をはたす.しかしながら,バースト発火の持続時間および頻度を制御する電流についてはほとんど解明されていない.この研究において,筆者らは,マウスの背側蝸牛神経核のcartwheelインターニューロンにおいて,バースト発火の頻度は二重のCa2+ナノドメインにおけるCa2+シグナル伝達により制御されることを見い出した.この二重のCa2+ナノドメインは,細胞膜の電位依存性Ca2+チャネルと小胞体膜のリアノジン受容体とのあいだ,および,リアノジン受容体と細胞膜の電位/Ca2+活性化型K+チャネルのあいだに形成されていた.活動電位にともなう脱分極により電位依存性Ca2+チャネルが活性化し,これにより流入するCa2+がリアノジン受容体に作用してCa2+誘発性Ca2+放出を起こすことがわかったが,このCa2+誘発性Ca2+放出は細胞体膜の近傍でのみ起こり,樹状突起あるいは神経軸索の初節においては起こらなかった.さらに,蛍光免疫染色法によりリアノジン受容体および電位/Ca2+活性化型K+チャネルは細胞体膜に共局在することが示された.このように,細胞体膜と細胞体膜の直下の小胞体とのあいだに形成される二重のCa2+ナノドメインは,ミリ秒単位の時間スケールで発生する活動電位の急激な制御を可能にしていた.
はじめに
ニューロンにおいて複数の活動電位が高頻度でまとまり発生する現象はバースト発火とよばれる.バースト発火は脳において普遍的な現象であり,シナプスの可塑性,睡眠および覚醒,報酬に関連した行動,運動学習などにおいて重要な役割をはたす.バースト発火はシナプス前終末において神経伝達物質の放出を増加させ,樹状突起においてはスパインの内部においてCa2+を増幅する.バースト発火は細胞膜が持続的な内向き電流により脱分極することにより誘発される.一方,バースト発火が消失するときには,バースト発火をひき起こした内向き電流が外向き電流により打ち消される必要があり,この外向き電流がバースト発火の持続時間や頻度などを決定すると考えられる.
バースト発火の誘発には電位依存性Ca2+チャネルの活性化が重要な場合が多く,この場合,Ca2+活性化型K+チャネルがバースト発火の発生に重要な役割を担うことが予想される.たとえば,背側蝸牛神経核に存在するcartwheelインターニューロンは自発的にあるいはシナプス入力をうけてバースト発火を起こす.このバースト発火は電位/Ca2+活性化型K+チャネルに強く依存しており,電位/Ca2+活性化型K+チャネルを阻害するとバースト発火の持続時間および頻度が顕著に上昇する1).このようなバースト発火において電位/Ca2+活性化型K+チャネルが活性化されるには,細胞におけるCa2+の濃度が急激かつ電位/Ca2+活性化型K+チャネルの近傍において上昇する必要がある.
細胞においてCa2+の濃度が急激かつ正確に時空間的な制御をうける場合には,Ca2+チャネルとCa2+との結合部位をもつタンパク質との距離が数十nm~数百nmであるCa2+ドメインにおいて制御がなされる2).このようなCa2+ドメインは,たとえば,シナプス前終末の神経伝達物質の放出にかかわる部位に存在する.一方,シナプス後細胞においてバースト発火の制御に関与するCa2+ドメインの候補として,細胞膜とCa2+ストアとしてはたらく小胞体とのあいだがあげられる.小胞体はさまざまな形態および機能を示す3).細胞膜の直下の小胞体は“subsurface ER cistern”とよばれ4),これは細胞膜に対しその内側からごく近接した形態を示し,Ca2+ストアとしてはたらく.Ca2+誘発性Ca2+放出においてはリアノジン受容体を介して小胞体からCa2+が放出されるが5),このCa2+が細胞膜に存在するCa2+依存性K+チャネルに作用してバースト発火を制御する可能性が考えられる.cartwheelインターニューロンは細胞膜の直下の小胞体を豊富にもつことが知られている6).そこで,cartwheelインターニューロンをバースト発火を起こすニューロンのモデルとし,Ca2+誘発性Ca2+放出がどのようにバースト発火の発生の頻度およびひとつのバースト発火における活動電位のあいだの頻度に関与するかを調べた.
1.リアノジン受容体を介したCa2+誘発性Ca2+放出は活動電位を制御する
16日齢~26日齢のマウスから背側蝸牛神経核を含む新鮮な脳の切片を作製し,ルーズセルパッチクランプ法により細胞体からcartwheelインターニューロンの自発発火を記録した.約60%のニューロンはバーストをともなわない発火を示したが,残りはバースト発火とバーストをともなわない発火の2種類が混在していた.リアノジン受容体の阻害剤であるリアノジンを投与してCa2+誘発性Ca2+放出を抑制したところ,バーストをともなわない発火を示すニューロンにおいて発火のパターンがバースト発火へと変化した.バースト発火を示すニューロンにおいてはCa2+誘発性Ca2+放出の阻害によりバースト発火の頻度が顕著に上昇した.また,Ca2+誘発性Ca2+放出の阻害は,ひとつのバースト発火に含まれる活動電位の数には影響しなかったが,1発目と2発目の活動電位の間隔を短縮した.このように,Ca2+誘発性Ca2+放出はバースト発火の頻度およびひとつのバーストにおける活動電位の間隔に関係することがわかった.
Ca2+誘発性Ca2+放出を阻害して増加したバースト発火が抑制性シナプス後電流の波型にどのように影響するかを検討するため,cartwheelインターニューロンのシナプス後細胞からシナプス前細胞の自発発火により誘発される抑制性シナプス後電流を記録した.リアノジンの投与のまえは抑制性シナプス後電流の波型はほとんどが1峰性であり,ときおり複数のピークをもつ波型が記録された.これは,それぞれ,バーストをともなわない発火により誘発されたシナプス後電流およびバースト発火により誘発されたシナプス後電流と考えられた.Ca2+誘発性Ca2+放出を阻害したのちには複数のピークをもつ波型の出現する頻度が顕著に上昇した.ピークのあいだの時間から計算した頻度は,ひとつのバースト発火における活動電位の頻度と一致した.このように,Ca2+誘発性Ca2+放出は発火にともない機能することにより,バースト発火を抑制してシナプス後細胞の過剰な抑制をふせぐ役割をもつことがわかった.
Ca2+誘発性Ca2+放出がどのように膜電位に影響をあたえて発火を制御するかを明らかにするため,穿孔パッチクランプ法により膜電位を記録した.cartwheelインターニューロンは小さな脱分極刺激によりひとつの活動電位を示し,大きな脱分極刺激によりバースト発火を示すことが知られている.Ca2+誘発性Ca2+放出を阻害したところ,小さな脱分極刺激の場合はバースト発火の発生の頻度が上昇し,大きな脱分極刺激の場合はバースト発火において1発目の活動電位のあとに起こる速い後過分極が浅くなった.これらをまとめると,Ca2+誘発性Ca2+放出は活動電位が発生したときに急速に再分極するのを助け,バースト発火を誘発する内向き電流に対抗する役割をもつことがわかった.
2.P/Q型Ca2+チャネルはCa2+誘発性Ca2+放出を誘発し電位/Ca2+活性化型K+チャネルの活性化をひき起こす
Ca2+誘発性Ca2+放出は急速な再分極に関与することがわかったことから,電位/Ca2+活性化型K+チャネルはCa2+誘発性Ca2+放出により活性化され後過分極を強めるはたらきをもつかのどうか検討した.活動電位を誘発した条件において電位/Ca2+活性化型K+チャネルの阻害剤を投与すると活動電位の波型の幅が広くなったが,この状況でさらにリアノジンを投与しCa2+誘発性Ca2+放出を阻害しても波型は変化しなかった.このことより,活動電位により誘発されたCa2+誘発性Ca2+放出は電位/Ca2+活性化型K+チャネルの活性化をひき起こすことがわかった.
Na+チャネルやAMPA受容体などのリガンド作動性チャネルを阻害した条件において電位固定法により細胞膜を脱分極させると,一過性の外向き電流が発生した.これは,電位/Ca2+活性化型K+チャネルの阻害により消失し,Ca2+誘発性Ca2+放出の阻害により減弱した.また,この一過性の外向き電流はサブタイプに非特異的な電位依存性Ca2+チャネルの阻害剤により消失した.これらのことより,電位依存性Ca2+チャネルが脱分極により開口し,これを介したCa2+の流入がCa2+誘発性Ca2+放出を誘発し,その結果,電位/Ca2+活性化型K+チャネルが活性化されたことにより一過性の外向き電流が誘発されたことがわかった.cartwheelインターニューロンはP/Q型,L型,T型の電位依存性Ca2+チャネルをもつ1).そこで,電位/Ca2+活性化型K+チャネルによる一過性の外向き電流を指標にしてそれぞれのサブタイプに特異的な阻害剤による影響について検討したところ,P/Q型Ca2+チャネルの阻害剤により一過性の外向き電流は顕著に減弱した.これらのことから,P/Q型Ca2+チャネルはCa2+誘発性Ca2+放出とそれにつづく電位/Ca2+活性化型K+チャネルの活性化に関与するおもな電位依存性Ca2+チャネルであることがわかった.
3.時間経過の早いCa2+誘発性Ca2+放出は細胞体膜の近傍において起こる
Ca2+誘発性Ca2+放出により誘発される一過性の外向き電流はひとつの活動電位が発生するあいだに発生したことから,リアノジンにより阻害される細胞におけるCa2+の上昇は非常に時間経過が早く,したがって,細胞膜に近接した部位において発生することが予想された.そこで,パッチクランプ法と2光子励起顕微鏡によるCa2+イメージング法を組み合わせ,cartwheelインターニューロンのどの部位の細胞膜の直下において活動電位に依存的なCa2+誘発性Ca2+放出が誘発されるかを調べた.活動電位を誘発して細胞においてCa2+を上昇させ,この上昇がCa2+誘発性Ca2+放出の阻害によりどのくらい減弱するかを細胞体,樹状突起,神経軸索の初節の3箇所において測定した.その結果,細胞体膜の直下において観察されたCa2+の上昇はリアノジンによるCa2+誘発性Ca2+放出の阻害により27%ほど減少した.この減少は小胞体においてCa2+ストアを枯渇させる薬剤であるシクロピアゾン酸の投与により再現された.一方,樹状突起および神経軸索の初節においてはリアノジンの投与により変化は観察されなかった.したがって,神経軸索の初節において発火によりCa2+が流入し7),また,樹状突起へは発火が逆向性に伝播するにもかかわらず8),活動電位に依存的なCa2+誘発性Ca2+放出は細胞体膜の近傍においてのみ誘発されることがわかった.
4.Ca2+誘発性Ca2+放出による自発的な微小外向き電流
大きな脱分極はCa2+誘発性Ca2+放出による一過性の外向き電流を誘発することが明らかにされた.一方,Na+チャネルやAMPA受容体などのリガンド作動性チャネルを阻害した条件においてより小さい脱分極をあたえた場合,自発的な微小外向き電流が発生した9).これは,電位/Ca2+活性化型K+チャネルの阻害剤,Ca2+誘発性Ca2+放出の阻害剤,P/Q型Ca2+チャネルの阻害剤により消失したことから,この微小外向き電流もP/Q型Ca2+チャネル,リアノジン受容体,電位/Ca2+活性化型K+チャネルが協調してはたらくことにより発生することがわかった.
5.P/Q型Ca2+チャネルとリアノジン受容体,リアノジン受容体と電位/Ca2+活性化型K+チャネルはそれぞれCa2+ナノドメインを形成する
自発的な微小外向き電流はP/Q型Ca2+チャネル,リアノジン受容体,電位/Ca2+活性化型K+チャネルの協調したはたらきにより発生したことから,これら3つのチャネルがCa2+ドメインを形成している可能性があり,このドメインにおける三者の距離が自発的な微小外向き電流の発生に重要であると考えられた.実験的に,Ca2+シグナル伝達の距離の推定にはBAPTAおよびEGTAというCa2+キレート剤を利用する方法が知られている2).Ca2+チャネルとエフェクターのCa2+センサーとの距離がナノドメインの範囲の場合には,Ca2+と結合する速度の速いBAPTAはCa2+をキレートしてCa2+シグナル伝達を阻害するが,Ca2+と結合する速度の遅いEGTAは効果を示さない.一方,距離がより遠いマイクロドメインの範囲の場合には,Ca2+シグナル伝達はEGTAにより阻害される.BAPTAあるいはEGTAを含むパッチ電極内液を用いて自発的な微小外向き電流に対する影響を検討したところ,EGTAは自発的な微小外向き電流の発生する頻度や大きさに影響しなかったが,BATPAは時間の経過とともに頻度を低下させ,10分後には自発的な微小外向き電流の発生は消失した.このことから,Ca2+の供給源およびその標的は異なる膜に存在するにもかかわらず,P/Q型Ca2+チャネル,リアノジン受容体,電位/Ca2+活性化型K+チャネルの三者はCa2+ナノドメインの範囲に位置することがわかった(図1).同じ方法を用いて,Ca2+誘発性Ca2+放出による一過性の外向き電流におけるCa2+シグナル伝達について調べたところ,自発的な微小外向き電流と同様にCa2+ナノドメインの範囲で起こることが明らかにされた.
6.細胞体膜におけるリアノジン受容体と電位/Ca2+活性化型K+チャネルとの共局在
リアノジン受容体と電位/Ca2+活性化型K+チャネルの機能的な共役がcartwheelインターニューロンのどの部位で起こるかを形態学的に確認するため,抗リアノジン受容体および抗電位/Ca2+活性化型K+チャネル抗体を用いて蛍光免疫染色法および共焦点顕微鏡により観察した.その結果,電位/Ca2+活性化型K+チャネルのシグナルは細胞体膜においてもっとも強く点状に存在し,細胞体の内部および樹状突起の全体にも弱いながらもシグナルが認められた.リアノジン受容体のシグナルも細胞体膜の付近においてもっとも強く点状に認められたが,中程度のシグナルが細胞体の内部および樹状突起の全体にも存在した.それぞれのシグナルの共局在を定量したところ,細胞体膜において多くの共局在がみられた一方,樹状突起の膜において共局在はほとんど観察されなかった.リアノジン受容体は小胞体に存在するチャネルであるが,強いシグナルは共焦点顕微鏡の解像度の関係から細胞体膜の付近に局在して観察された.このことから,リアノジン受容体が存在する小胞体と細胞膜は非常に近接しており,Ca2+誘発性Ca2+放出は電子顕微鏡を用いた研究において存在が発見された細胞膜の直下の小胞体“subsurface ER cistern”6) において起こることが強く示唆された.
おわりに
この研究において,筆者らは,P/Q型Ca2+チャネル,リアノジン受容体,電位/Ca2+活性化型K+チャネルの3種類のチャネルが細胞膜と細胞膜の直下の小胞体とのあいだに形成された二重のCa2+ナノドメインにおいてCa2+シグナルを介し相互作用することを示した(図1).P/Q型Ca2+チャネルを介して流入したCa2+はCa2+ナノドメインをこえて小胞体のリアノジン受容体に作用し,リアノジン受容体をとおり放出されたCa2+は同様の距離をこえて電位/Ca2+活性化型K+チャネルに作用する.あわせて考察すると,これらのチャネルおよび膜はバースト発火の頻度やひとつのバースト発火における活動電位の間隔を制御する“小器官”のように機能するといえるだろう.この研究において発見された二重のCa2+ナノドメインを構成する個々の要素,チャネルの種類,細胞膜の直下の小胞体,バースト発火,自発的な微小外向き電流は,中枢神経系において広く知られるものであり,発見された分子機構はバースト発火が発生する脳のほかの部位のニューロンにおいても使われているのかもしれない.また,活動電位より誘発される時間経過の早いCa2+誘発性Ca2+放出は細胞体に限局した一方,Ca2+誘発性Ca2+放出はシナプスの可塑性において重要な役割をはたすことが広く知られている.実際に,cartwheelインターニューロンにおけるシナプスの可塑性にはCa2+誘発性Ca2+放出が関与することが報告されている10).それゆえ,Ca2+誘発性Ca2+放出の機能は,リアノジン受容体と機能的に共役するチャネルなどの細胞における位置に依存して変わるといえるかもしれない.
文 献
- Kim, Y. & Trussell, L. O.: Ion channels generating complex spikes in cartwheel cells of the dorsal cochlear nucleus. J. Neurophysiol., 97, 1705-1725 (2007)[PubMed]
- Eggermann, E., Bucurenciu, I., Goswami, S. P. et al.: Nanodomain coupling between Ca2+ channels and sensors of exocytosis at fast mammalian synapses. Nat. Rev. Neurosci., 13, 7-21 (2012)[PubMed]
- Verkhratsky, A.: Physiology and pathophysiology of the calcium store in the endoplasmic reticulum of neurons. Physiol. Rev., 85, 201-279 (2005)[PubMed]
- Rosenbluth, J.: Subsurface cisterns and their relationship to the neuronal plasma membrane. J. Cell Biol., 13, 405-421 (1962)[PubMed]
- Endo, M., Tanaka, M. & Ogawa, Y.: Calcium induced release of calcium from the sarcoplasmic reticulum of skinned skeletal muscle fibres. Nature, 228, 34-36 (1970)[PubMed]
- Wouterlood, F. G. & Mugnaini, E.: Cartwheel neurons of the dorsal cochlear nucleus: a Golgi-electron microscopic study in rat. J. Comp. Neurol., 227, 136-157 (1984)[PubMed]
- Bender, K. J. & Trussell, L. O.: Axon initial segment Ca2+ channels influence action potential generation and timing. Neuron, 61, 259-271 (2009)[PubMed]
- Roberts, M. T., Bender, K. J. & Trussell, L. O.: Fidelity of complex spike-mediated synaptic transmission between inhibitory interneurons. J. Neurosci., 28, 9440-9450 (2008)[PubMed]
- Satin, L. S. & Adams, P. R.: Spontaneous miniature outward currents in cultured bullfrog neurons. Brain Res., 401, 331-339 (1987)[PubMed]
- Fujino, K. & Oertel D.: Bidirectional synaptic plasticity in the cerebellum-like mammalian dorsal cochlear nucleus. Proc. Natl. Acad. Sci. USA, 100, 265-270 (2003)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2008年 京都大学大学院医学研究科博士課程 修了,同年 小野薬品工業 研究員,2009年 群馬大学大学院医学研究科 助教,2011年 国立医薬品食品衛生研究所 主任研究官,2015年 米国Oregon Health and Science大学Postdoctoral researcherを経て,2017年より国立医薬品食品衛生研究所 主任研究官.
研究テーマ:聴覚系のニューロンを対象とした神経生理学的な現象.危険ドラッグが中枢神経系に作用する分子機構.
Laurence O. Trussell
米国Oregon Health and Science大学Professor.
© 2017 入江智彦・Laurence O. Trussell Licensed under CC 表示 2.1 日本