Toll様受容体TLR8の低分子阻害剤は不活性型の二量体構造を安定化する
丹治裕美1・Shuting Zhang 2・清水敏之1・Hang Yin 2
(1東京大学大学院薬学系研究科 蛋白構造生物学教室,2米国Colorado大学Boulder校Department of Chemistry and Biochemistry)
email:清水敏之
DOI: 10.7875/first.author.2017.139
Small-molecule inhibition of TLR8 through stabilization of its resting state.
Shuting Zhang, Zhenyi Hu, Hiromi Tanji, Shuangshuang Jiang, Nabanita Das, Jing Li, Kentaro Sakaniwa, Jin Jin, Yanyan Bian, Umeharu Ohto, Toshiyuki Shimizu, Hang Yin
Nature Chemical Biology, 14, 58-64 (2018)
Toll様受容体TLR7およびTLR8はウイルスや死細胞に由来するRNAを認識して自然免疫応答をひき起こすが,過剰な応答は全身性エリテマトーデスなどの自己免疫疾患と関係することが指摘されている.このため,TLR7あるいはTLR8を活性化するアゴニストと同様に,阻害するアンタゴニストの開発も望まれている.この研究において,筆者らは,TLR8とアンタゴニストとの複合体のX線結晶構造解析により,その阻害の機構を明らかにした.これまでの研究により,TLR8はリガンドと結合していない状態でも非活性型の二量体構造をとり,アゴニストが結合すると構造が再構成され活性型の二量体構造になることが知られていた.解析されたアンタゴニストはリガンド非結合型の二量体構造において形成されるポケットと結合し,構造を安定化することにより活性型の二量体への再構成をふせぐことにより阻害の効果を発揮することが判明した.
Toll様受容体(Toll-like receptor:TLR)は病原体の分子パターンを認識して自然免疫を活性化させるI型膜貫通タンパク質であり,リガンドを認識する細胞外のLRRドメインと,哺乳類のインターロイキン1受容体とショウジョウバエのTollとのあいだの相同性から同定されたTIRドメインからなる1).ヒトにおいては10種類が同定されており,2本鎖RNA,リポ多糖,リポタンパク質など多様な分子を認識する1).
Toll様受容体のうちTLR7,TLR8,TLR9は核酸を認識するサブファミリーを構成し,いずれもエンドソームに存在する2).TLR7およびTLR8はウイルスや細菌に由来する1本鎖RNAを認識し,活性化されると炎症性サイトカインやインターフェロンの産生を促進し,最終的に抗ウイルス応答や炎症応答をひき起こす3,4).一方,過度に応答した場合には全身性エリテマトーデスなどの自己免疫疾患に関係することが指摘されている5,6).TLR7およびTLR8は1本鎖RNAをリガンドとするが,イミダゾキノリン系やグアノシン系などの化学合成リガンドによっても活性化される7,8).
近年の筆者らによる研究により,リガンド非結合型のTLR8,低分子アゴニスト結合型のTLR8,さらには,1本鎖RNAとTLR8との複合体の構造が解明された9,10)(文献9) は新着論文レビュー でも掲載,文献10) は新着論文レビュー でも掲載).TLR8はリガンドと結合していない状態では非活性型の二量体構造をとり,リガンドとの結合により構造が再編成されて活性型の二量体構造をとる.化学合成リガンドは分子量300程度であり,これまでに,アゴニスト活性を示す低分子化合物が数多く合成され構造活性相関が研究されてきた.実際に,TLR8といくつかのアゴニスト活性を示す化学合成リガンドとの複合体の構造が報告され,そのすべてが活性型の二量体構造をとりその詳細な認識の機構が解明されている11).一方,TLR8の活性化を抑制するアンタゴニストは全身性エリテマトーデスなど自己免疫疾患の治療薬として期待されているものの,阻害の機構が構造科学的に証明された例はまだない.
この研究において,筆者らは,TLR8とアンタゴニストとの複合体のX線結晶構造解析により,その阻害の機構に関する構造基盤を明らかにした.
筆者らは,ハイスループットスクリーニングによりTLR8を特異的に阻害する化合物の候補を見い出し,CU-CPT8mおよびCU-CPT9bという強力なアンタゴニスト活性をもつ化合物の開発に成功した.HEK-Blue細胞を用いたNF-κBレポーター遺伝子アッセイの結果,CU-CPT8mの50%阻害濃度は67 nM,CU-CPT9bの50%阻害濃度は0.7 nMと算出された.CU-CPT8mおよびCU-CPT9bともTLR8を特異的に阻害することが示され,さらに,免疫細胞を用いた実験により,実際のサイトカインの産生などを阻害することも明らかにされた.
TLR8とCU-CPT8mあるいはCU-CPT9bとのあいだの親和性を等温滴定カロリメトリーにより直接的に測定した.その結果,CU-CPT8mとの解離定数は220 nM,CU-CPT9bとの解離定数は21 nMと見積もられた.アゴニストのひとつR848との解離定数は200 nMなので,CU-CPT8mおよびCU-CPT9bは同等もしくはより強くTLR8と結合した.実際に,あらかじめCU-CPT8mあるいはCU-CPT9bをTLR8と結合させておき,この溶液にR848を滴定しても熱の発生は観測されなかった.
ヒトのTLR8の細胞外ドメインの全長につきC末端にプロテインAタグを付加したコンストラクトを用い,糖鎖の生合成の阻害剤であるキフネンシンの存在のもとショウジョウバエS2細胞において発現させ,高純度の精製試料を得た.TLR8とCU-CPT8mあるいはCU-CPT9bとを蒸気拡散平衡法により共結晶化し,X線結晶構造解析により分解能2.4Åおよび2.3Åで構造を決定した(PDB ID:5WYX,5WYZ).
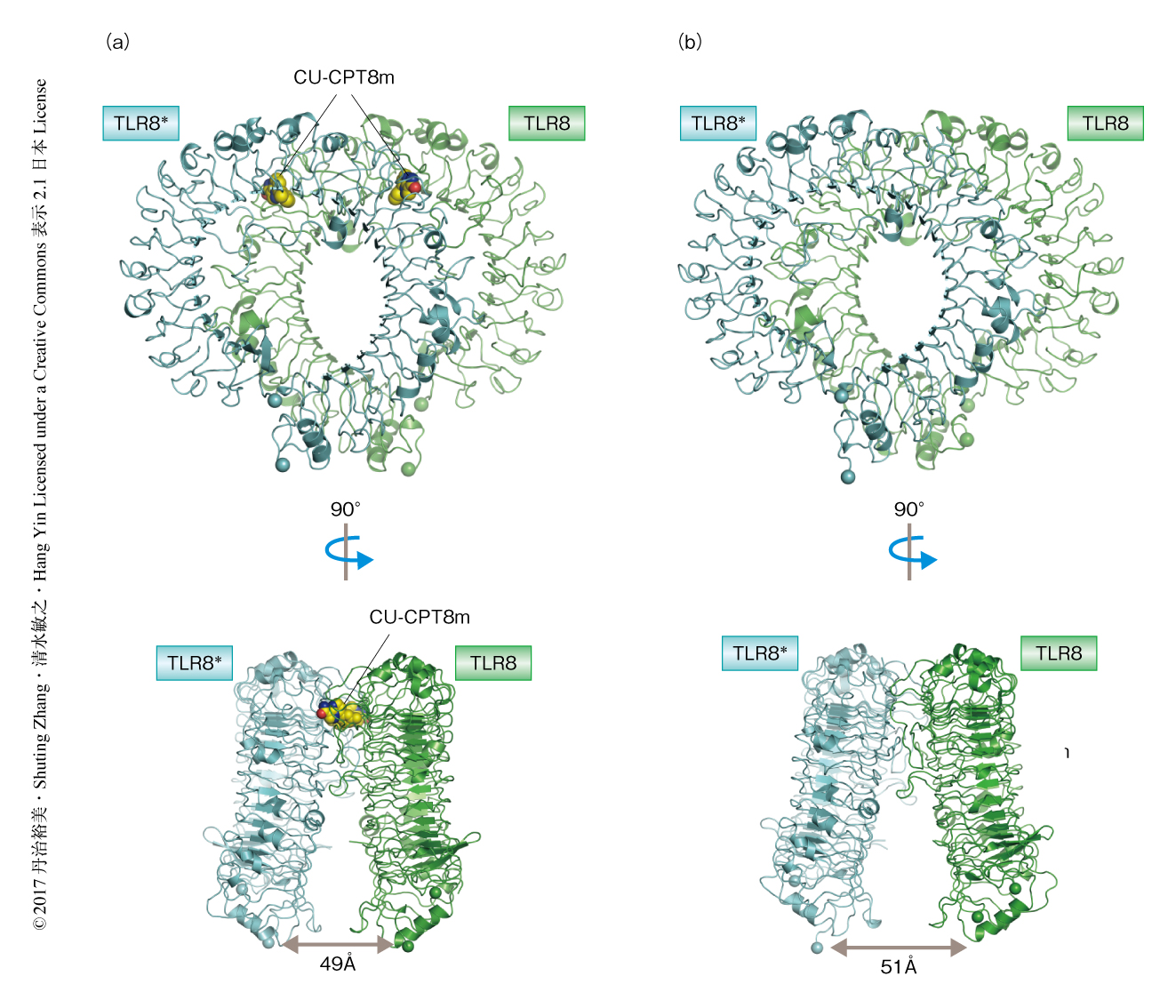
TLR8とCU-CPT8mあるいはCU-CPT9bとの複合体はリガンド非結合型の二量体構造と類似した二量体を形成し,2分子のC末端のあいだの距離は49Å離れていた(図1).リガンド非結合型の二量体構造においてはC末端のあいだの距離は51Åであり,アゴニスト結合型の二量体構造においては34Åであったことから,アンタゴニスト結合型のTLR8の構造はリガンド非結合型の二量体構造と類似し,不活性化型の二量体だと考えられた.
TLR8はリガンドと結合していない状態でも二量体構造をとるが,濃度が低いときは単量体として存在する.この状態においてアゴニストのひとつR848を添加すると二量体化が観測される.CU-CPT8mあるいはCU-CPT9bに対しても同様に実験したところ二量体化がひき起こされ,CU-CPT8mおよびCU-CPT9bはR848よりも二量体の形成能が強いことが示された.
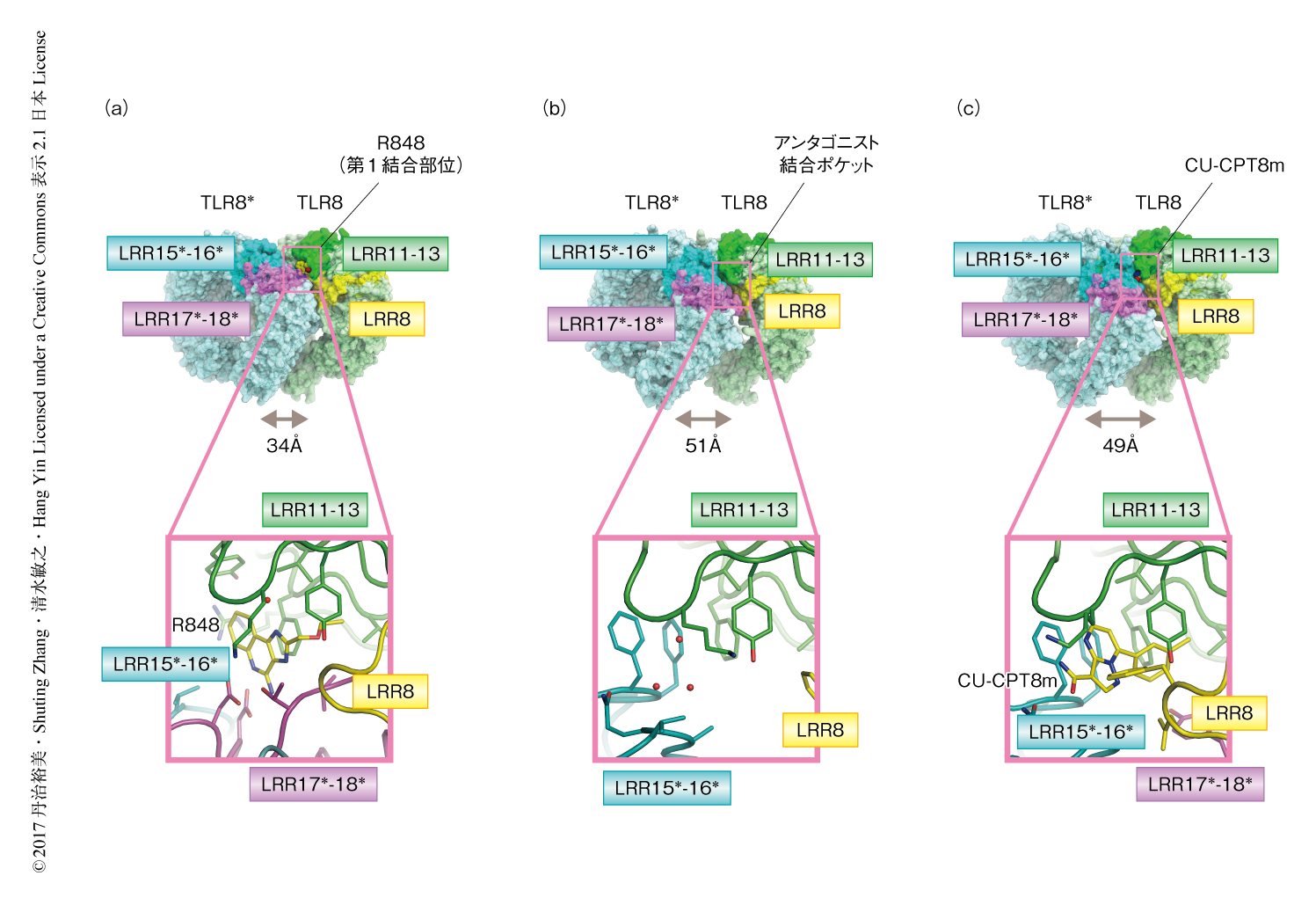
これまでの構造科学的な研究により10),活性型の二量体構造をとるTLR8には2つのリガンド結合部位が存在することが明らかにされている.アゴニスト活性を示す化学合成リガンドやウリジンなどのモノヌクレオシドは第1結合部位と結合する.この部位へのリガンドの結合は活性型の二量体構造のためには必須である.第2結合部位にはオリゴヌクレオチドが結合し,第1結合部位に対するリガンドの結合力を増強させる.一方,リガンド非結合型の二量体構造においては構造が再編成されているため第1結合部位は存在しない.
構造解析の結果,CU-CPT8mおよびCU-CPT9bはリガンド非結合型の二量体構造にのみに存在する,アンタゴニスト結合ポケットと名づけたポケットと結合した.アンタゴニスト結合ポケットは一方のプロトマーに由来するLRRドメインLRR11-13と,もう一方のプロトマーに由来するLRRドメインLRR15*-16*からおもに構成されていた(二量体を構成する2つのプロトマーについて,一方は無印,もう他一はアスタリスクを用いて表わす).なお,活性型の二量体構造にのみ存在する第1結合部位については,LRR11-13は共通して用いられていたが,もう一方にはLRR17*-18*が用いられていた(図2).
アンタゴニスト結合ポケットは疎水的なアミノ酸残基から構成され,アンタゴニストも主として疎水的な相互作用により認識されていた(図2).CU-CPT8mとTLR8との複合体においてはCU-CPT8mの含窒素複素環がTyr348およびPhe495*によりはさまれるようなスタッキング相互作用,また,Gly351およびVal520*との水素結合が観測された.CU-CPT9bも同様に認識されていたが,Ser516*との水素結合が新たに観測された.CU-CPT8mと比べCU-CPT9bは50%阻害濃度および解離定数とも強力であるが,このような付加的な相互作用も原因のひとつだと考えられた.
CU-CPT8mおよびCU-CPT9bは,TLR8とアミノ酸の相同性も高く1本鎖RNAを天然の基質とするTLR7に対し阻害活性を示さなかった.すでに決定されていたTLR7の結晶構造12) をもとにドッキングモデルを作製したところ,TLR8のPhe261に対応するTLR7のTyr264がアンタゴニストと立体障害を起こすこと,認識に重要なLRRドメインLRR15*のコンフォメーションがTLR8とTLR7とでは異なることが見い出された.これらの違いがTLR8とTLR7の選択の特異性に関与するものと考えられた.
以上の結果から,TLR8のアンタゴニストによる不活性化の機構は以下のように考えられた.TLR8はリガンド非結合型の二量体構造においてはアンタゴニスト結合ポケットが,活性型の二量体構造においてはアゴニストが結合する第1結合部位が形成されており,構造が再編成されてそれぞれの二量体が形成されるため,それぞれの結合部位が同時に存在することはない.これら2つのポケットの半分は共通した領域が利用されていた.CU-CPT8mおよびCU-CPT9bはリガンド非結合型の二量体構造にのみ存在するアンタゴニスト結合ポケットと結合することにより不活性型の二量体構造を安定化し,活性型への構造変換を阻止するという,まったく新しい機構により阻害の効果を発揮していた.
この研究により,新たに開発されたTLR8の低分子阻害剤による阻害の機構が詳細に明らかにされた.一般的に,アンタゴニストによる阻害は,アゴニストと同一の場所に結合してアゴニストの結合を阻害する競合阻害と,別の場所に結合して阻害を示す非競合阻害に大別されるが,CU-CPT8mおよびCU-CPT9bはどちらの範疇にもはいらない新しい阻害の機構を示すものといえよう.
Toll様受容体の生物活性は諸刃の剣であり,正常な応答は生体にとりなくてはならないものであるが,過剰な応答は生体を危機におとしいれる.このため,活性化するアゴニストと同じくらい,阻害するアンタゴニストの開発も重要である.これはTLR8にもあてはまる.これまでに開発されたTLR8のアンタゴニストはその阻害作用が生物活性だけで評価されており,TLR8に対し直接的に作用するのかすら不明であった.この研究において,アンタゴニストはTLR8と直接的に結合しており,これまでに知られていない阻害の形式が明らかにされた.ここで得られた構造科学的な知見は,さらにすぐれたアンタゴニストの開発を加速するものと期待される.CU-CPT8mおよびCU-CPT9bは不活性型の二量体構造を安定化するものであったが,当然,別の機構により阻害活性を示すアンタゴニストも考えられるだろう.
略歴:東京大学大学院薬学系研究科博士課程 在学中.
研究テーマ:自然免疫系の受容体のX線結晶構造解析.
抱負:タンパク質の構造解析をとおして,さまざまな生命現象を明らかにしたい.
Shuting Zhang
米国Colorado大学Boulder校.
清水 敏之(Toshiyuki Shimizu)
東京大学大学院薬学系研究科 教授.
研究室URL:http://www.f.u-tokyo.ac.jp/~kouzou/
Hang Hubert Yin
米国Colorado大学Boulder校 教授.
© 2017 丹治裕美・Shuting Zhang・清水敏之・Hang Yin Licensed under CC 表示 2.1 日本
(1東京大学大学院薬学系研究科 蛋白構造生物学教室,2米国Colorado大学Boulder校Department of Chemistry and Biochemistry)
email:清水敏之
DOI: 10.7875/first.author.2017.139
Small-molecule inhibition of TLR8 through stabilization of its resting state.
Shuting Zhang, Zhenyi Hu, Hiromi Tanji, Shuangshuang Jiang, Nabanita Das, Jing Li, Kentaro Sakaniwa, Jin Jin, Yanyan Bian, Umeharu Ohto, Toshiyuki Shimizu, Hang Yin
Nature Chemical Biology, 14, 58-64 (2018)
要 約
Toll様受容体TLR7およびTLR8はウイルスや死細胞に由来するRNAを認識して自然免疫応答をひき起こすが,過剰な応答は全身性エリテマトーデスなどの自己免疫疾患と関係することが指摘されている.このため,TLR7あるいはTLR8を活性化するアゴニストと同様に,阻害するアンタゴニストの開発も望まれている.この研究において,筆者らは,TLR8とアンタゴニストとの複合体のX線結晶構造解析により,その阻害の機構を明らかにした.これまでの研究により,TLR8はリガンドと結合していない状態でも非活性型の二量体構造をとり,アゴニストが結合すると構造が再構成され活性型の二量体構造になることが知られていた.解析されたアンタゴニストはリガンド非結合型の二量体構造において形成されるポケットと結合し,構造を安定化することにより活性型の二量体への再構成をふせぐことにより阻害の効果を発揮することが判明した.
はじめに
Toll様受容体(Toll-like receptor:TLR)は病原体の分子パターンを認識して自然免疫を活性化させるI型膜貫通タンパク質であり,リガンドを認識する細胞外のLRRドメインと,哺乳類のインターロイキン1受容体とショウジョウバエのTollとのあいだの相同性から同定されたTIRドメインからなる1).ヒトにおいては10種類が同定されており,2本鎖RNA,リポ多糖,リポタンパク質など多様な分子を認識する1).
Toll様受容体のうちTLR7,TLR8,TLR9は核酸を認識するサブファミリーを構成し,いずれもエンドソームに存在する2).TLR7およびTLR8はウイルスや細菌に由来する1本鎖RNAを認識し,活性化されると炎症性サイトカインやインターフェロンの産生を促進し,最終的に抗ウイルス応答や炎症応答をひき起こす3,4).一方,過度に応答した場合には全身性エリテマトーデスなどの自己免疫疾患に関係することが指摘されている5,6).TLR7およびTLR8は1本鎖RNAをリガンドとするが,イミダゾキノリン系やグアノシン系などの化学合成リガンドによっても活性化される7,8).
近年の筆者らによる研究により,リガンド非結合型のTLR8,低分子アゴニスト結合型のTLR8,さらには,1本鎖RNAとTLR8との複合体の構造が解明された9,10)(文献9) は新着論文レビュー でも掲載,文献10) は新着論文レビュー でも掲載).TLR8はリガンドと結合していない状態では非活性型の二量体構造をとり,リガンドとの結合により構造が再編成されて活性型の二量体構造をとる.化学合成リガンドは分子量300程度であり,これまでに,アゴニスト活性を示す低分子化合物が数多く合成され構造活性相関が研究されてきた.実際に,TLR8といくつかのアゴニスト活性を示す化学合成リガンドとの複合体の構造が報告され,そのすべてが活性型の二量体構造をとりその詳細な認識の機構が解明されている11).一方,TLR8の活性化を抑制するアンタゴニストは全身性エリテマトーデスなど自己免疫疾患の治療薬として期待されているものの,阻害の機構が構造科学的に証明された例はまだない.
この研究において,筆者らは,TLR8とアンタゴニストとの複合体のX線結晶構造解析により,その阻害の機構に関する構造基盤を明らかにした.
1.TLR8のアンタゴニスト活性を示す化学合成リガンドの開発
筆者らは,ハイスループットスクリーニングによりTLR8を特異的に阻害する化合物の候補を見い出し,CU-CPT8mおよびCU-CPT9bという強力なアンタゴニスト活性をもつ化合物の開発に成功した.HEK-Blue細胞を用いたNF-κBレポーター遺伝子アッセイの結果,CU-CPT8mの50%阻害濃度は67 nM,CU-CPT9bの50%阻害濃度は0.7 nMと算出された.CU-CPT8mおよびCU-CPT9bともTLR8を特異的に阻害することが示され,さらに,免疫細胞を用いた実験により,実際のサイトカインの産生などを阻害することも明らかにされた.
TLR8とCU-CPT8mあるいはCU-CPT9bとのあいだの親和性を等温滴定カロリメトリーにより直接的に測定した.その結果,CU-CPT8mとの解離定数は220 nM,CU-CPT9bとの解離定数は21 nMと見積もられた.アゴニストのひとつR848との解離定数は200 nMなので,CU-CPT8mおよびCU-CPT9bは同等もしくはより強くTLR8と結合した.実際に,あらかじめCU-CPT8mあるいはCU-CPT9bをTLR8と結合させておき,この溶液にR848を滴定しても熱の発生は観測されなかった.
2.アンタゴニスト結合型のTLR8の構造はリガンド非結合型の二量体構造と類似する
ヒトのTLR8の細胞外ドメインの全長につきC末端にプロテインAタグを付加したコンストラクトを用い,糖鎖の生合成の阻害剤であるキフネンシンの存在のもとショウジョウバエS2細胞において発現させ,高純度の精製試料を得た.TLR8とCU-CPT8mあるいはCU-CPT9bとを蒸気拡散平衡法により共結晶化し,X線結晶構造解析により分解能2.4Åおよび2.3Åで構造を決定した(PDB ID:5WYX,5WYZ).
TLR8とCU-CPT8mあるいはCU-CPT9bとの複合体はリガンド非結合型の二量体構造と類似した二量体を形成し,2分子のC末端のあいだの距離は49Å離れていた(図1).リガンド非結合型の二量体構造においてはC末端のあいだの距離は51Åであり,アゴニスト結合型の二量体構造においては34Åであったことから,アンタゴニスト結合型のTLR8の構造はリガンド非結合型の二量体構造と類似し,不活性化型の二量体だと考えられた.
TLR8はリガンドと結合していない状態でも二量体構造をとるが,濃度が低いときは単量体として存在する.この状態においてアゴニストのひとつR848を添加すると二量体化が観測される.CU-CPT8mあるいはCU-CPT9bに対しても同様に実験したところ二量体化がひき起こされ,CU-CPT8mおよびCU-CPT9bはR848よりも二量体の形成能が強いことが示された.
3.アンタゴニストはリガンド非結合型の二量体構造に存在するポケットと結合する
これまでの構造科学的な研究により10),活性型の二量体構造をとるTLR8には2つのリガンド結合部位が存在することが明らかにされている.アゴニスト活性を示す化学合成リガンドやウリジンなどのモノヌクレオシドは第1結合部位と結合する.この部位へのリガンドの結合は活性型の二量体構造のためには必須である.第2結合部位にはオリゴヌクレオチドが結合し,第1結合部位に対するリガンドの結合力を増強させる.一方,リガンド非結合型の二量体構造においては構造が再編成されているため第1結合部位は存在しない.
構造解析の結果,CU-CPT8mおよびCU-CPT9bはリガンド非結合型の二量体構造にのみに存在する,アンタゴニスト結合ポケットと名づけたポケットと結合した.アンタゴニスト結合ポケットは一方のプロトマーに由来するLRRドメインLRR11-13と,もう一方のプロトマーに由来するLRRドメインLRR15*-16*からおもに構成されていた(二量体を構成する2つのプロトマーについて,一方は無印,もう他一はアスタリスクを用いて表わす).なお,活性型の二量体構造にのみ存在する第1結合部位については,LRR11-13は共通して用いられていたが,もう一方にはLRR17*-18*が用いられていた(図2).
アンタゴニスト結合ポケットは疎水的なアミノ酸残基から構成され,アンタゴニストも主として疎水的な相互作用により認識されていた(図2).CU-CPT8mとTLR8との複合体においてはCU-CPT8mの含窒素複素環がTyr348およびPhe495*によりはさまれるようなスタッキング相互作用,また,Gly351およびVal520*との水素結合が観測された.CU-CPT9bも同様に認識されていたが,Ser516*との水素結合が新たに観測された.CU-CPT8mと比べCU-CPT9bは50%阻害濃度および解離定数とも強力であるが,このような付加的な相互作用も原因のひとつだと考えられた.
CU-CPT8mおよびCU-CPT9bは,TLR8とアミノ酸の相同性も高く1本鎖RNAを天然の基質とするTLR7に対し阻害活性を示さなかった.すでに決定されていたTLR7の結晶構造12) をもとにドッキングモデルを作製したところ,TLR8のPhe261に対応するTLR7のTyr264がアンタゴニストと立体障害を起こすこと,認識に重要なLRRドメインLRR15*のコンフォメーションがTLR8とTLR7とでは異なることが見い出された.これらの違いがTLR8とTLR7の選択の特異性に関与するものと考えられた.
4.TLR8のアンタゴニストによる不活性化の機構
以上の結果から,TLR8のアンタゴニストによる不活性化の機構は以下のように考えられた.TLR8はリガンド非結合型の二量体構造においてはアンタゴニスト結合ポケットが,活性型の二量体構造においてはアゴニストが結合する第1結合部位が形成されており,構造が再編成されてそれぞれの二量体が形成されるため,それぞれの結合部位が同時に存在することはない.これら2つのポケットの半分は共通した領域が利用されていた.CU-CPT8mおよびCU-CPT9bはリガンド非結合型の二量体構造にのみ存在するアンタゴニスト結合ポケットと結合することにより不活性型の二量体構造を安定化し,活性型への構造変換を阻止するという,まったく新しい機構により阻害の効果を発揮していた.
おわりに
この研究により,新たに開発されたTLR8の低分子阻害剤による阻害の機構が詳細に明らかにされた.一般的に,アンタゴニストによる阻害は,アゴニストと同一の場所に結合してアゴニストの結合を阻害する競合阻害と,別の場所に結合して阻害を示す非競合阻害に大別されるが,CU-CPT8mおよびCU-CPT9bはどちらの範疇にもはいらない新しい阻害の機構を示すものといえよう.
Toll様受容体の生物活性は諸刃の剣であり,正常な応答は生体にとりなくてはならないものであるが,過剰な応答は生体を危機におとしいれる.このため,活性化するアゴニストと同じくらい,阻害するアンタゴニストの開発も重要である.これはTLR8にもあてはまる.これまでに開発されたTLR8のアンタゴニストはその阻害作用が生物活性だけで評価されており,TLR8に対し直接的に作用するのかすら不明であった.この研究において,アンタゴニストはTLR8と直接的に結合しており,これまでに知られていない阻害の形式が明らかにされた.ここで得られた構造科学的な知見は,さらにすぐれたアンタゴニストの開発を加速するものと期待される.CU-CPT8mおよびCU-CPT9bは不活性型の二量体構造を安定化するものであったが,当然,別の機構により阻害活性を示すアンタゴニストも考えられるだろう.
文 献
- Akira, S. & Takeda, K.: Toll-like receptor signalling. Nat. Rev. Immunol., 4, 499-511 (2004)[PubMed]
- Roach, J. C., Glusman, G., Rowen, L. et al.: The evolution of vertebrate Toll-like receptors. Proc. Natl. Acad. Sci. USA, 102, 9577-9582 (2005)[PubMed]
- Diebold, S. S., Kaisho, T., Hemmi, H. et al.: Innate antiviral responses by means of TLR7-mediated recognition of single-stranded RNA. Science, 303, 1529-1531 (2004)[PubMed]
- Heil, F., Hemmi, H., Hochrein, H. et al.: Species-specific recognition of single-stranded RNA via toll-like receptor 7 and 8. Science, 303, 1526-1529 (2004)[PubMed]
- Hornung, V. Guenthner-Biller, M., Bourquin, C. et al.: Sequence-specific potent induction of IFN-α by short interfering RNA in plasmacytoid dendritic cells through TLR7. Nat. Med., 11, 263-270 (2005)[PubMed]
- Barrat, F. J., Meeker, T., Gregorio, J. et al.: Nucleic acids of mammalian origin can act as endogenous ligands for Toll-like receptors and may promote systemic lupus erythematosus. J. Exp. Med., 202, 1131-1139 (2005)[PubMed]
- Hemmi, H., Kaisho, T., Takeuchi, O. et al.: Small anti-viral compounds activate immune cells via the TLR7 MyD88-dependent signaling pathway. Nat. Immunol., 3, 196-200 (2002)[PubMed]
- Jurk, M., Heil, F., Vollmer, J. et al.: Human TLR7 or TLR8 independently confer responsiveness to the antiviral compound R-848. Nat. Immunol., 3, 499-499 (2002)[PubMed]
- Tanji, H., Ohto, U., Shibata, T. et al.: Structural reorganization of the Toll-like receptor 8 dimer induced by agonistic ligands. Science, 339, 1426-1429 (2013)[PubMed][新着論文レビュー]
- Tanji, H., Ohto, U., Shibata, T. et al.: Toll-like receptor 8 senses degradation products of single-stranded RNA. Nat. Struct. Mol. Biol., 22, 109-115 (2015)[PubMed][新着論文レビュー]
- Kokatla, H. P., Sil, D., Tanji, H. et al.: Structure-based design of novel human Toll-like receptor 8 agonists. ChemMedChem, 9, 719-723 (2014)[PubMed]
- Zhang, Z., Ohto, U., Shibata, T. et al.: Structural basis for activation of Toll-like receptor 7, a dual receptor for guanosine and single-stranded RNA. Immunity, 45, 737-748 (2016)[PubMed][新着論文レビュー]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:東京大学大学院薬学系研究科博士課程 在学中.
研究テーマ:自然免疫系の受容体のX線結晶構造解析.
抱負:タンパク質の構造解析をとおして,さまざまな生命現象を明らかにしたい.
Shuting Zhang
米国Colorado大学Boulder校.
清水 敏之(Toshiyuki Shimizu)
東京大学大学院薬学系研究科 教授.
研究室URL:http://www.f.u-tokyo.ac.jp/~kouzou/
Hang Hubert Yin
米国Colorado大学Boulder校 教授.
© 2017 丹治裕美・Shuting Zhang・清水敏之・Hang Yin Licensed under CC 表示 2.1 日本