非免疫細胞に特定の細胞を殺傷する機能を装備させる
小嶋良輔・Martin Fussenegger
(スイスFederal Institute of Technology in Zurich,Department of Biosystems Science and Engineering)
email:小嶋良輔
DOI: 10.7875/first.author.2017.135
Nonimmune cells equipped with T-cell-receptor-like signaling for cancer cell ablation.
Ryosuke Kojima, Leo Scheller, Martin Fussenegger
Nature Chemical Biology, 14, 42-49 (2018)
非免疫細胞に特定の細胞を認識してそれを殺傷する機能を付与することができれば,次世代のがんの治療に応用される可能性がある.この研究において,筆者らは,T細胞におけるシグナルのスイッチングの分子機構を参考に,多くの細胞においてはたらくJAK-STATシグナル伝達経路のオンオフを特定の細胞との接触にともなうシグナル阻害タンパク質の物理的な動きにより制御することにより,非免疫細胞に特定の細胞との接触を感知させる新しいシグナリングデバイスの開発に成功した.さらに,このシグナリングデバイスにより,プロドラッグ化された抗がん剤を活性化する酵素の発現を誘導し標的となる細胞に送り込むことにより,標的に選択的ながんの治療への応用の可能性が示された.この研究は,細胞を基盤とする次世代のがんの治療に役立つ技術を提供するとともに,細胞外の情報を細胞内に伝達するための合成生物学的なツールボックスを拡張するという観点からも有用であると考えられた.
特定の細胞との接触を感知するように改変された免疫細胞はがんの治療に有用である.たとえば,キメラ抗原受容体を発現するよう改変されたT細胞は白血病などいくつかの種類のがんに対し著効を示すことが報告されており,実際にさまざまな治験が進んでいる1).しかしながら,改変された免疫細胞は,サイトカイン放出症候群をひき起こす危険があるほか,がんに到達する頻度の低い場合もあるため,特定の種類のがんにはよく効く一方,効果の限定されるがんも多いといった問題をかかえている.
このような問題を解決するひとつの手段として,がん細胞に遊走しやすいことが報告されている間葉系幹細胞のような非免疫細胞にがん細胞を認識させ殺傷させるといったアプローチが考えられる.実際に,間葉系幹細胞にプロドラッグ化された抗がん剤を活性化する酵素を発現させ,生体においてがん細胞を殺傷させる治療法が基礎研究のレベルで報告されている2,3).抗がん剤による副作用を考慮するとがん細胞の周辺のみでプロドラッグを活性化することが望ましいが,これまで,間葉系幹細胞のような非免疫細胞に特定の細胞との接触を認識させることはむずかしかった.そこで,この研究においては,非免疫細胞に特定の細胞との接触を感知させるシグナリングデバイスの開発に取り組んだ.
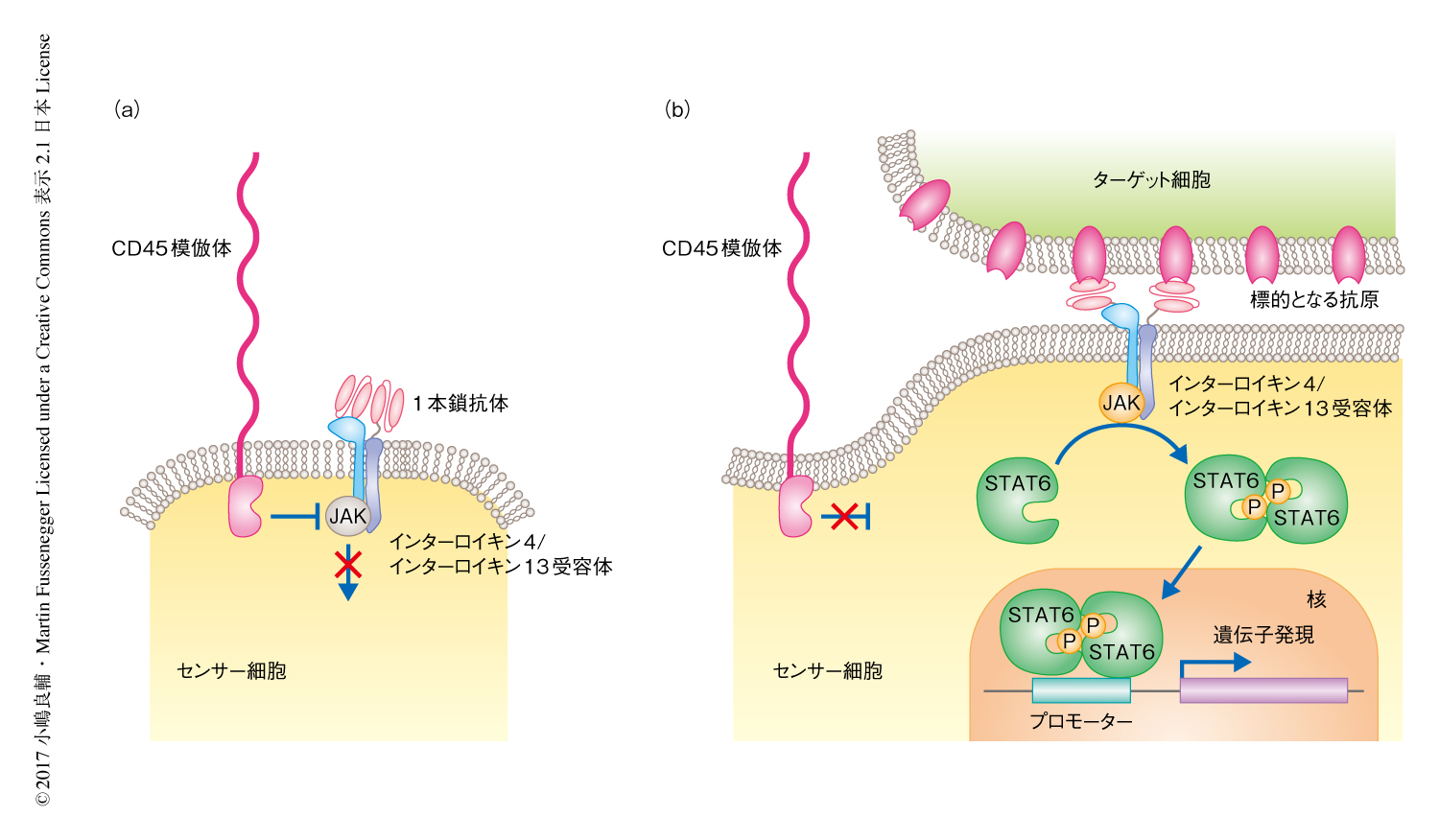
T細胞が特定の細胞を認識する際のシグナル伝達は,大きな細胞外ドメインおよび細胞内ホスファターゼドメインからなる膜タンパク質CD45が,T細胞と標的となる細胞とが抗原抗体反応により接触する際にその接触面から物理的に隔離されることにより,シグナルを発動するキナーゼ活性を阻害しなくなることが初発であると報告されている4,5).一方,CD45は非免疫細胞を含む多くの細胞においてはたらくJAK-STATシグナル伝達経路の阻害タンパク質としても報告されている6).この2つの事象に着目し,JAK-STATシグナル伝達経路のオンオフを特定の細胞との接触にともなうCD45の物理的な動きにより制御できるのではないかと仮説をたてた(図1).これが達成されれば,非免疫細胞に特定の細胞との接触を感知させることが可能になる.
筆者らの研究室において,STAT3およびSTAT6の活性化を検出するレポーター遺伝子が構築されていたことから,非免疫細胞であるHEK-293T細胞において,CD45と同じ機能を示すCD43の細胞外ドメインとCD45の細胞内ドメインを結合したキメラタンパク質CD43ex-45int(CD45模倣体)により5),STAT3およびSTAT6により介在されるJAK-STATシグナル伝達経路が抑制されるかどうか検証した.HEK-293T細胞においてはCD45の発現は低いことが知られており,同様の活性をもち高く発現するCD45模倣体を用いた.STAT3シグナルのトリガーとしてはインターロイキン10受容体,STAT6シグナルのトリガーとしてはインターロイキン4/インターロイキン13受容体を用い,それぞれの受容体と対応するSTATおよびそのレポーター遺伝子とCD45模倣体を共発現させたところ,インターロイキン4/インターロイキン13受容体により惹起されるJAK-STATシグナル伝達経路が抑制された.
インターロイキン4/インターロイキン13受容体の細胞外ドメインに乳がんの表面マーカーとして知られるHER2を認識する1本鎖抗体を結合することによりHER2認識受容体を構築し,これをCD45模倣体およびSTAT6とともにHEK-293T細胞に発現させた.このセンサー細胞をターゲット細胞のモデルであるHEK-HER2細胞あるいは非ターゲット細胞であるHEK-iRFP細胞と混合し,センサー細胞に遺伝的に導入したSTAT6レポーターの発現を観察した.その結果,適切な量のHER2認識受容体とCD45模倣体を発現するセンサー細胞がターゲット細胞と共存する場合のみSTAT6レポーター遺伝子からの明らかな発現が観察された.抗原認識部位を欠く場合,CD45模倣体の細胞外ドメインを欠失させた場合,CD45模倣体の細胞内ドメインを蛍光タンパク質に置換した場合にはターゲット細胞を認識しなかったことから,インターロイキン4/インターロイキン13受容体と結合した1本鎖抗体によるHER2の認識にともない,センサー細胞とターゲット細胞との接触面からCD45模倣体がその細胞外ドメインの立体的な障害により隔離され,STAT6を介したJAK-STATシグナル伝達経路がオンになったことが示唆された.さらに,それぞれの構成要素の局在を蛍光イメージングにより確認したところ,抗原認識受容体が細胞の接触面に集積する一方,CD45模倣体が細胞の接触面から隔離されていることが確認され,ターゲット細胞の感知がデザインされたとおりの分子機構により達成されていることが強く示唆された.
インターロイキン4/インターロイキン13受容体の細胞外ドメインを削除することにより,この特定の細胞との接触を感知するシグナリングデバイスのアウトプットの遺伝子発現を上昇させること,および,特定の細胞との接触を感知する機能を保持したままインターロイキン4/インターロイキン13受容体のネイティブのリガンドであるインターロイキン4およびインターロイキン13への反応性を喪失させることに成功し,特定の細胞との接触のみに反応する,よりパフォーマンスのすぐれたシグナリングデバイスが開発された.
HER2のほか,さまざまながん細胞のマーカーとして利用されるEpcamを発現する細胞を認識するシグナリングデバイスも開発され,また,このシグナリングデバイスはがんに遊走する活性をもつ間葉系幹細胞の不死化細胞株においても利用が可能であったことから,この特定の細胞との接触を感知するシグナリングデバイスの一般性および拡張性が示された.
この特定の細胞との接触を感知するシグナリングデバイスを細胞を基盤とするがんの治療に応用することを試みた.具体的には,これまでにがんに遊走する活性をもつ間葉系幹細胞にプロドラッグ化した抗がん剤を活性化する酵素を発現させ,がんの周辺においてプロドラッグを活性化するがんの治療がいくつか報告されているが2,3),ここにターゲットの認識能を付与することで,よりがん細胞に選択的な細胞の殺傷が可能になると考えた.
プロドラッグである5-フルオロシトシンを毒性のある5-フルオロウリジン一リン酸に変換するFCU1とよばれる酵素7) に,細胞膜の透過性を示すウイルスに由来するタンパク質VP22 8) を結合することにより,センサー細胞から発現されたFCU1が周囲のターゲット細胞の細胞質や核に拡散するようデザインした.このVP22-FCU1を,HER2を発現する細胞を認識するシグナリングデバイスを用いてセンサー細胞に発現させ,ターゲット細胞あるいは非ターゲット細胞と混合して5-フルオロシトシンの存在下において培養したところ,ターゲット細胞は選択的に殺傷された.一方,FCU1を恒常的な発現を誘導する遺伝子プロモーターにより発現した場合にはターゲット細胞および非ターゲット細胞が非選択的に殺傷された.このことから,この特定の細胞との接触を感知するシグナリングデバイスを用いることにより,ターゲット細胞を認識して選択的に殺傷する機能が発揮されることが示された.このシグナリングデバイスは,ターゲット細胞と非ターゲット細胞が共存してもターゲット細胞の選択的な殺傷にある程度の効果を発揮したほか,間葉系幹細胞の不死化細胞株を用いてHER2を高発現する乳がん細胞株であるSKBR-3細胞を抗原の認識に依存的して殺傷することも可能であった.
これまで,細胞外の情報を細胞内に伝達するための細胞機能の設計原理が不足していたため,非免疫細胞に特定の細胞との接触を感知させる方法はかぎられていた.この研究において,筆者らは,人為的に構築されたシグナル阻害タンパク質の細胞膜におけるダイナミックな動きを特定の細胞との接触の感知に利用できることが示された.このことは,今後,新たな細胞機能をデザインするための合成生物学的な観点から興味深い発見といえる.また,応用的な観点からいえば,がんに遊走する活性をもつ間葉系幹細胞を用いて乳がん細胞が殺傷されたことから,実際の治療に応用する可能性が示されたと考えられる.ただし,このセンサー細胞が個体においてどのようにふるまうかは未知数であるほか,複数の構成因子をその質を制御したうえで安定して細胞に導入することはまだむずかしいといった点は,さらなる応用を考える際にまだまだハードルとして残る.複数の遺伝子を安定して導入することが可能なゲノム編集技術がさらに発展していけば,このような細胞機能の設計原理が実際の医療に応用される日が近づくかもしれない.
略歴:2014年 東京大学大学院薬学系研究科博士課程 修了,同年 スイスFederal Institute of Technology in Zurich博士研究員を経て,2017年より東京大学大学院医学系研究科 助教.
研究テーマ:ドラッグデリバリーシステムなど,生物学的な材料を巧妙に利用した疾患の新しい治療のシステムの開発.
関心事:有機化学と合成生物学とのシナジー.次世代シークエンシング.研究者と音楽家との関係.
Martin Fussenegger
スイスFederal Institute of Technology in ZurichにてProfessor.
研究室URL:https://www.bsse.ethz.ch/research/research-groups/biotechnology-and-bioengineering.html
© 2017 小嶋良輔・Martin Fussenegger Licensed under CC 表示 2.1 日本
(スイスFederal Institute of Technology in Zurich,Department of Biosystems Science and Engineering)
email:小嶋良輔
DOI: 10.7875/first.author.2017.135
Nonimmune cells equipped with T-cell-receptor-like signaling for cancer cell ablation.
Ryosuke Kojima, Leo Scheller, Martin Fussenegger
Nature Chemical Biology, 14, 42-49 (2018)
要 約
非免疫細胞に特定の細胞を認識してそれを殺傷する機能を付与することができれば,次世代のがんの治療に応用される可能性がある.この研究において,筆者らは,T細胞におけるシグナルのスイッチングの分子機構を参考に,多くの細胞においてはたらくJAK-STATシグナル伝達経路のオンオフを特定の細胞との接触にともなうシグナル阻害タンパク質の物理的な動きにより制御することにより,非免疫細胞に特定の細胞との接触を感知させる新しいシグナリングデバイスの開発に成功した.さらに,このシグナリングデバイスにより,プロドラッグ化された抗がん剤を活性化する酵素の発現を誘導し標的となる細胞に送り込むことにより,標的に選択的ながんの治療への応用の可能性が示された.この研究は,細胞を基盤とする次世代のがんの治療に役立つ技術を提供するとともに,細胞外の情報を細胞内に伝達するための合成生物学的なツールボックスを拡張するという観点からも有用であると考えられた.
はじめに
特定の細胞との接触を感知するように改変された免疫細胞はがんの治療に有用である.たとえば,キメラ抗原受容体を発現するよう改変されたT細胞は白血病などいくつかの種類のがんに対し著効を示すことが報告されており,実際にさまざまな治験が進んでいる1).しかしながら,改変された免疫細胞は,サイトカイン放出症候群をひき起こす危険があるほか,がんに到達する頻度の低い場合もあるため,特定の種類のがんにはよく効く一方,効果の限定されるがんも多いといった問題をかかえている.
このような問題を解決するひとつの手段として,がん細胞に遊走しやすいことが報告されている間葉系幹細胞のような非免疫細胞にがん細胞を認識させ殺傷させるといったアプローチが考えられる.実際に,間葉系幹細胞にプロドラッグ化された抗がん剤を活性化する酵素を発現させ,生体においてがん細胞を殺傷させる治療法が基礎研究のレベルで報告されている2,3).抗がん剤による副作用を考慮するとがん細胞の周辺のみでプロドラッグを活性化することが望ましいが,これまで,間葉系幹細胞のような非免疫細胞に特定の細胞との接触を認識させることはむずかしかった.そこで,この研究においては,非免疫細胞に特定の細胞との接触を感知させるシグナリングデバイスの開発に取り組んだ.
1.特定の細胞との接触を感知させるシグナリングデバイスのデザイン
T細胞が特定の細胞を認識する際のシグナル伝達は,大きな細胞外ドメインおよび細胞内ホスファターゼドメインからなる膜タンパク質CD45が,T細胞と標的となる細胞とが抗原抗体反応により接触する際にその接触面から物理的に隔離されることにより,シグナルを発動するキナーゼ活性を阻害しなくなることが初発であると報告されている4,5).一方,CD45は非免疫細胞を含む多くの細胞においてはたらくJAK-STATシグナル伝達経路の阻害タンパク質としても報告されている6).この2つの事象に着目し,JAK-STATシグナル伝達経路のオンオフを特定の細胞との接触にともなうCD45の物理的な動きにより制御できるのではないかと仮説をたてた(図1).これが達成されれば,非免疫細胞に特定の細胞との接触を感知させることが可能になる.
2.CD45模倣体は非免疫細胞において人為的に構築されたJAK-STATシグナル伝達経路を抑制する
筆者らの研究室において,STAT3およびSTAT6の活性化を検出するレポーター遺伝子が構築されていたことから,非免疫細胞であるHEK-293T細胞において,CD45と同じ機能を示すCD43の細胞外ドメインとCD45の細胞内ドメインを結合したキメラタンパク質CD43ex-45int(CD45模倣体)により5),STAT3およびSTAT6により介在されるJAK-STATシグナル伝達経路が抑制されるかどうか検証した.HEK-293T細胞においてはCD45の発現は低いことが知られており,同様の活性をもち高く発現するCD45模倣体を用いた.STAT3シグナルのトリガーとしてはインターロイキン10受容体,STAT6シグナルのトリガーとしてはインターロイキン4/インターロイキン13受容体を用い,それぞれの受容体と対応するSTATおよびそのレポーター遺伝子とCD45模倣体を共発現させたところ,インターロイキン4/インターロイキン13受容体により惹起されるJAK-STATシグナル伝達経路が抑制された.
3.CD45模倣体の物理的な動きは特定の細胞との接触の感知に利用できる
インターロイキン4/インターロイキン13受容体の細胞外ドメインに乳がんの表面マーカーとして知られるHER2を認識する1本鎖抗体を結合することによりHER2認識受容体を構築し,これをCD45模倣体およびSTAT6とともにHEK-293T細胞に発現させた.このセンサー細胞をターゲット細胞のモデルであるHEK-HER2細胞あるいは非ターゲット細胞であるHEK-iRFP細胞と混合し,センサー細胞に遺伝的に導入したSTAT6レポーターの発現を観察した.その結果,適切な量のHER2認識受容体とCD45模倣体を発現するセンサー細胞がターゲット細胞と共存する場合のみSTAT6レポーター遺伝子からの明らかな発現が観察された.抗原認識部位を欠く場合,CD45模倣体の細胞外ドメインを欠失させた場合,CD45模倣体の細胞内ドメインを蛍光タンパク質に置換した場合にはターゲット細胞を認識しなかったことから,インターロイキン4/インターロイキン13受容体と結合した1本鎖抗体によるHER2の認識にともない,センサー細胞とターゲット細胞との接触面からCD45模倣体がその細胞外ドメインの立体的な障害により隔離され,STAT6を介したJAK-STATシグナル伝達経路がオンになったことが示唆された.さらに,それぞれの構成要素の局在を蛍光イメージングにより確認したところ,抗原認識受容体が細胞の接触面に集積する一方,CD45模倣体が細胞の接触面から隔離されていることが確認され,ターゲット細胞の感知がデザインされたとおりの分子機構により達成されていることが強く示唆された.
4.特定の細胞との接触を感知するシグナリングデバイスの最適化および一般化
インターロイキン4/インターロイキン13受容体の細胞外ドメインを削除することにより,この特定の細胞との接触を感知するシグナリングデバイスのアウトプットの遺伝子発現を上昇させること,および,特定の細胞との接触を感知する機能を保持したままインターロイキン4/インターロイキン13受容体のネイティブのリガンドであるインターロイキン4およびインターロイキン13への反応性を喪失させることに成功し,特定の細胞との接触のみに反応する,よりパフォーマンスのすぐれたシグナリングデバイスが開発された.
HER2のほか,さまざまながん細胞のマーカーとして利用されるEpcamを発現する細胞を認識するシグナリングデバイスも開発され,また,このシグナリングデバイスはがんに遊走する活性をもつ間葉系幹細胞の不死化細胞株においても利用が可能であったことから,この特定の細胞との接触を感知するシグナリングデバイスの一般性および拡張性が示された.
5.細胞を基盤とするがんの治療への応用
この特定の細胞との接触を感知するシグナリングデバイスを細胞を基盤とするがんの治療に応用することを試みた.具体的には,これまでにがんに遊走する活性をもつ間葉系幹細胞にプロドラッグ化した抗がん剤を活性化する酵素を発現させ,がんの周辺においてプロドラッグを活性化するがんの治療がいくつか報告されているが2,3),ここにターゲットの認識能を付与することで,よりがん細胞に選択的な細胞の殺傷が可能になると考えた.
プロドラッグである5-フルオロシトシンを毒性のある5-フルオロウリジン一リン酸に変換するFCU1とよばれる酵素7) に,細胞膜の透過性を示すウイルスに由来するタンパク質VP22 8) を結合することにより,センサー細胞から発現されたFCU1が周囲のターゲット細胞の細胞質や核に拡散するようデザインした.このVP22-FCU1を,HER2を発現する細胞を認識するシグナリングデバイスを用いてセンサー細胞に発現させ,ターゲット細胞あるいは非ターゲット細胞と混合して5-フルオロシトシンの存在下において培養したところ,ターゲット細胞は選択的に殺傷された.一方,FCU1を恒常的な発現を誘導する遺伝子プロモーターにより発現した場合にはターゲット細胞および非ターゲット細胞が非選択的に殺傷された.このことから,この特定の細胞との接触を感知するシグナリングデバイスを用いることにより,ターゲット細胞を認識して選択的に殺傷する機能が発揮されることが示された.このシグナリングデバイスは,ターゲット細胞と非ターゲット細胞が共存してもターゲット細胞の選択的な殺傷にある程度の効果を発揮したほか,間葉系幹細胞の不死化細胞株を用いてHER2を高発現する乳がん細胞株であるSKBR-3細胞を抗原の認識に依存的して殺傷することも可能であった.
おわりに
これまで,細胞外の情報を細胞内に伝達するための細胞機能の設計原理が不足していたため,非免疫細胞に特定の細胞との接触を感知させる方法はかぎられていた.この研究において,筆者らは,人為的に構築されたシグナル阻害タンパク質の細胞膜におけるダイナミックな動きを特定の細胞との接触の感知に利用できることが示された.このことは,今後,新たな細胞機能をデザインするための合成生物学的な観点から興味深い発見といえる.また,応用的な観点からいえば,がんに遊走する活性をもつ間葉系幹細胞を用いて乳がん細胞が殺傷されたことから,実際の治療に応用する可能性が示されたと考えられる.ただし,このセンサー細胞が個体においてどのようにふるまうかは未知数であるほか,複数の構成因子をその質を制御したうえで安定して細胞に導入することはまだむずかしいといった点は,さらなる応用を考える際にまだまだハードルとして残る.複数の遺伝子を安定して導入することが可能なゲノム編集技術がさらに発展していけば,このような細胞機能の設計原理が実際の医療に応用される日が近づくかもしれない.
文 献
- Almasbak, H., Aarvak, T. & Vemuri, M. C.: CAR T cell therapy: a game changer in cancer treatment. J. Immunol. Res., 2016, 5474602 (2016)[PubMed]
- Matuskova, M., Kozovska, Z., Toro, L. et al.: Combined enzyme/prodrug treatment by genetically engineered AT-MSC exerts synergy and inhibits growth of MDA-MB-231 induced lung metastases. J. Exp. Clin. Cancer Res., 34, 33 (2015)[PubMed]
- Nouri, F. S., Wang, X. & Hatefi, A.: Genetically engineered theranostic mesenchymal stem cells for the evaluation of the anticancer efficacy of enzyme/prodrug systems. J. Control. Release, 200, 179-187 (2015)[PubMed]
- Chang, V. T., Fernandes, R. A., Ganzinger, K. A. et al.: Initiation of T cell signaling by CD45 segregation at 'close contacts'. Nat. Immunol., 17, 574-582 (2016)[PubMed]
- James, J. R. & Vale, R. D.: Biophysical mechanism of T-cell receptor triggering in a reconstituted system. Nature, 487, 64-69 (2012)[PubMed]
- Irie-Sasaki, J., Sasaki, T., Matsumoto, W. et al.: CD45 is a JAK phosphatase and negatively regulates cytokine receptor signalling. Nature, 409, 349-354 (2001)[PubMed]
- Erbs, P., Regulier, E., Kintz, J. et al.: In vivo cancer gene therapy by adenovirus-mediated transfer of a bifunctional yeast cytosine deaminase/uracil phosphoribosyltransferase fusion gene. Cancer Res., 60, 3813-3822 (2000)[PubMed]
- Kerkis, A., Hayashi, M. A., Yamane, T. et al.: Properties of cell penetrating peptides (CPPs). IUBMB Life, 58, 7-13 (2006)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2014年 東京大学大学院薬学系研究科博士課程 修了,同年 スイスFederal Institute of Technology in Zurich博士研究員を経て,2017年より東京大学大学院医学系研究科 助教.
研究テーマ:ドラッグデリバリーシステムなど,生物学的な材料を巧妙に利用した疾患の新しい治療のシステムの開発.
関心事:有機化学と合成生物学とのシナジー.次世代シークエンシング.研究者と音楽家との関係.
Martin Fussenegger
スイスFederal Institute of Technology in ZurichにてProfessor.
研究室URL:https://www.bsse.ethz.ch/research/research-groups/biotechnology-and-bioengineering.html
© 2017 小嶋良輔・Martin Fussenegger Licensed under CC 表示 2.1 日本